宿州市2014年藥品不良反應監測情況分析
尹 創 左登平(宿州市食品藥品檢驗所 宿州234000)
?
宿州市2014年藥品不良反應監測情況分析
尹創左登平(宿州市食品藥品檢驗所宿州234000)
摘要:目的:分析藥品不良反應(ADR)數據,為臨床合理用藥提供參考。方法:收集宿州市2014年全年ADR報告數據,并進行分析統計。結果:ADR病例報告中涉及的藥品品種各季度有所變化,報告主要來自醫療機構和藥品經營企業,來自藥品生產企業的相對較少。結論:合理使用藥物并加強用藥檢測,減少不良反應。
關鍵詞:藥品不良反應監測情況
國家制定《藥品不良反應報告和監測管理辦法》的目的是保障人民群眾的身體健康和用藥安全[1]。宿州市藥品不良反應監測中心,始終堅持以科學發展觀為指導,樹立和實踐科學監測理念,大力推動藥品不良反應監測工作。在有關部門、單位的大力支持下,2014年宿州市監測工作發展迅速,成效顯著。
1 2014 年宿州市ADR工作開展情況分析
2014年宿州市藥械監測工作成績喜人。市ADR中心評價的病例報告榮獲2014年全省藥械安全性監測病例報告質量評選活動三等獎;宿州市10家單位13份藥械不良反應病例報告質量位居全省前三十名,并獲得通報表彰。2014年全年共收集上報藥品不良反應病例報告8101份,其中新的嚴重的病例報告1460份,占報表總數的18%;醫療機構病例報告數占報告總數的83.0%;每百萬人口報告數1243份。
1.1各個季度報告情況分析:報告主要來自醫療機構和藥品經營企業,來自藥品生產企業的僅3份,所占比例相對較小。百萬人口的報告數量在前三季度相比去年同期有所下降,第四季度提升顯著。新的嚴重的病例除第一季度略有下降外,其他各季度都比去年同期有所增長。各季度的報告情況見表1,報告來源情況見表2。

表1
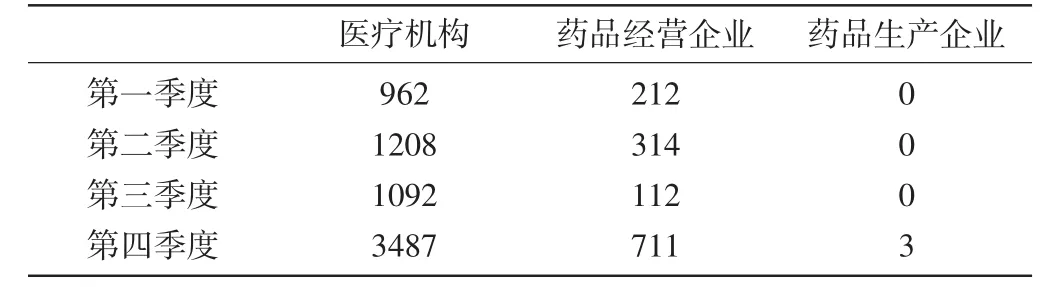
表2
1.2涉及藥品總體情況:ADR病例報告中涉及的藥品品種各季度有所變化,第一季度ADR病例報告涉及的藥品前三位分別是左氧氟沙星、阿奇霉素、阿莫西林克拉維酸鉀;第二季度前三位分別是左氧氟沙星、川芎嗪、參麥;第三季度前三位分別是左氧氟沙星、環丙沙星、頭孢曲松;第四季度前三位分別是左氧氟沙星、頭孢曲松、阿奇霉素。全年ADR病例報告累及系統傷害前三位的是胃腸系統損害、皮膚及其附件損害、中樞及外周神經系統損害。ADR病例報告中涉及的藥品以化學藥品為主,其次是中藥制劑和生物制劑。各季度ADR病例報告中藥品分類情況見表3。
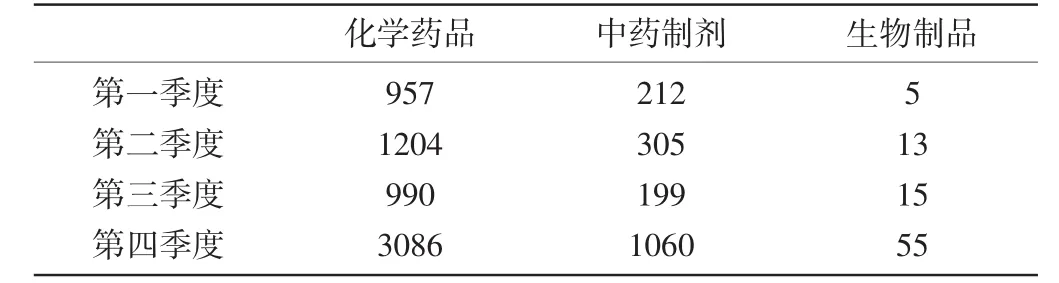
表3
1.3涉及基本藥物情況:全年ADR病例報告中涉及的國家基本藥物中,左氧氟沙星排名第一位,其中第一季度排名前三位的是左氧氟沙星、阿莫西林克拉維酸鉀、環丙沙星;第二季度排名前三位的是左氧氟沙星、環丙沙星、頭孢曲松鈉;第三季度排名前三位的是左氧氟沙星、環丙沙星、頭孢曲松鈉;第四季度排名前三位的是左氧氟沙星、頭孢曲松、頭孢他啶。全年報表涉及基本藥物累及系統及主要不良反應表現以胃腸系統損害最高,其次為皮膚及其附件損害。第一季度、第二季度、第三季度和第四季度提交的報告中涉及國家基本藥物分別是105個、136個、126個和241個。各季度報告中排名前列的藥品類別也有不同,但排名前兩位的都是抗感染藥、中藥制劑。各季度ADR病例報告中涉及國家基本藥物的具體品種見表4。
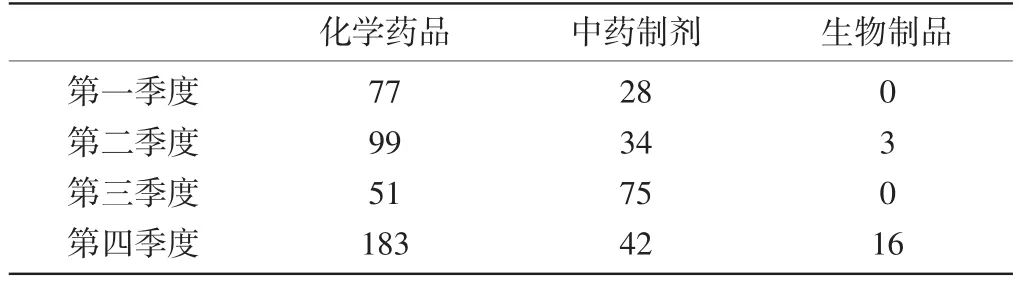
表4
1.4重點監測品種情況:全年報表涉及《國家藥品不良反應信息通報》的品種共162個2134份,其中嚴重報告6份。涉及國家重點監測品種共64個1302份,其中嚴重報告3份,主要表現為過敏性休克和面部水腫、嗜睡。
1.5疑似預防接種異常反應監測信息情況:全年通過疑似預防接種異常反應監測信息管理系統監測到本市疑似預防接種異常反應監測信息共436例,基本都是一般反應,9例為異常反應,1例偶合反應,3例待定,報告中以百白破(無細胞)發生率最高,共250例。AEFI<1的報告所占比例較大,為209例,其次為AEFI 1歲,為148例。
2 討論
2.1藥品生產企業的ADR報告數量有待提高:全年藥品生產企業報告數量僅為3例,這可能與藥品生產企業對ADR的認識和重視程度有關。藥品生產企業往往認為一旦報告ADR就是藥品質量的問題,是假藥劣藥。同時,藥品生產企業把ADR監測認為是藥品使用和管理部門的事,藥品一經賣出,就與企業沒什么關系了。ADR報告有無與企業的效益無關這一原因也是藥品生產企業不報或漏報的一個重要因素。藥品生產企業有的比較注重從經濟效益角度考慮問題,他們認為報告ADR是一件額外的事情,報與不報不能給企業或醫療機構增加效益。還有的藥品生產企業缺乏ARR監測必要的激勵和約束機制,使監測制度流于形式[2]。建議藥品生產企業加強與醫療機構的合作,建立與完善藥品上市后安全性、有效性等再評價工作,在主動收集本企業產品的藥品不良反應/事件的同時,開展藥品安全性、有效性研究,及時修訂、完善藥品說明書。
2.2部分報表質量有待提高:2014年,ADR的報表質量較以往有了很大的提高,但在對報表的審核中仍然發現存在一些問題:一是部分報告存在信息缺失,如患者性別、民族、體重、既往與家族不良反應史;二是不良反應過程描述中不良反應癥狀的描述過于簡單,部分報表仍存在缺少不良反應發生時間及采取治療措施的時間的描述;三是關聯性評價存在評價不準確。今后需進一步加強宣傳培訓教育,提高全社會對ADR監測工作重要性的認識,分期分批對轄區內藥品生產、經營企業、醫療機構相關人員進行培訓,擴大基層ADR監測工作骨干隊伍,提升ADR報告人員的業務水平,規范病例報表的質量,穩步提高不良反應報告的數量。
參考文獻
[1]陳志勇,項琪琪,尤昱洲.2012年度某市不良反應及醫療器械不良事件監測情況分析[J].中國醫藥指南,2013,11(24):780-781.
[2]程民.我市藥品不良反應監測工作開展情況現狀與建議[J].安徽醫藥,2007,11(4):374-375.
中圖分類號:R969.3
文獻標識碼:B
文章編號:1672-8351(2016)04-0168-02

