靈芝多糖乙酰化及其抗氧化活性研究
葉穎霞,趙菊香,陳盛強,孫衛文
(1.廣州醫科大學附屬第一醫院,廣東 廣州 510120;2.廣州醫科大學神經科學研究所,廣東 廣州 510260)
?
靈芝多糖乙酰化及其抗氧化活性研究
葉穎霞1,趙菊香1,陳盛強2,孫衛文2
(1.廣州醫科大學附屬第一醫院,廣東 廣州510120;2.廣州醫科大學神經科學研究所,廣東 廣州510260)
[摘要]目的通過化學修飾改變靈芝多糖分子結構,并研究其體內抗氧化活性。方法乙酰化修飾靈芝多糖(Ganoderma lucidum polysaccharide,GLP),得到GLP乙酰化衍生物(GLP acetyl derivatives,GLPa);將昆明種小鼠隨機分成空白對照組,陽性對照組,GLP高、低劑量組及GLPa高、低劑量組,測定小鼠血清和肝臟丙二醛(malondialdehyde,MDA)、總抗氧化能力(total antioxidant capacity,T-AOC)和過氧化氫酶(catalase,CAT);建立高脂血癥大鼠抗氧化損傷模型,考察GLP及GLPa的抗氧化能力。結果GLPa及GLP均可以顯著提高正常小鼠肝組織CAT活力及T-AOC,降低小鼠血清及肝臟MDA含量,GLPa抗氧化活性明顯優于GLP,且與給藥劑量相關。此外,GLPa及GLP還可以顯著降低四氧嘧啶致高脂大鼠的氧化損傷程度,提高其血清超氧化物歧化酶活力及肝臟T-AOC,并降低其血清MDA含量。結論乙酰化修飾可顯著提高靈芝多糖的抗氧化活性。
[關鍵詞]靈芝多糖;乙酰化;抗氧化
靈芝多糖(Ganodermalucidumpolysaccharide,GLP)為多孔菌科真菌赤芝Ganodermalucidum(Leyss. ex Fr.)Karst.菌絲體的次生代謝產物,存在于其菌絲體及子實體中[1]。GLP具有抗腫瘤[2]、提高免疫力[3]、抗氧化[1]及抗輻射[4]等作用。天然來源的多糖具有低毒、無不良反應的優勢,但也存在一些不足:天然多糖并不都具有生物學活性[5];一些多糖因為其理化性質或空間結構等問題從而限制其藥理活性;某些多糖活性較弱,還需要進一步改善[6]。當前已有大量關于分子修飾多糖從而獲得理想的活性多糖的文獻報道。分子修飾方法主要分為化學修飾、物理修飾及生物修飾,以化學修飾運用最為廣泛。化學修飾方法主要通過嫁接硫酸基、甲基、乙酰基等基團或者元素,以改變多糖理化性質及活性[7]。研究[8-9]表明,分子修飾后的多糖不僅可以提高原有的生物學活性,有些甚至可以產生新的藥理作用。
目前已有關于對GLP硫酸化修飾的研究報道,經硫酸化修飾使GLP具有顯著的抗腫瘤、抗癌活性[10]。而對于GLP乙酰化修飾尚無研究報道,從其他關于多糖乙酰化的研究報道可以推測,乙酰化可使多糖改變定向性及橫向次序,從而改變多糖的空間排布,增加其水溶性,改善其活性。因此本研究采用乙酰化修飾GLP,通過體內抗氧化實驗檢測乙酰化GLP抗氧化活性,為GLP相關藥品及功能保健品的開發奠定理論基礎。
1材料與儀器
1.1材料與試劑靈芝:多孔菌科真菌赤芝Ganodermalucidum(Leyss. ex Fr.)Karst的干燥子實體,購自于廣州清平藥材市場,經水體醇沉法[11]獲得粗多糖后,采用Superdex-G200分離得到純化GLP;過氧化氫酶(catalase,CAT)試劑盒、丙二醛(malondialdehyde,MDA)試劑盒、總抗氧化能力(total antioxidant capacity,T-AOC)試劑盒、超氧化物歧化酶(super oxide dismutase,SOD)試劑盒:江蘇省南京建成生物工程研究所;三氯乙酸、吡啶、甲酰胺、乙酸酐、無水乙醇均為分析純。
1.2實驗動物SPF級昆明種小鼠及SD大鼠,購自廣州中醫藥大學實驗動物中心,生產許可證號為SCXK(粵)2008-0001。
1.3儀器DL-5000B離心機:上海飛鴿科學儀器廠;FA2004電子天平:上海菁華儀器有限公司;501-A型超級恒溫器:上海實驗儀器廠有限公司;UV-360紫外可見分光光度計:日本島津公司;RE52-4旋轉蒸發儀:常州金壇儀器有限公司。
2方法
2.1GLP乙酰化衍生物(GLP acetyl derivatives,GLPa)制備按文獻[12]方法,稱取400 mg GLP溶于10 mL蒸餾水中,充分溶解,用NaOH調節溶液pH值至9.0,然后緩慢滴加5 mL甲酰胺,同時滴加NaOH溶液以維持反應體系的pH值在8.2左右,反應過程中持續攪拌,反應結束后再緩慢滴加鹽酸至溶液呈中性,后用乙醇沉淀反應體系,沉淀物用95%乙醇洗滌3次,沉淀物冷凍干燥后溶于100 mL蒸餾水中,3 000 Da透析袋透析72 h,濃縮,醇沉,冷凍干燥即得GLPa。采用紅外線檢測乙酰化成功與否[13]。
2.2GLPa對正常小鼠抗氧化能力的影響將60只昆明種小鼠隨機分成6組(雌雄各半)。分別為空白對照組:每天灌胃0.9%生理鹽水;陽性對照組:維生素C(vitamin C,Vc),500 mg/kg,用前新鮮配制;GLP低劑量組:100 mg/kg;GLP高劑量組:300 mg/kg;GLPa低劑量組:100 mg/kg;GLPa高劑量組:300 mg/kg,連續灌胃給藥15 d。末次給藥后眼眶取血,收集后離心取血清。麻醉處死小鼠,剖取肝臟,按試劑盒指導方法檢測血清和肝臟MDA、肝臟T-AOC和CAT。
2.3GLPa對高脂血癥大鼠抗氧化損傷能力的影響取雌性SD大鼠,灌胃給予實驗室配制的高脂飲食(豬油∶膽固醇∶膽鹽3號∶丙基硫氧嘧啶為50∶40∶8∶2),每只2 mL,連續20 d。根據血清三酰甘油含量,取48只雌性SD大鼠,隨機分為6組。陽性對照組:血脂康200 mg/kg;陰性對照組:0.9%生理鹽水;GLP低劑量組:100 mg/kg;GLP高劑量組:300 mg/kg;GLPa低劑量組:100 mg/kg;GLPa高劑量組:300 mg/kg;另取8只正常飲食的雌性SD大鼠作為正常對照組:灌胃給予生理鹽水。各組通過腹腔注射連續給藥40 d。于第37天,除正常對照組外,其余6組SD大鼠均腹腔注射四氧嘧啶,200 mg/kg。72 h后,麻醉處死,腹腔主動脈取血,離心(20 000 r/min,15 min),取血清,按試劑盒指示方法檢測血清MDA與SOD以及肝臟的T-AOC。

3結果
3.1GLPa對正常小鼠抗氧化能力的影響
3.1.1GLPa量效關系考察以空白對照組和GLPa高、低劑量組為實驗組合進行單因素方差分析,結果顯示,空白對照組和GLPa高低劑量組血清MDA、肝臟MDA、肝臟T-AOC和肝臟CAT活力比較,差異均具有統計學意義(血清MDA:F(2,27)=102.264,P=0.000;肝臟MDA:F(2,27)=238.222,P=0.000;肝臟T-AOC:F(2, 27)=190.601,P=0.000;肝臟CAT活力:F(2,27)=164.862,P=0.000),以GLPa高劑量組降低血清和肝臟MDA及升高肝臟T-AOC和CAT活力的效應最為顯著(P<0.05)。見表1。
3.1.2GLPa與陽性對照藥Vc抗氧化能力比較以GLPa高、低劑量組和陽性對照組為組合進行單因素方差分析,結果顯示,陽性對照組和GLPa高、低劑量組血清MDA、肝臟MDA、肝臟T-AOC和肝臟CAT活力比較,差異均具有統計學意義(血清MDA:F(2,27)=37.84,P=0.000;肝臟MDA:F(2,27)=57.78,P=0.000;肝臟T-AOC:F(2,27)=59.37,P=0.000;肝臟CAT活力:F(2,27)=75.61,P=0.000),GLPa高、低劑量組降低血清和肝臟MDA及升高肝臟T-AOC和CAT活力的效應均明顯優于Vc(P<0.05)。見表1。
3.1.3乙酰化修飾因素和劑量因素對正常小鼠抗氧能力影響的兩因素析因設計方差分析以GLP高、低劑量組和GLPa高、低劑量組為實驗組合進行兩因素析因設計的方差分析,結果顯示,乙酰化修飾因素和劑量因素對血清MDA、肝臟MDA、肝臟T-AOC和肝臟CAT活力的主效應均具有統計學意義(P<0.05),兩個因素的交互作用均無統計學意義(P>0.05)。結果提示,乙酰化修飾可明顯提高GLP對正常大鼠的抗氧化能力。見表2。
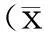
表1 GLPa對正常小鼠抗氧化能力的影響±s)
注:與空白對照組比較,*P<0.05;與GLPa低劑量組比較,#P<0.05;與陽性對照組比較,△P<0.05;與GLP低劑量組比較,◇P<0.05;與GLP高劑量組比較,▲P<0.05。

表2 乙酰化修飾因素和劑量因素對正常小鼠抗氧化能力影響的兩因素析因設計方差分析結果
3.2GLPa對高脂血癥大鼠抗氧化損傷能力的影響
3.2.1高脂血癥大鼠抗氧化能力的變化以空白對照組和陰性對照組為實驗組合進行兩個獨立樣本t檢驗,結果顯示,陰性對照組血清SOD和肝臟T-AOC水平較空白對照組明顯降低(P<0.05),血清MDA水平較空白對照組顯著升高(P<0.05)。結果提示,高脂血癥大鼠抗氧化能力較正常大鼠明顯降低。見表3。
3.2.2GLPa對高脂血癥大鼠抗氧化能力影響的量效關系考察以陰性對照組和GLPa高、低劑量組為實驗組合進行單因素方差分析,結果顯示,3組血清SOD、MDA和肝臟T-AOC水平比較,差異均具有統計學意義(血清SOD:F(2,21)=230.5,P=0.000;血清MDA:F(2,21)=1 656.7,P=0.000;肝臟T-AOC:F(2,21)=490.2,P=0.000),以GLPa高劑量升高血清SOD、肝臟T-AOC及降低血清MDA的作用為最優。見表3。
3.2.3GLPa與陽性對照組血脂康抗氧化能力比較以陽性對照組和GLPa高、低劑量組為實驗組合進行單因素方差分析,結果顯示,3組血清SOD、MDA和肝臟T-AOC水平比較,差異均具有統計學意義(血清SOD:F(2,21)=111.8,P=0.000;血清MDA:F(2,21)=292.3,P=0.000;肝臟T-AOC:F(2,21)=297.6,P=0.000),GLPa高、低劑量降低血清MDA及升高血清SOD和肝臟T-AOC的效應均明顯優于血脂康(P<0.05)。見表3。
3.2.4乙酰化修飾因素和劑量因素對高脂血癥大鼠抗氧化能力影響的兩因素析因設計的方差分析以GLP高、低劑量組和GLPa高、低劑量組為實驗組合進行兩因素析因設計的方差分析,結果顯示,乙酰化修飾因素和劑量因素對血清SOD、血清MDA和肝臟T-AOC的主效應均具有統計學意義(P<0.05),兩個因素對血清MDA的交互作用具有統計學意義(P<0.05)。結果提示,GLPa提高高脂血癥大鼠體內抗氧化能力的效應明顯優于GLP。見表4。
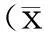
表3 GLPa對高脂血癥大鼠體內抗氧化能力的影響±s)
注:與空白對照組比較,*P<0.05;與陰性對照組比較,#P<0.05;與陽性對照組比較,△P<0.05;與GLP低劑量組比較,◇P<0.05;與GLPa低劑量組比較,▲P<0.05;與GLP高劑量組比較,□P<0.05。

表4 乙酰化修飾因素和劑量因素對高脂血癥大鼠體內抗氧化能力影響的兩因素析因設計方差分析結果
4討論
生物體內MDA是自由基作用于脂質過氧化所產生的代謝產物,因此MDA濃度越低,則脂質過氧化程度越低,表明機體抗氧化能力就越強[15]。因此,本研究選取MDA含量為其中的考察指標。多糖具有清除自由基、抗衰老等作用的機制是:①羥基與多糖碳鏈末端的氫原子結合而生成H2O;②多糖通過提高SOD、CAT等抗氧化酶的活性,從而發揮抗氧化、防衰老的作用;③改善機體免疫力以抗氧化及防衰老。因此,可以通過測定機體內SOD及MDA活力來評價受試藥的抗氧化活性[16-17]。
GLPa及GLP均可以顯著改善正常小鼠肝組織CAT活力及總抗氧化能力,降低小鼠血清及肝臟中MDA含量,GLPa的抗氧化活性明顯優于GLP,且兩者抗氧化活力與給藥劑量均具有一定相關性,高劑量效果更優。此外,GLPa及GLP對四氧嘧啶所致高脂大鼠的氧化損傷具有顯著改善能力,其作用機制為提高其血清SOD活力及肝臟T-AOC,并降低MDA含量。以上結果表明,GLPa的抗氧化活性顯著優于未經修飾的天然靈芝多糖,可能是因為乙酰化修飾改變靈芝多糖的空間排布及結構,進而增加其親水性,從而提高了GLPa活性。
參考文獻:
[1]張志軍,李淑芳,魏雪生,等.靈芝多糖體外抗氧化活性的研究[J]. 化學與生物工程,2011,28(3): 63-65.
[2]劉高強,王曉玲.靈芝多糖的抗癌構效關系及其抗癌作用機制[J].菌物學報,2006,25(3):430-438.
[3]吳旋,白東清,楊廣,等.靈芝多糖對黃顙魚免疫細胞活性的影響[J].華北農學報,2011,26(3):195-198.
[4]吳京燕,程光宇,江海濤,等.靈芝多糖合劑抗輻射保健功能的研究[J].南京師范大學學報(自然科學版),2003,26(3):79.
[5]Qiu S,Chen J,Chen X,et al.Optimization of selenylation conditions forlyciumbarbarumpolysaccharide based on antioxidant activity[J].Carbohydrate Polymers,2014,103:148-153.
[6]Shao P,Chen X,Sun P.Chemical characterization,antioxidant and antitumor activity of sulfated polysaccharide fromSargassumhorneri[J].Carbohydrate Polymers,2014,105:260-269.
[7]Sinha S,Astani A,Ghosh T,et al.Polysaccharides fromSargassumtenerrimum:structural features,chemical modification and anti-viral activity[J].Phytochemistry,2010,71(2/3):235-242.
[8]Song Y,Yang Y,Zhang Y,et al.Effect of acetylation on antioxidant and cytoprotective activity of polysaccharides isolated from pumpkin(Cucurbitapepo,ladygodiva)[J].Carbohydrate Polymers,2013,98(1):686-691.
[9]Barud HS,de Araújo Júnior AM,Santos DB,et al.Thermal behavior of cellulose acetate produced from homogeneous acetylation of bacterial cellulose[J].Thermochimica Acta,2008,471(1):61-69.
[10]張玨.靈芝多糖的硫酸化修飾及其衍生物抗腫瘤活性的初步研究[D].無錫:江南大學,2005.
[11]李世杰,張丹雁,嚴婭娟,等.響應面法優化陽春砂多糖的超聲輔助提取工藝[J].中國實驗方劑學雜志,2013,19(22):47-51.
[12]周林,郭祀遠,鄭必勝,等.裂褶多糖的乙酰化及光譜分析[J].華南理工大學學報(自然科學版),2006,34(12):88-91.
[13]Chen Y,Zhang H,Wang Y,et al.Acetylation and carboxymethylation of the polysaccharide fromGanodermaatrumand their antioxidant and immunomodulating activities[J].Food Chem,2014,156:279-288.
[14]Du X,Zhang J,Lv Z,et al.Chemical modification of an acidic polysaccharide(TAPA1) fromTremellaaurantialbaand potential biological activities[J].Food Chem,2014,143:336-340.
[15]Jung HY,Bae IY,Lee S,et al.Effect of the degree of sulfation on the physicochemical and biological properties ofPleurotuseryngiipolysaccharides[J].Food Hydrocolloids,2011,25:1291-1295.
[16]Li SQ,Shah NP.Antioxidant and antibacterial activities of sulphated polysaccharides fromPleurotuseryngiiandStreptococcusthermophilusASCC 1275[J].Food Chem,2014,165:262-270.
[17]Wang Z,Luo D.Antioxidant activities of different fractions of polysaccharide purified fromGynostemmapentaphyllumMakino[J].Carbohydrate Polymers,2007,68(1):54-58.
Acetylation ofGanodermalucidumPolysaccharide and Its Antioxidant Activities
YEYing-xia1,ZHAOJu-xiang1,CHENSheng-qiang2,SUNWei-wen2
(1.TheFirstAffiliatedHospitalofGuangzhouMedicalUniversity,GuangdongGuangzhou510120,China; 2.InstituteofNeuroscience,GuangzhouMedicalUniversity,GuangdongGuangzhou510260,China)
[Abstract]ObjectiveTo change the molecular structure of Ganoderma lucidum polysaccharide (GLP) through chemical modification, and to investigate its antioxidant activities in vivo. MethodsGLP was modified by acetylation to obtain the acetyl derivative GLPa. Kunming mice were randomly divided into blank control group, positive control group, high- and low-dose GLP groups, and high- and low-dose GLPa groups. The malondialdehyde (MDA), total antioxidant capacity (T-AOC), and catalase (CAT) in the serum and liver were measured; the model of anti-oxidative damage was established in hyperlipidemic rats to investigate the antioxidant capacity of GLP and GLPa. ResultsGLPa and GLP significantly increased the activity of CAT and T-AOC in the liver tissue of normal mice and reduced the levels of MDA in the serum and liver; the antioxidant activity of GLPa was better than that of GLP and was dose-dependent. In addition, GLPa and GLP significantly reduced the degree of oxidative damage induced by alloxan in the hyperlipidemic rats, increased the activity of serum superoxide dismutase and liver T-AOC, and reduced the serum level of MDA. ConclusionAcetylation can significantly improve the antioxidant activities of GLP.
[Key words]Ganoderma lucidum polysaccharide; Acetylation; Antioxidant
(收稿日期:2015-07-13;編輯:曹健)
[中圖分類號]R285.5[DOI]10.3969/j.issn.2095-7246.2016.02.024
作者簡介:葉穎霞(1974-),女,主管中藥師

