DEHP脅迫對高/低累積鄰苯二甲酸酯品種水稻抗氧化酶系統的影響
陳意良 魯磊安 莫測輝 蔡全英
摘 要 以前期篩選獲得的鄰苯二甲酸酯(PAEs)高/低累積基因型水稻(Oryza sativa L.)品種(培雜泰豐/豐優絲苗)進行土培試驗,對比研究鄰苯二甲酸二(2-乙基己基)酯(DEHP)污染脅迫下2個品種水稻體內過氧化物酶(POD)和多酚氧化酶(PPO)活性及丙二醛(MDA)含量變化,以揭示DEHP脅迫下2個品種的生理生化和DEHP累積差異。結果顯示,2個品種水稻體內DEHP含量隨土壤污染濃度增加而增加,但生物量下降,而且培雜泰豐地上部的生物量敏感性響應指數和DEHP含量比豐優絲苗的高,說明前者對DEHP的耐受性更強。2個品種水稻體內丙二醛含量基本保持不變,但過氧化物酶和多酚氧化酶活性則隨土壤DEHP濃度的增加而升高,說明水稻可能通過提高過氧化物酶和多酚氧化酶活性以降低DEHP脅迫。豐優絲苗的多酚氧化酶活性較培雜泰豐的高,可能影響到DEHP在水稻體內降解進而導致前者體內DEHP含量較低。
關鍵詞 鄰苯二甲酸二(2-乙基己基)酯;水稻;多酚氧化酶;過氧化物酶;丙二醛
中圖分類號 S511;X173 文獻標識碼 A
Abstract Two different genotypic cultivars of rice(Oryza sativa L.)with PAE(phthalic acid esters)high-accumulation(cultivar Peizataifeng)and low-accumulation(cultivar Fengyousimiao)were grown in soil spiked with di(2-ethylhexyl)phthalate(DEHP, 0, 50, and 100 mg/kg). The peroxidase(POD)and polyphenol oxidase(PPO)activities, malondialdehyde(MDA)content were measured to reveal the difference in DEHP accumulation, physiology and biochemistry changes between Peizataifeng and Fengyousimiao. The results indicated that DEHP concentrations in rice plants increased while the biomass of rice decreased with increasing concentrations of DEHP in the soil. The index of biomass response to stress of Peizataifeng was higher than that of Fengyousimiao, indicating that Peizataifeng was more tolerant to DEHP than Fengyousimiao. The MDA contents of the two cultivars kept unchanged while the activities of PPO and POD increased with increasing concentrations of DEHP in the soil. These results illustrated that the rice might alleviate DEHP stress by elevating the activities of PPO and POD. The PPO activity of Fengyousimiao was higher than that of Peizataifeng, which might affect the in-vivo degradation of DEHP, and thus led to a lower DEHP concentration in Fengyousimiao than Peizataifeng.
Key words Di(2-ethylhexyl)phthalate; Rice; Peroxidase; Polyphenol oxidase; Malondialdehyde
doi 10.3969/j.issn.1000-2561.2016.08.007
隨著農業生產中地膜覆蓋和塑料大棚的廣泛應用,2014年中國農用塑料薄膜使用量達258萬t(地膜使用量為144萬t)[1],約20%的地膜殘留在土壤中[2]。其中,鄰苯二甲酸酯(PAEs,俗稱塑化劑)在塑料中含量可達40%~60%[3],地膜殘留,加上大量施用化肥農藥及“三廢”污染,導致土壤PAEs含量上升。有研究發現,全國農業土壤PAEs含量以廣東最高,部分高達幾個到幾十個mg/kg[4-5]。而且廣東地區不同類型農業土壤中PAEs含量以水田的最高,其中以鄰苯二甲酸二(2-乙基己基)酯(DEHP)檢出最普遍且含量最高[6]。PAEs尤其是長鏈的DEHP屬于典型的環境內分泌干擾物,DEHP具有潛在“三致”毒性,被美國環保局(USEPA)列為“優控污染物”。
殘留在土壤中的DEHP會通過根系吸收進入植物體內,影響植物生長及生理生化功能[7-8]。作者前期研究結果表明,低濃度DEHP處理會促進大部分品種菜心生長(生物量增加),而高濃度處理則有明顯的抑制作用[8]。植物體內的生理生化過程是植物吸收累積外源污染物的內在調節因素[9],特別是植物體內的酶系統對植物應對污染物脅迫的能力至關重要。其中,多酚氧化酶(PPO)被認為在植物體內可降解環狀化合物[10],是與植物體內防御系統有關的重要蛋白質[11]。植物會提高體內PPO活性來應對受到的生物或者非生物性脅迫[12-13]。有研究發現,PAEs脅迫下植物體內會產生大量的活性氧自由基,可能會導致脂質過氧化和酶失活等[14]。丙二醛作為細胞內膜脂過氧化或脫脂的產物,其含量的多少可以代表膜損傷程度的大小。過氧化物酶(POD)是一種重要的保護酶,能清除植物體內多余的活性氧自由基,抑制膜脂的過氧化進程[15],從而保護植物生理活動的正常進行以應對外源污染物的脅迫。
外源污染脅迫下不同植物體內酶系統的反應不一樣,進而影響到污染物對植物的毒理效應以及污染物在體內的降解,最終表現為不同植物對污染物的吸收累積差異[8,16]。作者前期研究發現,不同品種水稻對DEHP的吸收累積存在差異[16],其根系形態和根系分泌物等也存在品種差異[17]。但DEHP脅迫下不同品種水稻的酶活性變化尚未清楚。本研究以前期篩選獲得的高/低累積PAEs水稻品種培雜泰豐和豐優絲苗為供試植物[17],研究DEHP污染脅迫下2種水稻體內的多酚氧化酶、過氧化物酶活性以及丙二醛含量的變化規律,為揭示其累積差異機理和保障農產品安全提供科學依據。
1 材料與方法
1.1 材料
DEHP(AR)購自阿拉丁(上海公司)。培雜泰豐種子購自華南農業大學,豐優絲苗種子購自廣東省農業科學研究院。水稻土取自華南農業大學試驗農場田間0~20 cm的耕作層,采集后于室內風干、粉碎過5 mm篩備用。水稻土DEHP背景值0.71 mg/kg,pH5.59,有機質30.2 g/kg,CEC 7.67 cmol/kg,全氮1.26 g/kg、全磷1.79 g/kg和全鉀18.0 g/kg,粒徑組成:砂粒52.0%,粉粒41.9%,粘粒6.1%。
1.2 方法
1.2.1 盆栽試驗方法 采用培雜泰豐(PAEs高累積)和豐優絲苗(PAEs低累積)進行土壤培養試驗。設置空白、低濃度、高濃度3個處理。采用人工配制污染土壤,即量取一定量的DEHP溶于丙酮(AR),添加到水稻土(過1 mm篩)中,混勻,放置暗處讓丙酮自然揮發3 d(中途不斷攪拌使丙酮盡快揮發),制得DEHP含量為500 mg/kg和1 000 mg/kg的污染土壤。按污染土壤與未污染土壤1 ∶ 9的比例進行攪拌混勻,制得盆栽污染土壤(DEHP含量為50 mg/kg(低濃度)和100 mg/kg(高濃度)。以不添加DEHP的土壤為對照處理(CK)。每個處理3個重復,采用隨機排列。
將豐優絲苗和培雜泰豐2個品種的種子分別用15%的過氧化氫消毒10 min,然后將消毒過的種子轉移到培養皿中,置于生化培養箱中催芽24 h。將催芽后的種子撒在鋪滿基質的育苗板上,待水稻苗長至4~5片葉子時進行移苗。移苗后,每天澆水保持土壤呈淹水狀態,并不定期添加營養液保證水稻正常生長。待長到45 d的時候,采集水稻根系和地上部樣品。分別測定生物量、DEHP含量、過氧化物酶活性、多酚氧化酶活性及丙二醛含量。
1.2.2 DEHP含量測定 植物樣品采用二氯甲烷(色譜純)超聲提取,方法參考 USEPA 3500b[16]并適當修改。準確稱量粉碎后的植物樣品(地上部1.0 g,地下部0.5 g)于50 mL玻璃離心管中。加入20 mL二氯甲烷超聲提取10 min,3 300 r/min離心分離(重復3次),將上述上清液合并后過硅膠柱凈化,旋轉蒸發儀(亞榮RE-52A,上海)濃縮,氮吹儀吹干后定容,4 ℃保存待測。待測液中DEHP采用氣相色譜-質譜儀聯機(GC-MS)分析,參考 USEPA 8270C 方法[17]并適當修改。GC-MS 聯用儀型號為 GC-MSQP2010(島津,日本),色譜柱為Rxi-5MS石英毛細管柱(30 m×0.25 mm×0.25 μm),載氣為高純氦氣(He)。質譜儀采用電子轟擊源(EI)。采用 DEHP 化合物標樣的0.1、0.2、0.5、1.0、2.0、4.0 mg/L為工作曲線。DEHP回收率為88.03%~100.3%。水稻體內DEHP含量以干重計。
1.2.3 植物酶活性的測定 采用分光光度法測定PPO、POD活性和MDA含量,具體的測定方法參照Ma等[18]的方法。
1.3 統計分析方法
采用Excel進行數據整理及制圖,SPSS進行統計分析。
為了比較培雜泰豐和豐優絲苗對PAEs污染脅迫的反應,按照下列公式計算生物量敏感性響應指數(BRS)[19]:
BRS/%=(BH-BL)/BL×100 BH(g)、BL(g)分別是高濃度處理和低濃度處理的生物量。
2 結果與分析
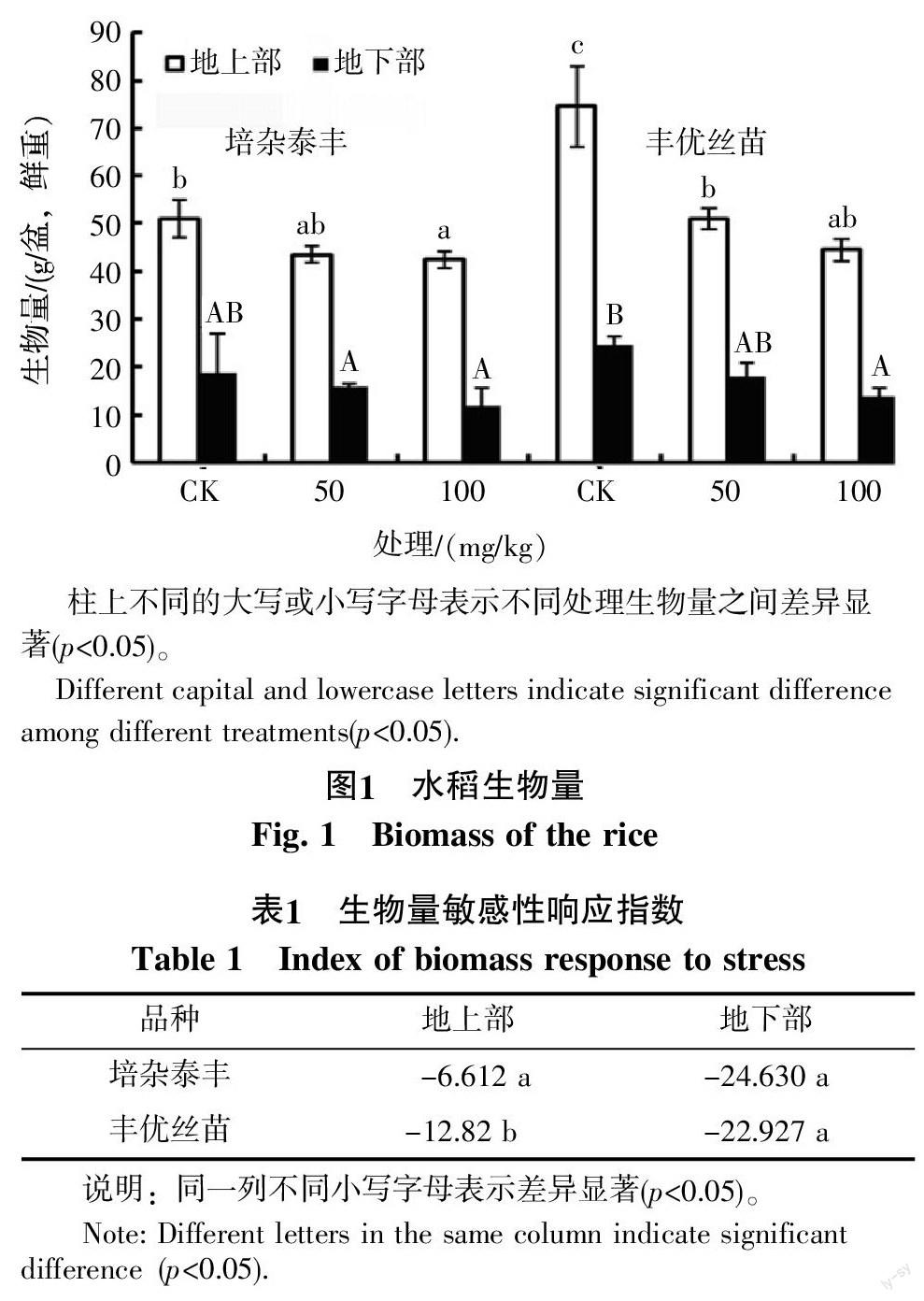
2.1 DEHP脅迫對水稻生物量的影響
由圖1可以看出,培雜泰豐和豐優絲苗的地上部和地下部的生物量均隨著DEHP濃度的增大而減小,說明50 mg/kg DEHP會抑制2種水稻的生長。而且,培雜泰豐地上部的生物量敏感性響應指數比豐優絲苗大,且差異顯著(p<0.05)(表1),說明豐優絲苗對DEHP脅迫比培雜泰豐更為敏感。
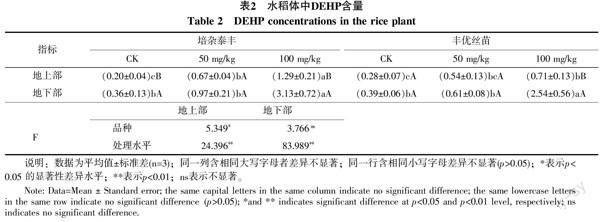
2.2 水稻體中DEHP含量
隨著DEHP濃度的升高,培雜泰豐和豐優絲苗的地上部和地下部DEHP的含量均增加,且不同處理水平之間差異極顯著(表2),說明水稻體對DEHP有累積效應。但2個品種水稻地上部的DEHP含量比同等污染水平下(100 mg/kg)的菜心地上部DEHP含量顯著低[8],說明水稻地上部較菜心累積DEHP少。同一處理地下部與地上部相比,前者DEHP含量較高,即DEHP在水稻體內的轉運系數小于1,說明DEHP更易被根系累積或滯留。經雙因素方差分析,品種間地上部DEHP含量差異顯著,地下部無顯著差異(表2),驗證了培雜泰豐和豐優絲苗分別是高、低累積DEHP的水稻品種。
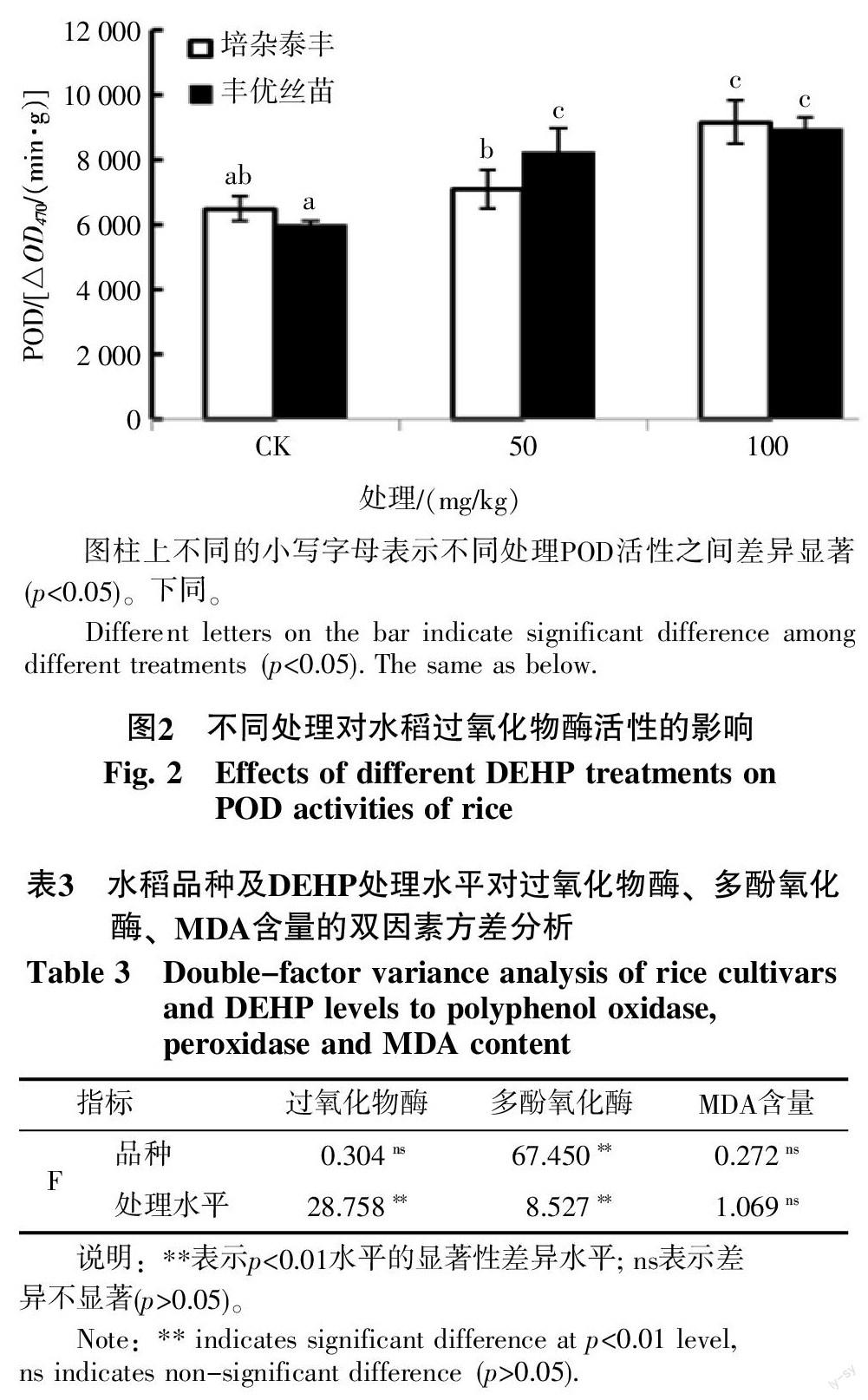
2.3 水稻體酶活性
2.3.1 過氧化物酶活性 過氧化物酶(POD)是植物抗氧化酶系統中的一種重要保護酶,能清除機體內活性氧自由基,有利于植物維持體內活性氧產生和淬滅的動態平衡,從而抑制膜脂過氧化的進程。如圖2所示,培雜泰豐和豐優絲苗地上部的POD活性均隨著DEHP濃度的升高而升高。經雙因素方差分析表明(表3),培雜泰豐和豐優絲苗2個品種的多酚氧化酶活性無顯著差異,但二者地上部的DEHP含量差異極顯著,這說明不同品種水稻對DEHP脅迫產生應激反應的閾值不同,培雜泰豐比豐優絲苗更耐受DEHP脅迫。
2.3.2 多酚氧化酶活性 多酚氧化酶(PPO)是一種存在于多種真菌和植物組織內、能夠促進酚類化合物氧化的一類酶的通稱[20]。圖3可知,隨著土壤DEHP濃度的升高,PPO活性整體呈上升趨勢,與植物中DEHP含量變化規律一致(表1)。說明高濃度DEHP處理會激活PPO,從而保護植物不受DEHP毒害。經雙因素方差分析可知(表3),不同濃度、不同品種之間PPO活性差異極顯著。
2.3.3 丙二醛含量 植物受到外源污染物入侵時,會產生大量的活性氧自由基,其易使植物細胞內膜發生過氧化作用或脫脂作用,丙二醛(MDA)作為細胞內膜脂過氧化或脫脂的產物,其含量的多少可以代表膜損傷程度的大小[15]。由圖4可以看到,低DEHP處理培雜泰豐的MDA含量顯著高于其對照,濃度增加后MDA含量下降;而豐優絲苗各處理間MDA含量無顯著差異。
3 討論與結論
3.1 討論
生物量被認為是植物受到污染物毒害最好的指示物[21]。污染物對植物生物量的影響與其濃度、植物種類以及生長期等有關[22]。有研究發現,低濃度DEHP或DBP處理促進植物生長,高濃度則抑制生長[8,13]。本研究中DEHP處理的生物量均比空白對照的低,說明DEHP脅迫抑制水稻生長。當植物受到DEHP脅迫時,會激發植物自身的防御體系,誘導POD活性增大以應對DEHP脅迫導致的體內氧自由基增加。類似的,有研究發現DBP和DEHP脅迫下綠豆POD活性隨著污染物濃度的增大而呈現上升趨勢,但達到最大值后,隨污染物濃度增大POD活性降低。這可能由于高濃度污染下產生的自由基數量超出了POD的清除能力而對植物造成傷害[13,23]。這說明POD活性存在一個閾值,對植物的保護作用存在一定的限度。本研究中POD活性一直保持上升的趨勢,可能是因為本研究水稻體內DEHP產生的自由基數量尚未超出POD的清除能力。
當植物吸收外源污染物后,體內的一些特定酶如酚氧化酶、氧化物酶、P450單加氧酶等,能對體內的外源污染物進行轉化/代謝[24-25]。例如,Gong等[26]研究發現,PPO主導了高羊茅(Festuca Arundinacea)體內多環芳烴的降解。本研究中,低濃度DEHP處理下培雜泰豐的PPO活性與對照間差異不顯著,而豐優絲苗的PPO活性顯著高于其對照,這可能是因為不同品種水稻對DEHP脅迫產生應激反應不同[22]。同一DEHP水平下,豐優絲苗的PPO活性顯著高于培雜泰豐的,可能影響水稻體內DEHP的降解進而導致前者體內DEHP含量較低。
2個品種水稻體內丙二醛含量基本保持不變(圖4),但其過氧化物酶和多酚氧化酶活性則隨DEHP濃度的增加而升高。這可能是因為水稻受到DEHP脅迫導致其體內活性氧自由基增加,地上部出現應激防御,提高POD和PPO活性,及時清除植物體內多余的活性氧自由基并降解DEHP,從而使MDA含量保持穩定,但具體原因有待進一步深入研究。
3.2 結論
DEHP脅迫下,培雜泰豐和豐優絲苗生物量均隨著DEHP濃度的升高而降低,說明50 mg/kg DEHP會抑制2種水稻的生長。培雜泰豐和豐優絲苗體內的DEHP含量均隨著DEHP濃度的升高而升高,說明2種水稻對DEHP均有累積效應,且DEHP更易被根系累積或滯留。
DEHP脅迫下,培雜泰豐和豐優絲苗體內的MDA含量基本保持不變,但POD和PPO活性均升高。豐優絲苗和培雜泰豐的POD和PPO活性變化規律不同,前者的POD活性比后者的高,可能影響到DEHP在水稻體內降解進而導致前者體內DEHP含量較低。
參考文獻
[1] 國家統計局農村社會經濟調查司. 中國農村統計年鑒[M]. 北京: 中國統計出版社, 2015: 41.
[2] 中國環境保護部. 第一次全國污染源普查公報[R]. 2010: 10.
[3] Mo C H, Cai Q Y, Zeng Q Y. Occurrence of priority organic pollutants in the fertilizers, China[J]. Journal of Hazardous Materials, 2008, 152(3): 1 208-1 213.
[4] Cai Q Y, Mo C H, Wu Q T, et al. The status of soil contamination by semivolatile organic chemicals(SVOCs)in China: A review[J]. Science of the Total Environment, 2008, 389(2-3): 209-224.
[5] Niu L L, Xu Y, Xu C, et al. Status of phthalate esters contamination in agricultural soils across China and associated health risks[J]. Environmental Pollution, 2014, 195: 16-23.
[6] 楊國義, 張天彬, 高淑濤, 等. 廣東省典型區域農業土壤中鄰苯二甲酸酯的分布特征[J]. 應用生態學報, 2007, 18(10): 2 308-2 312.
[7] Zhao H M, Du H, Xiang L, et al. Physiological differences in response to di-n-butyl phthalate(DBP)exposure between low- and high-DBP accumulating cultivars of Chinese flowering cabbage (Brassica parachinensis L.)[J]. Environmental Pollution, 2016, 208: 840-849.
[8] Zhao H M, Du H, Xiang L, et al. Variations in phthalate ester (PAE)accumulation and their formation mechanism in Chinese flowering cabbage(Brassica parachinensis L.)cultivars grown on PAE-contaminated soils[J]. Environmental Pollution, 2015, 206: 95-103.
[9] Ma T T, Christie P, Luo Y M, et al. Physiological and antioxidant responses of germinating Mung Bean seedlings to phthalate esters in soil[J]. Pedosphere, 2014, 24(1): 107-115.
[9] Mostofa M G, Hossain M A, Fujita M, et al. Physiological and biochemical mechanisms associated with trehalose-induced copper-stress tolerance in rice[J]. Scientific Reports, 2015, 5: 11 433.
[10] Edwards W, Bownes R, Leukes W D, et al. A capillary membrane bioreactor using immobilized polyphenol oxidase for the removal of phenols from industrial effluents[J]. Enzyme and Microbial Technology, 1999, 24: 209-217.
[11] Constabel C P, Bergey D R, Ryan C A. System in activates synthesis of wound-inducible tomato leaf polyphenol oxidase via the octadecanoid defense signaling pathway[J]. PNAS, 1995, 92: 407-411.
[12] Kwak S S, Kim S K, Park I H, et al. Enhancement of peroxidase activity by stressed-related chemicals in sweet potato[J]. Phytochemical Analysis, 1996, 43: 565-568.
[13] Ma T T, Christie P, Teng Y, et al. Rape(Brassica chinensis L.)seed germination, seedling growth, and physiology in soil polluted with di-n-butyl phthalate and bis(2-ethylhexyl)phthalate[J]. Environmental Science and Pollution Research, 2013, 20: 5 289-5 298.
[14] Winston G W. Oxidants and antioxidants in aquatic animals[J]. Comparative Biochemistry and Physiology, 1991, 100: 173-176.
[15] 嚴重玲, 洪業湯, 付舜珍, 等. Cd、Pb脅迫對煙草葉片中活性氧清除系統的影響[J]. 生態學報, 1997, 17(5): 488-492.
[16] Cai Q Y, Xiao P Y, Chen T, et al. Genotypic variation in the uptake, accumulation, and translocation of of di-(2-ethylhexyl) phthalate by twenty cultivars of rice(Oryza sativa L.)[J]. Ecotoxicology and Environmental Safety, 2015, 116: 50-58.
[17] 陳桐, 蔡全英, 吳啟堂, 等. PAEs脅迫對高/低累積品種水稻根系形態及根系分泌低分子有機酸的影響[J]. 生態環境學報, 2015, 24(3): 494-500.
[18] Ma T T, Christie P, Luo Y M, et al. Physiological and antioxidant responses of germinating Mung Bean seedlings to phthalate esters in soil[J]. Pedosphere, 2014, 24(1): 107-115.
[19] Wang J, Yuan J, Yang Z, et al. Variation in cadmium accumulation among 30 cultivars and cadmium subcellular distribution in 2 selected cultivars of water spinach(Ipomoea aquatica Forsk.)[J]. Journal of Agricultural and Food Chemistry,2009, 57: 8 942-8 949.
[20] John K S, Bhat S G, Rao UJSP, et al. Isolation and partial characterization of phenol oxidases from Mangifera indica L. sap(latex)[J]. Journal of molecular catalysis B-enzymatic, 2011, 68: 30-36.
[21] Shi G R, Cai Q S. Cadmium tolerance and accumulation in eight potential energy crops[J]. Biotechnology Advances, 2009, 27: 555-561.
[22] Xin J, Huang B, Liu A, et al. Identification of hot pepper cultivars containing low Cd levels after growing on contaminated soil: uptake and redistribution to the edible plant parts[J]. Plant soil, 2013, 373: 415-425.
[23] Liu W L, Zhang C B , Liu S Y. Effects of phthalate ester treatment on seed germination and antioxidant enzyme activities of Phaseolus radiatus L[J]. Bulletin of Environment Contamination and Toxicology, 2014, 92: 621-624.
[24] Kvesitadze E, Sadunishvili T, Kvesitadze G. Mechanisms of organic contaminant uptake and degradation in plants[J]. World Acad Sci Eng Technol, 2009, 55: 458-468.
[25] Schroder P. Phytoremediation: Methods and reviews[M]. Totowa: Humana Press, 2007: 251-263.
[26] Gong S S, Han J, Gao Y Z, et al. Effects of inhibitor and safener on enzyme activity and phenanthrene metabolism in root of tall fescue[J]. Acta Ecologica Sinica, 2011, 31: 4 027-4 033.

