氧化還原原理在電化學(xué)中的應(yīng)用
王章寧
摘要:電化學(xué)基礎(chǔ)在高中階段是一個(gè)知識(shí)難點(diǎn),利用氧化還原原理來(lái)進(jìn)行電化學(xué)的教學(xué),有利于學(xué)生對(duì)該部分知識(shí)的理解,反過(guò)來(lái)又鞏固和提高了氧化還原反應(yīng)知識(shí),更主要是訓(xùn)練了學(xué)生的思維,掌握了學(xué)習(xí)方法。通過(guò)研究和實(shí)踐探索,取得了較好的效果。證明采用氧化還原原理的分析方法是可行的、策略是有效的、措施是可控的、效果是顯著的。
關(guān)鍵詞:氧化還原;電化學(xué)基礎(chǔ);電化學(xué)應(yīng)用
氧化還原原理不僅僅是一個(gè)獨(dú)立的知識(shí)點(diǎn),更是一種工具,是貫穿整個(gè)高中化學(xué)知識(shí)體系的基本原理。體現(xiàn)在眾多的知識(shí)和題目解釋中,例如元素化合物的性質(zhì)、化學(xué)工業(yè)流程、化學(xué)實(shí)驗(yàn)探究、電化學(xué)應(yīng)用等,都會(huì)用到氧化還原原理。氧化還原的本質(zhì)就是電子的轉(zhuǎn)移,原電池的形成原理就是自發(fā)的氧化還原反應(yīng),在教學(xué)過(guò)程中,將兩者有效的結(jié)合起來(lái),能讓學(xué)生更好的理解電化學(xué),更好的應(yīng)用電化學(xué)的知識(shí)和電化學(xué)在生活中的應(yīng)用,并能鞏固和提高氧化還原反應(yīng)知識(shí)。
一、問(wèn)題研究的背景
氧化還原反應(yīng)在高一(人教版高中必修①)的課本中就已經(jīng)進(jìn)行過(guò)學(xué)習(xí),電化學(xué)的基礎(chǔ)在高一(人教版高中必修②)的課本開(kāi)始學(xué)習(xí)。高一必修②只是簡(jiǎn)單介紹了電化學(xué),詳細(xì)的介紹是在高二(人教版高中必修④第四章)學(xué)習(xí)。很多老師在電化學(xué)的教學(xué)過(guò)程中,簡(jiǎn)單的提及原電池和電解池與氧化還原反應(yīng)相關(guān),然后就進(jìn)行原電池和電解池的教學(xué),導(dǎo)致學(xué)生沒(méi)有從根本上理解電化學(xué)的來(lái)源和意義。從高一必修②中的Zn-Cu(H2SO4溶液)原電池、鋅錳干電池、鉛蓄充電電池、燃料電池,到高二選修④中的雙液電池、化學(xué)電源、電解池,有很多不同的電池需要了解和掌握。如果分散的進(jìn)行知識(shí)學(xué)習(xí),讓學(xué)生機(jī)械的記憶各種電池和其中的反應(yīng),會(huì)給學(xué)生造成很大的負(fù)擔(dān),也不利于學(xué)生對(duì)知識(shí)的掌握。尤其是選修④的教學(xué)中和高三的電化學(xué)復(fù)習(xí)過(guò)程中,必須要注意知識(shí)的聯(lián)系和銜接②。獨(dú)立的知識(shí)學(xué)習(xí)不利于學(xué)生對(duì)知識(shí)網(wǎng)絡(luò)的建立,以致電化學(xué)成為學(xué)生望而生畏的一個(gè)知識(shí)點(diǎn)。
無(wú)論是原電池還是電解池,均與氧化還原反應(yīng)直接相關(guān),如果能將氧化反應(yīng)原理貫穿于電化學(xué)的教學(xué)過(guò)程和復(fù)習(xí)過(guò)程中,就能形成一個(gè)完整的知識(shí)體系,同時(shí)很大程度的減輕學(xué)生需要記憶的壓力。
二、問(wèn)題研究的基本理論
1、美國(guó)當(dāng)代著名教育心理學(xué)家布魯納在他的《教育過(guò)程》中明確提出了學(xué)科結(jié)構(gòu)論的教學(xué)論思想,指出:“不論我們選教什么學(xué)科,務(wù)必使學(xué)生理解該學(xué)科的基本結(jié)構(gòu)”,“學(xué)習(xí)結(jié)構(gòu)就是學(xué)習(xí)事物間怎樣相互聯(lián)系的”。按照“認(rèn)知結(jié)構(gòu)組織起來(lái)的材料就是最有希望在記憶中‘自由出入的材料” ①。
2、新課程的“三維目標(biāo)”,包括“知識(shí)與技能”、“過(guò)程與方法”、“情感態(tài)度與價(jià)值觀”三方面。要求培養(yǎng)學(xué)生“獲取、收集、處理、運(yùn)用信息的能力、創(chuàng)新精神和實(shí)踐能力”。
三、問(wèn)題研究的方法
1、在幾個(gè)情況和基礎(chǔ)差不多的班級(jí)(高三),采用兩種不同的教學(xué)方法進(jìn)行電化學(xué)復(fù)習(xí),觀察其效果。其中一種是獨(dú)立的復(fù)習(xí)各種原電池、電解池,另一種是利用氧化還原原理復(fù)習(xí)原電池和電解池。
2、在幾個(gè)情況和基礎(chǔ)差不多的班級(jí)(高二),采用兩種不同的教學(xué)方法進(jìn)行電化學(xué)教學(xué),觀察其效果。其中一種是獨(dú)立的進(jìn)行各種原電池、電解池教學(xué),另一種是利用氧化還原原理進(jìn)行原電池和電解池教學(xué)。
3、廣泛交流,與同事討論電化學(xué)部分教學(xué)的方法、心得,分享教學(xué)過(guò)程中遇見(jiàn)的各種問(wèn)題。
四、問(wèn)題研究的案例
1、原電池的原理來(lái)源于氧化還原原理。氧化還原反應(yīng)的本質(zhì)是有電子的轉(zhuǎn)移,而判斷一個(gè)反應(yīng)是否屬于氧化還原反應(yīng)的方法則是看是否有化合價(jià)的變化。學(xué)生在高一的學(xué)習(xí)過(guò)程中已經(jīng)掌握了這個(gè)知識(shí),同時(shí)也明白了氧化還原反應(yīng)的內(nèi)涵。較早學(xué)習(xí)的氧化還原反應(yīng)是置換反應(yīng),如鋅與稀硫酸反應(yīng):Zn+H2SO4=ZnSO4+H2↑,其對(duì)應(yīng)的離子方程式為Zn + 2H+ = Zn2+ +H2↑。從氧化還原反應(yīng)的角度分析:
因?yàn)閆n直接與稀硫酸中的H+進(jìn)行了進(jìn)行了電子轉(zhuǎn)移,電能沒(méi)有得到應(yīng)用。而原電池的思維正是利用了氧化還原過(guò)程中發(fā)生的電子轉(zhuǎn)移,所以也要求原電池的形成原理就是自發(fā)的氧化還原反應(yīng)。將氧化反應(yīng)與還原反應(yīng)分開(kāi)來(lái),并將電子的“得”和“失”通過(guò)導(dǎo)線進(jìn)行連接,形成了電流,其裝置就是原電池。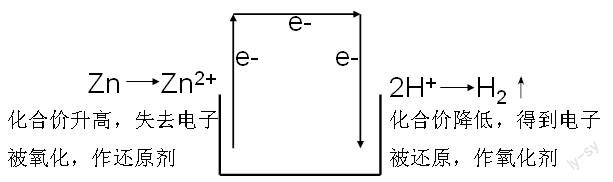
結(jié)合物理的知識(shí),失去電子的是負(fù)極,得到電子的是正極。負(fù)極反應(yīng)物為鋅,直接參與反應(yīng)并溶解。正極反應(yīng)物為H+,正極材料不需要直接反應(yīng),只需要是比Zn不活潑的導(dǎo)體就行了。如果正極用銅,就是必修②課本上都介紹到的Zn-Cu(H2SO4溶液)原電池。為此還可以引導(dǎo)學(xué)生去分析:如果另一個(gè)電極是比Zn更加活潑的金屬會(huì)有什么結(jié)果?其結(jié)論只不過(guò)是另一個(gè)氧化還原反應(yīng)而已。
為了使氧化反應(yīng)與還原反應(yīng)更加徹底的分開(kāi),于是就形成了雙液電池。我們將以上的反應(yīng)進(jìn)行設(shè)計(jì)成雙液電池,如下圖: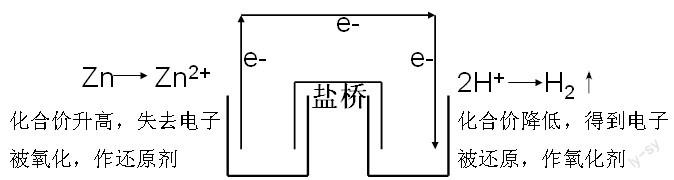
因此,理論上只要有自發(fā)的氧化還原反應(yīng),就可以設(shè)計(jì)成原電池。在這過(guò)程中,始終強(qiáng)調(diào)的是氧化還原反應(yīng)原理,即將氧化反應(yīng)與還原反應(yīng)分開(kāi),分別作為電池的負(fù)極和正極,從而實(shí)現(xiàn)了化學(xué)能向電能的轉(zhuǎn)化。
2、電極的判斷與電子的轉(zhuǎn)移、電解質(zhì)離子的移動(dòng)。根據(jù)原電池的原理與氧化還原原理的關(guān)系,原電池和化學(xué)電源對(duì)應(yīng)的各種問(wèn)題就迎刃而解了。首先進(jìn)行氧化還原分析,再根據(jù)氧化還原方法進(jìn)行電池分析。
例1:已知堿性鋅錳電池:Zn+2MnO2+2H2O = 2MnOOH+Zn(OH)2,根據(jù)氧化還原分析:

由此可知,Zn是負(fù)極,MnO2是正極,電子由Zn極經(jīng)過(guò)導(dǎo)線流向MnO2極。
例2:甲烷燃料電池(酸性環(huán)境):CH4+2O2→CO2+2H2O,根據(jù)氧化還原分析:
例3:鋼鐵吸氧腐蝕:2Fe+O2+2H2O=2Fe(OH)2,根據(jù)氧化還原分析:
由此可知,F(xiàn)e是負(fù)極,O2是正極,電子由Fe電極經(jīng)過(guò)導(dǎo)線流向O2所在電極碳。
例4:鉛蓄電池:Pb+PbO2+2H2SO4 = 2PbSO4+2H2O,根據(jù)氧化還原分析:
由此可知,Pb是負(fù)極,PbO2是正極,電子由Pb電極經(jīng)過(guò)導(dǎo)線流向PbO2電極。
歸納以上例子,只要依據(jù)氧化還原反應(yīng),就能很簡(jiǎn)單的判斷出電池的電極和電子的流動(dòng)方向及電流方向。
電子的移動(dòng)只存在導(dǎo)線中,根據(jù)物理的知識(shí),電流的形成需要有一個(gè)回路,因此在電解質(zhì)或電解質(zhì)溶液中,由離子導(dǎo)電。根據(jù)回路的方向特點(diǎn),陰離子帶負(fù)電,應(yīng)該與電子同一個(gè)方向,即同一個(gè)回路。而陽(yáng)離子帶正電,則與電流屬于同一個(gè)回路方向。具體理解如下圖所示: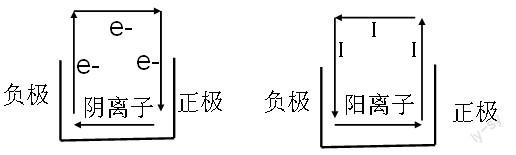
這個(gè)方法不僅適用于一般的原電池,同樣可以分析雙液電池和電解池中的離子移動(dòng)方向,如下圖所示: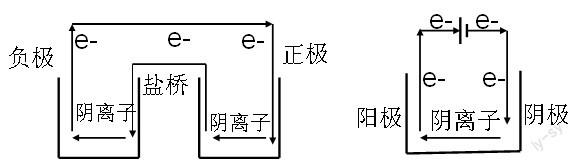
因此,在分析離子移動(dòng)方向的時(shí)候,不再是死記口訣,而是結(jié)合電子轉(zhuǎn)移來(lái)進(jìn)行理解,使得氧化還原的分析得到進(jìn)一步延伸和應(yīng)用。
3、原電池電極方程式書(shū)寫與氧化還原原理。原電池電極方程式的書(shū)寫是電化學(xué)中最難的一個(gè)部分,為此也出現(xiàn)了很多不同的方法。如果能夠結(jié)合氧化還原方程式的書(shū)寫方法,便能更好的理解電極方程式的來(lái)源。氧化還原方程式的書(shū)寫及其離子方程式書(shū)寫一般有三個(gè)步驟,其中包括:判斷反應(yīng)物和生成物,電子得失守恒,電荷守恒和元素守恒。因?yàn)樵姵厥菍⒀趸磻?yīng)拆開(kāi)了,因此步驟類似,但有所不同。應(yīng)該包括:判斷反應(yīng)物和生成物,電子得或失,電荷守恒和元素守恒。無(wú)論是書(shū)寫電極方程式,還是判斷電極方程式的正確與錯(cuò)誤,都應(yīng)該遵守以上三個(gè)步驟。
例5:堿性鋅錳電池:Zn+2MnO2+2H2O= 2MnOOH+Zn(OH)2,負(fù)極電極方程式的書(shū)寫過(guò)程包括:
正極電極方程式的書(shū)寫過(guò)程包括: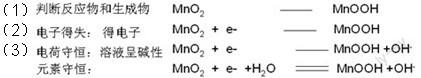
例6:堿性甲醇燃料電池:2CH3OH+3O2+4KOH = 2K2CO3+6H2O,負(fù)極電極方程式的書(shū)寫過(guò)程包括: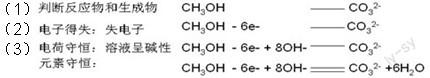
因此,遵循氧化還原反應(yīng)方程式書(shū)寫的過(guò)程,把氧化反應(yīng)與還原反應(yīng)分開(kāi)來(lái)分析,便可以得到原電池的電極方程式。不再需要其它的方法和進(jìn)行各種各樣的記憶,可以減輕學(xué)生的知識(shí)負(fù)擔(dān),同時(shí)也讓知識(shí)之間能融會(huì)貫通。
4、電解池與氧化還原原理。電解池是借助外電流發(fā)生的反應(yīng),由外界輸入能量推動(dòng),因此電解池不屬于自發(fā)的氧化還原反應(yīng)③。電子從外電源負(fù)極經(jīng)過(guò)導(dǎo)線流向電解池陰極,從電解池陽(yáng)極經(jīng)過(guò)導(dǎo)線流向外電源正極。因?yàn)橥瑯哟嬖陔娮拥牡檬В酝瑯邮谴嬖谘趸磻?yīng)和還原反應(yīng),只不過(guò)氧化反應(yīng)和還原反應(yīng)之間沒(méi)有了聯(lián)系,同時(shí)也不再將反應(yīng)物稱為氧化劑、還原劑。圖示如下: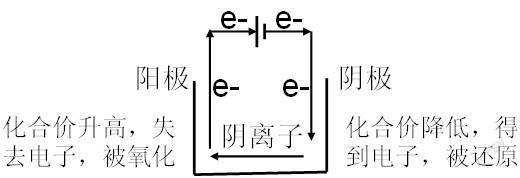
在陽(yáng)極,容易失去電子的物質(zhì)發(fā)生反應(yīng),可以是電極本身反應(yīng),也可以是電解質(zhì)或電解質(zhì)溶液中的離子(常見(jiàn)為陰離子)。于是根據(jù)還原性強(qiáng)弱,出現(xiàn)了離子放電順序。在陰極,容易得到電子的物質(zhì)發(fā)生氧化反應(yīng),同樣可以是電極本身,也可以是電解質(zhì)或電解質(zhì)溶液中的離子(常見(jiàn)為陽(yáng)離子)。根據(jù)離子氧化性的強(qiáng)弱來(lái)判斷哪種離子先發(fā)生還原反應(yīng)。
五、效果與反思
兩種不同教學(xué)方法和教學(xué)過(guò)程取得了不同的效果,利用氧化還原原理進(jìn)行電化學(xué)教學(xué)的方法所取得的效果明顯要優(yōu)越,其對(duì)比體現(xiàn)在以下三個(gè)方面:
1、學(xué)生評(píng)價(jià)。采用該方法使學(xué)生的思維能力、創(chuàng)新能力、實(shí)踐能力都得到了較大的提高。很多高三的學(xué)生在復(fù)習(xí)都說(shuō):“一直以來(lái)感覺(jué)電化學(xué)是一個(gè)知識(shí)難點(diǎn),看到題目就暈,學(xué)習(xí)運(yùn)用氧化還原方法后,電化學(xué)題目就特別容易了”。“原來(lái)化學(xué)知識(shí)都是相互關(guān)聯(lián)的,用一個(gè)知識(shí)解釋另一個(gè)知識(shí),我要嘗試在其它的問(wèn)題上也這樣去探索”。很多高二學(xué)生也說(shuō):“原來(lái)電化學(xué)的知識(shí)可以如此簡(jiǎn)單的理解,原來(lái)電流的產(chǎn)生是這么簡(jiǎn)單的原理,太神奇了。”
2、教師評(píng)價(jià)。站在整個(gè)高中化學(xué)知識(shí)體系的高度上去理解和研究化學(xué)教學(xué),讓學(xué)生從“學(xué)會(huì)”轉(zhuǎn)變?yōu)椤皶?huì)學(xué)”,掌握了知識(shí)的相互聯(lián)系,培養(yǎng)了學(xué)生知識(shí)運(yùn)用能力。體現(xiàn)了我校“博喻求真”的辦學(xué)理念和“因材施教、自主發(fā)展”的教學(xué)理念。
3、高考成績(jī)和競(jìng)賽成績(jī)。在各種的測(cè)試中,學(xué)生能得到更高的分?jǐn)?shù),體現(xiàn)出對(duì)了對(duì)知識(shí)更好的掌握情況。采用該方法的班級(jí)高考成績(jī)明顯要好一些,因?yàn)閷W(xué)生學(xué)會(huì)的不僅僅是一個(gè)知識(shí)點(diǎn),更是訓(xùn)練了一種分析問(wèn)題的思維,提高了一種知識(shí)運(yùn)用的能力。在高二年級(jí)參加的化學(xué)競(jìng)賽中,多名同學(xué)獲得了省、市、區(qū)的一等獎(jiǎng)。總體來(lái)看,利用氧化還原原理進(jìn)行電化學(xué)教學(xué)的方法是切實(shí)可行的,效果是顯著的。
但是,因?yàn)樵淼姆治錾嫌行┏橄螅瑢W(xué)生的分析問(wèn)題速度開(kāi)始會(huì)相對(duì)慢一些,從學(xué)會(huì)到靈活運(yùn)用需要一個(gè)熟悉過(guò)程。經(jīng)過(guò)仔細(xì)分析和探討,筆者認(rèn)為應(yīng)該讓學(xué)生自己學(xué)會(huì)畫(huà)圖,或者在已知的圖像上進(jìn)行標(biāo)注,從而加強(qiáng)對(duì)陌生電池的認(rèn)識(shí)和理解。因?yàn)橹灰Y(jié)合氧化還原原理,電化學(xué)的問(wèn)題都會(huì)迎刃而解。
參考文獻(xiàn)
[1] 邵守燦.高中化學(xué)整體結(jié)構(gòu)教學(xué)的構(gòu)建百度文庫(kù),2012.3.
[2] 王磊.理解與實(shí)踐高中化學(xué)新課程:與高中化學(xué)教師的對(duì)話[J].高等教育出版社,2007.7.
[3] 宋心琦.普通高中課程標(biāo)準(zhǔn)實(shí)驗(yàn)教科書(shū) 化學(xué)4選修[J].人民教育出版社,2008.6.

