甘蔗黃葉病與花葉病CP基因RNAi載體構建與轉化甘蔗研究
陳利平 陳平華 陳忠偉 王恒波 許莉萍 劉迪 高三基 郭晉隆 陳如凱


摘 要 甘蔗黃葉病和甘蔗花葉病是我國甘蔗最主要的病毒病,感病品種產量下降和品質變劣,傳統方法難以防治。RNA干擾技術使培育抗病毒甘蔗品種成為可能。本研究根據甘蔗黃葉病毒和侵染甘蔗的高粱花葉病毒結構與功能特性,廣泛收集不同來源病毒分離物CP基因序列,經過比對選取保守序列作為干擾序列。通過在序列兩端添加酶切位點,合成并連接成雙價甘蔗黃葉病和花葉病毒干擾序列,然后構建到中間載體pHANNIBAL上,形成雙價RNAi干擾結構,最后插入到pART27上形成干擾表達載體。利用基因槍轟擊甘蔗品種福農15號愈傷組織進行轉化,經G418篩選獲得抗性再生植株。通過提取DNA和 RNA分析,證實雙價RNAi干擾結構不僅以不同拷貝整合到甘蔗基因組中,而且得到了轉錄表達。
關鍵詞 甘蔗黃葉病毒;甘蔗花葉病毒;CP基因;雙價RNAi表達載體構建;遺傳轉化
中圖分類號 S566.1 文獻標識碼 A
Abstract Diseases caused by Sugarcane mosaic virus(SCMV)and Sugarcane yellow leaf virus(SCYLV)are widespread virus diseases in the growth of sugarcane in China. Sugarcane varieties infected the viruses produce less tonnage and sugar potential. Conventional methods don't work to control the diseases. The RNA interference technology makes it possible to create antiviral sugarcane varieties by genetic engineering. Based on the viral structure and functional characteristics of SrMV and SCYLV, sequences of the coat protein CP genes were collected and conserved sequences were selected as the RNA interference sequences after alignment. The two RNAi fragments were combined by designing PCR primers with restriction enzyme sites and constructed into vector pHANNIBAL to form the binary ihpRNA antiviral structure. The structure was then inserted the expression vector pART27. The expression vector was transformed into the calli of sugarcane cultivar FN15 via gene gun bombardment. Sugarcane plants were regenerated from G418 screening media. The regenerated plants were detected in DNA and RNA levels, which verifying the binary ihpRNA antiviral structure was not only integrated into the host genome in copies, but also transcribed successfully.
Key words SCYLV;SCMV;CP gene;Construction of binary ihpRNA expression vector;Genetic transformation
doi 10.3969/j.issn.1000-2561.2016.01.018
甘蔗是全世界最重要的糖料和能源作物[1]。甘蔗花葉病和黃葉病是甘蔗生產上最為普遍的兩種病毒病害[2-3]。我國的甘蔗花葉病多數情況下是由高粱花葉病毒(Sorghum moaic virus, SrMV)侵染引起[4],主要破壞甘蔗葉綠體,對甘蔗產量和含糖量造成嚴重損失[5],黃葉病不僅可造成甘蔗產量下降、品質變劣,而且會引起種性退化,嚴重可導致減產40%~60%[6]。化學防治對病毒病無效,防治方法主要是通過組織培養脫去甘蔗已經感染的病毒,但缺點是還會重新感染[7]。由于甘蔗是高度雜合的異源多倍體植物,其遺傳背景非常復雜,加之抗病毒病甘蔗種質匱乏[1],通過雜交培育抗病品種異常困難。隨著現代分子生物技術的發展,針對病毒病的RNA干擾技術為培育甘蔗抗病毒新品種指明了方向。如選取兩種病毒關鍵致病基因的保守序列,構建成RNA干擾結構,轉化甘蔗創制轉基因品種,干擾病毒RNA轉錄,則可培育抗病毒病甘蔗新品種。高梁花葉病毒是甘蔗花葉病的病原病毒之一[4],屬于馬鈴薯Y病毒屬[8],其基因組為正單鏈RNA,約有10 000個核苷酸。甘蔗花葉病毒CP基因致病機理的研究較多,其表達產物不僅可以包被病毒核酸,還可以促進蚜傳、系統侵染等[9]。目前已經有利用病毒CP基因保守序列構建RNAi表達載體轉化作物研究[10]。甘蔗黃葉病毒屬于馬鈴薯卷葉病毒[11],由蛋白質外殼及其包裹著的一條約5 890 bp單鏈正義RNA(ssRNA)構成[12],有6個明確的ORF框,5′端非翻譯區(UTR)以ACAAAA保守序列開始,3′端無Poly(A)尾巴,其中ORF3編碼病毒外殼蛋白(CP),對病毒RNA轉錄和病毒外殼組裝起作用。已有利用甘蔗黃葉病毒CP基因保守序列構建RNAi表達載體轉化煙草研究[13]。目前尚未有利用RNAi技術創制兼抗甘蔗花葉病和黃葉病甘蔗的研究報道。本研究擬在分析甘蔗花葉病毒和黃葉病毒分離物序列的基礎上,選取對病毒病致病起關鍵作用的CP基因,通過序列比對獲得保守序列,利用RNA干擾技術創制雙價抗花葉病和黃葉病聚合轉基因甘蔗新種質,為甘蔗產業持續健康發展提供核心技術支撐。
1 材料與方法
1.1 材料
1.1.1 植物受體材料 用作轉基因的受體甘蔗品種福農15號由福建農林大學國家甘蔗工程技術中心選育、保存。
1.1.2 菌株及質粒 RNAi中間載體pHANNIBAL和表達載體pART27、大腸桿菌感受態DH5α、福州地區甘蔗分離物高粱花葉病毒CP蛋白基因序列SrMV-FZ由福建農林大學農業部福建甘蔗生物學與遺傳育種重點實驗室提供。克隆載體pMD18-T購自TaKaRa公司。
1.1.3 試劑 甘蔗黃葉病毒CP基因保守序列由上海生物工程公司合成;限制性內切酶購自Fermentas公司;E.Z.N.A.TMGel Extraction Kit(D2500-02)、E.Z.N.A.TMPlasmid Mini Kit(D6942-02)購自OMEGA公司;T4 DNA Ligase 和DNA分子量標準D15 000+2 000 DNA Marker(MD116)、100 bp DNA Ladder(MD109)購自天根生化科技(北京)有限公司;Biospin Plant Genomic DNA Extraction Kit(BSC13S1)購自杭州博日科技有限公司;SYBRR Select Master Mix購自ABI公司;TrizolR試劑購自invitrogen公司;Premix TaqTM(RR902A)和RNA kit ver.3.0試劑盒購自TaKaRa公司。
1.1.4 儀器 德國Eppendorf公司5331型PCR儀,美國ABI公司ABI7500型實時熒光定量PCR儀,美國伯樂公司Bio-Rad PDS-1000/He基因槍及其耗材。
1.2 方法
1.2.1 甘蔗花葉病毒和黃葉病毒分離物序列比對與干擾序列獲得 通過登錄GenBank數據庫和查閱文獻,檢索甘蔗花葉病不同來源分離物SCMV的CP基因序列(以福州分離物高粱花葉病毒SrMV-FZ為參照)和甘蔗黃葉病毒不同來源分離物SCYLV的CP基因序列,利用BLAST方法對分離物進行同源比對,根據各病毒分離物CP基因共有的保守區域,選取適宜長度作為干擾序列,甘蔗花葉病毒CP基因干擾序列記為MCP,甘蔗黃葉病毒CP基因干擾序列記為YCP。根據質粒載體pHANNIBAL插入位置兩側內切酶位點和選取的保守序列設計引物,在MCP引物正義鏈的5′端分別引入ClaⅠ和EcoRⅠ酶切位點,反義鏈5′端引入XbaⅠ酶切位點;在YCP引物正義鏈5′端引入XbaⅠ位點,反義鏈5′端分別引入XhoⅠ和HindⅢ位點。MCP保守序列從本實驗室保存質粒中克隆,YCP保守序列以及PCR引物由上海生物工程公司合成。
1.2.2 雙價正反序列ihpRNA的中間載體構建
MCP和YCP用XbaⅠ酶切并回收,用T4 DNA Ligase連接形成雙價目的片段,經PCR擴增合成雙價連接片段 MYCP,測序確認。然后克隆到pMD18-T,重組質粒記為pT-MYCP,轉化DH5α。提取pT-MYCP和pHANNIBAL質粒,用XhoⅠ和EcoRⅠ雙酶切,回收目的片段、連接,重組質粒記為pHB-MYCP,轉化DH5α。提取質粒,用ClaⅠ和Hind Ⅲ分別雙酶切pT-MYCP和pHB-MYCP,回收目的片段,連接形成含內含子發夾結構的中間載體pRNAi YCP-MCP-intron-MCP-MCP,記為pHB-MYCP-YMCP,轉化DH5α,酶切驗證。
1.2.3 RNAi表達載體構建 對質粒pHB-MYCP-YMCP和pART27分別用NotⅠ酶切,回收pHB-MYCP-YMCP的4 290 bp片段和pART27的11 667 bp片段,連接形成含內含子發夾結構ihpRNA表達載體,命名為pART27-MYCP,轉化DH5α,酶切鑒定。
1.2.4 遺傳轉化和抗性苗篩選 以甘蔗品種福農15號愈傷組織為材料,按照陳平華等基因槍轉化甘蔗愈傷組織的方法[14],用構建的雙價RNAi表達載體pART27-MYCP包被鎢粉,利用基因槍轟擊轉導愈傷組織。轟擊后的愈傷組織用含40 mg/L G418的MS分化培養基篩選,對抗性再生植株提取DNA并進行分子鑒定。其中,分化篩選培養基成分:MS+3 mg/L 6-BA+0.5 mg/L KT+0.2 mg/L NAA +8.5 g/L瓊脂+30 g/L蔗糖+40 mg/L G418(pH 5.8);生根培養基:MS+3 mg/L NAA+0.2 mg/L 6-BA+8.5 g/L 瓊脂+30 g/L 蔗糖(pH 5.8)。
1.2.5 抗性再生植株DNA的制備與目的序列PCR檢測 按照Biospin 植物基因組DNA提取試劑盒說明書提取福農15號轉化抗性再生植株葉片DNA,測定DNA質量并將其濃度調整到50 ng/μL。為防止假陽性結果,按照張卓等的方法[15]對福農15號轉化抗性再生植株的DNA進行甘蔗內源ALS基因的PCR檢測,如果出現目的條帶則說明DNA樣品質量達到PCR反應要求,可以作為模板進行目的序列的PCR鑒定。
2 結果與分析
2.1 甘蔗花葉病毒和黃葉病毒分離物CP基因序列比對與干擾序列獲得
通過檢索Genbank數據庫和相關文獻,對國內外甘蔗花葉病毒已發布分離物的CP基因序列進行比對,所選序列Genbank登錄號分別為AY042184、AY149118、AF494510、AJ278405、AJ297628、NC004035、NC003398、AJ310198、smu57358,以本實驗室分離的福州地區分離物(本實驗室分離保存,未提交)的CP基因序列SrMV-FZ為參照。比對結果顯示,各分離物CP基因序列在8 900~9 500 bp同源性較高,達到85.3%,但中間穿插若干1~3 bp同源性低的小微片段,因序列保守性不是特別強,為提高對各病毒株系的干擾效果,選取了CP基因序列中8 960至9 382 bp之間、含多個同源性100%的區段、長度為423 bp的保守序列為甘蔗花葉病毒干擾序列MCP。
通過檢索Genbank數據庫和相關文獻,收集了國內外甘蔗黃葉病毒分離物22個,即bra-yl1、chn-yl1、per-yl1a、per-yl1b、reu-yl1a、reu-yl1b、reu-yl2、scylv-a、scylv-c3、scylv -chn1、scylv-cub2、scylv-f、scylv-fj1、scylv-fj2、scylv-fj3、scylv-gd1、scylv-gd2、scylv-gx1、scylv-gx2、scylv-in、scylv-yn1、scylv-yn2,序列比對結果顯示,不同來源甘蔗黃葉病毒分離物CP基因序列同源性極高,在180~400 bp同源性高達94.8%,同源小微片段很少且長度不超過2 bp。根據比對結果,以本地分離物ScYLV-fj1序列為參照,選取CP基因序列中180至409 bp之間高度保守的230 bp為甘蔗黃葉病毒干擾序列YCP。
根據選取的保守序列和質粒載體插入區域兩側內切酶位點,利用軟件Primer 5.0設計兩種病毒CP基因干擾序列MCP和YCP克隆引物如下:
連接產物克隆到pMD18-T,經轉化DH5α,提取質粒,用XhoⅠ和EcoRⅠ酶切鑒定,獲得3 377 bp的pT-MYCP。
2.3 雙價目的片段RNAi表達載體構建過程
pT-MYCP和pHANNIBAL質粒經過XhoⅠ和EcoRⅠ雙酶切,回收pT-MYCP小片段與質粒pHANNIBAL大片段,連接形成中間載體pHB-MYCP。再對pHB-MYCP和pT-MYCP分別同時進行ClaⅠ和Hind Ⅲ雙酶切,回收pT-MYCP小片段和pHB-MYCP大片段,連接形成含有雙價目的片段正反方向序列的中間載體pHB-MYCP-YMCP。最后對pHB-MYCP-YMCP和pART27用NotⅠ酶切,回收大片段,連接形成RNAi表達載體pART27-MYCP,總長度15 957 bp,用可以同時鑒別目的序列和供體質粒pART27的NotⅠ和SalⅠ酶切消化,預期可以產生4個條帶,SalⅠ(Ⅰ)至Lac Z 多克隆位點上NotⅠ(978)之間長度為978 bp,兩個NotⅠ中間插入的目的 RNAi 序列長度4 290 bp,第2個NotⅠ(5 268)與SalⅠ(7 954)位點間片段長度為2 686 bp,剩余片段長8 003 bp。質粒圖譜和酶切電泳結果見圖2,與預期一致,載體構建成功。
2.4 基因槍轟擊轉化及抗性苗再生與PCR檢測
通過基因槍轟擊和抗性篩選,獲得了161株再生苗,見圖3。
對提取的抗性植株DNA進行內參基因ALS檢測。取能夠擴增出171 bp特異性片段(對照正常)的抗性植株DNA,用正、反向檢測引物MYf和MYr進行干擾序列PCR檢測。隨機抽取其中20株檢測結果見圖4(相同編號為同一植株),可以看出,20株抗性植株檢測到正、反向干擾序列的植株各有3株(圖4-A中泳道6,11,15,圖4-B中泳道6,15,16),同時轉入正反向雙價抗病干擾序列的植株有2株(圖4-A和圖4-B中泳道6和15),說明已經將雙價抗病干擾序列轉入部分甘蔗植株中。
2.5 PCR陽性植株拷貝數測定
取5株具有完整正、反向干擾序列的轉基因植株(命名為MYCP1、MYCP2、MYCP3、MYCP4、MYCP5),依據用質粒建立的標準曲線方程,將各樣品的Ct值代入計算出相應的拷貝數。由于甘蔗基因組比較復雜,80%的甘蔗高貴種的基因組大小在7 500×106~8 500×106 bp之間[17],因此取甘蔗基因組平均值7 740×106 bp,則由拷貝數/2×{[6.02×1023×10-9×100/(7 740×106×660)]}得出各個樣品中MYCP干擾序列在甘蔗單個細胞基因組的拷貝數見表1。
通過標準差分析數據(保留小數點后2位),獲得各個轉基因樣品 MYCP干擾序列的拷貝數依次為 MYCP1 3.77±1.04,MYCP2 3.15±1.29,MYCP3 5.93±1.27,MYCP4 4.29±0.78,MYCP5 3.64±1.03。可見,5個轉基因植株MYCP的拷貝數范圍在2~7之間。
2.6 轉基因陽性植株干擾序列的表達分析
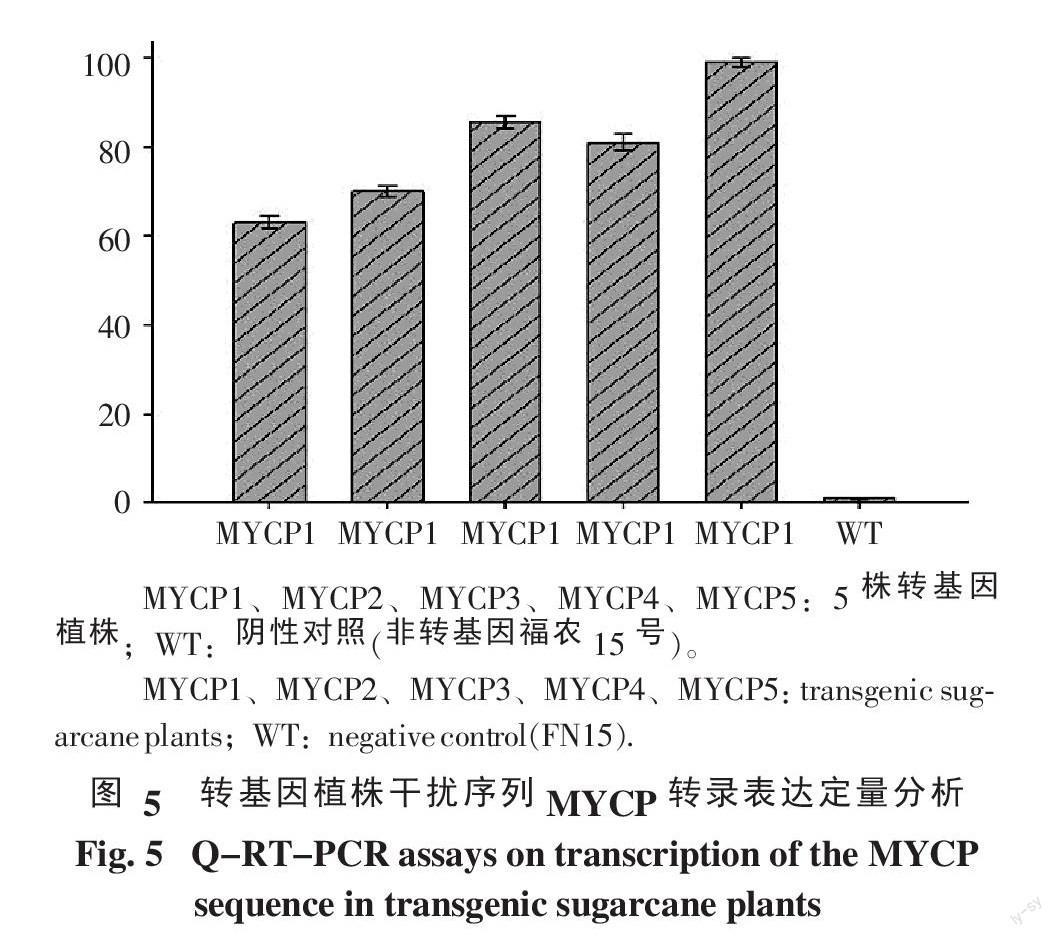
利用實時熒光定量RT-PCR對上述5株轉基因植株的MYCP干擾序列的表達量進行分析,以25SrRNA為內參基因,非轉基因福農15號為陰性對照,結果如圖5。
從圖5中的表達量中可以看出,所選的5株轉基因植株的MYCP干擾序列都進行了轉錄表達,但不同植株表達量存在差異,其中MYCP5的表達量比其它植株都高,而其干擾序列的拷貝數并不是最高,可見,MYCP干擾序列表達量與拷貝數沒有直接關系。
3 討論與結論
入選病毒分離物的代表性。本研究隨機選取不同來源的甘蔗花葉病與黃葉病分離物,既有國外,也有國內不同地域,比對結果發現不同來源的病毒分離物CP基因序列均存在不同程度的同源性,只是不同區段的同源性程度有差異。說明病毒在進化過程中盡管在不同地域發生了變異,形成了不同株系,但病毒的基本結構相似,這也解釋了為什么同類病毒盡管有多種不同株系,但其病征和癥狀大體相同的原因。因不同來源的病毒分離物CP基因序列均有同源性,通過選取同源性較高的區段就有可能獲得廣譜的干擾效果。
植物干擾片段大小選擇。經典的RNAi理論中,起干擾作用的RNAi片段較短,一般只有幾十個bp[18],但在植物上RNAi靶基因片段長度一般可以達到幾百個bp,相對容易操作成功[19]。較長的保守序列含有較多同源位點,通過轉化,有可能使受體作物同時獲得沉默一族病毒基因表達的優良轉基因甘蔗材料。保守序列是病毒長期進化或變異中保留下來的相對穩定的遺傳組成,可以經受時間的考驗,有可能較長期地保持對同族多種病毒的抗病性。
轉基因植株分子檢測。一般情況,轉基因植物的分子鑒定應該有Southern blot檢測和蛋白表達方面的內容。可能由于干擾片段較短、拷貝數較低以及甘蔗基因組較大等原因,Southern blot檢測結果不理想,因此選用定量分析的方法檢測出各轉基因植株目的序列的拷貝數,RNA檢測結果進一步表明干擾序列在轉錄水平進行了表達,證明干擾序列已成功整合入甘蔗基因組中。蛋白表達方面,RNAi抗病原理是在轉錄水平起作用,在病毒侵染轉基因作物后,干擾序列產生與病毒RNA同源的雙鏈RNA片段,使病毒mRNA發生降解而導致相應基因表達沉默,其干擾功能在RNA水平發揮,而不是依靠產生的蛋白起作用;加之,干擾序列只是DNA片段,不是基因,因此,沒有進行蛋白表達分析。
參考文獻
[1] 陳如凱. 現代甘蔗遺傳育種[M]. 北京: 中國農業出版社, 2010.
[2] 許東林, 周國輝. 侵染華南地區甘蔗的SCMV遺傳多樣性初探[J]. 植物病理學報, 2005, 35(6): 143-144.
[3] 許東林, 李俊光, 周國輝. 廣東甘蔗黃葉病田間調查及病原病毒的分子檢測[J]. 植物病理學報, 2006, 36(5): 404-406.
[4] 許東林, 周國輝, 沈萬寬,等. 侵染甘蔗的高梁花葉病毒遺傳多樣性分析[J]. 作物學報, 2008, 34(11): 1 916-1 920.
[5] Grisham M, Benda G T A, Koike H. Field losses in sugarcane from sugarcane mosaic virus(SCMV)infection[J]. Phytopathol, 1986, 76: 1 109-l 110.
[6] Lockhart B E L,Irey M J,Comstock J C. Sugarcane bacilliform virus, sugarcane mild mosaic virus and sugarcane yellow leaf syndrome[J]. In: Sugarcane Germplasm Conservation and Exchage B J, Croft C1V1, Piggin E S, Wallis and D M Hogarth(eds), AC1AR Proceedings. 1996, 67: 113-115.
[7] 周雪平, 李德葆. 抗病毒基因工程與轉基因植物釋放的環境風險評估[J]. 生命科學, 2000, 12(1): 4-6.
[8] Koike H, Gillaspie A G, Hughes G. G Mosaic. In: Ricaud C, Egan B T, Gillaspie A G, et al. Diseases of sugarcane: major diseases[G]. Elsevier Amsterdam, 1989: 301-322.
[9] Shukla D D, Ward C W. Structure of potyvirus coat proteins and its application in the taxonomy of the potyvirus group[J]. Adv. Virus Res., 1989, 36: 273-314.
[10] 秦 榮, 張 偉, 劉煒煒, 等. 黃瓜花葉病毒和番茄花葉病毒雙價抗性RNA沉默表達載體的構建[J]. 石河子大學學報, 2012, 4(8): 429-433.
[11] Moonan F, Molina J, Mirkov T E. Sugarcane yellow leaf virus: an emerging virus that has evolved by recombination between luteoviral and poleroviral ancestors[J]. Virology, 2000, 269(1): 156-171.
[12] Scagliusi S M, Lockhart B E L. Transmission, characerization and serology of a Lutrovirus associated with yellow leaf syndrome of sugarcane[J]. Phytopathology, 2000. 90: 120-124.
[13] 張雨良, 熊國如, 王健華,等. 甘蔗黃葉病毒CP蛋白基因ihpRNA表達載體構建及煙草轉化[J]. 植物研究, 2011, 31(5): 537-542.
[14] 陳平華, 陳如凱. 基因槍轉化甘蔗愈傷組織體系的優化[J]. 福建農林大學學報(自然科學版), 2004, 33(3): 355-358.
[15] 張 卓, 陳平華, 許莉萍, 等. 四價抗病蟲除草劑RNAi植物表達載體構建與轉化甘蔗研究[J]. 基因組學與應用生物學, 2014, 33(3): 661-673.
[16] Livak K J, Schmittgen T D. Analysis of Relative Gene Expression Data Using Real-Time Quantitative PCR and the 2-ΔΔCT Method[J]. Methods, 2001, 25(4): 402-408.
[17] Zhang J S, Nagai C, Yu Q Y, et al. Genome size variation in three Saccharum species[J]. Euphytica, 2012, 185(3): 511-519.
[18] Gupta P K. RNA interference-gene silencing by double-stranded RNA: The 2006 Nobel Prize for Physiology or Medicine[J]. Current Science, 2006, 91(11): 10.
[19] 郭志鴻, 王亞軍, 張金文, 等. 采用一種新型RNAi載體培育轉基因高直鏈淀粉馬鈴薯[J]. 作物學報, 2009, 35(5): 809-815.
責任編輯:凌青根

