不同遺傳類(lèi)群甘蔗黑穗病菌分離物與甘蔗互作防御酶差異的研究
徐剛紅,沈萬(wàn)寬,吳夏明,陳 雙,羅明珠,陳培壽
(華南農(nóng)業(yè)大學(xué) 農(nóng)學(xué)院,農(nóng)業(yè)部華南地區(qū)作物栽培科學(xué)觀察實(shí)驗(yàn)站,廣東 廣州 510316)
?
不同遺傳類(lèi)群甘蔗黑穗病菌分離物與甘蔗互作防御酶差異的研究
徐剛紅,沈萬(wàn)寬,吳夏明,陳雙,羅明珠,陳培壽
(華南農(nóng)業(yè)大學(xué) 農(nóng)學(xué)院,農(nóng)業(yè)部華南地區(qū)作物栽培科學(xué)觀察實(shí)驗(yàn)站,廣東 廣州510316)
摘要:為研究來(lái)源于不同遺傳類(lèi)群甘蔗黑穗病菌分離物侵染寄主甘蔗防御酶活性變化差異,采用注射接種法,將5個(gè)不同遺傳類(lèi)群的代表分離物(分離物編號(hào)依次為16,24,25,47,89號(hào))侵染抗病甘蔗品種Q171和感病甘蔗品種ROC22,測(cè)定甘蔗與甘蔗黑穗病菌分離物互作過(guò)程中超氧化物歧化酶(SOD)、過(guò)氧化物酶(POD)、過(guò)氧化氫酶(CAT)、苯丙氨酸解氨酶(PAL)和多酚氧化酶(PPO)的活性變化。結(jié)果表明:5株分離物侵染引起的寄主甘蔗SOD、POD、CAT活性變化曲線中均存在2個(gè)酶峰值,抗病甘蔗品種Q171中PPO和感病甘蔗品種ROC22中PAL也存在2個(gè)酶峰值,接種后1 d出現(xiàn)峰值Ⅰ,接種后3~5 d出現(xiàn)峰值Ⅱ。其中峰值Ⅱ時(shí)期,5株分離物侵染的甘蔗上述5種防御酶活性均高于對(duì)照,但不同分離物侵染的甘蔗SOD、POD、PAL活性的峰值Ⅱ大小及出現(xiàn)時(shí)間表現(xiàn)出差異,尤其是89號(hào)分離物峰值Ⅱ比其余4個(gè)分離物峰值Ⅱ出現(xiàn)時(shí)間提早1~2 d且峰值差異明顯。初步認(rèn)為89號(hào)分離物可能代表著與其他分離物不同的致病型生理小種。
關(guān)鍵詞:甘蔗;甘蔗黑穗病菌;防御酶
甘蔗(SaccharumofficinarumL.)屬重要的糖料作物及較有發(fā)展?jié)摿Φ目稍偕镔|(zhì)能源作物。我國(guó)是世界上第三大甘蔗糖生產(chǎn)大國(guó)(位于巴西、印度之后),廣西、云南、廣東是我國(guó)三大甘蔗糖產(chǎn)區(qū)。由甘蔗鞭黑粉菌(Sporisoriumscitamineum)引起的甘蔗黑穗病是一種世界性主要甘蔗病害,幾乎世界上所有的甘蔗生產(chǎn)國(guó)或地區(qū)都有甘蔗黑穗病發(fā)生的報(bào)道[1],該病嚴(yán)重影響甘蔗的產(chǎn)量和品質(zhì)[2]。近20年來(lái),甘蔗黑穗病在我國(guó)蔗區(qū)普遍發(fā)生,現(xiàn)有主栽品種普遍抗性較差,經(jīng)濟(jì)損失嚴(yán)重,該病已嚴(yán)重威脅我國(guó)甘蔗產(chǎn)業(yè)的可持續(xù)發(fā)展。由于甘蔗黑穗病潛伏期長(zhǎng),發(fā)病率高,藥劑防治效果極差,因此深入研究甘蔗對(duì)黑穗病的防御機(jī)制,選育抗黑穗病甘蔗品種是控制甘蔗黑穗病的重要措施之一[3]。以往對(duì)甘蔗黑穗病的研究主要集中在病原菌形態(tài)特征、快速檢測(cè)、遺傳多樣性、生理小種及病原菌與甘蔗互作等方面[4-9],而對(duì)甘蔗黑穗病菌侵染寄主甘蔗后寄主體內(nèi)超氧化物歧化酶(SOD)、過(guò)氧化物酶(POD)、過(guò)氧化氫酶(CAT)、苯丙氨酸解氨酶(PAL)和多酚氧化酶(PPO)等抗性酶的變化規(guī)律報(bào)道較少,至今未見(jiàn)不同分子遺傳背景甘蔗黑穗病菌分離物與甘蔗抗性酶活性關(guān)系的報(bào)道。本研究在華南農(nóng)業(yè)大學(xué)農(nóng)學(xué)院甘蔗研究室對(duì)我國(guó)90個(gè)甘蔗黑穗病菌分離物分子遺傳多樣性研究的基礎(chǔ)上,篩選出5株不同遺傳類(lèi)群的代表性分離物,通過(guò)對(duì)這5株分離物侵染不同抗性甘蔗品種后的寄主甘蔗主要防御酶活性變化的比較分析,旨在探討不同分子遺傳類(lèi)群的甘蔗黑穗病菌分離物與寄主互作防御酶活性變化差異,為甘蔗黑穗病菌生理小種鑒定提供參考依據(jù)。
1材料和方法
1.1供試材料
供試菌株:來(lái)源于華南農(nóng)業(yè)大學(xué)農(nóng)學(xué)院甘蔗研究室對(duì)我國(guó)90個(gè)甘蔗黑穗病菌分離物遺傳多樣性研究中的5個(gè)遺傳聚類(lèi)組中的代表菌株,編號(hào)分別為:16,24,25,47,89號(hào)分離物(表1)。分離物活化后“+”、“-”交配型分離物按1∶1(體積比)配成5×106孢子/mL的黑穗病菌孢子懸浮液,作為接種源。
供試甘蔗品種:高感甘蔗黑穗病品種新臺(tái)糖22(ROC22)和高抗甘蔗黑穗病品種Q171,來(lái)自于華南農(nóng)業(yè)大學(xué)甘蔗親本資源圃。供試材料于2014年12月種植于黑色塑料盆中,兩品種各種植30盆,每盆4株苗。
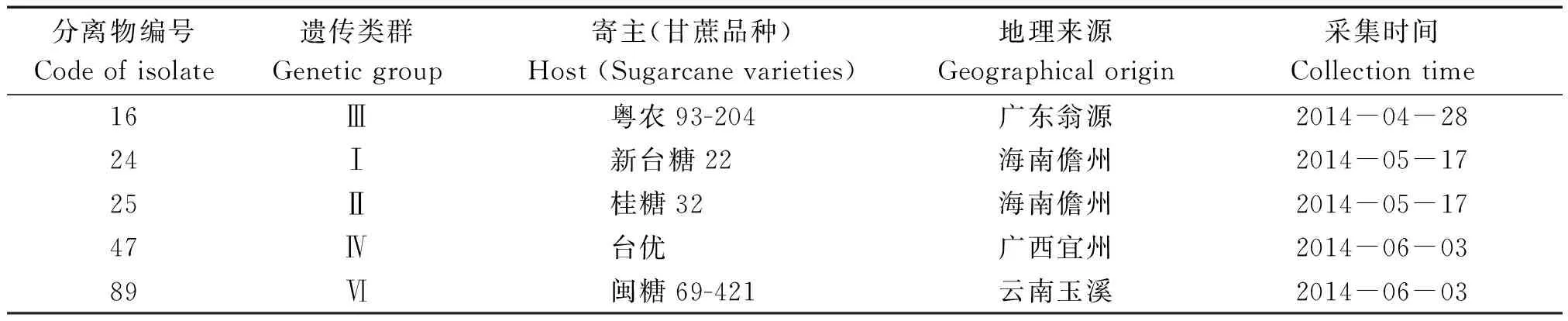
表1 甘蔗黑穗病菌分離物信息
1.2接種及采樣
待甘蔗幼苗長(zhǎng)至5-6葉期時(shí),對(duì)甘蔗小苗進(jìn)行注射接種,注射接種點(diǎn)位于蔗株生長(zhǎng)點(diǎn)下1 cm處。每個(gè)分離物每品種接種5盆(即20株甘蔗小苗/品種/分離物),以無(wú)菌水作為空白對(duì)照(CK),接種量為每株苗接種100 μL。接種后第0,1,2,3,4,5,6 天取樣,每個(gè)處理3次重復(fù),每個(gè)重復(fù)取3株苗+1葉混合作為樣品。樣品保存于-80 ℃冰箱,用于酶活性的測(cè)定。
1.3粗酶液的提取
參照Moerschbacher等[10]的方法,稍加改變,去掉葉片中脈,稱(chēng)取鮮樣0.3 g,液氮研磨,加2 mL 0.1 mol/L pH值8.8 的硼酸緩沖液(含1 mmol/L EDTA-Na2和5 mmol/L β-巰基乙醇)勻漿,轉(zhuǎn)入離心管,再用4 mL硼酸緩沖液沖洗研缽及研棒然后一并轉(zhuǎn)入離心管,4 ℃下振蕩5 min,同樣溫度下8 000 r/min離心15 min,轉(zhuǎn)移上清液置于-20 ℃貯存,用于超氧化物歧化酶(SOD)、過(guò)氧化物酶(POD)、過(guò)氧化氫酶(CAT)、苯丙氨酸解氨酶(PAL)、多酚氧化酶(PPO)的活性測(cè)定。
1.4SOD活性測(cè)定
參照陳建勛和王曉峰[11]的方法,3 mL反應(yīng)體系中含13 mmol/L 甲硫氨酸,75 μmol/L NBT,10 μmol/L EDTA-Na2,2.0 μmol/L核黃素,0.05 mol/L磷酸緩沖液(pH值7.8),加入50 μL的酶液(對(duì)照管以緩沖液代替),混勻。1只對(duì)照置于暗處,3只對(duì)照和樣品置于4 000 lux日光燈下反應(yīng)20 min。反應(yīng)結(jié)束后,以不光照對(duì)照做空白,分別測(cè)定其他反應(yīng)液在560 nm波長(zhǎng)下的吸光值。酶活性單位以抑制NBT光化反應(yīng)50%為1個(gè)酶活性單位表示。
1.5CAT活性測(cè)定
參照陳建勛和王曉峰[11]的方法,3 mL反應(yīng)體系包括0.3% H2O21 mL,H2O 1.95 mL,最后加50 μL的酶液,對(duì)照以H2O代替,迅速混勻,在240 nm波長(zhǎng)處進(jìn)行比色,立即開(kāi)始計(jì)時(shí),每隔30 s記錄一次吸光值,共測(cè)2 min。將每分鐘OD減少0.01定義為1個(gè)活力單位。
1.6POD活性測(cè)定
參照陳建勛和王曉峰[11]及李楊瑞等[12]的方法,3 mL反應(yīng)體系包括0.3% H2O21 mL、0.2% 愈創(chuàng)木酚 0.95 mL,0.05 mol/L pH值7.0 磷酸緩沖液1 mL,最后加50 μL的酶液,對(duì)照以緩沖液代替,迅速混勻,在470 nm波長(zhǎng)處進(jìn)行比色,立即開(kāi)始計(jì)時(shí),每隔30 s記錄一次吸光值,共測(cè)2 min。將每分鐘OD增加0.1定義為1個(gè)活力單位。
1.7PAL活性測(cè)定
參照李合生[13]和金慶超等[14]的方法,4 mL反應(yīng)體系包括0.02 mol/L L-苯丙氨酸1 mL,0.1 mol/L pH值8.8硼酸緩沖液2 mL,然后加酶液1 mL,對(duì)照以緩沖液代替,混勻后,立即在290 nm處測(cè)起始OD值,并精確計(jì)時(shí)。將測(cè)定后的各管于38 ℃水浴保溫30 min,冰浴終止反應(yīng),再于290 nm處測(cè)定各管的OD值。以每30 min,OD增加0.01定義為1個(gè)活力單位。
1.8PPO活性測(cè)定
參照曹建康等[15]和楊麗濤等[16]的方法,稍加改變,3 mL 反應(yīng)體系包括0.02 mol/L領(lǐng)苯二酚 0.5 mL,0.1 mol/L pH值7.0磷酸緩沖液2 mL,最后加0.5 mL酶液,對(duì)照以緩沖代替,迅速混勻,在398 nm波長(zhǎng)處進(jìn)行比色,立即開(kāi)始計(jì)時(shí),每隔30 s記錄一次吸光值,共測(cè)2 min。以每分鐘OD增加0.01定義為1個(gè)活力單位。
2結(jié)果與分析
2.1超氧化物歧化酶(SOD)
抗、感甘蔗品種Q171和ROC22接種甘蔗黑穗病菌后SOD活性變化如圖1:SOD活性在抗、感品種中變化趨勢(shì)基本一致,總體表現(xiàn)為“上升-下降-上升”的趨勢(shì),接種后1 d均出現(xiàn)峰Ⅰ。在抗病品種Q171中,89號(hào)分離物處理出現(xiàn)3個(gè)峰值,接種后第3天出現(xiàn)峰值Ⅱ,第5天出現(xiàn)峰值Ⅲ;16,24號(hào)分離物處理在接種后第4天出現(xiàn)峰值Ⅱ,25,47號(hào)分離物處理在第5天出現(xiàn)峰值Ⅱ。峰值Ⅱ時(shí),接種不同分離物的甘蔗SOD活性都高于對(duì)照,且不同分離物間的甘蔗SOD活性差異明顯,接種第4天,16號(hào)分離物與89號(hào)分離物間差異達(dá)顯著水平,接種第5天,16,24號(hào)分離物與25,47,89號(hào)分離物間差異達(dá)顯著水平。在感病品種ROC22中,89號(hào)分離物在接種后第4天出現(xiàn)峰值Ⅱ,其余4個(gè)分離物在第5天出現(xiàn)峰值Ⅱ。峰值Ⅱ時(shí)期各分離物處理SOD活性均高于對(duì)照,不同分離物間SOD活性差異不明顯。
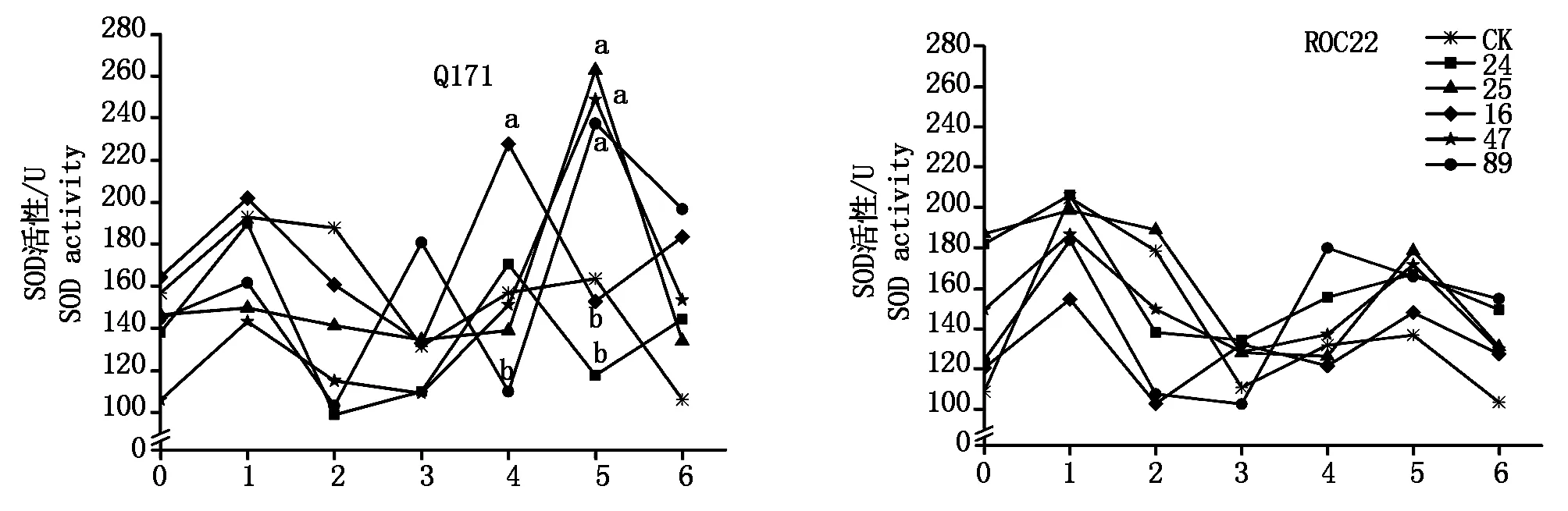
a、b表示同一時(shí)間內(nèi)在0.05水平差異顯著。圖2-5同。
2.2過(guò)氧化物酶(POD)
抗、感甘蔗品種Q171和ROC22與甘蔗黑穗病菌的互作過(guò)程中,POD活性變化總體表現(xiàn)為“上升-下降-上升”的趨勢(shì),接種后1 d出現(xiàn)峰Ⅰ。在抗病品種Q171中,24,89號(hào)分離物接種后第4天出現(xiàn)峰值Ⅱ,16,25,47號(hào)分離物接種后第5天出現(xiàn)峰值Ⅱ。峰值Ⅱ時(shí)期,所有分離物處理的甘蔗POD活性均高于對(duì)照,不同分離物間的POD活性差異不明顯。在感病品種ROC22中,25,47,89號(hào)分離物接種后第4天出現(xiàn)峰值Ⅱ,16,24號(hào)分離物接種后第5天出現(xiàn)峰值Ⅱ。峰值Ⅱ時(shí)期,所有分離物處理的甘蔗POD活性均高于對(duì)照,各分離物間的POD活性差異明顯,其中16號(hào)分離物與47號(hào)分離物間差異達(dá)顯著水平(圖2)。
2.3過(guò)氧化氫酶(CAT)
抗、感甘蔗品種Q171和ROC22與甘蔗黑穗病菌的互作過(guò)程中,CAT活性變化明顯。在抗病品種Q171中,89號(hào)分離物處理的甘蔗CAT活性呈穩(wěn)定上升趨勢(shì),并不出現(xiàn)明顯的峰值,而16,24,25,47號(hào)分離物處理的甘蔗CAT活性在接種后第1天有出現(xiàn)峰值的趨勢(shì),但不明顯,分別在第3,5天出現(xiàn)峰值Ⅰ、峰值Ⅱ。5個(gè)分離物的甘蔗CAT活性在第5天后均高于對(duì)照,各分離物間差異明顯,其中47號(hào)分離物與89號(hào)分離物間差異達(dá)顯著水平。在感病品種ROC22中,所有分離物接種后第1天均出現(xiàn)峰值Ⅰ,24,25,89號(hào)分離物第3天出現(xiàn)峰值Ⅱ,16,47號(hào)分離物第4天出現(xiàn)峰值Ⅱ;接種第4天后,各分離物處理CAT活性均高于對(duì)照,各分離物間差異較大,接種后第6天89號(hào)分離物與24號(hào)分離物間差異達(dá)顯著水平(圖3)。
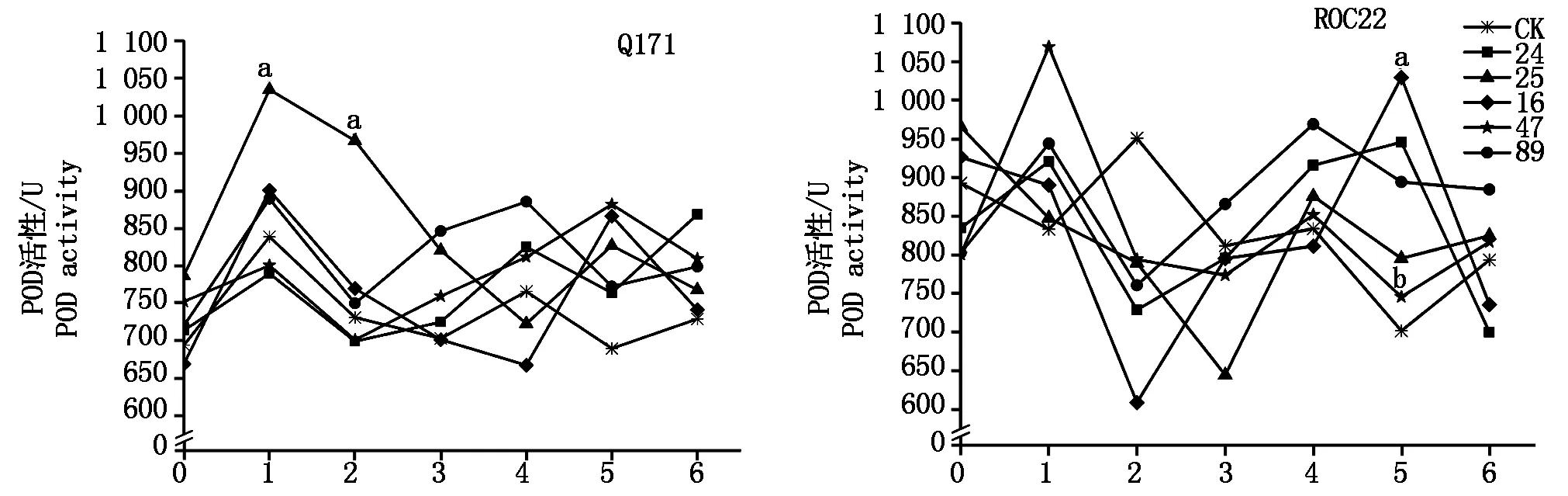
圖2 甘蔗與甘蔗黑穗病菌互作過(guò)程中POD活性變化
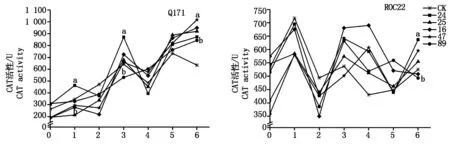
圖3 甘蔗與甘蔗黑穗病菌互作過(guò)程中CAT活性變化
2.4苯丙氨酸解氨酶(PAL)
抗、感甘蔗品種Q171和ROC22與甘蔗黑穗病菌的互作過(guò)程中,PAL活性變化明顯。抗病品種Q171接種后,各分離物處理的甘蔗PAL活性穩(wěn)定上升,89號(hào)分離物接種后第3天出現(xiàn)峰值Ⅰ,16,25號(hào)分離物第4天出現(xiàn)峰值Ⅰ,24,47號(hào)分離物第5天出現(xiàn)峰值Ⅰ。接種4 d后,除25號(hào)分離物外,其余4個(gè)分離物處理的甘蔗PAL活性均高于對(duì)照,各分離物處理間差異明顯,接種第3天,89號(hào)分離物與24,25,47號(hào)分離物間差異達(dá)顯著水平,接種第5天,47號(hào)分離物與25號(hào)分離物間差異也達(dá)顯著水平。感病品種ROC22接種后1 d各分離物處理均出現(xiàn)峰值Ⅰ,16,47,89號(hào)分離物處理第4天出現(xiàn)峰值Ⅱ,24,25號(hào)分離物處理第5天出現(xiàn)峰值Ⅱ。各分離物峰值Ⅱ時(shí)期PAL活性都高于對(duì)照,接種第4天,16號(hào)分離物與25號(hào)分離物間差異達(dá)顯著水平,接種第5天,89號(hào)分離物與24號(hào)分離物間差異達(dá)顯著水平(圖4)。
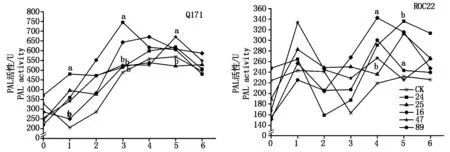
圖4 甘蔗與甘蔗黑穗病菌互作過(guò)程中PAL活性變化
2.5多酚氧化酶(PPO)
抗、感甘蔗品種Q171和ROC22與甘蔗黑穗病菌的互作過(guò)程中,PPO活性變化明顯。抗病品種Q171接種后第2,5天出現(xiàn)峰值Ⅰ和峰值Ⅱ,峰值Ⅱ值大于峰值Ⅰ值;接種第5天,除25號(hào)分離物處理外,其他4個(gè)分離物處理的甘蔗PPO活性均大于對(duì)照,各分離物間差異不顯著。感病品種ROC22接種后PPO活性呈一穩(wěn)定上升單峰曲線,第5天出現(xiàn)峰值Ⅰ;在峰值Ⅰ時(shí)期,除89號(hào)分離物處理外,其余4個(gè)分離物處理的甘蔗PPO活性均大于對(duì)照,各分離物間差異不顯著(圖5)。
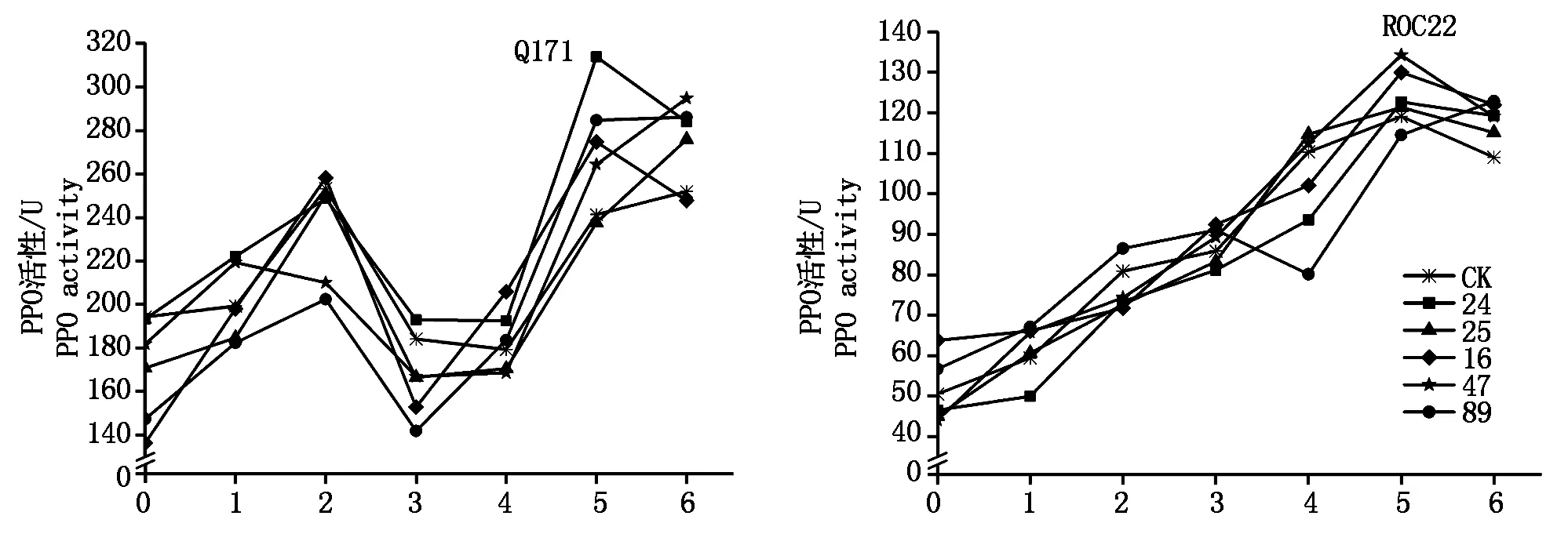
圖5 甘蔗與甘蔗黑穗病菌互作過(guò)程中PPO活性變化
3討論
SOD、CAT、POD是細(xì)胞內(nèi)防御酶系統(tǒng)的主要成員,是活性氧清除酶類(lèi),能抵御活性氧和氧自由基對(duì)細(xì)胞膜系統(tǒng)的傷害,對(duì)細(xì)胞具有保護(hù)作用。本試驗(yàn)中,接種不同遺傳類(lèi)群分離物的抗、感甘蔗品種SOD活性總體均呈現(xiàn)先上升,后下降,再上升的兩峰值的趨勢(shì),這與孔凡明等[17]研究煙草/TMV互作的結(jié)果和李赤等[18]研究香蕉/香蕉枯萎病菌互作結(jié)果有差別,與鄒芳斌等[19]研究黃瓜/枯萎病互作和莫鳳連[20]研究甘蔗/甘蔗黑穗病互作中抗性酶活性變化曲線存在2個(gè)峰值的結(jié)果是一致的。SOD活性在接種后1 d出現(xiàn)峰值Ⅰ和4~5 d峰值Ⅱ,與莫鳳連[20]的結(jié)果相比,峰值Ⅰ和峰值Ⅱ出現(xiàn)的時(shí)間提前2 d,這可能與選擇的寄主甘蔗品種抗病性有關(guān)。抗、感2個(gè)甘蔗品種的各分離物處理的第Ⅱ峰值時(shí)期(4~5 d)SOD活性均比對(duì)照高,與宋培玲等[21]和汪紅等[22]的結(jié)果一致。健康的植株內(nèi)本身存在SOD,在體內(nèi)維持著動(dòng)態(tài)平衡,當(dāng)病原菌侵入后,啟動(dòng)SOD防御體系,因此在感病高發(fā)期,接種病原菌植株SOD活性均高于對(duì)照。本研究中,接種后抗病品種Q171的CAT活性除89號(hào)分離物呈穩(wěn)定上升趨勢(shì),其他4個(gè)分離物均呈現(xiàn)一上升的雙峰值曲線,分別在接種后第3,5天出現(xiàn)峰值Ⅰ和峰值Ⅱ;而感病品種ROC22分別在接種后第1天和第3~4天出現(xiàn)峰值Ⅰ和峰值Ⅱ,但峰值小于抗病品種Q171。本研究中,接種后抗、感品種的POD活性變化幅度不大,但始終處于較高活性水平,總體呈現(xiàn)先上升,后下降,再上升的趨勢(shì),第4天后,各分離物處理的甘蔗POD活性均高于對(duì)照,但各分離物間差異不明顯。許莉萍等[23]認(rèn)為POD可以作為一個(gè)甘蔗抗黑穗病生理指標(biāo),Armas等[2]認(rèn)為黑穗病菌侵染引起甘蔗POD活性升高,POD活性增加是甘蔗抵御黑穗病菌的重要防御機(jī)制,但不是防御機(jī)制中的決定性因素。左示敏等[24]在研究水稻/紋枯病菌毒素互作中發(fā)現(xiàn),SOD酶系統(tǒng)啟動(dòng)要早于POD酶系統(tǒng)。王海河等[25]認(rèn)為在寄主抗病性反應(yīng)過(guò)程中,SOD酶系統(tǒng)的啟動(dòng)時(shí)間比啟動(dòng)POD酶系統(tǒng)的時(shí)間早,POD酶防御系統(tǒng)是SOD酶防御系統(tǒng)的補(bǔ)救體系。本試驗(yàn)中,SOD比POD對(duì)甘蔗黑穗病菌入侵反應(yīng)更敏感,酶活變化幅度更明顯。因此,可以初步認(rèn)為POD酶防御系統(tǒng)是SOD酶防御系統(tǒng)在甘蔗抗黑穗病菌入侵的補(bǔ)救系統(tǒng)。
PAL、PPO是次生代謝有關(guān)酶類(lèi)。PAL催化苯丙氨酸脫氨基后產(chǎn)生肉桂酸并最終轉(zhuǎn)化為木質(zhì)素,是與細(xì)胞內(nèi)木質(zhì)素生成和沉積有關(guān)的防御酶。PPO的作用機(jī)制是將細(xì)胞代謝產(chǎn)物中的酚類(lèi)物質(zhì)氧化為醌類(lèi)來(lái)殺死細(xì)胞限制病原物進(jìn)一步擴(kuò)展[26]。有關(guān)學(xué)者研究認(rèn)為PAL、PPO在植株受病原菌侵染后其活性升高,與抗病性呈正相關(guān),可將PAL、PPO作為衡量植株抗性的生理指標(biāo)[27-28]。本試驗(yàn)接種后,抗病品種Q171和感病品種ROC22的PAL、PPO活性明顯升高,抗病品種Q171的酶活性及酶活性升高幅度均高于感病品種ROC22,這與酶活性與抗病性呈正相關(guān)的結(jié)論一致[29-30],也與Santiago等[31]認(rèn)為抗性品種比易感品種酶活能維持更長(zhǎng)時(shí)間,更高活性水平的結(jié)論相一致。
王海河等[25]在研究黃瓜花葉病毒不同毒性毒株與煙草細(xì)胞內(nèi)防御酶系統(tǒng)的關(guān)系時(shí)發(fā)現(xiàn),致病力極強(qiáng)的毒株在侵染寄主后可能造成防御酶系統(tǒng)崩潰或抑制防御酶系統(tǒng),致病力弱的毒株可以誘導(dǎo)寄主細(xì)胞防御酶體系產(chǎn)生抗性反應(yīng),寄主細(xì)胞中SOD、PPO、PAL酶系統(tǒng)對(duì)不同致病力毒株入侵的反應(yīng)明顯不同,認(rèn)為同一寄主內(nèi)防御酶活性可以作為病毒毒株致病力的鑒別指標(biāo)。本研究中,從試驗(yàn)結(jié)果可以看出,接種不同遺傳類(lèi)群甘蔗黑穗病菌分離物的甘蔗SOD、POD、PAL對(duì)病原菌入侵的反應(yīng)速度和強(qiáng)度都表現(xiàn)出差異,尤其是在反應(yīng)速度上,5株分離物處理的甘蔗SOD、POD、PAL酶活分別在接種后3~5 d的不同時(shí)間里出現(xiàn)峰值Ⅱ,但89號(hào)分離物處理的甘蔗SOD、POD、PAL出現(xiàn)峰值Ⅱ的時(shí)間比其余4株分離物提早1~2 d,且89號(hào)分離物處理的抗病品種Q171的SOD、CAT、PAL與24、47號(hào)分離物間的差異在接種后第3-6 d不同時(shí)間里能達(dá)到顯著水平。表明89號(hào)分離物與甘蔗互作引起的寄主甘蔗主要防御酶活性變化與來(lái)源于其余4個(gè)不同遺傳類(lèi)群的4株分離物引起的寄主甘蔗防御酶活性變化存在明顯差異。89號(hào)分離物的致病力與其余4株分離物是否存在明顯差異或代表著一個(gè)不同生理小種,有待于進(jìn)一步測(cè)定其致病力。
參考文獻(xiàn):
[1]Singh N,Somai B M,Pillay D.Smut disease assessment by PCR and microscopy in inoculated tissue cultured sugarcane cultivars[J].Plant Science,2004,167(5):987-994.
[2]Armas R D,Santiago R,Legaz M E,et al.Levels of phenolic compounds and enzyme activity can be used to screen for resistance of sugarcane to smut(Ustilagoscitaminea)[J].Australasian Plant Pathology,2007,36(1):32-38.
[3]Croft B J,Braithwaite K S.Management of an incursion of sugarcane smut in Australia[J].Australasian Plant Pathology,2006,35(2):113-122.
[4]Alexander K C,Krishna R K.Studies on smut disease(Ustilagoscitaminea)of sugarcane:Longevity and viability of teliospores[J].Indian Journal of Sugarcane Technology,1978,1:47-49.
[5]吳轉(zhuǎn)娣,昝逢剛,吳才文,等.甘蔗黑穗病菌的快速檢測(cè)[J].西南農(nóng)業(yè)學(xué)報(bào),2010,23(5):1548-1550.
[6]沈萬(wàn)寬,楊湛端,劉睿,等.基于PCR和巢式PCR技術(shù)的甘蔗黑穗病早期檢測(cè)[J].熱帶作物學(xué)報(bào),2013,34(9):1756-1760.
[7]Shen W K,Xi P G,Li M H,et al.Genetic diversity ofUstilagoscitamineaSyd.in Southern China revealed by combined ISSR and RAPD analysis[J].African Journal of Biotechnology,2012,11(54):11693-11703.
[8]熊?chē)?guó)如,趙更峰,伍蘇然,等.海南蔗區(qū)甘蔗黑穗病菌生理小種鑒定[J].熱帶作物學(xué)報(bào),2013,34(7):1328-1334.
[9]莫鳳連,楊麗濤,潘如科,等.甘蔗黑穗病菌脅迫對(duì)甘蔗內(nèi)源激素含量的影響[J].南方農(nóng)業(yè)學(xué)報(bào),2012,43(11):1676-1681.
[10]Moerschbacher B M,Noll U M,Flott B E,et al.Lignin biosynthetic enzymes in stem rust infected,resistant and susceptible near-isogenic wheat lines[J].Physiological and Molecular Plant Pathology,1988,33(1):33-46.
[11]陳建勛,王曉峰.植物生理學(xué)實(shí)驗(yàn)指導(dǎo)[M].廣州:華南理工大學(xué)出版社,2002:68-73.
[12]李楊瑞.甘蔗組織中過(guò)氧化物酶活性及其與生長(zhǎng)和工藝成熟的關(guān)系初探[J].廣西農(nóng)學(xué)院學(xué)報(bào),1990,9(1):13-18.
[13]李合生.植物生理生化實(shí)驗(yàn)原理和技術(shù)[M].北京:高等教育出版社,2000:12-78.
[14]金慶超,葉華智,張敏.苯丙氨酸解氨酶活性與玉米對(duì)紋枯病抗性的關(guān)系[J].四川農(nóng)業(yè)大學(xué)學(xué)報(bào),2003,21(2):116-118.
[15]曹建康,姜微波,趙玉梅.果蔬采后生理生化實(shí)驗(yàn)指導(dǎo)[M].北京:中國(guó)輕工業(yè)出版社,2007:76-120.
[16]楊麗濤,李楊瑞,莫家讓.硝酸鑭、混合稀土對(duì)甘蔗葉片多酚氧化酶和過(guò)氧化物酶活性的影響[J].廣西農(nóng)學(xué)院學(xué)報(bào),1990,9(3):80-84.
[17]孔凡明,楊光,陳學(xué)平,等.煙草與TMV不同互作體系中的活性氧及抗氧化酶系活性比較[J].安徽農(nóng)業(yè)大學(xué)學(xué)報(bào),2002,29(3):217-223.
[18]李赤,黎永堅(jiān),于莉.香蕉枯萎病菌對(duì)不同香蕉品種防御酶系的影響[J].中國(guó)農(nóng)學(xué)通報(bào),2010,26(17):251-255.
[19]鄒芳斌,司龍亭,李新,等.黃瓜枯萎病抗性與防御系統(tǒng)幾種酶活性關(guān)系的研究[J].華北農(nóng)學(xué)報(bào),2008,23(3):181-184.
[20]莫鳳連.甘蔗受黑穗病菌侵染后的形態(tài)結(jié)構(gòu)及生理生化變化[D].南寧:廣西大學(xué),2012.
[21]宋培玲,張鍵,郝麗芬,等.不同抗性油菜品種接種黑脛病菌防御酶活性變化研究[J].華北農(nóng)學(xué)報(bào),2015,30(2):110-115.
[22]汪紅,劉輝,袁紅霞,等.棉花黃萎病不同抗性品種接菌前后體內(nèi)酶活性及酚類(lèi)物質(zhì)含量的變化[J].華北農(nóng)學(xué)報(bào),2001,16(3):46-51.
[23]許莉萍,王建南,陳如凱.甘蔗對(duì)黑穗病的生化反應(yīng)及其與抗病性的關(guān)系[J].甘蔗,1994,1(3):13-16.
[24]左示敏,陳夕軍,陳紅旗,等.不同抗性水平水稻品種對(duì)紋枯病菌毒素的防衛(wèi)反應(yīng)與生理差異[J].中國(guó)水稻科學(xué),2014,28(5):551-558.
[25]王海河,林奇英,謝聯(lián)輝,等.黃瓜花葉病毒三個(gè)毒株對(duì)煙草細(xì)胞內(nèi)防御酶系統(tǒng)及細(xì)胞膜通透性的影響[J].植物病理學(xué)報(bào),2001,31(1):43-49.
[26]田麗波,楊衍,商桑,等.不同苦瓜品系的抗白粉病能力及其與防御酶活性的相關(guān)性[J].沈陽(yáng)農(nóng)業(yè)大學(xué)學(xué)報(bào),2015,46(3):284-291.
[27]王紅英,錢(qián)春桃,張永兵,等.不同抗性甜瓜接種蔓枯病菌后若干生理指標(biāo)的變化[J].中國(guó)瓜菜,2012,25(1):7-10.
[28]楊輝,沈火林,朱鑫,等.防御酶活性、木質(zhì)素和總酚含量與辣椒抗黃瓜花葉病毒的關(guān)系[J].中國(guó)農(nóng)學(xué)通報(bào),2006,22(5):369-373.
[29]馬景蕃,劉喜明,劉建奎,等.不結(jié)球白菜感染菌核病后防御酶活性的變化[J].江蘇農(nóng)業(yè)學(xué)報(bào),2012,28(6):1403-1408.
[30]馬艷玲,吳鳳芝.枯萎病菌對(duì)不同抗性黃瓜品種苯丙氨酸解氨酶的影響[J].沈陽(yáng)農(nóng)業(yè)大學(xué)學(xué)報(bào),2006,37(3):335-338.
[31]Santiago R,De armas R,Fontaniella B,et al.Changes in soluble and cell wall-bound hydroxycinnamic and hydroxybenzoic acids in sugarcane cultivars inoculated with Sporisorium scitamineum sporidia[J].European Journal of Plant Pathology,2009,124(3):439-450.
Study on the Difference of Defensive Enzyme Activities in Interaction BetweenSporisoriumscitamineumIsolates from Different Molecular Genetic Groups and Sugarcane
XU Ganghong,SHEN Wankuan,WU Xiaming,CHEN Shuang,LUO Mingzhu,CHEN Peishou
(College of Agronomy,South China Agricultural University,Scientific Observing and Experimental Station of Crop Cultivation in South China,Ministry of Agriculture,Guangzhou510316,China)
Abstract:In order to investigate the changes of defensive enzyme activities in sugarcane infected by Sporisorium scitamineum isolates originated from different molecular genetic groups.Five representative S.scitamineum isolations,including isolates 16,24,25,47 and 89,were injected to the resistant variety Q171 and susceptible variety ROC22 by using injected inoculation method.The activities of superoxide dismutase(SOD),peroxidase(POD),catalase(CAT),phenylalanine ammonialyase(PAL)and polyphenol oxidase(PPO)were determined during the interactions of Q171 and ROC22 sugarcane varieties with isolates of S.scitamineum.The results showed that the activities of SOD,POD and CAT existed 2 peaks,PPO of resistant variety Q171 and PAL of susceptible variety ROC22 also existed 2 peaks.PeakⅠappeared in the first day,peak Ⅱ appeared in the third to fifth days after inoculation.During the peak Ⅱ,activities of five defensive enzymes mentioned above were higher in sugarcane plants inoculated by five isolates of S.scitamineum than those in the corresponding non-inoculated controls.However peak Ⅱ values and occurrence time of the SOD,POD and PAL showed significant difference among five isolates.Especially,peak Ⅱ of isolate 89 was earlier 1-2 days than other four isolates in the occurrence time and its value also showed significant difference from other isolates.It was initially considered that the isolate 89 might be represent a new physiological race which was different from other four isolates.
Key words:Sugarcane;Sporisorium scitamineum;Defensive enzyme
doi:10.7668/hbnxb.2016.02.035
中圖分類(lèi)號(hào):S435.3
文獻(xiàn)標(biāo)識(shí)碼:A
文章編號(hào):1000-7091(2016)02-0218-06
作者簡(jiǎn)介:徐剛紅(1990-),男,湖南張家界人,在讀碩士,主要從事甘蔗生物技術(shù)研究。通訊作者:沈萬(wàn)寬(1969-),男,江蘇泰州人,研究員,博士,主要從事甘蔗抗病育種與生物技術(shù)研究。
基金項(xiàng)目:廣東省公益研究與能力建設(shè)專(zhuān)項(xiàng)資金項(xiàng)目 (2014A020208094;2015A020209102);華南農(nóng)業(yè)大學(xué)人才引進(jìn)啟動(dòng)項(xiàng)目(k13009)
收稿日期:2016-02-17

