左心輔助裝置致心肌梗死早期心肌卸負荷后心肌細胞變化的研究
甘 宇,周建業,胡盛壽,唐 躍,楊新衛,陳海波,閆曉倩,孫嘉康
1.山西醫科大學第一臨床醫學院(太原 030001);2.中國醫學科學院,北京協和醫學院,國家心血管病中心,阜外醫院,心血管疾病國家重點實驗室
?
左心輔助裝置致心肌梗死早期心肌卸負荷后心肌細胞變化的研究
甘宇1,周建業2,胡盛壽2,唐躍2,楊新衛1,陳海波2,閆曉倩2,孫嘉康2
1.山西醫科大學第一臨床醫學院(太原 030001);2.中國醫學科學院,北京協和醫學院,國家心血管病中心,阜外醫院,心血管疾病國家重點實驗室
摘要:目的 制作羊急性心肌梗死模型,觀察左心輔助裝置卸負荷干預下心肌細胞發生的變化,為左心輔助裝置能否應用于急性心肌梗死病人提供依據。方法實驗組3只成年小尾寒羊在心臟不停跳下植入左心輔助裝置(FW-Ⅱ型軸流泵),另3只為對照組不作卸負荷處理。記錄心肌梗死后12 h、24 h、36 h、48 h、72 h肌鈣蛋白I(CTn I)值評價心肌細胞損傷程度。72 h后取出標本,觀察心肌細胞破壞及炎癥細胞浸潤情況,以及檢測兩組動物心肌細胞凋亡情況。結果卸負荷后各個時間點實驗組CTn I值變化幅度與對照組比較差異有統計學意義(P<0.05),實驗組心肌梗死及梗死邊帶區域炎癥細胞浸潤較少,壞死心肌細胞較少,大量心肌細胞呈冬眠細胞狀態存活;而對照組對應區域炎癥細胞浸潤廣泛,壞死心肌細胞較多。細胞凋亡結果顯示:實驗組梗死邊帶區域心肌細胞凋亡程度低于對照組[(47.83±16.24)%比(75.80±11.16)%,P<0.05]。結論左心輔助裝置對心肌梗死早期心肌卸負荷,可以有效減輕心肌梗死心肌細胞死亡程度,減少炎癥細胞滲出,為心肌梗死后續治療提供良好的心肌細胞基礎。
關鍵詞:心肌梗死;左心輔助裝置;卸負荷;動物模型;冬眠細胞;小尾寒羊
急性心肌梗死(AMI)是一個具有高發病率與高死亡率的全球性疾病。急性心肌梗死是冠心病最嚴重的類型,當冠脈管腔狹窄到一定程度,心肌供血減少,心肌的氧需量(MVO2)與供氧量之間存在矛盾,部分心肌細胞進入冬眠狀態(myocardial hibernation)[1],以保護缺血心肌。若供氧與需氧矛盾無法調和,缺氧心肌細胞將發生不可逆性的損傷乃至死亡[2-3 ]。因此,采取適當的干預措施緩解心肌氧的供需矛盾,保護缺血的心肌細胞不發生死亡、甚至恢復到正常狀態,正成為心肌梗死治療的新策略。體外模式氧合器裝置(ECMO)、主動脈內球囊反搏(IABP)作為臨時、部分心臟輔助已應用于心肌梗死病人,但不能使心肌梗死面積縮小。
左心輔助裝置(LVAD)通過輔助心臟部分泵功能,應用于晚期心力衰竭病人[4-5]。但對于急性心肌梗死后是否使用左心輔助裝置,目前尚存在爭議, 部分學者認為使用輔助裝置有可取之處,如:Xydas 等[6]發現左心輔助裝置能夠顯著降低心肌氧需量,Kloner[7]認為借助左心輔助裝置的機械卸負荷(mechanical unloading)作用,減少梗死心肌氧需求,從而減少心肌梗死面積;還有研究發現通過對心肌梗死心臟使用左心輔助裝置,能限制心肌梗死后的左室重構[8],與ECMO、IABP相比較,Thiele等[9-10]認為LVAD不受左心功能限制,并對外周循環有充分的支持,即使左心功能受損情況下,仍可對左心室充分卸負荷,并能緩解心肌氧需求,縮小心肌梗死面積。目前也有對心肌梗死及心源性休克病人使用左心輔助裝置的個案報道[11]。但也學者認為,心肌梗死病人使用左心輔助裝置后,存在血栓形成等并發癥,并且與ECMO、IABP等治療方法相比較,在病人生存率方面,左心輔助裝置并無優勢。所以左心助裝置能否應用于心肌梗死病人還需進一步的證據[12-13]。
通過使用左心輔助裝置卸負荷,可以緩解氧供給與需求的矛盾,保護缺血心肌細胞免于死亡,從而為心肌梗死治療提供良好的心肌細胞基礎、贏得治療時間。本研究制作羊急性心肌梗死模型,用FW-2型軸流血泵進行輔助循環,觀察卸負荷干預下心肌細胞的變化。
1材料與方法
1.1實驗儀器與材料選用FW-2型軸流式輔助血泵作為左心輔助裝置(阜外心血管病醫院自行研制),LEICA DM 6000B正置熒光顯微鏡(德國),LEICA sp8激光掃描共聚焦顯微鏡(德國),Swan-gaze漂浮導管(愛德華生命科學有限公司,美國)。
1.2實驗動物12只成年小尾寒羊,均為雄性,體重(54.2±8)kg,數字法隨機分為兩組,實驗組(MI+VAD)5只,對照組(MI) 7只;實驗組制作心肌梗死模型后加FW-2型軸流泵卸負荷,實驗組僅制作心肌梗死模型不作進一步處理。該實驗按照《北京市實驗動物管理條例》進行,本研究得到阜外心血管病醫院實驗動物福利倫理審查委員會批準。
1.3術前處理術前24 h禁食,12 h禁水;術前抽血檢查生化全套,心肌損傷標志物肌鈣蛋白(CTnI)、血常規、血氣分析等項目。
1.4心肌梗死動物模型制作丙泊酚誘導動物麻醉成功后,氣管插管,異氟烷吸入維持全麻,動物右側臥位,常規消毒、鋪無菌巾,取左側胸第4肋間手術切口,經靜脈給予肝素(3 mg/kg)后,保持全血激活凝血時間(ACT)在400 s以上。心表噴灑利多卡因,5-0 prolene線于鈍緣支根部結扎,觀察鈍緣支分布心肌組織顏色變紫、心臟跳動異常,心率增快,心電圖顯示心肌缺血改變(見圖1),心肌梗死動物模型制作成功。

注:A1為實驗組術前心電圖;A2為實驗組冠脈結扎后心電圖;B1為對照組術前心電圖;B2為對照組冠脈結扎后心電圖。
圖1實驗組、對照組冠脈結扎前后心電圖變化
1.5實驗組植入FW-2型軸流泵實驗組動物心肌梗死造模前,將FW-2型軸流泵輸入端經心尖部進入左心室,輸出端用牛頸靜脈與降主動脈行端側吻合,排氣后連接牢靠。在心肌梗死動物模型制作成功的同時,開啟FW-2型軸流泵,將流速調至接近術前心排量,置入的Swan-gaze漂浮導管記錄確認卸負荷成功。檢查各吻合口無滲血,血泵轉速、流量平穩,留置左側胸腔負壓引流管,常規關胸。對照組僅留置左側胸腔負壓引流管后,術畢。
1.6術后處理實驗組、對照組經靜脈微量泵持續泵入肝素,將ACT維持于280 s~320 s;并肌肉注射青霉素48×105U,12 h1次;術后1 h、24 h、36 h、48 h、72 h抽血檢測記錄CTnI,常規飼養。期間檢測FW-2型軸流泵轉速,并使流量盡量接近心排量,維持卸負荷狀態。存活72 h后,全麻動物,原手術部位進入胸腔,靜脈推注氯化鉀處死動物的同時,FW-2型軸流泵停轉,完整取出動物心臟,去除各插管,分別取心肌梗死、梗死邊帶區域、正常心肌組織置入10%甲醛溶液固定。
1.7組織病理學檢查分別取實驗組、對照組各自心肌梗死、梗死邊帶區域、正常心肌組織行固定、包埋、制片,蘇木素-伊紅(haematoxylin-eosin,HE)常規染色。低倍顯微鏡下觀察心肌細胞死亡及炎癥細胞浸潤的大體分布,高倍顯微鏡觀察心肌細胞形態及心肌纖維的改變。
1.8免疫組織化學檢查兩組梗死邊帶區域各采用數字法隨機取4個組織蠟塊行TUNEL法細胞凋亡實驗,每個蠟塊拍取5張照片,每張照片計算超過200細胞,計算細胞凋亡比例。
1.9統計學處理應用SPSS 19.0軟件進行統計學分析。對CTnI結果進行重復測量方差分析,實驗組與對照組心肌凋亡細胞所占心肌細胞百分數均采用獨立樣本t檢驗,P<0.05 為差異有統計學意義。
2結果
2.1實驗動物總體情況實驗組5只,1只結扎冠脈時發生室顫死亡,1只心臟非手術區域小破口術中未發現,術后心臟破裂死亡;存活3只(編號:A、B、C);對照組7只,4只結扎冠脈時發生室顫死亡,存活3只(編號:D、E、F)。
2.2實驗組心肌卸負荷評價(見表1)實驗組心肌梗死模型建立后心排量較術前下降(P<0.05),心肌梗死后心室的容量負荷升高;FW-2型軸流泵啟動后心排量較心肌梗死模型建立后上升(P<0.05);心肌梗死模型建立后肺動脈楔壓較術前肺動脈楔壓升高(P<0.05),心肌梗死后心室的容量負荷升高;FW-2型軸流泵啟動后肺動脈楔壓較心肌梗死模型建立后肺動脈楔壓下降(P<0.05),FW-2型軸流泵啟動后心室的容量負荷下降。FW-2型軸流泵卸負荷結果與Jung等[14]描述的經典卸負荷效果相似,卸負荷作用確切。

表1 實驗組心臟卸負荷評價(±s)
2.3兩組CTnI水平比較(見表2、圖2)實驗組較對照組CTnI上升及下降均為一個緩慢的過程,相比對照組,實驗組的缺血、缺氧心肌細胞是緩慢壞死的過程。實驗組與對照組以時間點進行兩兩比較,差異有統計學意義(P<0.05)。

表2 兩組CTnⅠ水平比較
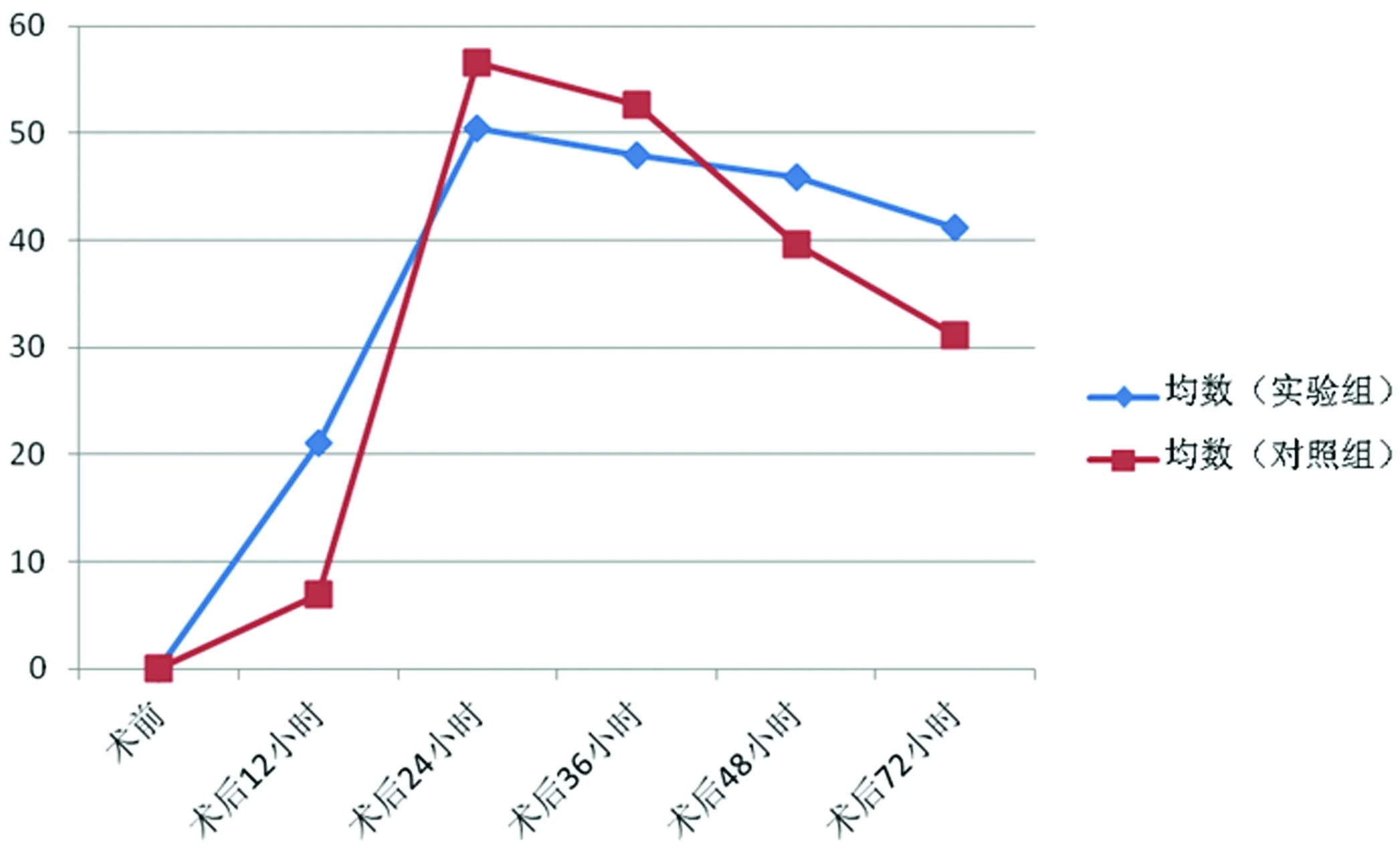
圖2 實驗組與對照組CTn I均數比較
2.4HE染色實驗組:心肌梗死區域存在大量細胞水腫、細胞核水腫,肌束水平波浪樣改變及橫紋紊亂的
冬眠心肌細胞,其形態特征與Page等[15]描述的冬眠心肌細胞特征相同,同時少量炎癥細胞浸潤。對照組:心肌壞死破壞程度較大,僅留有視野中央部分心肌纖維未被破壞,病理顯示大量心肌細胞破壞崩解并炎癥細胞滲出。
2.5TUNEL法檢測細胞凋亡情況(見圖3)TUNEL標記的細胞核被熒光激發后呈黃綠色,4,6-二脒基-2-苯基吲哚(DAPI)標記后細胞核被熒光激發后呈藍色。實驗組細胞凋亡率低于對照組[(47.83±16.24)%比(75.80±11.16)%,P<0.05]。提示實驗組梗死邊帶區域心肌細胞凋亡程度低于對照組。
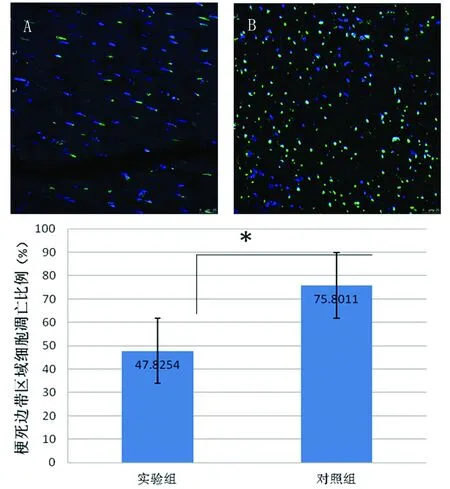
注:A為實驗組;B為對照組。
3討論
急性心肌梗死是心血管疾病中最危重的緊急事件之一,由于心肌細胞大量死亡,心臟泵功能衰竭,導致該病發病兇險,死亡率高;同時由于大量心肌細胞死亡,炎癥細胞滲出引起的左室重構與心臟破裂及真、假室壁瘤形成等嚴重并發癥和心臟擴大、心力衰竭有關,也是影響AMI近遠期預后的主要原因之一[16]。如何挽救更多的缺血、缺氧瀕臨死亡的心肌細胞,同時減輕心肌梗死后心室重構是心肌梗死治療的目的之一。本實驗在建立羊急性心肌梗死模型的基礎上,成功地運用FW-2型軸流血泵進行輔助循環,有效減少了缺血左室的容量負荷后,代表心肌破壞的CTnI、心肌凋亡以及病理結果均證實,通過對心肌梗死動物模型使用左心輔助裝置,使心肌梗死心肌卸負荷,能夠有效減少心肌梗死心肌死亡、破壞,使原本將要死亡的心肌細胞在術后72 h仍以冬眠心肌細胞形式存在。
基于本實驗結果認為,在心肌梗死早期通過使用左心輔助裝置輔助心肌梗死心肌泵功能,能增加心排血量,維持臟器灌注,保護臟器功能,最主要的是能夠有效保護缺血、缺氧心肌,使本應死亡的心肌梗死心肌細胞轉變為冬眠心肌細胞而存活,從而為經皮冠狀動脈介入(PCI)或心臟血管重建贏得時間,增加手術成功率。心肌炎癥細胞浸潤是心肌梗死后左室重構的主要原因之一。
本實驗結果顯示,在心肌梗死早期使用左心輔助裝置,能有效減少炎癥細胞浸潤,因此認為使用左心輔助裝置能減輕心肌梗死后左室重構的程度,并改善AMI近、遠期預后。
參考文獻:
[1]Camici PG,Prasad SK,Rimoldi OE.Stunning,hibernation,and assessment of myocardial viability[J].Circulation,2008,117(1):103-114.
[2]Fallavollita JA. Hibernating myocardium retains metabolic and contractile reserve despite regional reductions in flow,function,and oxygen consumption at rest[J].Circulation Research,2002,92(1):48-55.
[3]Vanoverschelde JL,Wijns W,Borgers M,et al.Chronic myocardial hibernation in humans.From bedside to bench[J].Circulation,1997,95(7):1961-1971.
[4]Wang TS,Hernandez AF,Felker GM,et al.Valvular heart disease in patients supported with left ventricular assist devices[J].Circ Heart Fail,2014,7(1):215-222.
[5]Stepanenko A,Potapov EV,Jurmann B,et al.Outcomes of elective versus emergent permanent mechanical circulatory support in the elderly:a single-center experience[J].The Journal of Heart and Lung Transplantation, 2010,29(1):61-65.
[6]Xydas S,Rosen RS,Pinney S,et al.Reduced myocardial blood flow during left ventricular assist device support:a possible cause of premature bypass graft closure[J].The Journal of Heart and Lung Transplantation,2005,24(11):1976-1979.
[7]Kloner RA.Can myocardial infarct size be reduced by mechanically unloading the left ventricle? [J].Circulation,2013,128(4):318-321.
[8]Sun X,Li J,Zhao W,et al.Early assistance with left ventricular assist device limits left ventricular remodeling after acute myocardial infarction in a swine model[J].Artif Organs,2016,40(3):243-251.
[9]Thiele H,Smalling RW,Schuler GC.Percutaneous left ventricular assist devices in acute myocardial infarction complicated by cardiogenic shock[J].European Heart Journal,2007,28(17):2057-2063.
[10]Garatti A,Russo C,Lanfranconi M,et al.Mechanical circulatory support for cardiogenic shock complicating acute myocardial infarction:an experimental and clinical review[J].ASAIO J, 2007,53(3):278-287.
[11]Selzman CH,Chang PP,Vernon-Platt T,et al.Use of the Jarvik 2000 continuous flow left ventricular assist device for acute myocardial infarction and cardiogenic shock[J].J Heart Lung Transplant,2007,26(7):756-758.
[12]Westaby S,Anastasiadis K,Wieselthaler GM.Cardiogenic shock in ACS.Part 2: role of mechanical circulatory support[J].Nature Reviews Cardiology,2012,9(4):195-208.
[13]Werdan K,Gielen S,Ebelt H,et al.Mechanical circulatory support in cardiogenic shock[J].European Heart Journal,2014,35(3):156-167.
[14]Jung MH,Hassager C,Balling L,et al.Relation between pressure and volume unloading during ramp testing in patients supported with a continuous-flow left ventricular assist device[J].ASAIO J,2015,61(3):307-312.
[15]Page BJ,Banas MD,Suzuki G,et al.Revascularization of chronic hibernating myocardium stimulates myocyte proliferation and partially reverses chronic adaptations to ischemia[J].Journal of the American College of Cardiology, 2015,65(7):684-697.
[16]Latet SC,Hoymans VY,Van Herck PL,et al.The cellular immune system in the post-myocardial infarction repair process[J].Int J Cardiol,2015,179:240-247.
(本文編輯郭懷印)
Research on the Effects of Volume Unloading on Myocardial Cells with Left Ventricular Assist Device During the Early Stage of Myocardial Infarction
Gan Yu,Zhou Jianye,Hu Shengshou,Tang Yue,Yang Xinwei,Chen Haibo,Yan Xiaoqian,Sun Jiakang
The First Clinical College,Shanxi Medical University,Taiyuan 030001,Shanxi,China
Abstract:ObjectiveTo investigate the changes of cardiomyocyte after left ventricular assist device(LVAD) unloading in a ovine model of acute myocardial infarction (AMI),in order to provide the evidence that LVAD could be used in AMI.MethodsAMI models were established in six adult sheep by ligation of circumflex coronary artery.Three of them were mechanically unloaded with an continue-flow LVAD (FW-2 axial pump) with heart beating.The others without LVAD supporting served as control.Postoperative 12 hours,24 hours,36 hours,48 hours,72 hours,CTn I and other routine serum items were examined to evaluate the damage of cardiomyocytes.After 72 hours,the hearts were harvested for histological examinations.TUNEL staining was performed to evaluate the apoptosis of cardimyocytes.ResultsThere were differences in CTn I value in each time point between two groups.Inflammatory cells infiltration was less both in the peri-infarction and infarction area of unloading group than those of control group.A large number of myocardial cells were in hibernation status.And the myocardial cell apoptosis was significantly lower than that in control group[(47.83±16.24)% vs (75.80±11.16)%,P<0.05)].ConclusionThe results suggest that early assistance with an LVAD in AMI can maintain myocardial cells in hibernation status,and inhibit apoptosis and inflammatory cells infiltration.These may provide a good condition for myocardial infarction treatment.
Key words:myocardial infarction;left ventricular assist device;unloading;animal model;myocardial hibernation;small tailed han sheep
(收稿日期:2015-12-18)
Corresponding Author:Zhou Jianye(State Key Laboratory of Cardiovascular Disease,Fuwai Hospital,National Center for Cardiovascular Diseases,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing,100037,China)
中圖分類號:R547.2R256.2
文獻標識碼:A
doi:10.3969/j.issn.1672-1349.2016.09.012
文章編號:1672-1349(2016)09-0963-04
通訊作者:周建業,E-mail:zhoujianye@fuwaihospital.org
基金項目:國家自然科學基金(No.81300183);人工心臟專項基金[No.醫科函(2014)58號]

