酶聯免疫法檢測自身免疫性肝炎I型抗纖維肌動蛋白抗體的評估
劉 玲,黃 潔,彭曉明,肖明中,李曉東
湖北省中醫院1.檢驗科;2.肝病科,湖北 武漢 430061
酶聯免疫法檢測自身免疫性肝炎I型抗纖維肌動蛋白抗體的評估
劉 玲1,黃 潔1,彭曉明1,肖明中2,李曉東2
湖北省中醫院1.檢驗科;2.肝病科,湖北 武漢 430061
目的 對使用酶聯免疫吸附試驗(ELISA)檢測自身免疫性肝炎(autoimmune hepatitis,AIH)Ⅰ型患者抗纖維肌動蛋白抗體(AFA)進行評估分析。方法 收集163例AIH-Ⅰ型、15例AIH-Ⅱ型、36例AIH-Ⅲ型患者臨床資料及血清標本,采用ELISA法檢測患者的AFA,同時采用間接免疫熒光法(IFA)檢測患者的AFA和抗平滑肌抗體(ASMA)作為對照,對檢測結果進行統計學分析。結果 以IFA≥1∶320、ELISA≥30 U為陽性判斷標準,除AFA-ELISA與ASMA-IFA檢測AIH-Ⅱ型的陽性例數差異有統計學意義外(P=0.03),AFA-ELISA與AFA-IFA、ASMA-IFA比較,檢測其他AIH各型患者陽性例數差異均無統計學意義(P﹥0.05)。AFA-ELISA與AFA-IFA檢測AIH-Ⅰ型的相關性比ASMA-IFA更好(r=0.97vs0.52)。AFA-ELISA與AFA-IFA相比,檢測AIH-Ⅰ型有稍高的敏感性(76.07%vs71.17%)和略低的特異性(72.55%vs78.43%);AFA-ELISA與ASMA-IFA相比,檢測AIH-Ⅰ型有更高的敏感性和特異性(76.07%vs64.42%,72.55%vs60.78%);AFA-ELISA 檢測AIH-Ⅰ型的約登指數與AFA-IFA相近(0.49vs0.50),比ASMA-IFA高(0.49vs0.25)。AFA-ELISA檢測AIH-Ⅰ型的ROC面積為0.86,當濃度為54.06 U/ml時檢測的敏感性和特異性最好。結論 AFA-ELISA檢測AIH-Ⅰ型的敏感性和特異性與AFA-IFA相近,但操作更方便,與ASMA-IFA的敏感性相近,但特異性更好。AFA-ELISA可作為AIH-Ⅰ型較好的篩查方法。
自身免疫性肝炎;抗纖維肌動蛋白抗體;抗平滑肌抗體;酶聯免疫吸附試驗;間接免疫熒光法
自身免疫性肝炎(autoimmune hepatitis,AIH)Ⅰ型是一種慢性進行性肝臟疾病,免疫抑制劑能有效控制部分患者病情的發展,如果不能正確診斷和及時有效治療,最終可導致肝硬化、肝功能衰竭,因而早期準確診斷是關鍵[1]。抗纖維肌動蛋白抗體(anti-filamentous actin antibody,AFA)近年來備受關注,被認為對AIH-Ⅰ型具有較好的診斷價值[2-3],但目前對AIH自身抗體的檢測方法亟待規范[4-5]。我們使用酶聯免疫吸附試驗(enzyme linked immunosorbent assay, ELISA)檢測AIH患者的AFA,并將檢測結果與其他數據比較分析,現將結果報道如下。
1 資料與方法
1.1 一般資料收集2010年12月-2014年12月湖北省中醫院確診的163例AIH-Ⅰ型、15例AIH-Ⅱ型、36例AIH-Ⅲ型肝病患者臨床資料及血清標本,AIH患者中凡伴有其他自身免疫性疾病如自身免疫性甲狀腺炎、格雷夫斯病、干燥綜合征、類風濕關節炎的均排除在外。另收集197名健康獻血者標本作為對照組,收集血清后分裝,-80 ℃凍存備用。研究對象均保留詳細的臨床資料,且簽訂知情同意書。
1.2 觀察指標(1)臨床表現:包括性別、年齡、臨床癥狀;(2)影像學檢查:觀察患者初診時肝臟情況;(3)血清生化指標檢測:丙氨酸轉氨酶(ALT)、天冬氨酸轉氨酶(AST)、堿性磷酸酶(ALP)、血清總膽紅素(TBil)、γ-谷氨酰轉移酶(γ-GT)、球蛋白(GLO)、免疫球蛋白(IgA、IgM、IgG);(4)AIH自身抗體:ANA、AFA、ASMA;(5)肝臟組織病理學檢查:AIH、原發性膽汁性肝硬化(PBC)、原發性硬化性膽管炎(PSC)、重疊綜合征(AIDOS)患者于診斷前行肝穿刺活檢,評價病理組織學特點。
1.3 方法
1.3.1 AIH的診斷:結合國際自身免疫性肝炎工作組(International AIH Group,IAIHG)1992年AIH診斷評分標準[6]、1999年AIH修訂診斷評分標準[7]和2008年AIH簡化評分標準[8]進行評分。主要內容有:(1)無遺傳代謝類疾病(α1抗胰蛋白酶及血清銅藍蛋白指標正常)、無活動性病毒感染、無飲酒或服用已知對肝臟有損傷的藥物史;(2)AST、ALT顯著升高,免疫球蛋白IgG升高大于正常上限;(3)自身抗體陽性,包括ANA、AFA、ASMA、抗LKM-1、抗LC-1、抗SCA/LP;(4)肝臟病理學表現以界面肝炎為主,無膽管的病理改變。
1.3.2 AIH分型:已經診斷的AIH患者參考相關標準[13],按照患者自身抗體的檢測情況進行分型。
1.3.3 ELISA法檢測AFA:選用美國INOVA公司提供的ELISA試劑,標本用標本稀釋液1∶1稀釋后加入50 μl于反應孔內,立即加入50 μl的生物素標記的抗體。蓋上膜板輕輕振蕩混勻,37 ℃溫育1 h,甩去孔內液體,洗凈拍干。每孔加入80 μl的親和鏈酶素-HRP,37 ℃溫育30 min。甩去孔內液體,洗凈拍干。每孔加入底物A、B各50 μl,37 ℃溫育10 min。取出酶標板迅速加入50 μl終止液,在450 nm波長處測定各孔的OD值。以吸光度OD值為縱坐標(Y),相應的α-ASMA標準品濃度為橫坐標(X)獲得相應曲線,根據OD值由標準曲線換算出濃度。濃度≥30 U判定為陽性,濃度<20 U判定為陰性,濃度20~30 U判定為可疑。
1.3.4 IFA法檢測AFA和ASMA:AFA和ASMA試劑均為歐蒙(德國)醫學實驗診斷公司生產的Hep-2細胞生物薄片。選擇Hep-2細胞、猴肝、大鼠腎、大鼠胃作基質的生物薄片,將待測血清稀釋與基質常溫孵育30 min,PBS緩沖液浸洗5 min,加異硫氰酸熒光素標記的抗體常溫孵育30 min,PBS緩沖液浸洗5 min后封片,用熒光顯微鏡觀察結果。
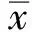
2 結果
2.1 一般情況及臨床表現AIH-Ⅰ型組的平均年齡為(59.26±10.24)歲,AIH-Ⅱ型組為(66.54±8.21)歲,AIH-Ⅲ型組為(63.38±12.92)歲。AIH患者中女性多于男性(女男比例3.28∶1),大多隱襲性起病,臨床癥狀及體征各異。常見癥狀包括乏力、惡心、嘔吐、上腹部不適或疼痛、關節痛、肌痛、皮疹等。部分患者無明顯臨床癥狀及體征,只有在生化檢查出肝功能異常后才發現。少數患者表現為急性、亞急性甚至暴發性起病。
2.2 AFA-ELISA、AFA-IFA和ASMA-IFA檢測AIH患者結果統計IFA≥1∶320、ELISA≥30 U檢測例數,AFA-ELISA檢測AIH-Ⅰ型的陽性例數與AFA-IFA、ASMA-IFA比較,差異均無統計學意義(χ2=0.25,P=0.62;χ2=1.22,P=0.27);檢測AIH-Ⅱ型的陽性例數與AFA-IFA比較,差異無統計學意義(χ2=0.24,P=0.62),但與ASMA-IFA比較,差異有統計學意義(χ2=5.0,P=0.03);檢測AIH-Ⅲ型的陽性例數與AFA-IFA、ASMA-IFA比較,差異均無統計學意義(χ2=0.69,P=0.41;χ2=2.17,P=0.14);檢測健康獻血者的陽性例數與AFA-IFA、ASMA-IFA比較,差異均無統計學意義(χ2=0.34,P=0.56;χ2=0.20,P=0.65,見表1)。

表1 AFA-ELISA、AFA-IFA和ASMA-IFA檢測AIH患者結果[例數(%)]
注:以IFA≥1∶320、ELISA≥30 U分析同型AIH患者:*P>0.05、#P<0.05。
2.3 AFA-ELISA與AFA-IFA、ASMA-IFA檢測AIH-Ⅰ患者結果相關性分析通過SPSS 19.0相關性分析,AFA-ELISA與不同滴度ASMA-IFA的相關性為:r=0.52,0.95%CI:0.17~0.81,P<0.05(見表2)。AFA-ELISA與不同滴度的AFA-IFA的相關性為:r=0.97,0.95%CI:0.93~0.99,P<0.001(見表3)。AFA-ELISA檢測AIH-Ⅰ型與不同滴度的AFA-IFA、ASMA-IFA都有相關性,但與AFA-IFA的相關性更好(r=0.97vs0.52)。

表2 AFA-ELISA對ASMA-IFA陽性AIH-I型患者檢測結果 [例數(%)]

表3 AFA-ELISA對AFA-IFA陽性AIH-I型患者檢測結果[例數(%)]
2.4 AFA-ELISA、AFA-IFA和ASMA-IFA檢測AIH-Ⅰ型的性能評估將全部AIH作為統計對象,AFA-ELISA檢出的真陽性數為124例、真陰性數為37例;AFA-IFA檢出的真陽性數為116例、真陰性數為40例;ASMA-IFA檢出的真陽性數為105例、真陰性數為31例。AFA-ELISA 與AFA-IFA相比,檢測AIH-Ⅰ型有稍高的敏感性(76.07%vs71.17%)和略低的特異性(72.55%vs78.43%);AFA-ELISA與ASMA-IFA相比,檢測AIH-Ⅰ型有更高的敏感性和特異性(76.07%vs64.42%,72.55%vs60.78%);AFA-ELISA檢測AIH-Ⅰ型的約登指數與AFA-IFA相近(0.49vs0.50),比ASMA-IFA高(0.49vs0.25,見表4)。

表4 AFA-ELISA、AFA-IFA和ASMA-IFA檢測AIH-Ⅰ型的性能評估
2.5 AFA-ELISA檢測AIH-Ⅰ型的ROC曲線運用SPSS 19.0統計軟件繪制受試者工作曲線,以檢測結果的1-特異性為橫坐標,敏感性為縱坐標繪制曲線,曲線下面積為0.86,當濃度為54.06 U/ml時檢測AFA-ELISA的敏感性、特異性最好(見圖1)。

圖1 AFA-ELISA檢測AIH-Ⅰ型的ROC曲線
3 討論
隨著臨床實踐經驗的積累和對AIH-Ⅰ型認識的提高,人們逐漸認識到AIH-Ⅰ型相關性自身抗體在AIH-Ⅰ型的診斷與分型中的重要作用[9]。AIH-Ⅰ型自身抗體的臨床意義不僅體現在疾病診斷上,某些自身抗體在反映疾病活動度、監測病程、評價療效和預后判斷等方面也有重要參考指標[10-11]。
我國2010年自身免疫性肝病研討會紀要對AIH診斷的結論:ANA或ASMA≥1∶40計1分,ANA或ASMA≥1:80計2分,≥6分為可能診斷為AIH,≥7分為確定診斷AIH[12]。我們的研究顯示AFA-ELISA檢測AIH與不同滴度的AFA-IFA、ASMA-IFA都有相關性,但與AFA-IFA的相關性更好(r=0.97vs0.52)。
ASMA是傳統的用于AIH-Ⅰ型診斷的重要指標,ASMA可以識別包括微管、中間絲和微絲在內的多種細胞骨架成分,有文獻[13]顯示ASMA滴度越高,診斷AIH-Ⅰ型的敏感性越好,高滴度的ASMA對AIH-Ⅰ型診斷具有更好的靈敏度。平滑肌亞結構是微絲結構蛋白,以兩種形式存在,即單體和多聚體,多聚體形成肌動蛋白絲,稱為纖維狀肌動蛋白(F-actin),近年使用AFA篩查AIH-Ⅰ型得到廣泛的應用[14]。AFA是AIH-Ⅰ型相關熒光模型針對的主要靶抗原,根據IFA典型的AFA熒光模型診斷AIH-Ⅰ型,可獲得比ASMA更佳的特異性和敏感性[15]。Grunwald等[16]研究得出ASMA對AIH-Ⅰ型檢測的敏感性為16%,而AFA對AIH-Ⅰ型診斷的靈敏度為71%。以IFA≥1∶320、ELISA≥30 U為陽性判斷標準,我們的研究結果顯示除AFA-ELISA與ASMA-IFA檢測AIH-Ⅱ型的陽性例數比較,差異有統計學意義外,AFA-ELISA與AFA-IFA、ASMA-IFA比較,檢測其他AIH各型患者例數差異均無統計學意義。
臨床上最常用的IFA被認為是檢測自身抗體的金標準[17],然而AFA的操作及結果識別需要有一定經驗的操作者,這可能導致AFA的檢測質量下降。ELISA法由于其易實現自動化且不需要操作者的高技能水平,被越來越多地用來檢測AFA。本文采用IFA和ELISA兩種方法檢測自身免疫疾病患者血清AFA,以IFA法作為金標準研究ELISA法檢測AFA的性能,并探討兩者之間的相關性,發現AFA-ELISA檢測AIH型與不同滴度的AFA-IFA、ASMA-IFA都有相關性,但與AFA-IFA的相關性更好(r=0.97vs0.52)。由于AFA-ELISA的檢測方法簡單易行,適合無IFA操作經驗的人員開展工作,值得推廣。
目前我國臨床實驗室檢測AIH 自身抗體的質量不高,檢測方法亟待規范[4-5],從我國154家實驗室檢測ASMA的統計結果可知IFA法檢測ASMA的陽性符合率為57.3%,陰性符合率為96.8%[18],這個結果不是太理想,臨床急需敏感性更高檢測AIH-Ⅰ型的自身抗體。目前由于AIH-Ⅰ型的發病機制尚不清楚,自身抗體是病理損傷的結果還是原因尚無定論,所以自身抗體AFA檢測只能作為AIH-Ⅰ型診斷的參考依據[19]。我們的研究顯示AFA-ELISA 與AFA-IFA相比,檢測AIH-Ⅰ型有稍高的敏感性(76.07%vs71.17%)和略低的特異性(72.55%vs78.43%);AFA-ELISA與ASMA-IFA相比,檢測AIH-Ⅰ型有更高的敏感性和特異性(76.07%vs64.42%,72.55%vs60.78%);AFA-ELISA 檢測AIH-Ⅰ型的約登指數與AFA-IFA相近(0.49vs0.50),比ASMA-IFA高(0.49vs0.25),AFA-ELISA檢測AIH-Ⅰ型的ROC面積為0.86,按照ROC曲線評價標準(AUC在0.7~0.9時有較高的準確性),AFA-ELISA檢測AIH-Ⅰ型的方法有可行性。
總之,AFA-ELISA檢測AIH-Ⅰ型的敏感性和特異性比ASMA-IFA好,AFA-ELISA檢測AIH-Ⅰ型與AFA-IFA的敏感性和特異性相近,但前者不需要操作者的高技能水平,因此,AFA-ELISA可作為AIH-Ⅰ型的較好篩查方法,值得推廣應用。
[1]Sebode M, Lohse AW. Future perspective: immunomodulatory therapy for autoimmune hepatitis [J]. Dig Dis, 2014, 32(5): 502-506.
[2]Hadzic N, Hierro L. Autoimmune liver disease: novelties in management [J]. Clin Res Hepatol Gastroenterol, 2014, 38(3): 273-276.
[3]Cui X, Zhang X, Yin Q, et al. F-actin cytoskeleton reorganization is associated with hepatic stellate cell activation [J]. Mol Med Rep, 2014, 9(5): 1641-1647.
[4]Li LJ, Zhang SL, Li YZ. Analysis of external quality assessment of autoantibodies testing from 102 laboratories in 2009 in China [J]. Chin J Lab Med, 2012, 35(3): 265-270. 李麗君, 張蜀瀾, 李永哲. 2009年我國102家醫院實驗室自身抗體檢測室間質量評價分析[J]. 中華檢驗醫學雜志, 2012, 35(3): 265-270.
[5]Hu CJ, Li YZ. Pay attention to the detection standardization and rational application of autoimmune liver disease relevant autoantibodies [J]. Chin J Lab Med, 2014, 37(2): 81-83. 胡朝軍, 李永哲. 重視自身免疫性肝病相關自身抗體的規范檢測與合理應用[J]. 中華檢驗醫學雜志, 2014, 37(2): 81-83.
[6]Johnson PJ, McFarlane IG. Meeting report: international autoimmune hepatitis group [J]. Hepatology, 1993, 18(4): 998-1005.
[7]Alvarez F, Berg PA, Bianchi FB, et al. International autoimmune hepatitis group report: review of criteria for diagnosis of autoimmune hepatitis [J]. J Hepatol, 1999, 31(5): 929-938.
[8]Hennes EM, Zeniya M, czaja AJ, et al. Simplified criteria for the diagnosis of autoimmune hepatitis [J]. Hepatology, 2008, 48(1): 169-176.
[9]Czaja AJ. Diagnosis and management of autoimmune hepatitis [J]. Clin Liver Dis, 2015, 19(1): 57-79.
[10]Roep BO, Buckner J, Sawcer S, et al. The problems and promises of research into human immunology and autoimmune disease [J]. Nat Med, 2012, 18(1): 48-53.
[11]Bogdanos DP, Mieli-Vergani G, Vergani D. Autoantibodies and their antigens in autoimmune hepatitis [J]. Semin Liver Dis, 2009, 29(3): 241-253.
[12]Duan WJ, Zhang J, Jia JD, et al. Symposium on autoimmune liver disease [J]. Chin J Intern Med, 2010, 49(4): 339-341. 段維佳, 張炬, 賈繼東, 等. 自身免疫性肝病研討會紀要[J]. 中華內科雜志, 2010, 49(4): 339-341.
[13]Czaja AJ. Challenges in the diagnosis and management of autoimmune hepatitis [J]. Can J Gastroenterol, 2013, 27(9): 531-539.
[14]Villalta D, Bizzaro N, Da Re M, et al. Diagnostic accuracy of four different immunological methods for the detection of anti-AFA autoantibodies in type 1 autoimmune hepatitis and other liver-related disorders [J]. Autoimmunity, 2008, 41(1): 105-110.
[15]Jaskowski TD, Konnick EQ, Ashwood ER, et al. Prevalence of IgG autoantibody against AFA in patients suspected of having autoimmune or acute viral hepatitis [J]. J Clin Lab Anal, 2007, 21(4): 249-253.
[16]Grunwald D, Kothari D, Malik R. Noninvasive markers in the assessment and management of autoimmune liver diseases [J]. Eur J Gastroenterol Hepatol, 2014, 26(10): 1065-1072.
[17]Jeon YL, Kim MH, Lee WI, et al. Comparison of indirect immunofluorescence and line immunoassay for autoantibody detection [J]. Clin Exp Rheumatol, 2013, 31(1): 84-90.
[18]Deng CW, Hu CJ, Bai YN, et al. A multi-center comparison of smooth muscle autoantibodies and mitochondrial autoantibodies in 154 laboratories of China [J]. Chin J Lab Med, 2014, 37(2): 127-131. 鄧垂文, 胡朝軍, 白依娜, 等. 中國154家實驗室檢測抗平滑肌抗體和抗線粒體抗體的比對分析[J]. 中華檢驗醫學雜志, 2014, 37(2): 127-131.
[19]Conrad K, Roggenbuck D, Reinhold D, et al. Autoantibody diagnostics in clinical practice [J]. Autoimmun Rev, 2012, 11(3): 207-211.
(責任編輯:王全楚)
Evaluation on anti-filamentous actin antibodies with the enzyme-linked immunosorbent assay in autoimmune hepatitis type I patients
LIU Ling1, HUANG Jie1, PENG Xiaoming1, XIAO Mingzhong2, LI Xiaodong2
1. Department of Clinical Laboratory; 2. Department of Liver Diseases, Hubei Provincial Hospital of TCM, Wuhan 430061, China
Objective To evaluate anti-filamentous actin antibodies (AFA) with the enzyme-linked immunosorbent assay (ELISA) in autoimmune hepatitis type I (AIH-Ⅰ) patients. Methods Two hundred and fourteen consecutive untreated AIH patients (163 cases of AIH-Ⅰ, 15 cases of AIH-Ⅱ, 36 cases of AIH-Ⅲ) and 197 blood donors (controls) from Dec. 2010 to Dec. 2014 were collected. AFA was detected with ELISA, detecting AFA and anti-smooth muscle antibodies (ASMA) with indirect immunofluorescence assay (IFA) were compared. The results were statistically analyzed with SPSS 19.0. Results There was significant difference in AIH-Ⅱ patients between AFA-ELISA and ASMA-IFA (P=0.03);there was no any significant difference in other AIH patients between AFA-ELISA and AFA-IFA or ASMA-IFA (IFA≥1∶320, ELISA≥30 U). AFA-ELISA was both correlated with different titers of AFA-IFA and ASMA-IFA, but the correlation was better in AFA-IFA than ASMA-IFA for AIH-Ⅰ patients (r=0.97vs0.52). In prospective analysis, AFA-ELISA showed a similar sensitivity, specificity and Youden index but operation easier than AFA-IFA. A superior sensitivity (76.07%vs64.42%), superior specificity (72.55%vs60.78%) and superior Youden index (0.49vs0.25) compared with ASMA-IFA. The area under the curve ofROCof AFA-ELISA was 0.86, and when the concentration was 54.06 U/ml, the detection sensitivity and specificity were the best. Conclusion AFA-ELISA is a useful diagnostic method in AIH-Ⅰ patients, which is easier operated than AFA-IFA, and superior sensitivity and specificity than ASMA-IFA.
Autoimmune hepatitis; Anti-filamentous actin antibody; Anti-smooth muscle antibody; Enzyme-linked immunosorbent assay; Indirect immunofluorescence assay

10.3969/j.issn.1006-5709.2016.06.016
國家中醫臨床研究基地業務建設科研專項課題基金(JDZX2012051)
劉玲,碩士,研究方向:肝病致病機理及臨床診斷學
李曉東,主任醫師,教授,研究方向:肝病。E-mail: deng13098855103@163.com
R575.1
A
1006-5709(2016)06-0658-05
2015-05-17

