產幾丁質酶側孢短芽孢桿菌的篩選及其酶學性質研究
劉蒲臨 程德勇 繆禮鴻
(武漢輕工大學生物與制藥工程學院,武漢 430023)
產幾丁質酶側孢短芽孢桿菌的篩選及其酶學性質研究
劉蒲臨 程德勇 繆禮鴻
(武漢輕工大學生物與制藥工程學院,武漢 430023)
篩選并鑒定高產幾丁質酶的芽孢桿菌菌株,旨在研究其酶學特性為高效利用幾丁質酶資源奠定基礎。分離純化產幾丁質酶芽孢桿菌,將目的菌株的幾丁質酶基因異源表達并純化后研究其酶學參數。考慮到菌株的生物安全性,選擇側孢短芽孢桿菌CDY64為進一步研究對象,將其幾丁質酶基因表達于大腸桿菌BL21中。酶學研究表明,純化后的幾丁質酶最適反應溫度為60℃,在pH6.0-8.0范圍內均表現出良好的活性;使用膠體幾丁質作為底物時Km與kcat值分別為5.85 μmol/L和29.27 S-1。結果表明,側孢短芽孢桿菌CDY64所產幾丁質酶在高溫下具有良好的催化能力,在體外對多種植物病原真菌表現出了良好的拮抗作用。
幾丁質酶;側孢短芽孢桿菌;酶學性質
幾丁質酶可以催化幾丁質的水解,廣泛存在于高等動植物、微生物以及某些病毒體內[1]。自Skujins等[2]首次發現來源于鏈霉菌(Streptomyces)的幾丁質酶可以分解黑曲霉(Aspergillus niger)和腐皮鐮刀菌(Fusarium solani)的細胞壁以來,利用幾丁質酶來防治植物真菌病害已經成為最主要的應用研究領域。幾丁質酶和產生幾丁質酶的菌株除了可以單獨用于植物病蟲害防治以外,也可以通過和其他抗生素與殺蟲劑共同使用來減少其他化學試劑的用量,進而減少對環境和人類健康的危害。已有研究表明將內切幾丁質酶和蘇云金芽孢桿菌的殺蟲晶體蛋白同時使用可以將δ-毒素的殺蟲效力提高近10倍[3,4]。此外,由于幾丁質降解所得到的幾丁寡糖具有抗菌、調節免疫力和抗癌等功能,其在功能食品和保健藥品等方面具有廣闊的應用前景。例如,幾丁六糖和幾丁七糖已被證明具有良好的抗腫瘤活性[5,6]。與其他方法相比,幾丁質酶解產生幾丁寡糖的方法具有反應專一性強,不會引起結構破壞,副反應少等優點。因此利用幾丁質酶來生產幾丁寡糖也成為幾丁質酶的應用研究領域之一。
本研究以獲得產幾丁質酶的芽孢桿菌出發,從土壤中分離出7株菌株。經過比較分析后篩選出一株側孢短芽孢桿菌,將其幾丁質酶基因克隆表達于大腸桿菌中,并通過對該幾丁質酶的酶學性質研究,旨在為幾丁質酶制劑的開發和廢棄幾丁質資源的有效利用奠定基礎。
1 材料與方法
1.1 材料
1.1.1 植物病原真菌 尖孢鐮刀菌(F. oxysporum ACCC209139), 禾 谷 絲 核 菌(Rhizoctonia solani CICC40529)和腐皮鐮刀菌(F. solani CICC2603),分別購于中國農業微生物菌種保藏管理中心(ACCC)和中國工業微生物菌種保藏中心(CICC)。
1.1.2 培養基 分離純化培養基(g/L):膠體幾丁質 7.0,酵母提取物 2.0,KH2PO43.0,K2HPO42.0,NH4Cl 1.0,MgSO4·7H2O 0.2,瓊脂 15。酶活測定培養基:分離純化培養基不添加瓊脂。細菌計數培養基:牛肉膏蛋白胨培養基。大腸桿菌培養基:LB培養基。病原真菌培養與拮抗能力檢測培養基:PDA培養基。上述培養基[7]均于1.01×105Pa滅菌30 min后使用。
1.2 方法
1.2.1 膠體幾丁質的制備 將30 g幾丁質粉末(Sigma-Aldrich,USA)緩慢加入至300 mL預冷的濃鹽酸中,磁力攪拌2 h后放入4℃靜置24 h。然后將該混合液緩慢加入至2 L預冷的蒸餾水中攪拌均勻。5 000 ×g離心10 min收集白色的膠體幾丁質沉淀,反復沖洗至pH約為6.5。最后用500 mL蒸餾水重懸,即獲得濃度為6%的膠體幾丁質母液。
1.2.2 菌株的篩選 土壤樣品為棉田和菜園土壤,采自于湖北武漢市周邊。采集土壤樣品后,取10.0 g土樣加入90 mL無菌水中制備土壤懸液。經過80℃處理20 min后梯度稀釋。將稀釋液涂布在分離培養基上,28℃恒溫培養。待菌落周圍出現透明圈后反復劃線分離,得到純培養。
1.2.3 菌種的16S rRNA基因序列測定 將菌株接種至液體牛肉膏蛋白胨培養基中,培養至穩定生長期后使用TIANamp細菌基因組抽提試劑盒(Tiangen Biotech,China)抽提獲得基因組DNA。采用通用引物27F和1492R進行16S rRNA基因的PCR擴增。PCR產物經過純化后TA克隆至載體pMD18-T中測序。將測序所得序列提交至GenBank中。
1.2.4 幾丁質酶活力的測定 使用DNS法[8](3,5-二硝基水楊酸比色法),以β-D-N-乙酰氨基葡萄糖繪制標準曲線,分別對待測樣品以及樣品空白進行測定。將每分鐘產生相當于1 μmol β-D-N-乙酰氨基葡萄糖的還原糖所需的酶量定義為1個酶活力單位。
1.2.5 拮抗病原真菌能力的測定 采用平板對峙培養法[9]:分別將尖孢鐮刀菌,禾谷絲核菌和腐皮鐮刀菌培養2-3 d,然后從菌落邊緣取下直徑5 mm大小的菌餅置于新的PDA平板中央。使用打孔器取下濾紙片,然后將濾紙片貼至距中央3 cm處。定量滴加菌懸液(或酶溶液)后,置于30℃培養并觀察抑菌情況。培養7 d后測量菌落半徑和抑菌圈半徑(x-±s),分別用D和H來表示。根據抑菌圈半徑和菌苔半徑的比值大小判斷菌株(或幾丁質酶)的抑菌能力。
1.2.6 幾丁質酶基因的克隆與異源表達 根據側孢短芽孢桿菌DSM25和GI9全基因組序列信息設計兼并引物,以菌株CDY64總基因組DNA為模板,PCR擴增得到除信號肽之外的ORF片段,引物序列見表1。將得到的不含信號肽的ORF片段通過Sac I和Xho I酶切后,連接進入表達載體pET28a中。將酶連產物轉化E. coli DH5α,轉化子經過PCR以及酶切驗證后,所得到的正確的重組質粒命名為pETChi72A。

表1 本研究所使用的引物序列
1.2.7 幾丁質酶的分離純化 將重組質粒pETChi72A轉化進入E. coli BL21(DE3)中。篩選轉化子后使用液體LB過夜培養獲得種子液,然后以1%接種量接種至新的LB液體培養基中(含50 mg/mL硫酸卡那霉素),37℃振蕩培養。當OD600達到0.4時,加入終濃度為0.1 mmol/L的IPTG。然后28℃培養8 h誘導幾丁質酶的表達。由于重組蛋白N端含有六聚組氨酸標簽,因此使用Ni-瓊脂糖蛋白純化試劑盒(Tiandz,China)對異源表達的幾丁質酶進行純化。菌體的高壓破碎、蛋白上樣與洗脫均參照試劑盒手冊進行。使用葡聚糖凝膠除鹽后進行SDS-PAGE電泳,檢測是否得到純化的幾丁質酶。所獲得的幾丁質酶溶液經過Bradford法[10]定量后用于酶學特性研究。
1.2.8 酶學性質的測定 最適溫度和pH值的測定:分別于20-80℃以及pH為3.0-10.0條件下測定Chi72A的活性,并以相對酶活的百分比為縱坐標,溫度為橫坐標進行作圖。
熱穩定性的測定:將Chi72A置于20-80℃下水浴3 h后檢測酶活,并以相對酶活的百分比為縱坐標,以溫度為橫坐標進行作圖。
酶促動力學參數的測定:在幾丁質酶的最適反應條件下,使用純酶液與不同濃度的膠體幾丁質(1-25 mg/mL)反應,測定其酶促反應的初始速度。通過雙倒數法作圖確定Km和Vmax值。幾丁質酶的催化常數由方程kcat= Vmax/[E]計算得出,[E]代表幾丁質酶的濃度。
金屬離子對幾丁質酶酶活的影響:向酶促反應體系中分別加入Mg2+、K+、Ca2+、Fe2+、Fe3+和Cu2+共6種金屬離子至終濃度為10 mmol/L。定量測定不同金屬離子對Chi72A酶活的影響。
2 結果
2.1 產幾丁質酶芽孢桿菌的分離
使用平板計數法對不同土壤樣品中可培養細菌總數進行測定后,發現不同土壤樣品的可培養細菌總數介于0.8×108-3.3×108cfu/g之間。與此同時,將不同土壤懸液80℃處理20 min后,涂布至以膠體幾丁質為唯一碳源的篩選平板上。28℃培養3-7 d后,有多種細菌菌落產生水解圈。能分泌幾丁質酶產生水解圈的菌落數量平均占可培養細菌總數的1.4%。本實驗共篩選純化得到7個不同菌株。
2.2 菌株產酶能力與拮抗病原真菌能力的測定
將上述菌株接種至100 mL酶活測定培養基中,使用搖瓶發酵的方法分別在12、24、36和48 h取樣測定不同菌株的產幾丁質酶能力。來源于菜園土壤的菌株(Paenibacillus sp. W1,Paenibacillus sp. A14,Br. laterosporus CDY64和 Brevibacillus sp. CDY118)平均酶活較高,其中CDY118酶活最高達到63.7 U/L;而來源于棉田的菌株(Paenibacillus sp. H316,B. aryabhattai H2-16和 Brevibacillus sp. L2)平均酶活較低,菌株H316整個發酵周期內所測得的最高酶活僅為24.3 U/L。不同菌株的產幾丁質酶能力如表2所示
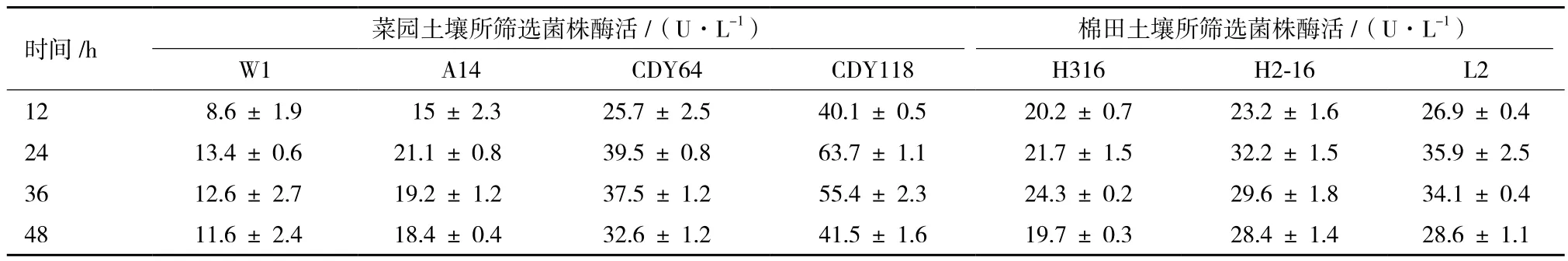
表2 不同菌株在整個培養周期內的酶活變化

表3 不同菌株對尖刀鐮孢菌的拮抗能力
不同菌株拮抗尖孢鐮刀菌的能力如表3所示。所有被試菌株均表現出了對植物病原真菌的拮抗性能。
2.3 側孢短芽孢桿菌中幾丁質酶基因克隆與分析
使用菌株CDY64的基因組DNA為模板,擴增獲得全長的幾丁質酶基因(chi72A,KT205398)。經過TA克隆后測序發現,chi72A全長為1 950 bp,所編碼蛋白質分子量為72.23 kD。對該基因所編碼蛋白質進行結構域分析后發現,該幾丁質酶存在兩個結構域,分別為N端催化結構域和C端的幾丁質結合結構域。由于Chi72A的活性中心(F169EGIDIDYE177)與PROSITE數據庫中第18糖苷酶家族活性中心的氨基酸序列([LIVMFY]-[DN]-G-[LIVMF]-[DN]-[LIVMF]-[DN]-x-E)一致,因此可以判斷該幾丁質酶屬于第18糖苷酶家族。多序列比對結果(圖1)表明,Chi72A催化區域的氨基酸序列與側孢短芽孢桿菌DSM25所編碼的幾丁質酶表現出了97.4%的相似性;與蠟狀芽孢桿菌ATCC4342的幾丁質酶ChiC,環狀芽孢桿菌WL-12的幾丁質酶ChiA1以及粘質沙雷氏菌2170的幾丁質酶ChiA的序列相似性分別為49%、51%和40%。
此外,多序列比對還發現,Chi72A的幾丁質結合結構域除了與其他幾種細菌幾丁質酶表現出序列相似性以外,還與鏈霉菌所編碼的纖維素結合結構域表現出了較高的序列相似性。

圖1 幾丁質酶Chi72A催化區域的多序列比對圖譜
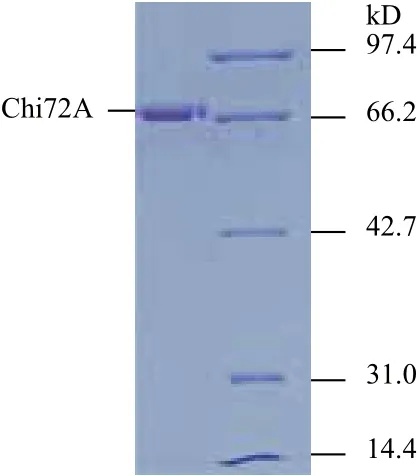
圖2 Chi72A純化后的SDS-PAGE電泳檢測圖譜
2.4 異源表達幾丁質酶的純化
為了進一步研究Chi72A的酶學特性與影響因素,將除信號肽以外的ORF序列酶切后連接進入表達載體pET28a中。重組菌株使用0.1 mmol/L IPTG,28℃誘導8 h后,使用高壓破碎儀進行破碎。然后12 000 ×g離心10 min取上清。最后使用Ni-瓊脂糖和葡聚糖凝膠進行分離純化。所獲得純品幾丁質酶的檢測結果如圖2所示。
2.5 Chi72A對病原真菌拮抗能力的檢測
將純化后的幾丁質酶溶液50 μL緩慢滴加至濾紙片上,30℃培養3 d后觀察抑菌情況。結果(圖3)顯示,該幾丁質酶除對尖孢鐮刀菌表現出了很強的拮抗能力以外,還顯著抑制了禾谷絲核菌以及腐皮鐮刀菌的生長。這也進一步證實,該幾丁質酶為菌株CDY64產生真菌拮抗能力的重要原因之一。
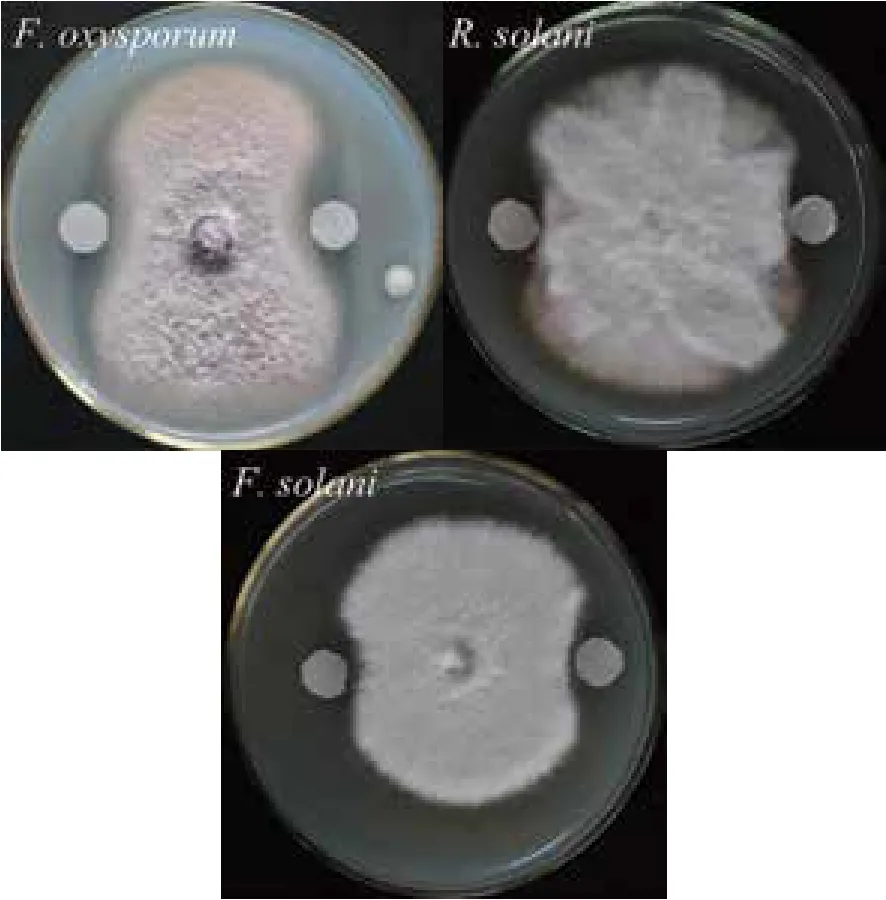
圖3 Chi72A對植物病原真菌拮抗作用的示意圖
2.6 溫度與pH對幾丁質酶活力的影響
溫度與pH值對純化后Chi72A的影響如圖4所示。Chi72A在pH為6.0-8.0的范圍內比較穩定;當反應緩沖液pH分別為3.0與10.0時,Chi72A酶活力分別下降至最高值的15%和27%(圖4-A)。圖4-B表明,Chi72A的最適反應溫度為60℃。當溫度為20℃時,Chi72A的酶活為最高值的23%;而當反應溫度為80℃時,Chi72A酶活僅為最高值的18%。為了進一步研究Chi72A對高溫的耐受能力,將酶溶液分別置于20-80℃預處理3 h,然后在60℃以及pH=8.0的條件下測定酶溶液的殘余酶活力。圖4-C表明,Chi72A在50℃條件下處理3 h后,其酶活力沒有受到顯著影響。而當預處理溫度提高至60℃時,其酶活力僅下降9%,具有較強的熱穩定性。
2.7 金屬離子對幾丁質酶活力的影響
金屬離子往往有助于維持酶的三維結構,甚至直接參與酶的催化過程。因此,本研究分別檢測了Mg2+、K+、Ca2+、Fe2+、Fe3+和Cu2+,6種金屬離子對純化后Chi72A酶活力的影響。結果(表4)顯示,當向反應液中添加CaCl2至終濃度為10 mmol/L時,Chi72A催化活性升高了10.5%;Fe3+和Cu2+對Chi72A表現出了抑制能力;尤其是添加Cu2+至終濃度為10 mmol/L時,Chi72A的活性下降了49%;而Mg2+、K+和Fe2+對Chi72A的酶活力沒有顯著影響。
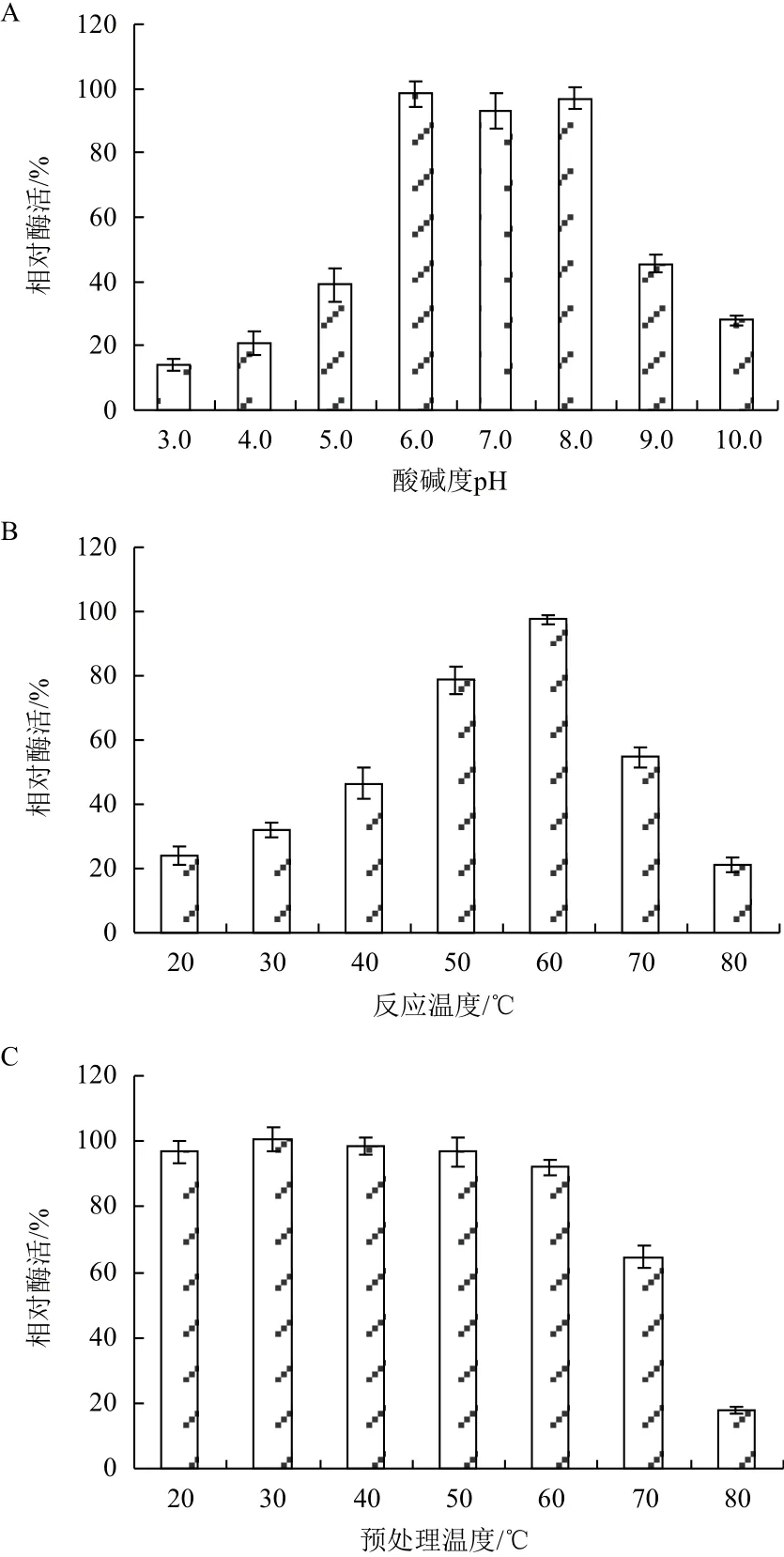
圖4 Chi72A的酶學特性研究
表4 不同金屬離子對Chi72A酶活的影響
2.8 幾丁質酶酶學參數的測定
分別用不同濃度的膠體幾丁質(1-25 mg/mL),在最適反應條件下對純化后Chi72A的起始反應速度進行測定。以底物濃度的倒數為橫坐標,酶促反應速度的倒數為縱坐標作圖,獲得酶促動力學參數。結果(圖5)表明,Chi72A的Km值為5.85 μmol/L,而其催化常數,kcat為29.27 S-1(即每秒鐘可以產生相當于29.27個N-乙酰氨基葡萄糖的還原性末端)。
圖5 Chi72A酶促反應的Lineweaver-Burk圖譜
3 討論
具有幾丁質降解能力的細菌在自然界碳/氮循環過程中具有非常重要的作用。此類菌株以及相關降解基因的分離也有助于幾丁質酶在工農業上的應用。本實驗所篩選菌株以膠體幾丁質作為底物時,培養液中的幾丁質酶的酶活力介于24.3 U/L和63.7 U/L之間,這與Trivedi等[11]所篩選的菌株酶活相似。由于側孢短芽孢桿菌在微生物肥料安全通用技術準則(NY1009-2006)和農業部發布的《飼料添加劑目錄(2013)》中均屬于生物安全菌種,同時側孢短芽孢桿菌 CDY64又具有較高的產幾丁質酶能力以及拮抗病原真菌的能力,因此本研究以CDY64為目的菌株,對其所編碼的幾丁質酶展開進一步研究。
側孢短芽孢桿菌往往存在于多種水體、土壤或某些昆蟲的體表,能夠產生多種與殺蟲和拮抗病原真菌有關的蛋白質和抗生素[12]。然而,側孢短芽孢桿菌中幾丁質酶的酶學性質和酶促動力學參數尚未有報道。大多數細菌所產生的幾丁質酶屬于第18糖苷酶家族,而第18糖苷酶家族的幾丁質酶又可以分為A、B和C三個亞類[13]。根據氨基酸序列相似性,Chi72A可歸類于A亞類。酶學特性研究表明Chi72A的最適反應pH范圍為6.0-8.0,與地衣芽孢桿菌(B. licheniformis)SK-1[14]所編碼的幾丁質酶類似。迄今為止,大多數幾丁質酶的最適反應pH值介于4.0-10.0之間,只有少部分幾丁質酶的最佳pH超出這一范圍。例如,Pradeep等[15]發現一株鏈霉菌所產幾丁質酶的最適pH值為12.5。由于高溫酶促催化過程有助于降低污染風險以及提高酶促反應的速率,因此很多工業上的酶促反應是在高溫下進行的。本研究中所涉及的幾丁質酶Chi72A具有良好的熱穩定性,這將有助于該酶在幾丁質廢棄物生物轉化方面的推廣與應用。
4 結論
本研究在不同土壤樣品中共分離得到7株不同的產幾丁質酶菌株,16S rRNA序列分析發現,這些菌株可歸類于類芽孢桿菌、短芽孢桿菌和芽孢桿菌3個屬。酶學研究表明,側孢芽孢桿菌CDY64所編碼的幾丁質酶(Chi72A)具有良好的熱穩定性,其最佳反應溫度為60℃;而且在50℃條件下預處理3 h沒有造成顯著的酶活喪失。此外,該幾丁質酶在體外對多種植物病原真菌具有拮抗作用。
[1]Morimoto K, Karita S, Kimure T, et al. Cloning sequencing and expression of the gene encoding Clostrium paraputrificum chitinase ChiB and analysis of the functions of novel cadherin-like domains and a chitin-binding domain[J]. Journal of Bcteriology, 1997, 179:7306-7314.
[2]Manjeet K, Purushotham P, Neeraja C, et al. Bacterial chitin binding proteins show differential substrate binding and synergy with chitinases[J]. Micorbiological Reaearch, 2013, 168:461-468.
[3]Ding X, Luo Z, Gao B, et al. Improving the insecticidal activity by expression a recombinant cry1A gene with chitinase-encoding gene in a crystalliferous Bacillus thuringiensis[J]. Current Microbiology, 2008, 56:442-446.
[4]Regev A, Keller M, Strizhov N, et al. Synergistic activity of a Bacillus thuringensis delta-endotoxin and a bacterial endochitinase against Spodoptera littoralis larvae[J]. Applied Environmental Microbiology, 1996, 62:3581-3586.
[5]Nanjo F, Sakai K, Ishikawa M, et al. Properties and transglycosylationreaction of a chitinase from Nocardia orientalis[J]. Agricultural and Biological Chemistry, 1989, 53:2189-2196.
[6]Usui T, Matsui H, Isobe K. Enzymic synthesis of chitooligosaccharides utilizing transglycosylation by chitinolytic enzymes in a buffer containing ammonium sulfate[J]. Carbohydrate Research, 1990, 203:65-77.
[7]趙斌, 何紹江. 微生物學實驗[M]. 北京:科學出版社, 2002:85-88.
[8]Miller GL. Use of dinitrisalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry, 1959, 31:426-428.
[9]Roberts WK, Selitrennikoff CP. Isolation and partial characterization of two antifungal proteins from barley[J]. Biochimica et Biophysica acta, 1986, 880:161-170.
[10]Bradford MM. A rapid and sensitive method for the quantization of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72:248-254.
[11]Trivedi P, Spann T, Wang N. Isolation and characterization of beneficial bacteria associated with Citrus roots in Florida[J]. Microbial Ecology, 2011, 62:324-336.
[12]Ruiu L. Brevibacillus laterosporus, a pathogen of invertebrates and a broad-spectrum antimicrobial species[J]. Insects, 2013, 4:476-492.
[13]Terahara T, Ikeda S, Noritake C, et al. Molecular diversity of bacterial chitinase in arable soils and the effects of environmental factors on the chitinolytic bacterial community[J]. Soil Biology and Biochemistry, 2009, 41:473-480.
[14]Kudan S, Pichyanqkura R. Purification and characterization of thermostable chitinase from Bacillus licheniformis SK-1[J]. Applied Biochemistry and Biotechnology, 2009, 157:23-35.
[15]Pradeep GC, Choi YH, Choi YS, et al. An extremely alkaline novel chitinase from Streptomyces sp. CS495[J]. Process Biochemistry, 2014, 49:223-229.
(責任編輯 馬鑫)
Isolation of a Chitinase-producing Strain Brevibacillus laterosporus and Its Enzymatic Properties
LIU Pu-lin CHENG De-yong MIAO Li-hong
(School of Biology and Pharmaceutical Engineering,Wuhan Polytechnic University,Wuhan 430023)
This study aims to screen and identify Bacillus strain producing high yield of chitinase and to study its enzymatic properties for laying groundwork in the efficient utilization of chitinase resources. Firstly,the Bacillus producing chitinase was isolated and purified,and then chitinase gene in the target strain was heterologously expressed,and enzymatic parameters of the purified chitinase were assayed at optimal conditions. Considering the bio-safety of the strain,Brevibacillus laterosporus CDY64 was selected as study object,and its chitinase(Chi72A)was expressed in Escherichia coli BL21(DE3). Enzymatic studies revealed that the purified Chi72A by Ni-NTA affinity presented solid activity at pH range 6.0-8.0,and the optimal temperature of its activity was 60℃;and the Km and kcatof Chi72A were 5.85 μmol/L and 29.27 S-1,respectively while using colloidal chitin as substrate. In conclusion,Chi72A from CDY64 had high catalytic ability at high temperature and exhibited high antifungal activity against many phytopathogenic fungi in vitro.
chitinase;Brevibacillus laterosporus;enzymatic properties
10.13560/j.cnki.biotech.bull.1985.2016.06.025
2015-09-24
國家“863”高技術研究發展計劃項目(2013AA10280),武漢輕工大學科研啟動經費(2014RZ19)
劉蒲臨,男,博士,研究方向:環境微生物學;E-mail:liunan3585@163.com
繆禮鴻,男,博士,研究方向:資源與環境微生物學;E-mail:miaowhpu@126.com

