拉曼光譜技術在亞硝酸鈉中毒快速檢測中的研究
秦真科,曹芳琦,劉文斌,楊飛宇,郝紅飛,孟航,2,張潤生,2(.上海市刑事科學技術研究院上海市現場物證重點實驗室,上海200083;2.上海市公安局物證鑒定中心,上海200083)
?
拉曼光譜技術在亞硝酸鈉中毒快速檢測中的研究
秦真科1,曹芳琦1,劉文斌1,楊飛宇1,郝紅飛1,孟航1,2,張潤生1,2
(1.上海市刑事科學技術研究院上海市現場物證重點實驗室,上海200083;2.上海市公安局物證鑒定中心,上海200083)
摘要:目的對亞硝酸鈉引起的血紅蛋白結構變化進行研究,為亞硝酸鈉中毒案件的快速、準確鑒定提供新的理論基礎和技術儲備。方法向全血中加入不同體積的同一濃度亞硝酸鈉(NaNO2)溶液,研究分離提取的氧合血紅蛋白(HbO2)及高鐵血紅蛋白(MetHb)的拉曼光譜及其結構與性能變化。結果通過血紅蛋白拉曼譜峰中反映血紅素平面和鐵離子軸向配體鍵微小變形的400~700cm-1、與鐵離子自旋態相關的1210~1230 cm-1和1500~1650 cm-1及與血紅蛋白卟啉環反π*軌道上電荷濃度相關的1350~1380 cm-1處拉曼峰強度變化及峰位位移的信息,可以鑒別氧合血紅蛋白和高鐵血紅蛋白。結論拉曼光譜技術在亞硝酸鈉中毒的快速檢測中具有較大優勢,可為亞硝酸鹽中毒鑒定提供重要判斷依據。
關鍵詞:氧合血紅蛋白;高鐵血紅蛋白;拉曼光譜;亞硝酸鈉中毒
亞硝酸鈉(NaNO2)是白色至淡黃色粉末或顆粒狀的一種無機鹽,其外觀及味道都與食鹽相似,價格便宜,常在非法食品制作時用作食鹽的不合理替代品。據統計,我國2005—2011年食物中毒案例中,亞硝酸鈉中毒案件數位居前列[1]。
亞硝酸鈉是強氧化劑,進入血液后可將亞鐵血紅蛋白(hemoglobin,Hb)氧化成高鐵血紅蛋白(methemoglobin,MetHb),即將血紅蛋白的輔基血紅素中Fe2+氧化成Fe3+,使整個血紅蛋白分子的結構及化學鍵發生變化,失去載氧能力,造成機體組織缺氧而中毒[2]。進食含亞硝酸鹽的食物后,短時間內皮膚、口唇黏膜、甲床就會出現紫紺,食入0.3~0.5g的亞硝酸鹽即可引起中毒甚至死亡。
目前對于亞硝酸鹽中毒的鑒定方法主要有三類:(1)化學分析法(包括聯苯胺冰醋酸反應、安替比林反應、格利斯試劑反應),該類方法成本低、操作簡便,可用于快速定性檢測,但靈敏度較低,且亞硝酸鹽在酸性條件下容易分解揮發,容易造成漏檢[3]。(2)光度法,其中應用最廣泛的是重氮耦合分光光度法,該方法成熟、準確度較高,但靈敏度一般,常用試劑存在致癌性,容易造成二次污染,當樣品中亞硝酸鹽含量較高時,紫紅色偶氮化合物難以生成,會造成假陰性,而熒光光度法雖然能提高檢測的靈敏度,但干擾因素大,條件不易控制,因而降低了檢測的重現性[4-5]。(3)色譜法(包括氣相色譜法、離子色譜法),該類方法準確度高、檢出限低、定量線性范圍寬,適合于各種生物基質中亞硝酸鹽的微量甚至痕量分析,但前處理相對復雜,氣相色譜法的前處理需要進行衍生化,增加了人為操作誤差的風險[6]。
拉曼光譜作為分子結構鑒定的手段,能夠反映待測分子的化學鍵及官能團信息,近年來在生物、醫學、公共安全、有機化學等領域展現了較大的優勢,特別適用于結構鑒定。拉曼光譜在血紅蛋白結構研究及功能分析中具有無需標記、制樣簡單、無損檢測和分析效率高等優越性[7-8]。本文用激光顯微拉曼光譜儀分析了血液與亞硝酸鈉反應后所引起的血紅蛋白分子結構的變化,對氧合血紅蛋白(HbO2)和高鐵血紅蛋白(MetHb)進行鑒定區分,進而為亞硝酸鈉中毒鑒定提供一種新的快捷、簡便、準確的方法。
1 材料與方法
1.1試劑及儀器
亞硝酸鈉(NaNO2分析純)、生理鹽水、超純水;高速冷凍離心機;點樣玻璃毛細管;inVia Reflex激光顯微拉曼光譜儀(英國Renishaw公司)。
1.2方法
1.2.1全血中血紅蛋白的氧化反應
靜脈抽取健康成人的血液4 mL于肝素鋰抗凝管中,等分成4份,各1mL,標記1、2、3、4號樣品。以生理鹽水為溶劑,配置4mg/mL的NaNO2溶液10mL。1號樣品作為空白參照,2號樣品按照1:1體積比加入1mL的NaNO2溶液,3號樣品按照1:2體積比加入2 mL的NaNO2溶液,4號樣品按照1:4體積比加入4mL的NaNO2溶液,在室溫下充分反應1h。
1.2.2全血中血紅蛋白及高鐵血紅蛋白的分離制備
將四組樣品分別以離心速率:3 000 r/min離心10min分離出紅細胞,以生理鹽水洗滌,再以同樣的速率離心洗滌3次,分離出紅細胞。再以1∶4體積比加入超純水,在4℃溫度下離心速率:1500r/min高速離心30min,分離提取反應后的血紅蛋白。
1.2.3血紅蛋白及高鐵血紅蛋白的檢測分析
將四組樣品分別進行拉曼光譜分析,光譜采集范圍為400~1800 cm-1,每次光譜采集時間10 s,采集3次。
數據分析處理軟件為Origin 8。
1.3方法優化
本次實驗,分別采用三種激發波長:532、633、785 nm對分離提取的氧合血紅蛋白和高鐵血紅蛋白進行檢測,以期獲得最優激發波長。
2 結果與討論
2.1最優激發波長的選擇
比較發現,532 nm激光激發的拉曼譜圖效果最好,推測該波長下的拉曼峰以血紅素的共振增強效應為主,而在633nm和785nm激光激發下,出現信噪比非常弱的拉曼峰,無法進行有效分析。
實驗研究發現,激光功率越大,拉曼信號越強。然而,激光功率過強易導致蛋白質變性,無法測出血紅蛋白明顯的拉曼譜圖。在用低功率激光強度下能夠測出拉曼信號時,不建議提高激光功率進行測試,高功率激光在提高待測信號的同時,也提高了噪聲信號。
2.2全血與不同體積比NaNO2反應后的顏色變化
亞硝酸鹽中毒后,主要癥狀是高鐵血紅蛋白血癥,表現為紫紺現象,先口唇、手指、腳趾青紫,然后全身皮膚青紫。在亞硝酸鹽中毒致死案件中,尸斑呈藍褐色,血液呈醬油色,不凝固。
本實驗中,從外觀顏色觀察,全血與NaNO2氧化反應前后,全血顏色由紅色變成紫褐色,且隨著加入的NaNO2體積的增加,紫褐色越深。分析可能與血紅蛋白的輔基血紅素中Fe2+氧化成Fe3+并出現分子結構變化有關。該顏色變化,與實際亞硝酸鹽中毒案件中紫紺現象基本一致[5]。
2.3全血與不同體積比NaNO2反應后血紅蛋白的拉曼光譜
2.3.1血紅蛋白與高鐵血紅蛋白的拉曼光譜及特征峰分析
全血和不同體積比的亞硝酸鈉溶液反應前后,提取血紅蛋白與高鐵血紅蛋白測其拉曼光譜(圖1),拉曼位移及部分峰位歸屬見表1[9-11]。拉曼光譜峰位的歸屬分析可以得到官能團、化學鍵和電子密度等分子結構及其變化的信息。由于具有卟啉結構的血紅素有較大拉曼散射截面,拉曼光譜可以很好的反映血紅蛋白中血紅素平面及其與鐵離子軸向配體鍵的振動信息。血紅蛋白拉曼光譜受血紅素卟啉環中電子密度、卟啉環中心尺寸、鐵離子與卟啉環平面的距離、鐵離子自旋態等影響而變化。
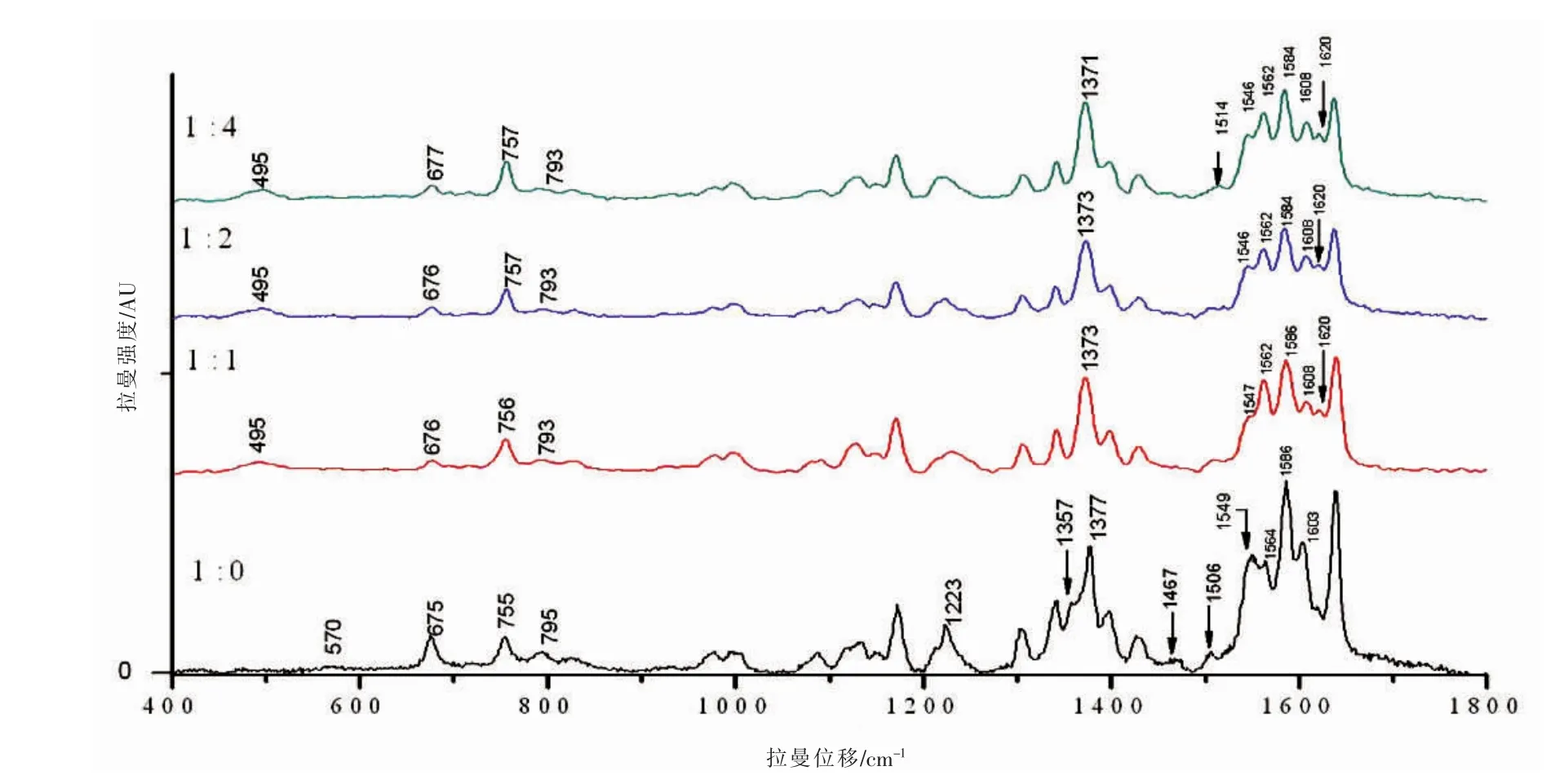
圖1 全血與NaNO2反應前后提取血紅蛋白的拉曼光譜
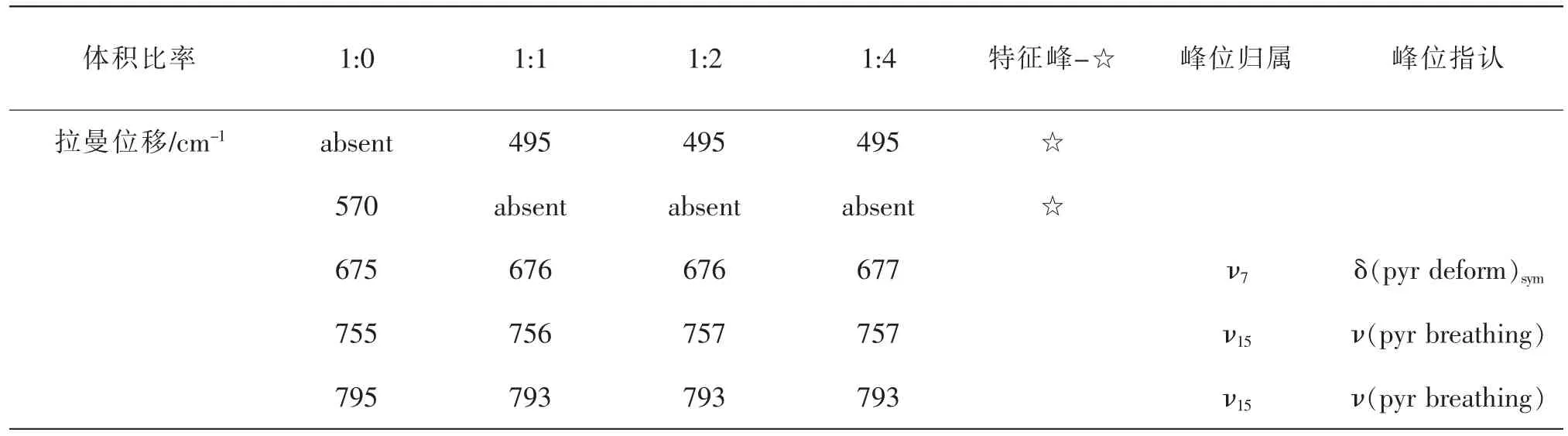
表1 全血中加入不同體積比NaNO2的拉曼位移、特征峰及部分峰位歸屬
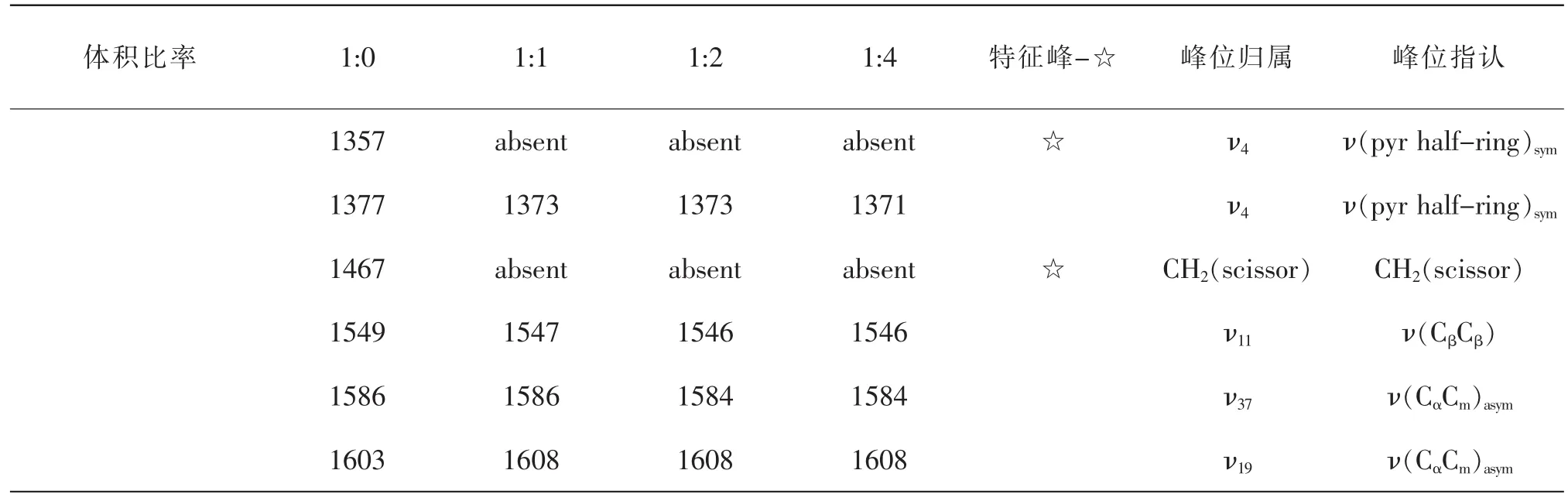
續表1
由圖1可知,正常氧合血紅蛋白在570、1357、1467 cm-1處有較明顯的特征峰,高鐵血紅蛋白在495、1514 cm-1處有較明顯的特征峰,570、1357、1467cm-1峰消失[12]。低頻區400~700 cm-1反映血紅素平面和鐵離子軸向配體鍵的微小變形[13]。高頻區(1200~1700 cm-1)反映血紅素環骨架振動模式,由圖2可知,該頻段是血紅素結構變化的敏感譜帶。其中,1210~1230cm-1的拉曼光譜峰歸屬于次甲基變形模式,與自旋態相關;1370~1379 cm-1的拉曼光譜峰代表血紅蛋白處在氧化態[14],與血紅蛋白卟啉環反π*軌道電荷濃度相關;1500~1650cm-1的拉曼光譜峰不僅對鐵離子自旋態敏感,而且能夠反映血紅素中心與吡咯環N原子之間的距離,即卟啉環中心孔徑大小卟啉環中心孔徑大小每產生0.1nm的變化,對中心孔徑大小敏感的特征峰將會產生5~6cm-1的移動,波數將隨中心孔徑的變小而增大[15]。
2.3.2血紅蛋白與高鐵血紅蛋白的低頻區拉曼光譜分析
在低頻區,鐵離子結合配體的不同將引起血紅素電子分布的變化及卟啉環結構的變化。高鐵血紅蛋白在495cm-1出現新的特征峰,與Alian等發現的在500 cm-1處附近的特征峰結果一致[16]。血紅蛋白特征峰570 cm-1代表了Fe-O2伸縮振動[12],它的消失表明了鐵氧鍵的斷裂,氧合血紅蛋白消失,氧化成高鐵血紅蛋白。隨著NaNO2的加入,675cm-1峰向高波數方向移動,移至677cm-1處;755cm-1峰向高波數方向移動,移至757cm-1處;795cm-1峰向低波數方向移動,移至793cm-1處,是由于Fe2+被氧化成Fe3+,引起血紅素卟啉環中電子濃度分布的改變所致[17]。
2.3.3血紅蛋白與高鐵血紅蛋白的高頻區拉曼光譜分析
在高頻區,1350~1380 cm-1區域的譜線對應ν4振動模式,當卟啉環反π*軌道上電荷濃度增加時成鍵軌道能量變弱,引起拉曼頻移,使ν4振動拉曼峰向低波數方向移動。其中,1356~1361cm-1區域的峰表示鐵離子為處在低自旋態的亞鐵離子Fe2+,隨著NaNO2的加入,Fe2+被氧化成Fe3+,表征低自旋態的亞鐵血紅蛋白特征峰1357cm-1消失;1370~1379cm-1區域的峰表示處在氧化態的血紅蛋白,1377 cm-1向低波數移動,分別移至1373 cm-1和1371cm-1處且強度減弱(圖2),說明卟啉環反π*軌道電荷濃度增加,亞鐵血紅蛋白減少,高鐵血紅蛋白增加[9]。
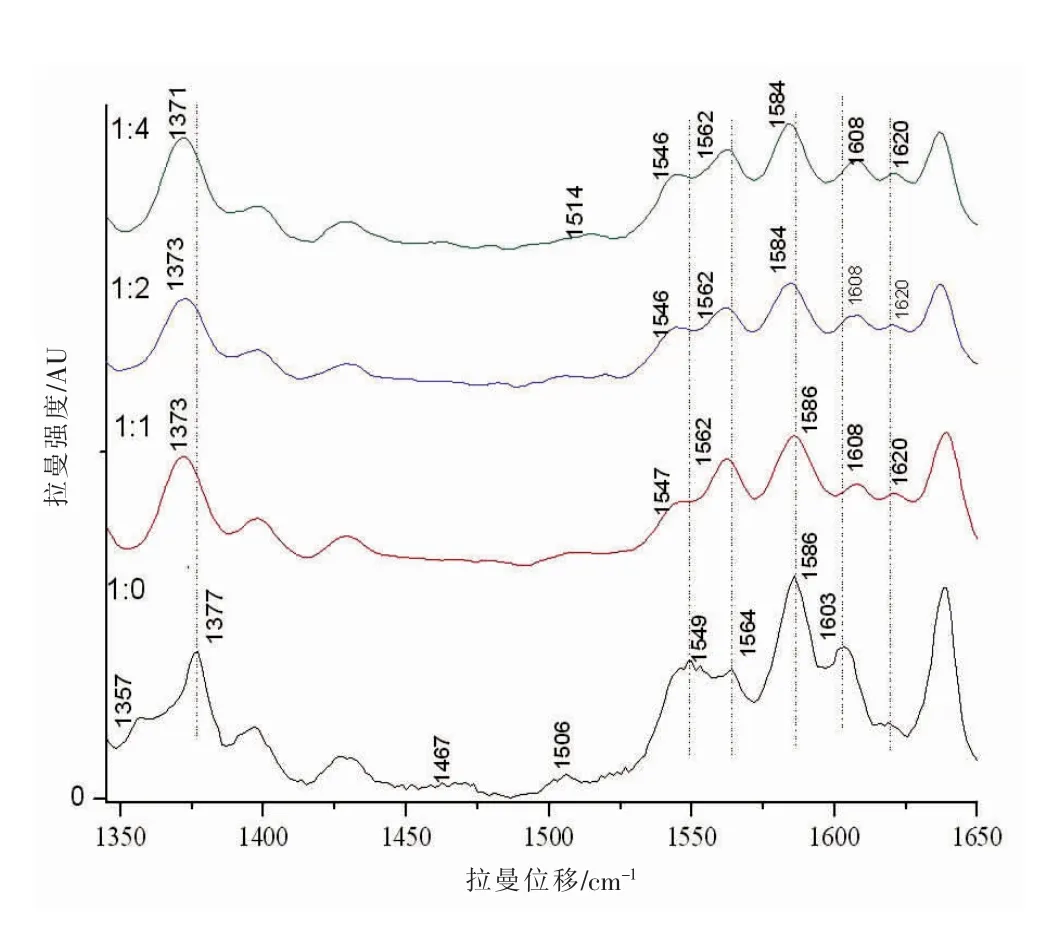
圖2 高頻區部分拉曼峰的位移圖譜
1210~1230 cm-1、1500~1650 cm-1區域的譜線對鐵離子自旋態敏感[18]。隨著NaNO2的加入,1223cm-1強度減弱較大。1549cm-1附近的峰向低波數方向移動,移至1546cm-1。1564cm-1峰向低波數方向移至高自旋態特征峰1562 cm-1處。1586 cm-1峰向低波數方向移至高自旋態特征峰1584 cm-1處,且強度減弱(圖2)。
1500~1650 cm-1區域的譜線不僅對鐵離子自旋態敏感,還能反映卟啉環中心孔徑的大小。鐵離子由低自旋態變成高自旋態,就遠離卟啉環,使中心孔徑變小,特征峰的波數也隨之變大[15]。對卟啉環中心孔徑大小敏感的特征峰1603 cm-1峰向高波數方向移動,移至1608 cm-1處,說明鐵離子逐漸偏離卟啉環導致中心孔徑變小,鐵離子由低自旋態變為高自旋態,亞鐵血紅蛋白減少,高鐵血紅蛋白增加。1506 cm-1逐漸減弱并消失,1514 cm-1出現新峰,1620 cm-1處峰強迅速增加,同樣表明高自旋態的Fe3+的增多(圖2)。
2.3.4血紅蛋白與高鐵血紅蛋白的拉曼譜峰強度變化
除了特征峰的出現及拉曼位移能夠反映分子結構變化,拉曼峰的強度變化,也能很好的反應血紅蛋白的結構變化。如血紅蛋白在675 cm-1處有較強的峰,高鐵血紅蛋白在此處峰強減弱;血紅蛋白在1564、1620 cm-1處有較微弱的峰,高鐵血紅蛋白在此處有較強的峰。
為了便于比較這三個峰的相對強度的變化,參照其相鄰的強度變化不明顯的拉曼峰,考慮兩個相鄰峰強度的相對變化,不考慮拉曼峰移,拉曼峰的相對強度同樣能表現分子的化學鍵及官能團的變化信息,計算未有拉基線處理的原始數據(表2)。隨著NaNO2的加入,I675/I755比值明顯升高,I1549/I1564、I1603/ I1620比值明顯降低,變化趨勢如圖3所示。隨著加入NaNO2量的增加,比值呈現一定的遞變規律。
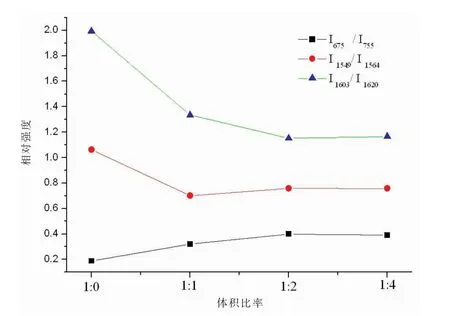
圖3 全血與不同體積NaNO2溶液反應后相鄰拉曼峰的相對強度變化趨勢
2.4體外實驗樣品存放時間對拉曼光譜的影響
亞硝酸鹽中毒實際案件中,采集的樣品往往并非新鮮血液,如血液存放時間較長、血液發生腐敗等。本實驗以1∶4體積比向新鮮全血中加入NaNO2溶液4mg/mL反應后,放置不同時間,進行拉曼光譜測試,以研究中毒不同時間后血紅蛋白所發生的變化。分別研究在室溫下充分反應1、6、24、48、72 h后高鐵血紅蛋白的拉曼光譜,實驗發現,1、6 h拉曼光譜數據變化不大,推測以1∶4體積比向新鮮全血中加入NaNO2溶液4 mg/mL反應1h后,反應充分完成,血紅蛋白幾乎全部被氧化成高鐵血紅蛋白。但是,隨著血液存放時間的延長,提取的血紅蛋白的拉曼光譜信號逐漸減弱,471cm-1譜峰逐漸增強,產生原因可能和血紅蛋白的變質變性有關,拉曼光譜如圖4所示。拉曼光譜表明,血液存放時間較長,血紅蛋白結構出現了較大變化,此時拉曼光譜技術在鑒定亞硝酸鹽中毒方面,具有局限性。
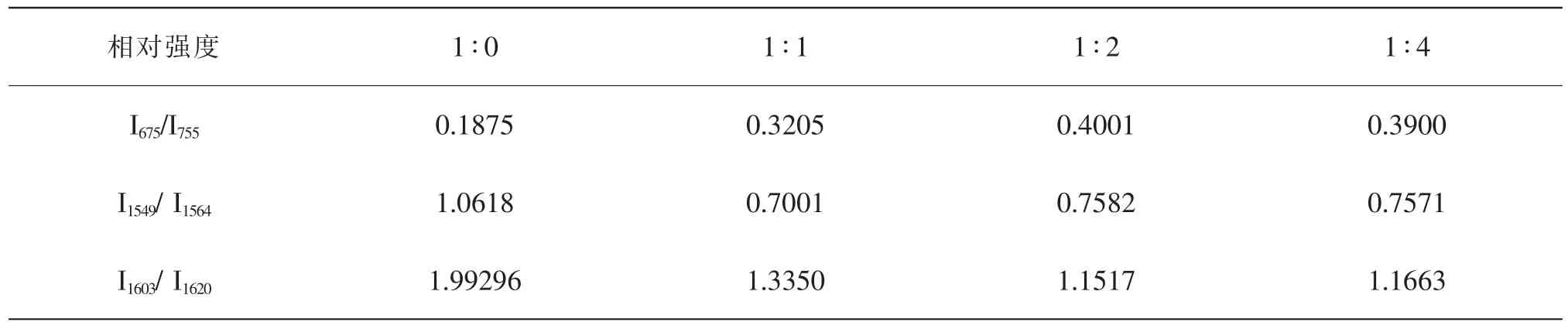
表2 全血與不同體積NaNO2溶液反應后相鄰拉曼峰的相對強度
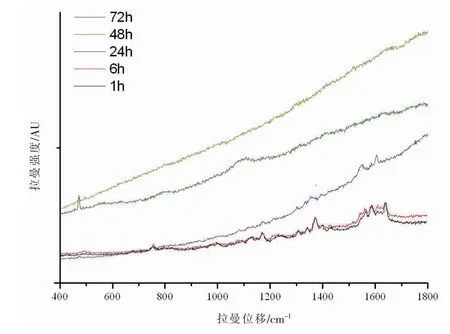
圖4 全血與不同體積NaNO2溶液反應并放置不同時間后的拉曼光譜
3 結論
本文基于拉曼光譜技術,研究了血紅蛋白和高鐵血紅蛋白的特征拉曼峰,發現532 nm激光激發的拉曼光譜以血紅素的共振增強效應為主,能較好的反映全血中血紅蛋白氧化過程所發生的分子結構變化,血紅素平面和鐵離子軸向配體鍵微小變形的400~700cm-1、與鐵離子自旋態相關的1210~1230cm-1和1500~1650cm-1及與血紅蛋白卟啉環反π*軌道上電荷濃度相關的1350~1380 cm-1處拉曼峰強度變化及峰位位移的信息,可以鑒別氧合血紅蛋白和高鐵血紅蛋白,為亞硝酸鹽中毒案件的檢驗鑒定提供了重要依據。但樣品存放時間過長,高鐵血紅蛋白的拉曼信號會逐漸變弱,推斷和血紅蛋白的變質變性有關,這給實際中毒案件的判定帶來不確定性。
參考文獻:
[1]聶艷,尹春,唐曉純,等.1985-2011年我國食物中毒特點分析及應急對策研究[J].食品科學,2013,34(5): 218-222.
[2]Power G G,Bragg S L,Oshiro B T,et al. A Novel Method of Measuring Reduction of Nitrite-Induced Methemoglobin Applied to Fetal and Adult Blood of Humans and Sheep[J]. Journal of Applied Physiology,2007,103(4): 1359-1365.
[3]苗翠英.毒物毒品檢驗[M].北京:中國人民公安大學出版社,2013: 96.
[4]柏林洋,宋金海,馮剛.亞硝酸鹽檢測方法的研究進展[J].廣州化工,2011,39(13): 31-33.
[5]廖林川.法醫毒物分析[M].北京:人民衛生出版社,2013:271.
[6]陳永平,林黎明,宮慶禮,等.亞硝酸鹽和硝酸鹽檢測方法的研究進展[J].分析試驗室,2008,27(S1):193-198.
[7]郭世珺,曾常春,李麗君,等.亞硝酸鈉化高鐵血紅蛋白的拉曼光譜量化檢測研究[J].光譜學與光譜分析,2013,(7): 1805-1809.
[8]Lu M,Zhao L,Wang Y,et al. Measurement of the Methemoglobin Concentration Using Raman Spectroscopy[J]. Artificial Cells,Nanomedicine,and Biotechnology,2014,42 (1): 63-69.
[9]Wood B R,McNaughton D. Raman Excitation Wavelength Investigation of Single Red Blood Cells in Vivo[J]. Journal of Raman Spectroscopy,2002,33(7): 517-523.
[10]Abe M,Kitagawa T,Kyogoku Y. Resonance Raman Spectra of Octaethylporphyrinato-Ni(II)and Meso-Deuterated and 15N Substituted Derivatives. II. A Normal Coordinate Analysis[J]. The Journal of Chemical Physics,1978,69 (10): 4526-4534.
[11]Hu S,Smith K M,Spiro T G. Assignment of Protoheme Resonance Raman Spectrum by Heme Labeling in Myoglobin[J]. Journal of the American Chemical Society,1996,118(50): 12638-12646.
[12]Jeyarajah S,Proniewicz L M,Bronder H,et al. Low Frequency Vibrational Modes of Oxygenated Myoglobin,Hemoglobins,and Modified Derivatives[J]. Journalof Biological Chemistry,1994,269(49): 31047-31050.
[13]Rimai L,Salmeen I,Petering D H. Comparison of the Resonance Raman Spectra of Carbon Monoxy and Oxy Hemoglobin and Myoglobin. Similarities and Differences in Heme Electron Distribution[J]. Biochemistry,1975,14(2): 378-382.
[14]Yamamoto T,Palmer G,Gill D,et al. The Valence and Spin State of Iron in Oxyhemoglobin as Inferred from Resonance Raman Spectroscopy[J]. Journal of Biological Chemistry,1973,248(14): 5211-5213.
[15]Smulevich G. Understanding Heme Cavity Structure of Peroxidases: Comparison of Electronic Absorption and Resonance Raman Spectra with Crystallographic Results[J]. Biospectroscopy,1998,4(S5): S3-S17.
[16]Desbois A,Lutz M,Banerjee R. Low-Frequency Vibrations in Resonance Raman Spectra of Horse Heart Myoglobin. Iron-Ligand and Iron-Nitrogen Vibrational Modes[J]. Biochemistry,1979,18(8): 1510-1518.
[17]Podstawka E,Proniewicz L M. Resonance Raman Study of Deoxy and Ligated(O2and CO)Mesoheme IX-Reconstituted Myoglobin,Hemoglobin and its α and β Subunits[J]. Journal of Inorganic Biochemistry,2004,98(9): 1502-1512.
[18]Wood B R,Caspers P,Puppels G J,et al. Resonance Raman Spectroscopy of Red Blood Cells Using Near-Infrared Laser Excitation[J]. Analytical and Bioanalytical Chemistry,2007,387(5): 1691-1703.
(本文編輯:施妍)
Application of Raman Spectroscopy in the Rapid Detection of Sodium Nitrite Poisoning
QIN Zhen-ke1,CAO Fang-qi1,LIU Wen-bin1,YANG Fei-yu1,HAO Hong-fei1,MENG Hang1,2,ZHANG Run-sheng1,2
(1.Shanghai Key Laboratory of Crime Scene Evidence,Institute of Criminal Science and Technology,Shanghai Municipal Public Security Bureau,Shanghai 200083,China;2.Institute of Forensic Science,Shanghai Municipal Public Security Bureau,Shanghai 200083,China)
Abstract:Objective To investigate the structural change of oxyhemoglobin(HbO2)induced by sodium nitrite(NaNO2),and to establish a new method for the rapid identification of nitrite poisoning. Method Different volumes of sodium nitrite solution at the same concentration were added to the whole blood samples,and the hemoglobin was extracted and purified. Then the variations in the structure and properties of HbO2and methemoglobin(MetHb)were investigated with micro-Raman spectroscopy. Results The changes of intensity and location of Raman peaks at 400-700 cm-1,which is assigned to the iron-ligand modes,1210-1230 cm-1and 1500-1650 cm-1,which corresponds to the low spin state of iron,and 1350-1380 cm-1,which reflects the electron population in the porphyrin π* orbitals,can be used as indexes to detect HbO2and MetHb. Conclusion The Raman spectroscopy is of great potential in the rapid detection of nitrite poisoning in criminal cases.
Key words:oxyhemoglobin;methemoglobin;Raman spectroscopy;nitrite poisoning
中圖分類號:DF795.1
文獻標志碼:A
doi:10.3969/j.issn.1671-2072.2016.03.007
文章編號:1671-2072-(2016)03-0044-06
收稿日期:2015-09-06
基金項目:上海市現場物證重點實驗室資助項目(2014XCW ZZ04);物證的初檢技術(2014XCWZZ05);公安部技術研究計劃項目資助(2015JSYJB06)
作者簡介:秦真科(1987—),男,助理研究員,主要從事物證光學探測及理化分析研究。E-mail: binhuzhen@163.com。
通信作者:張潤生(1960—),男,研究員,主要從事毒品毒物的分析鑒定工作。E-mail:zhangrs0607@sina.com。

