1起家庭聚集性肺炎病原學檢測及基因特征分析
許玉玲 王海霞 聶軼飛 羅成琳 黃學勇 趙 坤 許汴利
1起家庭聚集性肺炎病原學檢測及基因特征分析
許玉玲 王海霞 聶軼飛 羅成琳 黃學勇 趙 坤 許汴利
目的 分離鑒定引起家庭聚集性肺炎的病原體,并進行基因特征分析。方法 采集該家庭每個成員的血清、咽拭子和肺炎患者的肺泡灌洗液,通過PCR方法、病毒分離、hexon測序、BLAST比對和血清IgG酶聯免疫方法檢測病原,并對hexon序列進行進化樹分析。對陽性病毒分離物進行全基因組擴增。結果 父母咽拭子2份、孩子肺泡灌洗液2份經PCR檢測均為腺病毒(AdV)陽性,肺泡灌洗液病毒分離陽性,4份標本hexon區域PCR擴增測序,核苷酸同源性為99.5%~100.0%,病毒全序擴增拼接分析,BLAST比對與腺病毒7型核苷酸同源性97.0%,基因進化樹分析顯示hexon基因分型與腺病毒7d位于同一分支。ELISA方法檢測一家4口均出現恢復期與急性期血清腺病毒IgG4倍增高現象。結論 腺病毒7型是該起家庭聚集性肺炎的病因。
腺病毒7;大葉性肺炎;聚集性病例
近些年,多地大型綜合性醫院和綜合性兒童醫院發表有關兒童“大葉性肺炎”病例增多趨勢的文獻,試圖從臨床和病原等方面多角度剖析該病高發的原因。2002~2004年,臺灣地區的兒童大葉性肺炎在肺炎中的比例從7%上升到了19%[1];安徽省也有兒童大葉性肺炎比例從2008年的4.2%上升到2009年14.4%的報道[2];河南省兒童醫院及各綜合醫院兒科數據顯示,近幾年兒童大葉性肺炎患者數量增加,臨床癥狀及治療效果與以往均有變化,抗生素治療效果不佳,肺部炎癥消散較慢。為研究引起兒童大葉性肺炎病原學構成,為臨床診斷和治療提供更科學的依據,本單位與河南省中醫學院兒科建立合作關系。現將一起家庭聚集性肺炎的檢測方法和結果報道如下。
1 資料與方法
1.1 病例與標本采集 2010年12月10日該院兒科收一3歲患兒,以“咳嗽1周,加重伴發熱4d”入院,入院查體:體溫40℃,脈搏140次/min,呼吸38次/min,呼吸音粗,消化系統和循環系統無異常,精神狀態欠佳。血常規檢測:白細胞總數6.62×109/L,胸部CT檢查:右上肺有滲出,右側顯示有胸腔積液。患兒父母告知,自行抗生素治療4d,未見好轉。該患兒姐姐7歲,于11月中旬出現咳嗽、流涕、低熱等上呼吸道癥狀,抗生素治療10d不愈,2周后逐步發展為左側大葉性肺炎入院治療,給予甲潑尼龍、頭孢和痰熱清針輸液治療5d,癥狀逐步緩解。其母親出現呼吸道感染癥狀,父親無明顯癥狀。為明確病因,采集家庭成員相關標本進行病原學檢測。
1.2 主要試劑和儀器 核酸提取試劑為Qiagen Elute(Cat:52904),呼吸道多病原檢測試劑盒為江蘇合創科技有限公司生產,該試劑盒采用四通道實時熒光PCR方法,檢測15種呼吸道病毒:腺病毒(AdV)、合胞病毒(RSV)、鼻病毒(Rhino)、甲型流感病毒通用(Flu A)、乙型流感病毒(Flu B)、冠狀病毒(229E+HKU1;NL63+OC43)、甲3型流感、博卡病毒、偏肺病毒(hMPV)、副流感病毒I~iv型(hPIVI~iv型)、新H1N1型。PCR擴增試劑為Taraka公司ExTaq酶試劑盒。細胞培養基為日本日水MEM粉劑,青鏈霉素、0.25%胰酶、谷氨酰胺均為Hyclone公司生產,腺病毒IgG檢測試劑盒為賽潤維潤公司。熒光PCR儀器為BIO-RAD IQ5。
1.3 標本核酸提取與熒光RT-PCR檢測 對肺泡灌洗液、咽拭子進行震蕩、離心,提取上清液,按照核酸提取試劑盒說明書操作,提取各類標本核酸,-20℃保存,為后期試驗準備。
呼吸道多種病原檢測反應體系為各組分17.22μL,酶混合液0.8μL,樣品核酸2.0μL,總體積共20μL,反應條件:逆轉錄階段42℃10min,預變性階段94℃,10sec,預擴增94℃,5s,50℃,20sec,72℃,20sec,5個循環,檢測階段:94℃,5sec,56℃,50sec,72℃,15sec,共40個循環,在檢測階段延伸處收集信號。觀察擴增曲線和Ct值,記錄陽性結果。
1.4 病毒分離 采用Hep2、Hela細胞進行病毒分離。將肺泡灌洗液和咽拭子經震蕩、離心前處理后,取200μL接種單層細胞,每個標本2孔,36度培養5~7d,將第1代培養產物凍融2次后,離心,取上清200μL接種單層細胞繼續二代培養,3~5d出現細胞變圓、皺縮或脫落等CPE現象,即可收獲病毒,并用試劑盒提取核酸保存備用。
1.5 引物設計與腺病毒hexon基因PCR擴增 依據呼吸道病原實時熒光PCR結果判斷分離病毒為腺病毒,設計合成腺病毒hexon引物ZY-1:GCTTTGAAAATGAGACACC,ZY-2:TAAGGTCCAAAGGTCCATCC,進行PCR擴增,擴增條件:94℃,5min;94℃,1min,54℃,45s,72℃,50s,35個循環,72℃,10min;電泳條件:瓊脂糖凝膠濃度1.2%,電泳液1×TAE,電壓6V/cm,30min,于BIO-RAD凝膠成像儀觀察成像,并保存。
1.6 酶聯免疫法檢測腺病毒IgG 按照腺病毒IgG試劑盒說明書進行操作,將急性期血清稀釋1∶2000倍,恢復期血清稀釋1∶8000倍,經加樣、孵育、洗板、顯色等過程后,于酶標儀上檢測各標本OD值,結合說明書判讀結果。
1.7 生物信息學分析 將PCR產物委托南京金斯瑞公司進行測序,測序結果使用生物學軟件ATGC進行拼接,在genebank上進行BLAST,獲得比對結果。從網上下載腺病毒7型不同亞型代表株hexon基因14株,mega4.0分析其基因高變區(參考株Gomen的hexon基因403~1356bp)[3-4]核苷酸同源性分析,并繪制基因進化樹。
2 結果
2.1 標本采集情況 收集到醫院對肺炎患兒肺部灌洗液2份,一家4人每人咽拭子、急性期血清和恢復期血清各1份,共14份標本。
2.2 熒光RT-PCR結果 咽拭子、肺泡灌洗液和血清標本15種呼吸道病毒實時熒光PCR檢測結果。見表1。
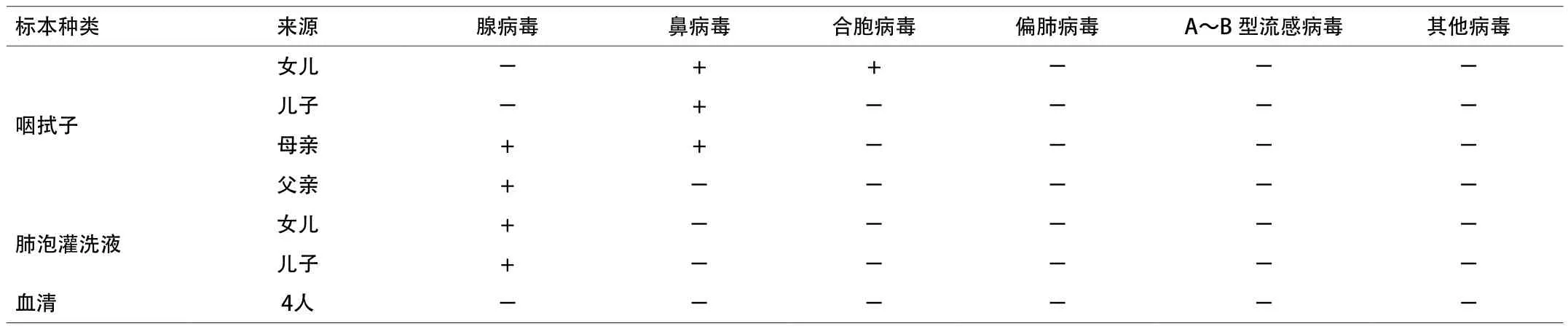
表1 各類標本實時熒光PCR檢測結果
2.3 病毒分離鑒定結果 2份肺泡灌洗液在Hep2細胞1代接種第4天均出現明顯CPE現象,其余標本無陽性結果。實時熒光檢測腺病毒陽性的4份標本經hexon基因PCR擴增后,在850bp處均有亮帶,對測序結果進行拼接分析,核苷酸同源性為99.5%~100.0%,網上BLAST比對顯示與腺病毒7型核苷酸同源性為99%。分離病毒經全序擴增,測序、拼接,網上BLAST比對顯示與腺病毒7型核苷酸同源性達97.0%。
2.4 hexon進化樹分析 分離獲得2株病毒,兩株病毒hexon區核苷酸同源性99%,河南分離株hexon高變區與其余腺病毒7型各種亞型之間的核苷酸同源性為97.2%~100%,與7a、7d、7d2、7l亞型分離株的同源性均為100%,與1954年美國分離的Gomen原型株7p差異最大為2.8%,進化樹分為2支,河南分離株與2010年中國分離株、2011年臺灣分離株處于同一簇,距離HADV 7d最近。見圖1。
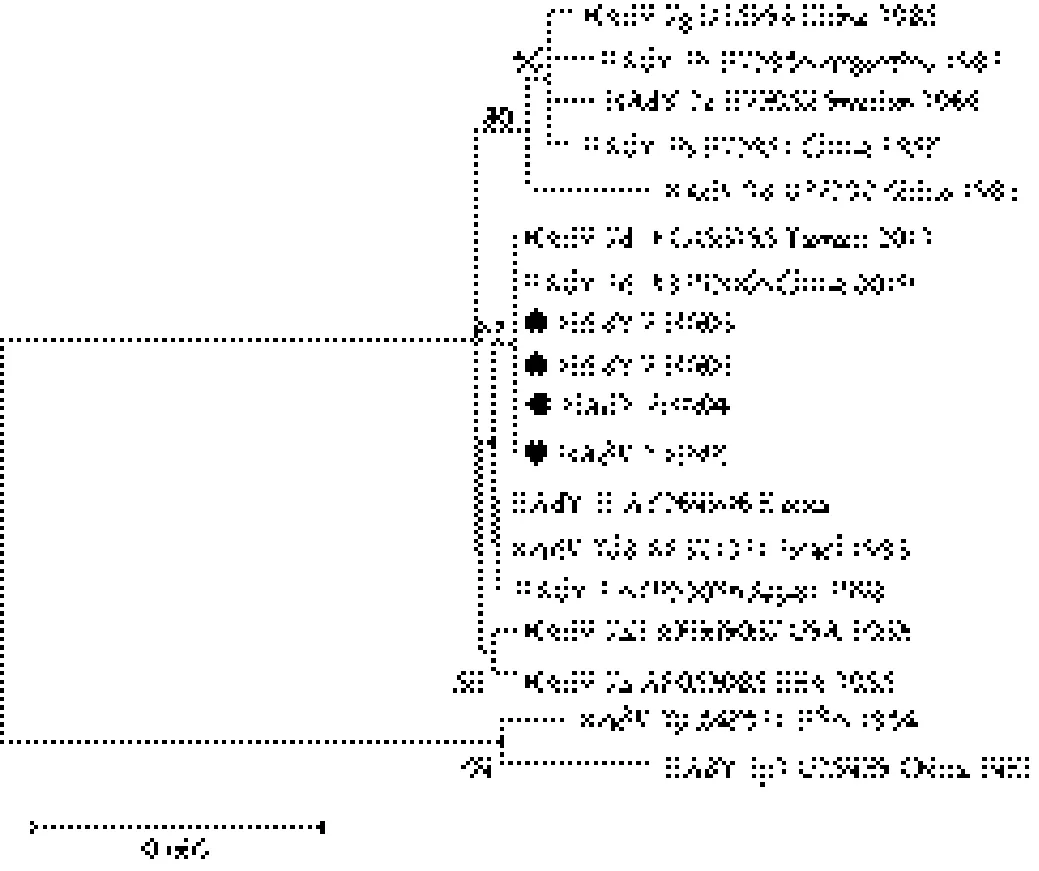
圖1 于hexon基因的腺病毒進化樹分析注:“●”, henan adenovirus strain
2.5 血清腺病毒IgG結果 腺病毒陽性對照OD平均值為1.455,依據說明書計算出OD值>0.733為腺病毒IgG陽性。父母孩子急性期血清IgG OD值分別為0.355、0.131、0.207、0353,均為陰性,而恢復期血清OD值分別為0.800、0.928、1.438、2.379,均為陽性,說明一家4人腺病毒IgG水平均出現恢復期比急性期4倍增高。
3 討論
腺病毒可引起多種疾病,急性呼吸道感染、肺炎、角結膜炎、胃腸炎、腦膜腦炎、急性出血性膀胱炎等等[5],不同的血清型與不同的疾病譜相關。腺病毒型別眾多,目前已鑒定的血清型有57種,分屬于A~G 7個不同的亞組,與呼吸道感染有關的是B、C、E組,尤其B亞組可引起嚴重的呼吸道疾病。腺病毒7型屬于B亞組,可引起暴發流行,特別是在嬰幼兒中可引起嚴重的支氣管炎甚至是致命的肺炎[6]。世界多地均有腺病毒7型引起的呼吸道疾病報導,我國山西近年出現由腺病毒7型引起的70例嬰幼兒下呼吸道感染暴發疫情,1例死亡[7];美國在上世紀90年底末期,由腺病毒7型引起的呼吸道感染疾病占總腺病毒引起疾病的20%,所致疾病有輕型的上呼吸道感染,也有嚴重的肺炎等;韓國、日本、臺灣、瑞士等多地均有腺病毒7型病毒致不同疾病的相關報導。
本研究一個家庭4人均感染腺病毒7型,父親無任何癥狀,僅在雙份血清中查出腺病毒IgG四倍增高,母親則出現輕微上呼吸道感染癥狀,有咳嗽、咽痛等。兩個孩子均出現發熱、咳嗽及單側肺葉炎癥,抗生素治療效果差,肺部炎癥消散慢。上述情況說明人群對腺病毒普遍易感,因嬰幼兒免疫系統發育不完善,抵抗力較低,感染腺病毒后易導致嚴重下呼吸道感染疾患,如支氣管炎和肺炎等,而且肺炎感染后期會出現細菌合并感染現象。故早期診斷,明確病原,針對病因及時治療比單純對癥用藥效果顯著。
檢測呼吸道感染疾病的標本有鼻、咽拭子、痰液和下呼吸道標本等,鼻/咽拭子為開放性標本,所含病原比較豐富,在機體免疫力正常時,能與機體和諧共存,當機體免疫力降低,可致機體發病;肺泡灌洗液為下呼吸道深部標本,檢測到的病原很可能就是患者的致病原因。本研究兩個孩子肺泡灌洗液中均檢測出腺病毒陽性,而咽拭子僅檢測到其他病毒,父母咽拭子檢測到腺病毒及其他病毒的混合感染,這些數據表明呼吸道疾病病原多種,僅檢測咽拭子不能明確病因,即使檢測呼吸道深部標本某種病原陽性,仍需與該患者雙份血清該病原IgG四倍增高結合,才能明確病因。
既往腺病毒7分型依據不同的限制性內切酶圖譜,可分為7a~7l,7p等10多種亞型,近年來依據基因序列進行進化樹分析型別,因其快速準確已被廣泛應用。不同國家不同時間有不同亞型占主導地位,毒株在不同國家之間傳播與循環。1966~2000年,美國分離腺病毒7型以7b型為主,占65%,7d2占28%,1998~2000年出現7h,僅占2%,1996年日本上呼吸道感染標本分離腺病毒7型以7h為主[8],韓國2005~2006年以7d流行占主導地位[9],自1980年以來,我國腺病毒流行株為7d,山西省自2009年以來分離的腺病毒以7d為主,本研究分離腺病毒hexon基因遺傳進化樹分析與7d分離株親緣關系最近。不同的亞型株是否與所致疾病輕重有關,還需要更多的臨床資料與進一步的實驗數據去驗證。
明確腺病毒7型為該起家庭聚集性大葉性肺炎的致病原,提示了腺病毒7型在河南流行的可能性,為河南省兒童大葉性肺炎尋找流行病原提供實驗室依據。
[1] Lin CJ,Chen PY,Huang FL,et al.Radiographic,clinical and prognostic features of complicated and uncomplicated community-acquired lobar pneumonia in children[J].J Microbiol Immunol Infect,2006,39(6): 489-495.
[2] 侯舒,許曉燕,王亞亭,等.兒童大葉性肺炎危險因素分析[J].臨床肺科雜志,2011,16(5):701-702.
[3] Erdman DD,Xu Wh,Su L,et al.Molecular epidemiology of adenovirus type 7 in the United States,1966-2000[J].Emerg Infect Dis,2002,8(3):269-277.
[4] 黃學勇,王海霞,許玉玲,等.腺病毒7型河南分離株全基因序列測定及基因重組分析[J].中國病原生物學雜志,2014,9(9):804-807.
[5] Jones M,Harrach B,Ganac RD,et al.New adenovirus species found in a patient presenting with gastroenteritis[J].J virol,2007,81(11): 5978-5984.
[6] Kim Y,Hong J,Lee H,et al.Genome type analysis of adenovirus type 3 and 7 isolated during successive outbreaks of lower respiratory tract infectious in children[J].J Clin Microbiol,2003,41:4594-4599.
[7] Tang LY,Wang L,Tan XJ,et al.Adenovirus serotype 7 associated with a severe lower respiratory tract disease outbreak in infants in shanxi Province,China[J].Virol J,2011,8(23):1-7.
[8] Hashido M,Mukouyama A,Sakae K,et al.Molecular and serological characterization of adenovirus genome type 7h isolated in Japan[J]. Epidemiol Infect,1999,122:281-286.
[9] Lee WJ,Kang C,Chung YS,et al.Molecular classification of human adenovirus type 7 isolated from acute respiratory disease outbreak in Korea,2005-2006[J].Public health Res Perspect,2010,1(1):10-16.
Objective To isolate and identify the pathogen leading to a family gathered pneumonia and analyze its gene characteristics. Methods Collect everyone’s serum (acute and recovery stage), throat swab and bronchoalveolar lavage fluid of the family. The etiology was identified by PCR, virus isolation, hexon gene sequenced, BLAST and ELISA. The whole genome of the virus were further amplified and sequenced. Results 2 virus were obtained by Hep2 cell from 2 bronchoalveolar lavage fluids. Adenovirus was detected positive by PCR in parent 2 throat swabs and 2 children bronchoalveolar lavage fluids and 2 isolates. The nucleotide acid homologies of the 4 samples hexon genes were 99.5%-100%. The virus was finally identified as adenovirus 7 by 97.0% homology of nucleotide through BLSAT in the genebank. It was localized into the same cluster with AdV7d stains based on hexon gene using Mega 4.0. The level of adenovirus IgG in the recovery stage serum was 4 times higher than in the acute stage serum through ELISA in the 4 persons. Conclusion Adenovirus serotype 7 was the primary pathogen induced the family gathered pheunomia.
Adenovirus type 7; Lobar pneumonia; Gathered cases
10.3969/j.issn.1009-4393.2016.26.003
河南省醫學科技攻關重大項目(132102310060)
河南 450016 河南省疾病預防控制中心 (許玉玲 王海霞聶軼飛 黃學勇 許汴利) 450002 鄭州大學附屬鄭州中心醫院 (羅成琳)450008 河南中醫學院一附院(趙坤)
許汴利 E-mail:xubl@hncdc.com.cn

