從尖尾東鱉甲中提取甲殼素的研究
張建英,賈龍,張大治,喜巧紅(.寧夏大學生命科學學院,寧夏銀川7500;.寧夏大學農學院,寧夏銀川7500)
?
從尖尾東鱉甲中提取甲殼素的研究
張建英1,賈龍2,張大治1,喜巧紅1
(1.寧夏大學生命科學學院,寧夏銀川750021;2.寧夏大學農學院,寧夏銀川750021)
摘要:通過單因素試驗和正交試驗探討從尖尾東鱉甲(Anatolica mucronata Reitter,1889)中提取甲殼素的最佳條件,并對甲殼素樣品進行定性和定量分析。試驗結果表明:利用酸浸堿煮法提取甲殼素的最佳試驗條件為:氫氧化鈉濃度7%、溫度87℃、時間5h、固液比1∶13(g/mL),檸檬酸濃度1.6g/L、室溫、時間28h、固液比1∶9(g/mL);對在最佳試驗條件下提取得到的甲殼素樣品進行紅外光譜檢測,并計算其得率為21.45%。用紫外吸收法和干法灰化法分別測定提取物中殘余蛋白質和無機鹽含量。
關鍵詞:甲殼素;尖尾東鱉甲;最佳試驗條件;提取;昆蟲資源
尖尾東鱉甲(Anatolica mucronata Reitter,1889)隸屬于鞘翅目擬步甲科,是蒙古高原的特有種,是我國北方的優勢土壤昆蟲,國內已知分布于內蒙古中西部、陜西北部、甘肅中北部和寧夏中北部,分布地區偏向蒙新區中部[1-2]。尖尾東鱉甲棲息于荒漠半荒漠草原,體色光亮,食性較雜,取食葉片、草根等。成蟲通常喜氣溫大于15℃,地面溫度大于18℃外出活動,且單獨活動于沙面等較開闊地帶,爬行速度快,活動范圍大,活動高峰期集中于10:00-17:00,正午高溫時,表現出短時背光現象[1-3]。蟲體富含營養物質并具一定藥用價值,特別是其防御腺分泌物有較強的化學毒性,具有重要醫學價值。
甲殼素又名甲殼質、幾丁質、蟹殼素等,廣泛存在于低等動物,特別是節肢動物體內[4-6],如:昆蟲、甲殼動物等體內,它是一種天然的高分子多糖。由于甲殼素的化學結構和植物纖維素非常相似,且是自然界中唯一帶正電荷的天然高分子聚合物,因此具備特殊的理化性質且天然無毒,被廣泛應用于醫藥、農業、食品、化工、廢水處理和生物工程等諸多領域中[5,7-8]。現今已引起了許多國家的重視,已成為最熱門的研究領域之一[9]。目前,歐美學術界已稱其為六大生命元素之一(蛋白質、脂質、糖類、維生素、礦質元素、甲殼素)[10-11],現階段工業上用來制備甲殼素的主要原料是水產加工場廢棄的蝦殼和蟹殼,但存在生產成本高,重金屬難以脫除等限制問題。通過前人從蠅、蠶等一些蟲種中提取甲殼素的研究發現,昆蟲中甲殼素含量比較高,而且鈣和重金屬含量低,雜質少,純度高,質量好,提取過程中對水、酸、堿消耗少,生產成本低。可見,昆蟲甲殼素要優于蝦、蟹甲殼素。因此,開發新的甲殼素資源具有重要的意義,而資源量大、種類多的昆蟲正是潛在的甲殼素來源[5,8]。目前國內已有蠶蛹、蜣螂、蟋蟀等昆蟲中甲殼素的提取報道[6,12],但未有從尖尾東鱉甲中提取甲殼素的有關報道[1-2,13]。
1 材料與方法
1.1材料、儀器與試劑
1.1.1材料
尖尾東鱉甲成蟲:采自寧夏靈武。
1.1.2儀器
電熱恒溫鼓風干燥箱(DHG-9140A型):上海一恒科技有限公司;電熱恒溫水浴鍋(二列六孔):北京長源實驗設備廠;紫外可見分光光度計(T6):北京普析通用儀器有限責任公司;電子分析天平(AL204):梅特勒-托利多儀器(上海)有限公司;馬弗爐(sx4-10):深圳市中達電爐廠;紅外光譜儀(TENSOR27):德國布魯克;低速臺式離心機(KA-1000):上海安亭科學儀器廠;pH計(320A):梅特勒-托利多儀器(上海)有限公司。
1.1.3化學試劑
氫氧化鈉(分析純):天津市北聯精細化學品開發有限公司;檸檬酸(分析純):天津市凱通化學試劑有限公司;標準甲殼素樣品(C9752-250MG):Sigma Aldrich;過氧化氫(30%):北京化工廠;溴化鉀(分析純):天津市風船化學試劑科技有限公司。
1.2方法
1.2.1工藝流程
新鮮甲蟲→預處理(除雜,烘干,粉碎)→脫除無機鹽→水洗至中性→脫除蛋白質→水洗至中性→干燥→脫色[14]→甲殼素樣品
1.2.2指標測定
測定脫除無機鹽后樣品的灰分,以確定脫除無機鹽最佳試驗條件;通過測定脫除蛋白質后樣品的剩余蛋白質含量,以確定脫除蛋白質的最佳試驗條件。總灰分/%=(恒重后坩堝和灰分重量-恒重后坩堝重量)/樣品重量×100[15];蛋白質含量/(μg/mL)=(1.45A280-0.74A260)×稀釋倍數[16],式中:A280、A260分別為蛋白質溶液在280、260 nm處測得的吸光度。
1.3單因素試驗
1.3.1檸檬酸酸浸濃度的確定
稱取5份尖尾東鱉甲干粉1.000 g,分別置于三角瓶中,在固液比1∶11(g/mL)、反應時間30 h、室溫條件下,分別加入濃度為0.6、1.0、1.4、1.8、2.2 g/L檸檬酸溶液,離心并將固體產物水洗至中性,干燥后得脫無機鹽尖尾東鱉甲粉,測定產物灰分含量確定檸檬酸的最適濃度,重復3次。
1.3.2檸檬酸酸浸時間的確定
稱取5份尖尾東鱉甲粉1.000 g,分別置于三角瓶中,在固液比1∶11(g/mL)、檸檬酸濃度1.4 g/L、室溫條件下,恒溫20、25、30、35、40 h,離心并將固體產物水洗至中性,干燥后得脫無機鹽尖尾東鱉甲粉,測定產物灰分含量確定檸檬酸的酸浸的最適時間,重復3次。
1.3.3檸檬酸酸浸固液比的確定
稱取5份尖尾東鱉甲粉1.000 g,分別置于三角瓶中,在檸檬酸濃度1.4 g/L、反應時間30 h、室溫條件下,分別以固液比1∶7、1∶9、1∶11、1∶13、1∶15(g/mL)加入檸檬酸溶液,離心并將固體產物水洗至中性,干燥后得脫無機鹽尖尾東鱉甲粉,測定產物灰分含量確定檸檬酸的最適固液比,重復3次。
1.3.4氫氧化鈉堿浸濃度的確定
稱取5份尖尾東鱉甲粉1.000g,分別置于三角瓶中,在固液比1∶12(g/mL)、90℃水浴、恒溫5 h條件下,分別加入4%、6%、8%、10%、12%氫氧化鈉溶液,離心并將固體產物水洗至中性,得脫蛋白尖尾東鱉甲粉,測定產物蛋白質含量確定氫氧化鈉的最適濃度,重復3次。
1.3.5氫氧化鈉堿浸時間的確定
稱取5份尖尾東鱉甲粉1.000 g,分別置于三角瓶中,在固液比1∶12(g/mL)、90℃水浴、濃度8%條件下,分別恒溫1、3、5、7、9 h,離心并將固體產物水洗至中性,得脫蛋白尖尾東鱉甲粉,測定產物蛋白質含量確定氫氧化鈉堿浸的最適時間,重復3次。
1.3.6氫氧化鈉堿浸溫度的確定
稱取5份尖尾東鱉甲粉1.000 g,分別置于三角中,在固液比1∶12(g/mL)、恒溫5 h、濃度8%條件下,分別置于80、85、90、95、100℃水浴鍋中,離心并將固體產物水洗至中性,得脫蛋白尖尾東鱉甲粉,測定產物蛋白質含量確定氫氧化鈉堿浸的最適溫度,重復3次。
1.3.7氫氧化鈉堿浸固液比的確定
稱取5份尖尾東鱉甲粉1.000 g,分別置于三角瓶中,在90℃水浴、恒溫5 h、濃度8%條件下,分別以固液比1∶8、1∶10、1∶12、1∶14、1∶16(g/mL)加入氫氧化鈉溶液,離心并將固體產物水洗至中性,得脫蛋白尖尾東鱉甲粉,測定產物蛋白質含量確定氫氧化鈉的最適固液比,重復3次。
1.4正交試驗
1.4.1檸檬酸脫除無機鹽的正交試驗設計
在單因素試驗得到的最適檸檬酸濃度、酸浸時間、固液比的基礎上,在室溫條件下,選擇檸檬酸濃度、酸浸時間、固液比3個因素為考察對象,設計三因素三水平正交試驗對工藝條件進行優化。正交試驗設計見表1。

表1 脫除無機鹽的正交試驗因素水平表Table 1 Factors and levels of demineralization orthogonal experiment
1.4.2氫氧化鈉脫除蛋白質的正交試驗設計
在單因素試驗得到的最適氫氧化鈉濃度、堿浸時間、堿浸溫度、固液比的基礎上,選擇氫氧化鈉濃度、堿浸時間、堿浸溫度、固液比4個因素為考察對象,設計四因素三水平正交試驗對工藝條件進行優化。正交試驗設計見表2。

表2 脫除蛋白質的正交試驗因素水平表Table 2 Factors and levels of deproteinization orthogonal experiment
1.5甲殼素樣品定性和定量分析
甲殼素定性檢測采用紅外光譜對比法:分別將標準甲殼素和所制備的甲殼素烘干,2 mg待測樣品與100 mg KBr混合,通過壓片法制成薄片,用紅外光譜儀掃描范圍400 cm-1~4 000 cm-1[17],通過對比兩者的紅外光譜圖,確定本研究制備的樣品是否為甲殼素。
甲殼素得率計算方法:甲殼素含量/%=(所提甲殼素重量干重W1/所用該種昆蟲干重W2)×100[6,18]。
2 結果與分析
2.1單因素試驗
2.1.1檸檬酸酸浸濃度試驗結果的分析
檸檬酸酸浸濃度試驗結果見圖1。

圖1 檸檬酸濃度對脫除無機鹽的影響Fig.1 Effect of citric acid concentration on demineralization
由圖1可知,隨著檸檬酸濃度的增加,灰分含量逐漸下降,脫除無機鹽的效果較明顯;當檸檬酸濃度達到1.8 g/L以后其灰分含量總體雖也在下降,但下降趨勢不明顯,當濃度由1.8 g/L變為2.2 g/L時,灰分含量減少量不大,且隨著檸檬酸濃度的增加甲殼素容易水解。同時也考慮在實際操作中,檸檬酸濃度過高會使反應速率過快而不容易控制,因此,選擇檸檬酸濃度為1.8 g/L較為合適。
2.1.2檸檬酸酸浸時間試驗結果的分析
檸檬酸酸浸時間試驗結果見圖2。
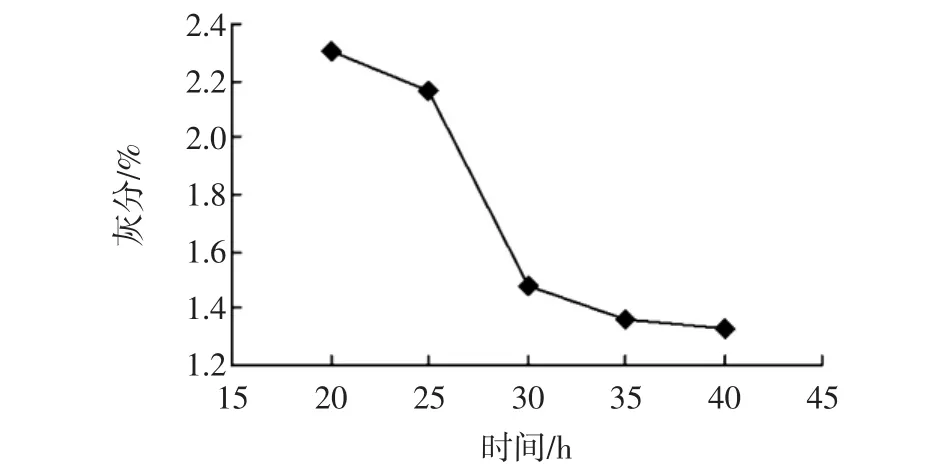
圖2 反應時間對除去無機鹽的影響Fig.2 Effect of reaction time on demineralization
在反應的初始階段,隨著酸浸時間的延長,灰分含量下降較為明顯,脫除無機鹽效果較明顯;當反應時間達到30 h以后其灰分含量總體雖也在下降,但下降趨勢明顯減緩。由于甲殼中碳酸鈣是與甲殼素和蛋白質結合在一起的,在檸檬酸與碳酸鈣的反應中,部分碳酸鈣被甲殼素緊密的膠狀分子團結構所包圍,檸檬酸很難完全滲透到里面,導致其不能徹底與其反應完全。當達到30 h以后,檸檬酸和碳酸鈣的反應基本達到了平衡,再延長時間對脫除無機鹽效果的影響不大。因此,選擇酸浸時間為30 h即可。
2.1.3檸檬酸酸浸固液比試驗結果分析
檸檬酸酸浸固液比試驗結果見圖3。
當固液比由1∶7(g/mL)變至1∶9(g/mL)時,灰分含量下降趨勢較為明顯,而當固液比由1∶9(g/mL)變至1∶11(g/mL)時灰分含量有所減少,但很緩慢。故以固液比1∶9(g/mL)浸泡脫除無機鹽為宜。
2.1.4氫氧化鈉堿浸濃度試驗結果分析
氫氧化鈉堿浸濃度試驗結果見圖4。

圖3 固液比對除去無機鹽的影響Fig.3 Effect of solid-liquid ratio on demineralization

圖4 氫氧化鈉濃度對除去蛋白質的影響Fig.4 Effect of NaOH concentration on deproteinization
結果表明,氫氧化鈉的質量分數濃度越高,脫除蛋白質的效果越好,當氫氧化鈉質量分數>6%時,對脫除蛋白質的影響效果不是很大,而且隨著氫氧化鈉濃度的增加容易使甲殼素脫乙酰化生成殼聚糖,綜合考慮各種因素以質量分數為6%的氫氧化鈉溶液浸泡為宜。
2.1.5氫氧化鈉堿浸時間試驗結果分析
氫氧化鈉堿浸時間試驗結果見圖5。

圖5 堿浸時間對除去蛋白質的影響Fig.5 Effect of NaOH reaction time on deproteinization
從圖5可以看出,在反應的初始階段,隨著堿煮時間的延長,殘余蛋白質的含量急劇下降,脫除蛋白效果明顯;在5 h以后其蛋白質含量總體雖在下降,但下降的趨勢減緩。一般來說,脫蛋白時間越長,蛋白質水解的越徹底,但水解速度逐漸減慢;當延長到某一時刻以后,蛋白質的水解反應進行得非常緩慢,其對脫除蛋白效果的影響便不再明顯。同時也考慮到長時間高溫反應會帶來生產成本上的增加,因此,選擇堿煮時間為5 h較為合適。
2.1.6氫氧化鈉堿浸溫度試驗結果的分析
氫氧化鈉堿浸溫度試驗結果見圖6。
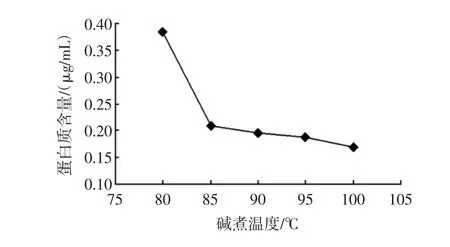
圖6 堿浸溫度對除去蛋白質反應的影Fig.6 Effect of NaOH reaction temperature on deproteinization
結果表明,隨著堿煮溫度的升高,殘余蛋白質含量急劇下降,脫蛋白效果明顯;當達到85℃以后,殘余蛋白質含量下降的趨勢減緩。溫度對氫氧化鈉水解蛋白質有很大的影響,在其它條件固定的情況下,反應溫度越高,蛋白質堿水解的速度越快;但溫度達到一定值時,蛋白質堿水解速度逐漸變慢,蛋白質的堿水解反應慢慢趨于平衡,繼續升溫對脫蛋白效果影響不大。同時也考慮到高溫反應會增加生產成本,因此,堿煮溫度取85℃比較合適。
2.1.7氫氧化鈉堿浸固液比試驗結果的分析
氫氧化鈉堿浸固液比試驗結果見圖7。

圖7 堿浸固液比對除蛋白質反應的影響Fig.7 Effect of NaOH solid-liquid ratio on deproteinization
結果表明,固液比越大,脫除蛋白質的效果也越好,固液比大于1∶12(g/mL)時,對除蛋白的影響效果不是很大,因此以1∶12(g/mL)的固液比浸泡為宜。
2.2正交試驗
2.2.1脫除無機鹽的正交試驗結果
脫除無機鹽的正交試驗結果分析見表3。
結果表明,以檸檬酸處理過的樣品中的灰分含量為指標,篩選出脫除無機鹽的最佳條件,灰分含量越低,說明無機鹽脫除的越徹底,從表3可得最佳條件為A1B1C2,即檸檬酸濃度1.6 g/L、固液比1∶9(g/mL)、在室溫條件下反應28 h即可;由正交試驗灰分含量的極差結果可以看出,C>B>A,即在室溫條件下,固液比>檸檬酸濃度>反應時間,固液比的極差最大,檸檬酸濃度次之,這兩個因素是影響脫除無機鹽的關鍵性因素,而反應時間的極差最小,說明它對脫除無機鹽的影響較小。
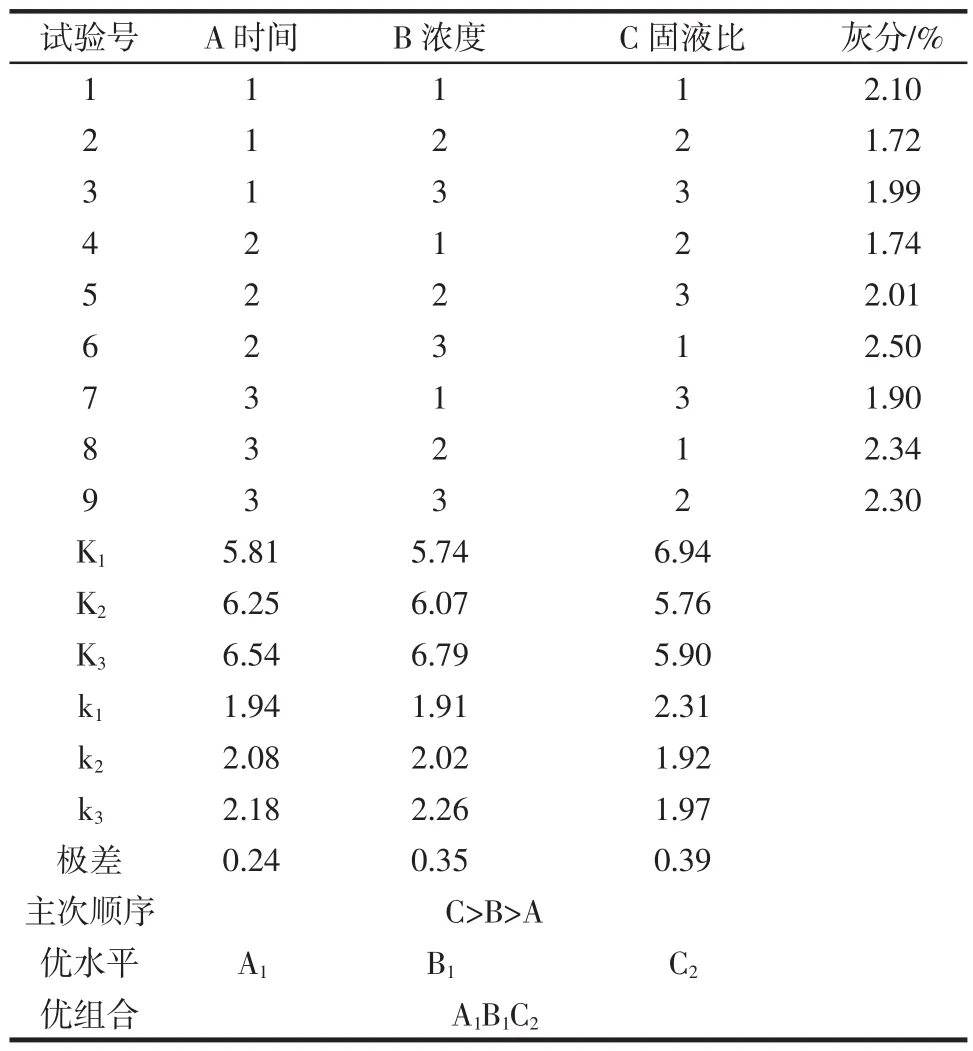
表3 脫除無機鹽的正交試驗設計及結果Table 3 Orthogonal test results of demineralization
按最佳條件進行驗證試驗,測得殘余灰分為1.54%,說明該條件脫除無機鹽最徹底。
2.2.2脫除蛋白質的正交試驗結果
脫除蛋白質的正交試驗結果見表4。

表4 脫除蛋白質的正交試驗設計及結果Table 4 Orthogonal test results of deproteinization

續表4 脫除蛋白質的正交試驗設計及結果Continue table 4 Orthogonal test results of deproteinization
結果表明,以氫氧化鈉處理過的樣品中蛋白質含量為指標,篩選出脫除蛋白質的最佳試驗條件,剩余蛋白質含量越低,說明蛋白質脫除的越徹底,從表4正交試驗結果可得最佳條件為A3B2C3D3,即氫氧化鈉濃度7%、固液比1∶13(g/mL)、在87℃下反應5 h即可;由正交試驗剩余蛋白質含量的極差結果可以得出,D>B>C>A,即氫氧化鈉溶液濃度對蛋白質脫除影響最大,反應時間次之,固液比再次之,溫度對蛋白質脫除影響最小。
按照最佳條件進行驗證試驗,測得殘余蛋白質含量為0.015 μg/mL,說明該條件脫除蛋白質最徹底。
2.3定性和定量分析
2.3.1定性分析
甲殼素的紅外吸收光譜分析:對在最佳條件下制備的甲殼素產品進行質量分析與結構表征。甲殼素產品紅外光譜如圖8所示。

圖8 兩種甲殼素樣品的紅外光譜Fig.8 IR spectrum of two samples
紅外光譜圖中3 400cm-1是O-H伸縮振動吸收峰;3 270 cm-1是N-H伸縮振動吸收峰;2 960 cm-1~2 879 cm-13個吸收峰是C-H伸縮振動吸收峰;分別在1 657、1 557、1 315 cm-1的吸收峰,分別是酰胺Ⅰ、Ⅱ、Ⅲ譜帶,這3個吸收峰是甲殼素的特征吸收峰;1 030 cm-1~1 157 cm-1之間的4個吸收峰,是C-O伸縮振動吸收峰;897 cm-1是環伸縮振動吸收峰[11]。由圖8可見,通過比對在最佳條件下制備的甲殼素樣品與標準甲殼素樣品紅外光譜圖可知,本工藝制備的尖尾東鱉甲甲殼素樣品與標準甲殼素樣品化學結構一致。
2.3.2定量分析
在最佳試驗條件下,得到的甲殼素樣品的得率為21.45%。
3 結論
1)本試驗以尖尾東鱉甲為試驗材料,先通過單因素試驗得到各因素的最佳試驗條件,然后根據單因素試驗得到的結果再進行正交試驗,從而對單因素試驗得到的各因素的最佳試驗條件進一步優化,最終得到提取甲殼素的最佳條件。
2)通過紫外吸收法測定提取物中的殘余蛋白質含量,根據國標測定提取物中殘余灰分含量。初步確定了甲殼素提取的最佳工藝條件:檸檬酸濃度1.6 g/L,浸泡固液比1∶9(g/mL),浸泡時間28 h;脫除蛋白質的條件:氫氧化鈉溶液濃度7%,浸泡溫度87℃,固液比1∶13(g/mL),浸泡時間5h。在此工藝條件下制備的甲殼素產品為白色蓬松狀固體,甲殼素得率21.45%。
3)本研究首次以尖尾東鱉甲成蟲為試驗材料制備甲殼素,結果顯示,該蟲甲殼素得率達20%以上,高于蝦蟹殼的得率,產品顏色呈白色片狀固體;對其產品進行紅外光譜分析并比對標準圖譜,證實了本試驗所提取的甲殼素樣品與標準甲殼素樣品化學結構一致,確為甲殼素。昆蟲作為甲殼素含量豐富的資源,其自身優勢十分明顯。目前由單位昆蟲獲得的甲殼素產量、質量和提取流程上,具有比蝦蟹殼單位產量高、提取流程簡單、產品質量高、蛋白含量相對較少等明顯優勢,具有廣泛利用的前景,能夠用于解決多種人類“文明病”。目前對昆蟲類甲殼素涉及其免疫調節和抑制真菌的功效僅有少量報道。對于昆蟲類甲殼素制備方面的研究開展相對比較滯后,研究也局限在個別昆蟲種類。對甲殼素制備方面和利用的研究的欠缺明顯制約了昆蟲類甲殼素的廣泛應用。昆蟲豐富的物種資源以及其巨大的天然合成能力沒有得到相應的利用,相信隨著對大量不同種類昆蟲的深入研究,必定能夠利用好這一豐富的天然資源。
參考文獻:
[1]任國棟,巴義彬.中國土壤擬步甲(第二卷鱉甲類)[M].北京:科學出版社,2010:179-181
[2]任國棟,于有志.中國荒漠半荒漠的擬步甲科昆蟲[M].保定:河北大學出版社,1999:163-164
[3]張大治,張峰舉,于有志.六種擬步甲行為初探[J].寧夏大學學報(自然科學版),2003,24(1):94-96
[4]王建剛,嚴濤海,陳光藝.蝦蟹殼制取甲殼素工藝的實驗研究[J].輕紡工業與技術,2012,41(5):1-3
[5]劉高強,劉衛星,魏美才,等.蟲類甲殼素/殼聚糖的研究及其開發前景[J].西北林學院學報,2005,20(4):143-146
[6]王敦,胡景江,劉銘湯.從臭蜣螂中提取甲殼素/殼聚糖的研究[J].林業科學,2004,40(5):180-185
[7]李維莉,林男英,李文鵬,等.從云南琵琶甲中提取甲殼素的研究[J].云南大學學報(自然科學版),1999,21(2):139-140
[8]凌霞,吳潔.甲殼素提取和應用[J].淮陰工業專科學校學報,1998,7(3/4):5-8
[9]劉高強,劉衛星,魏美才,等.從害蟲馬尾松毛蟲中提取甲殼素的初步研究[J].西北林學院學報,2007,22(2):138-141
[10]陳一,周強,王鳳彩.甲殼素的開發應用前景[J].食品工程,2002 (3):38-39
[11]彭元懷,黃川,趙澤潔.超聲波輔助提取蝦殼甲殼素的工藝研究[J].食品工業科技,2012,33(9):304-308
[12]吉惠杰,馬艷麗.蠶蛹甲殼素提取工藝研究[J].吉林化工學院學報,2012,29(5):28-33
[13]李偉.彎齒琵甲防御分泌物成分及甲殼素制備[D].保定:河北大學,2009
[14]朱洪紅,陳亮,吳大洋.家蠶蛹甲殼素精制工藝的研究及產品質量檢測[J].蠶業科學,2007,33(3):489-492
[15]中華人民共和國衛生部. GB 5009.4-2010食品安全國家標準食品中灰分的測定[S].北京:中國標準出版社,2010
[16]陳毓荃.生物化學實驗方法和技術[M].北京:科學出版社,2002:166-168
[17]包淑云,吳少云,李朝品,等.蠶蛹甲殼素的制備工藝研究[J].時珍國醫國藥,2012,23(3):697-698
[18]郭寶華.四種昆蟲甲殼素的提取及昆蟲殼聚糖和羧甲基殼聚糖的制備[D].北京:中國林業科學研究院,2005
Study on the Extracting Chitin from Anatolica mucronata Reitter
ZHANG Jian-ying1,JIA Long2,ZHANG Da-zhi1,XI Qiao-hong1
(1. College of Life Science,Ningxia University,Yinchuan 750021,Ningxia,China;2. College of Agriculture,Ningxia University,Yinchuan 750021,Ningxia,China)
Abstract:This article discussed the optimum conditions of extracting chitin from Anatolica mucronata Reitter by single-factor and orthogonal test. The chitin sample was carried on the qualitative and quantitative analysis. Test results showed that the optimum conditions by using acid-alkali method to extract chitin were as follows:the NaOH concentration 7%,the temperature 87℃,the time 5 h,the solid- liquid ratio 1∶13(g/mL),the citric acid concentration 1.6 g/L,the time 28 h,the solid- liquid ratio 1∶9(g/mL),at room temperature. Using infrared spectrum to analysis chitin sample extracted under optimum conditions and the extraction rate of chitin was 21.45%. Then residual protein and inorganic salt content in the extract were measured by UV absorption and dry ashing method.
Key words:chitin;Anatolica mucronata Reitter;oputimum conditions;extraction;insect resource
DOI:10.3969/j.issn.1005-6521.2016.09.015
基金項目:2015年度寧夏自然科學基金資助項目(NZ15052)
作者簡介:張建英(1978—),女(漢),副教授,碩士,從事動物資源開發與利用研究。
收稿日期:2015-03-23

