骨形態發生蛋白2對成牙骨質細胞中硬化蛋白表達調控機理的研究
陳悅 李書琴 黃蘭 戴紅衛重慶醫科大學附屬口腔醫院正畸科·口腔疾病與生物醫學重慶市重點實驗室·重慶市高校市級口腔生物醫學工程重點實驗室,重慶 401147
?
骨形態發生蛋白2對成牙骨質細胞中硬化蛋白表達調控機理的研究
陳悅李書琴黃蘭戴紅衛
重慶醫科大學附屬口腔醫院正畸科·口腔疾病與生物醫學重慶市重點實驗室·重慶市高校市級口腔生物醫學工程重點實驗室,重慶 401147
[摘要]目的探索成牙骨質細胞OCCM-30中骨形態發生蛋白2(BMP2)對硬化蛋白(SOST)表達的調控機制。方法用2種質量濃度的BMP2(50、100 ng·mL-1)處理成牙骨質OCCM-30細胞3、5、7 d,相同體積的PBS液為對照組,采用實時熒光定量聚合酶鏈反應(RT-PCR)、免疫印跡法檢測SOST mRNA和蛋白的表達情況。將OCCM-30細胞分為5組:空白對照組、BMP2組、BMP2+dorsomorphin組、BMP2+SB202190組、BMP2+PD98059組,根據分組分別加入100 ng·mL-1的BMP2和相應的試劑共培養,于3、5 d時檢測SOST mRNA和蛋白的表達情況。結果100 ng·mL-1BMP2對SOST表達的上調作用強于50 ng·mL-1BMP2,且有時間依賴性(P<0.05)。BMP2+dorsomorphin組、BMP2+ SB202190組、BMP2+ PD98059組的SOST mRNA水平和蛋白質水平均降低,其中BMP2+dorsomorphin組降低最明顯(P<0.05)。結論成牙骨質細胞中BMP2主要是通過Smad信號通路介導上調SOST的表達。
[關鍵詞]成牙骨質細胞;骨形態發生蛋白2;硬化蛋白;Smad信號通路;牙根修復
Correspondence: Huang Lan, E-mail: lanhuang29@126.com.
牙骨質是覆蓋在牙根表面的礦化組織,較牙槽骨有較強的抗吸收能力,這是臨床正畸治療的重要基礎,然而在正畸治療時卻常常發現有牙根的吸收。成牙骨質細胞是牙周膜中重要的功能細胞之一,能抵抗破牙骨質細胞的附著,更重要的是能夠分泌形成新生的成牙骨質樣組織,對已吸收的牙根表面進行修復。骨形態發生蛋白2(bone morphogenetic protein 2,BMP2)可誘導牙周組織中前體細胞分化為成骨細胞和成牙骨質細胞;在分化成熟的成牙骨質細胞中,BMP2也表現出顯著的調控礦化相關基因表達的作用,同時抑制細胞的體外礦化[1-2]。硬化蛋白(sclerostin,SOST)是一種骨形成負向調節的蛋白,能競爭BMP受體Ⅰ/Ⅱ與BMP的結合部位,從而減少BMP信號進而抑制成骨細胞的礦化[3]。在成牙骨質細胞中,SOST可抑制其增殖分化[4]。然而,在成骨細胞中BMP的Ⅰ型受體信號缺失可下調SOST的表達,提示BMP2信號可正向調控SOST[5]。由此可見,BMP2和SOST之間的調控機制認識尚未完善。本課題以成牙骨質細胞為研究對象,通過增強BMP2信號研究其對SOST表達的影響,并初步探索哪些BMP相關通路參與了BMP2的這種調控作用。
1 材料和方法
1.1主要材料和設備
成牙骨質細胞株OCCM-30(四川大學華西口腔醫院白丁教授惠贈)。人重組 BMP2蛋白(Sigma公司,美國),Smad信號通路抑制劑dorsomorphin、細胞外信號調節激酶(extracellular signal-regulated kinase,ERK)1/2通路抑制劑PD98059、p38絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路抑制劑SB202190(Selleck公司,美國),實時熒光定量聚合酶鏈反應(real-time fluorescence quantitative polymerase chain reaction,RTPCR)試劑盒(TaKaRa公司,日本),倒置相差顯微鏡及照相系統(尼康公司,日本),FTC2000型RT-PCR基因擴增儀、FTC2000型聚合酶鏈反應合成儀(上海楓嶺生物技術有限公司),ChemiDox XRS型凝膠成像及圖像分析系統(Bio-Rad公司,美國)。目的基因SOST以及內參甘油醛-3-磷酸脫氫酶(glyceraldehydephosphate dehydrogenase,GAPDH)的引物序列由上海生工生物工程技術服務有限公司設計合成,其序列見表1。

表1 引物序列Tab 1 Primer sequences
1.2OCCM-30的培養
細胞培養液的組分為89%DMEM、10%新生小牛血清、1%的青霉素+鏈霉素。細胞生長至80%時在無菌條件下進行傳代。用預熱的PBS清洗3次,然后滴加0.5 mL胰酶消化細胞,顯微鏡下見細胞變圓,并開始脫落時用細胞培養液中和。離心(1 000 r·min-1,5 min)后去上清液,加入新鮮培養基,吹散細胞制成懸液,按1︰3傳代,置于CO2孵箱,每2 d換液。
1.3不同濃度BMP2處理OCCM-30細胞后SOSTmRNA
和蛋白的表達
將同一批傳代的對數期OCCM-30細胞鋪六孔板,密度為每孔1×105個。鋪板完成后將6孔板置于CO2孵箱內繼續培養6 h,待細胞貼壁后,吸干培養液,每孔加入2 mL無血清培養基對細胞進行血清饑餓,于CO2孵箱內繼續培養24 h。然后將實驗分為3個組,實驗1組和實驗2組分別加入50 ng·mL-1和100 ng·mL-1的BMP2作用3、5、7 d,對照組加入相同體積的PBS液作用3、5、7 d,每 2 d換液。采用RT-PCR檢測3組各時間點的SOST mRNA表達,免疫印跡法(Western blot)檢測SOST蛋白表達。實驗重復3次。
1.4BMP2相關通路對SOST表達的影響
OCCM-30細胞按密度為2×105個·mL-1接種于6孔板中,待細胞達到70%~80%融合時按照分組加入相應試劑。實驗分為5組:空白對照組(A組)、BMP2組(B組)、BMP2+dorsomorphin組(C組)、BMP2+ SB202190組(D組)、BMP2+PD98059組(E組),后4組分別加入無血清培養基、2 μmol·mL-1dorsomorphin、10 μmol·mL-1SB202190、10 μmol·mL-1PD98059預作用6 h后,在培養液中加入終濃度為100 ng·mL-1的BMP2繼續培養,并于第3天、第5天收集細胞進行檢測。采用RT-PCR檢測實驗組和對照組各時間點的SOST mRNA的表達量,免疫印跡法檢測SOST蛋白的表達量。實驗重復3次。
1.5統計學分析
采用SPSS 17.0軟件進行方差分析,LSD檢驗進行組間多重比較,檢驗水準為雙側α=0.05。
2 結果
2.1不同濃度BMP2處理后SOST mRNA和蛋白的表
達
各組的SOST mRNA和蛋白表達水平見圖1、2。在同一時間點,與對照組相比,實驗1組和實驗2組的SOST mRNA及蛋白表達水平均升高(P<0.05),且實驗2組對SOST表達的上調作用強于實驗1組(P<0.05),表現出濃度依賴性。無論是對照組還是實驗組,隨著培養時間的增加,SOST mRNA及蛋白的表達水平均呈現逐漸升高趨勢(P<0.05),表現出時間依賴性。
2.2藥物處理3 d后各組SOST mRNA和蛋白的表達
藥物處理3 d后各組SOST mRNA和蛋白表達水平見圖3和4。RT-PCR結果顯示:與B組相比,C組SOST mRNA表達水平明顯降低(P<0.05),而D、E組SOST mRNA表達水平無明顯變化。免疫印跡法檢測結果顯示,與B組相比,C、D、E組SOST蛋白表達水平均降低,但C組降低最明顯(P<0.05)。

圖1 各組SOST mRNA 水平Fig 1 The level of SOST mRNA of each group

圖2 各組SOST蛋白表達水平Fig 2 Relative expression of SOST protein of each group
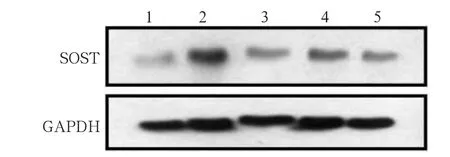
圖3 處理3 d后各組SOST mRNA的表達Fig 3 The level of SOST mRNA of each group treated for three days

圖4 處理3 d后各組SOST蛋白的表達Fig 4 Relative expression of SOST protein of each group treated for three days
2.3藥物處理5 d后各組SOST mRNA和蛋白的表達
藥物處理5 d后各組SOST mRNA和蛋白表達水平見圖5和6。與B組相比,C、D、E組的SOST mRNA和蛋白質水平均降低,其中C組降低最明顯(P<0.05);與A組相比,D、E組SOST蛋白表達水平無明顯變化,而C組降低(P<0.05)。處理5 d與3 d相比,除C組SOST mRNA和蛋白水平顯示出減弱的趨勢外,其余4組均表現出增強的趨勢(P<0.05)。

圖5 處理5 d后各組SOST mRNA的表達Fig 5 The level of SOST mRNA of each group treated for five days

圖6 處理5 d后各組SOST蛋白的表達Fig 6 Relative expression of SOST protein of each group treated for five days
3 討論
SOST是一種在成骨微環境中起重要作用的分泌型蛋白,與骨形成以及骨吸收過程中多種信號通路中的轉錄因子均有交互作用[6]。BMP/Smad信號通路在骨代謝過程中發揮著重要作用,與間充質干細胞的遷移、增殖、分化關系密切,除了正向調控骨形成之外,在某些特定條件下BMP2通過上調Wnt信號通路抑制劑DKK1、SOST等的表達水平而負性調控骨形成[7]。
Dudley等[8]在對人類成骨細胞的一項研究中發現,高表達的BMP2可以增加SOST基因啟動子近端去甲基化,使得SOST基因轉錄活性得到提高,SOST mRNA水平升高,從而抑制骨形成。本研究通過使用50 ng·mL-1以及100 ng·mL-1的BMP2作用于成牙骨質細胞,分別于3、5 d后與對照組進行比較,發現在成牙骨質細胞中外源性的BMP2對SOST的表達也是具有促進作用的,并且100 ng·mL-1組的促進作用強于50 ng·mL-1組且有時間依賴性,與成骨細胞中的研究結果相符。Kim等[9]使用2 000、200、100、50 ng·mL-1的BMP2培養人骨膜細胞發現,高濃度的BMP2(2 000 ng·mL-1)通過DKK1與SOST抑制該細胞增殖且促進該細胞凋亡,低濃度BMP2對于骨膜細胞的增殖與凋亡卻并未出現這種情況。本實驗中BMP2的濃度分別為50、100 ng·mL-1,均為較低濃度的BMP2,結果表明在本實驗涉及的濃度范圍內,BMP2確實上調了SOST表達,也為本課題組后續研究BMP2上調SOST表達的可能機制篩選出了一個可靠的BMP2使用濃度,而更多濃度梯度的BMP2對于SOST基因的表達調控仍需要更深入的研究。
Delgado-Calle等[10]對BMP2上調SOST表達的機制進行了深入研究,利用甲基化抑制劑AzadC上調BMP2后再分別阻斷了成骨細胞中的Smad信號通路、p38MAPK通路、MEK1/2信號通路及JNK信號通路,發現阻斷Smad信號通路及阻斷p38MAPK通路后SOST的表達明顯降低,而其余組無明顯變化,因此他們認為BMP2對于SOST基因表達的調控是經由BMP/ Smad信號通路和P38MAPK通路共同介導的。
本研究首先用100 ng·mL-1的BMP2增強SOST表達,然后加入Smad信號通路抑制劑dorsomorphin、p38 MAPK通路抑制劑SB202190、ERK1/2通路抑制劑PD98059,觀察這種由BMP2帶來的增強效應減弱的情況,分析其對應通路的調節作用。結果表明,處理3 d后BMP2+dorsomorphin組SOST mRNA水平明顯低于BMP2組,BMP2+dorsomorphin組、BMP2+ SB202190組、BMP2+PD98059組SOST蛋白水平低于BMP2組,BMP2+dorsomorphin組降低最明顯;處理5 d后,BMP2+dorsomorphin組、BMP2+SB202190組、BMP2+PD98059組的SOST mRNA水平和蛋白質水平均低于BMP2組,其中BMP2+dorsomorphin組降低最明顯,且BMP2+dorsomorphin組低于空白對照組,而BMP2+PD98059組和BMP2+SB202190組的SOST蛋白水平與對照組持平。這與BMP/Smad信號通路阻斷劑dorsomorphin關系密切。Yu等[11]詳細研究了dorsomorphin及其作用機制,在其抑制Smad依賴型的BMP信號的同時,抑制BMPⅠ型受體的功能,還能抑制成骨細胞的分化。由此推測,dorsomorphin可能同樣抑制了OCCM-30中一些結構相關BMP或者其他蛋白,使得BMP2+dorsomorphin共同作用的SOST水平遠低于空白對照組。
綜上所述,在成牙骨質細胞中BMP2正向調控SOST表達,且由BMP/Smad、P38MAPK 、ERK1/2信號通路共同介導,其中BMP/Smad信號通路可能在其中起主導作用。正畸過程中機械力的刺激是否促進了BMP2介導的SOST的表達,從而抑制成牙骨質細胞的修復功能,還需進一步的研究。
[參考文獻]
[1]Tian Y, Huang L, Guo YW, et al.Expression of alkaline phosphatase in immortalized murine cementoblasts in response to compression-force[J].Saudi Med J, 2011, 32(12): 1235-1240.
[2]Zhao M, Berry JE, Somerman MJ.Bone morphogenetic protein-2 inhibits differentiation and mineralization of cementoblasts in vitro[J].J Dent Res, 2003, 82(1):23-27.
[3]林婷婷, 陸爾奕.骨硬化蛋白在骨組織改建中作用的分子機制[J].國際口腔醫學雜志, 2012, 39(2):269-272.Lin TT, Lu EY.Molecular mechanism of sclerostin on bone remoldling[J].Int J Stomatol, 2012, 39(2):269-272.
[4]Bao X, Liu Y, Han G, et al.The effect on proliferation and differentiation of cementoblast by using sclerostin as inhibitor[J].Int J Mol Sci, 2013, 14(10):21140-21152.
[5]Kamiya N, Kobayashi T, Mochida Y, et al.Wnt inhibitors Dkk1 and Sost are downstream targets of BMP signaling through the typeⅠA receptor (BMPRIA) in osteoblasts[J].J Bone Miner Res, 2010, 25(2):200-210.
[6]Devarajan-Ketha H, Craig TA, Madden BJ, et al.The sclerostin-bone protein interactome[J].Biochem Biophys Res Commun, 2012, 417(2):830-835.
[7]Kamiya N.The role of BMPs in bone anabolism and their potential targets SOST and DKK1[J].Curr Mol Pharmacol, 2012, 5(2):153-163.
[8]Dudley DT, Pang L, Decker SJ, et al.A synthetic inhibitor of the mitogen-activated protein kinase cascade[J].Proc Natl Acad Sci USA, 1995, 92(17):7686-7689.
[9]Kim HK, Oxendine I, Kamiya N.High-concentration of BMP2 reduces cell proliferation and increases apoptosis via DKK1 and SOST in human primary periosteal cells[J].Bone, 2013, 54(1):141-150.
[10]Delgado-Calle J, Arozamena J, Pérez-López J, et al.Role of BMPs in the regulation of sclerostin as revealed by an epigenetic modifier of human bone cells[J].Mol Cell Endocrinol, 2013, 369(1/2):27-34.
[11]Yu PB, Hong CC, Sachidanandan C, et al.Dorsomorphin inhibits BMP signals required for embryogenesis and iron metabolism[J].Nat Chem Biol, 2008, 4(1):33-41.
(本文編輯 李彩)
Preliminary research on the expression of sclerostin mediated by bone morphogenetic protein 2 in cementoblast
Chen Yue, Li Shuqin, Huang Lan, Dai Hongwei.(Dept.of Orthodontics, The Affiliated Hospital of Stomatology, Chongqing Medical University, Chongqing Key Laboratory for Oral Diseases and Biomedical Sciences, Chongqing Municipal Key Laboratory of Oral Biomedical Engineering of Higher Education, Chongqing 401147, China)
[Key words]cementoblast;bone morphogenetic protein 2;sclerostin;Smad signal pathway;root repair
[Abstract]Objective This research explores the regulatory role of bone morphogenetic protein 2 (BMP2) in the expression of sclerostin in OCCM-30 cementoblast.MethodsOCCM-30 cementoblasts were treated with 50 and 100 ng·mL?1BMP2 for 3, 5, and 7 days.SOST mRNA was detected by real-time quantitative polymerase chain reaction (RT-PCR).Western blot analysis was employed to detect the sclerostin levels in the nucleus.Five groups were prepared for the experiments: control, BMP2, BMP2+dorsomorphin, BMP2+SB202190, and BMP2+PD98059.OCCM-30 was pretreated with BMP2 for 3 and 5 days, and then the sclerostin and SOST mRNA levels were measured.ResultsRT-PCR and Western blot analyses showed that BMP2 upregulated the expression of SOST in a concentration-dependent manner.SOST expression increased with time (P<0.05).Moreover, sclerostin levels of BMP2+dorsomorphin, BMP2+SB202190, and BMP2+PD98059 groups were lower than that of the BMP2 group, and the sclerostin level in BMP2+dorsomorphin group was lowest (P<0.05).ConclusionThe upregulation of SOST by BMP2 in OCCM-30 is mainly mediated by the BMP2/Smad signal pathway.
[中圖分類號]R 780.2
[文獻標志碼]A [doi]10.7518/hxkq.2016.03.006
[收稿日期]2015-11-16; [修回日期]2016-01-18
[作者簡介]陳悅,碩士,E-mail:824314196@qq.com
[通信作者]黃蘭,副教授,博士,E-mail:lanhuang29@126.com

