NDY1 shRNA真核表達質粒構建及其在卵巢癌A2780細胞中的穩定表達*
盧芳芳,況 燕,徐朝歡,王 旗,李美儀
(廣西醫科大學第一附屬醫院婦產科,南寧 530021)
?
NDY1 shRNA真核表達質粒構建及其在卵巢癌A2780細胞中的穩定表達*
盧芳芳,況燕△,徐朝歡,王旗,李美儀
(廣西醫科大學第一附屬醫院婦產科,南寧 530021)
[摘要]目的構建NDY1 shRNA真核表達載體,并獲得穩定表達shNDY1質粒的卵巢癌A2780細胞。方法根據GenBank數據庫提供的NDY1基因核苷酸序列,設計并合成靶向干擾NDY1基因的小發夾RNA(shRNA)序列,插入表達載體獲得重組質粒pGPU6/GFP/Neo-shNDY1。重組質粒測序鑒定正確后,脂質體介導轉染A2780細胞,經G418篩選及有限稀釋法獲得穩定轉染細胞,采用實時定量聚合酶鏈反應法(RT-qPCR)和蛋白免疫印跡法分別檢測A2780穩定轉染細胞NDY1 mRNA及蛋白表達。結果重組質粒測序正確,轉染shNDY1后,A2780細胞mRNA及蛋白表達水平分別下降(72.89±4.83)%及(55.85±4.84)%,與對照組相比差異有統計學意義(P<0.05)。結論成功構建pGPU6/GFP/Neo-shNDY1真核表達質粒,并獲得shNDY1穩定轉染的卵巢癌A2780細胞,為細胞水平研究NDY1與卵巢癌的關系奠定實驗基礎。
[關鍵詞]卵巢腫瘤;NDY1;質粒構建;A2780細胞
組蛋白去甲基化酶NDY1(not dead yet-1,NDY1)是一種重要的表觀調控因子。它屬于包含JmjC 結構域的組蛋白去甲基化酶(JmjC domain-containing histone demethylase,JHDM)家族成員,能夠特異性催化H3K36me2和H3K4me3脫甲基[1],并在細胞增殖,細胞周期,干細胞自我更新及腫瘤轉化等過程中發揮重要調節功能[1-3]。NDY1異常表達可促使細胞增殖失控,導致腫瘤表型表達。研究發現,在胰腺癌、乳腺癌、急性白血病等惡性腫瘤中NDY1高表達,并與腫瘤細胞的增殖、侵襲轉移、臨床預后密切相關[4-6]。對鼠胚胎成纖維細胞(mouse embryonic fibroblasts,MEFs)的研究表明,NDY1通過逆轉microRNA let-7b對癌基因EZH2 mRNA的轉錄后抑制,誘導MEFs永生化。目前已有研究提示NDY1具有促癌功能,而NDY1與卵巢癌的關系則未見報道。為探明二者的關系,本研究構建表達NDY1 shRNA的真核表達質粒pGPU6/GFP/Neo-shNDY1,轉染卵巢癌A2780細胞后獲得穩定轉染細胞株,從而為進一步研究NDY1和卵巢癌的關系奠定實驗基礎。
1材料與方法
1.1材料人上皮性卵巢癌細胞A2780獲贈于華中科技大學同濟醫學院附屬協和醫院婦瘤實驗室。質粒載體pGPU6/GFP/Neo購自上海吉瑪公司,質粒中量抽提試劑盒購自杭州愛思進生物技術有限公司,DNA內切酶(BpiⅠ、PstⅠ、BamHⅠ)、DNA連接酶及DNA mark均購自Fermentas公司,DNA凝膠回收試劑盒購自天根生化科技有限公司,LipofectamineTM2000、G418購自Invitrogen公司,RNA提取試劑盒購自Axygen公司,逆轉錄試劑盒購自Takara公司,SYBR Green Real Time PCR Master Mix購自Roche公司,胎牛血清購自杭州四季青公司,RPMI 1640培養基購自Hyclone公司,細胞質蛋白及核蛋白抽提試劑盒購自碧云天公司,兔抗人NDY1多克隆抗體購自Millipore公司,兔抗人LaminB1抗體購自Abcam公司,辣根過氧化物酶(horse radish peroxidase,HRP)標記的山羊抗兔IgG抗體購自CST公司,引物由Takara公司合成。
1.2方法
1.2.1NDY1 shRNA序列的設計及合成根據GenBank提供的NDY1基因序列(序列號:NM_032590.4),由上海吉瑪公司設計并合成針對NDY1 的特異性RNAi序列,NDY1-S:5′-CAC CGG GCA AAG ATT TCA ACT ATG ATT CAA GAG ATC ATA GTT GAA ATC TTT GCC CTT TTT TG-3′;NDY1-AS:5′-GAT CCA AAA AAG GGC AAA GAT TTC AAC TAT GAT CTC TTG AAT CAT AGT TGA AAT CTT TGC CC-3′;相應陰性對照(nagtive control,NC)序列如下,NC-S:5′-CAC CGT TCT CCG AAC GTG TCA CGT CAA GAG ATT ACG TGA CAC GTT CGG AGA ATT TTT TG-3′,NC-AS:5′-GAT CCA AAA AAT TCT CCG AAC GTG TCA CGT AAT CTC TTG ACG TGA CAG TTC GGA GAA C-3′。
1.2.2pGPU6/GFP/Neo-NDY1質粒的構建及鑒定在PCR儀上進行NDY1 shRNA單鏈退火反應,反應條件為:95 ℃ 5 min;85 ℃ 5 min;75 ℃ 5 min;70 ℃ 5 min。退火處理后得到NDY1 shRNA 模板用于連接反應。將pGPU6/GFP/Neo載體用BpiI、BamHI 37 ℃酶切1 h,瓊脂糖電泳估算濃度并回收。在連接反應體系中加入線性化的載體及NDY1 shRNA 模板,T4連接酶22 ℃反應1 h,用于構建pGPU6/GFP/Neo-NDY1真核表達質粒。連接產物轉化感受態Top10細菌,取 200 μL轉化后的細胞涂布于含 50 μg/mL卡那霉素的LB 平板上,37 ℃培養16 h,從每塊平板上挑取5個菌落,接種到含 50 μg/mL卡那霉素的LB液體培養基中,37 ℃搖床振搖16 h;使用堿裂解法抽提質粒,所得質粒用BamHⅠ,PstⅠ分別酶切鑒定,挑選兩個酶切結果正確的質粒送至上海英駿公司測序。
1.2.3卵巢癌A2780細胞株的穩定轉染選擇處于對數生長期的A2780細胞,以每孔1.5×105個細胞接種于24孔板中,每孔添加含10%胎牛血清的RPMI 1640培養基500 μL,并置于37 ℃ 含5% CO2的恒溫培養箱中培養。24 h后待細胞匯合度達到80%~90%,按照LipofectamineTM2000轉染試劑說明書將pGPU6/GFP/Neo-shNDY1質粒轉染A2780細胞,同時轉染pGPU6/GFP/Neo-shNC作為陰性對照,以未轉染A2780作為空白對照。轉染24 h后,細胞以1∶10比例傳代并接種于另一塊24孔板,次日加入終濃度為300 μg/mL的G418進行篩選。2周后用有限稀釋法挑取單個陽性克隆細胞接種于96孔板,待其長滿后逐漸傳入24孔板,6孔板、最后移入培養瓶中擴大培養。
1.2.4RT-qPCR檢測NDY1 mRNA的相對表達采用Axygen公司RNA提取試劑盒提取各組細胞總RNA,按照Takara逆轉錄試劑盒說明書合成相應cDNA,用于定量PCR的NDY1引物序列如下,上游引物:5′-CTC ACT GCT GTT GGC ACC AC-3′,下游引物:5′-TGC TTG CAG TAC CTC AGG TCA ATA-3′;以β-actin作為內參,上游引物序列:5′-CAG GCA CCA GGG CGT GAT-3′,下游引物序列:5′-TAG CAA CGT ACA TGG CTG GG-3′,擴增反應在ABI 7300熒光定量PCR儀上完成。PCR反應條件:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,共40個循環,反應結束后用2-△△Ct法計算各組細胞NDY1/β-actin比值,本實驗重復3次。
1.2.5Western blot 檢測NDY1蛋白表達試劑盒法提取細胞核蛋白,BCA法測定蛋白濃度。將蛋白樣品煮沸變性5 min,取20 μg核蛋白置于含10%分離膠的SDS-PAGE中電泳;隨后200 mA,2 h轉移至PVDF膜,5%BSA封閉液封閉2 h;加入兔抗人NDY1一抗(1∶500)及兔抗人LaminB1(1∶10 000)一抗4 ℃孵育過夜,TBST洗膜3次,加入HRP標記的山羊抗兔熒光二抗(1∶8 000)避光孵育1 h,TBST洗膜3次,采用Odyssey紅外熒光掃描系統識別并拍照;本實驗重復3次。
1.3統計學處理采用SPSS13.0軟件對數據進行統計學處理,多組間的均值比較采用單因素方差分析,進一步兩兩比較采用SLD法,P<0.05為差異有統計學意義。
2結果
2.1pGPU6/GFP/Neo-shNDY1真核表達質粒的鑒定如圖1所示,分別用DNA內切酶PstⅠ、BamHⅠ酶切鑒定重組質粒,經PstⅠ處理后質粒不能被切開;經BamHⅠ酶切后,在5 175 bp處出現條帶;結果表明:合成目的片段正確插入pGPU6/GFP/Neo載體預期位點。經上海英駿公司測序結果證實質粒測序結果正確,pGPU6/GFP/Neo-sh NDY1真核表達質粒構建成功(圖2)。
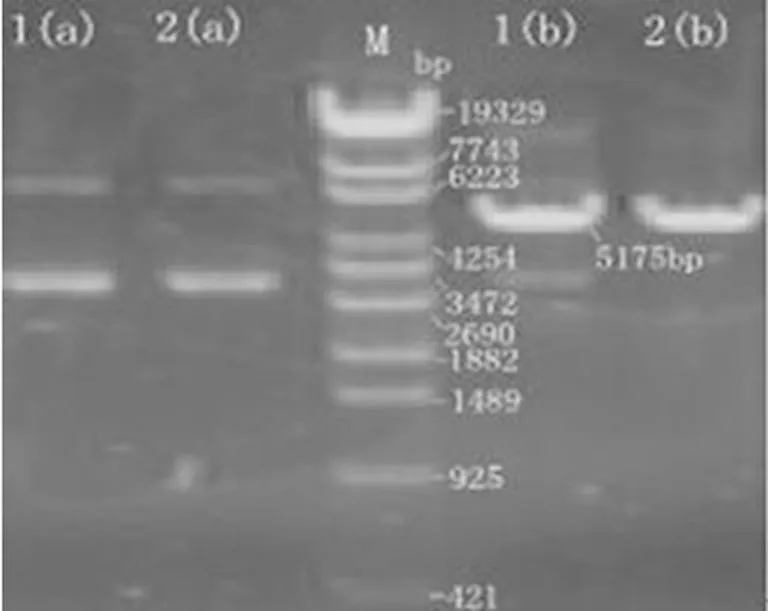
M:Lamda/Eco130I DNA Marker;1(a)、2(a):pGPU6/GFP/Neo-sh NDY1質粒1,2的PstⅠ酶切鑒定結果;1(b)、2(b):pGPU6/GFP/Neo-sh NDY1質粒1,2的BamHⅠ 酶切鑒定結果。
圖1pGPU6/GFP/Neo-shNDY1酶切鑒定結果
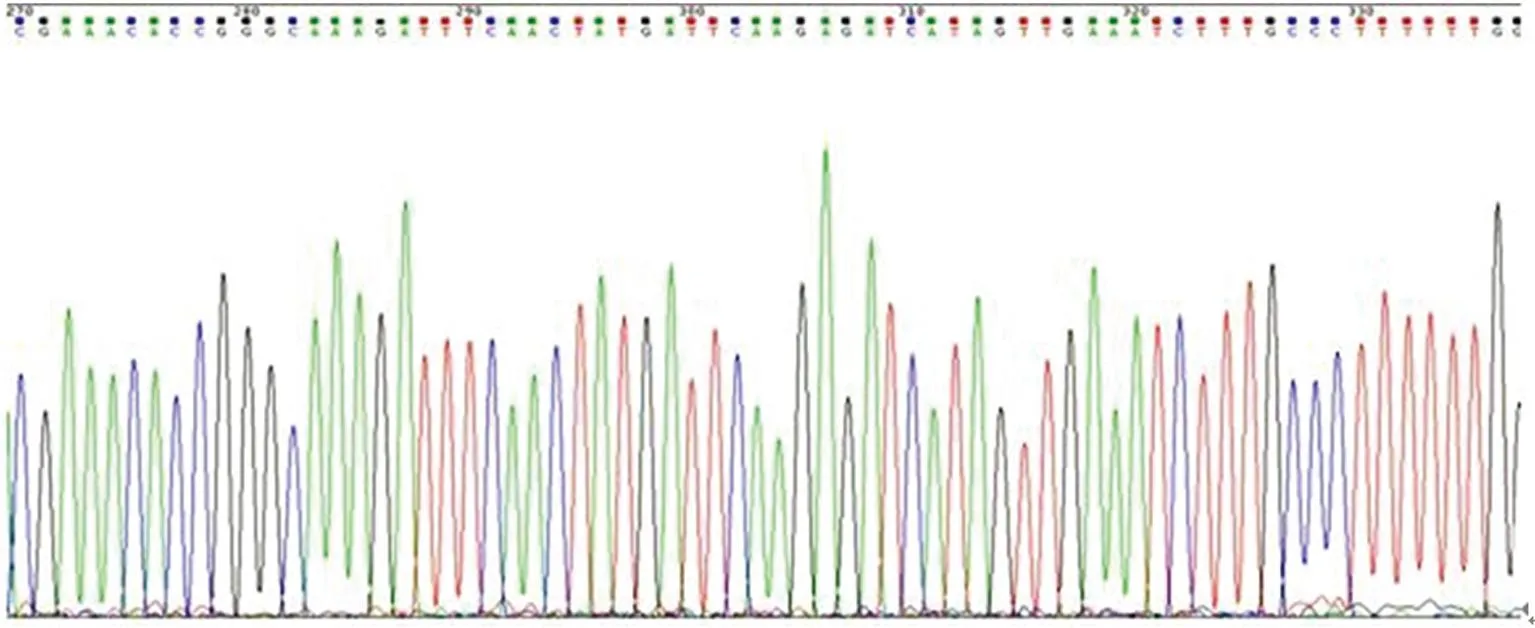
圖2 pGPU6/GFP/Neo-shNDY1質粒測序圖譜
2.2shNDY1穩定轉染的A2780細胞株篩選重組質粒轉染24 h后,熒光顯微鏡下可見表達綠色熒光蛋白的A2780細胞;經擴大培養以及G418篩選2周后,顯微鏡下可見陽性克隆細胞團形成,轉染效率達90%(圖3)。

A:shNDY1-A2780細胞熒光源成像;B:shNDY1-A2780細胞普通光源成像;C:shNC-A2780細胞熒光源成像;D:shNC-A2780細胞普通光源成像。
圖3pGPU6/GFP/Neo-shNDY1在穩定轉染的A2780細胞中的表達(×100)
2.3A2780細胞NDY1 mRNA的相對表達RT-qPCR結果顯示,以未轉染的A2780細胞NDY1 mRNA表達水平為100%,shNDY1-A2780細胞mRNA表達水平較未轉染組下降(72.89±4.83)%(P=0.001),較shNC組亦有明顯下調(P=0.001);而與未轉染組細胞相比,shNC組NDY1 mRNA相對表達量下降約(5.34±8.79)%,二者差異無統計學意義(P>0.05),表明所構建的質粒能明顯抑制A2780細胞NDY1 mRNA表達(圖4)。
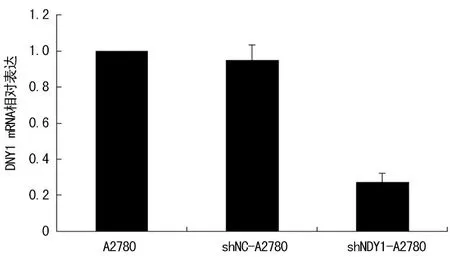
圖4 RT-qPCR檢測各組細胞NDY1 mRNA表達情況
2.4A2780細胞NDY1蛋白表達變化以未轉染A2780細胞的NDY1蛋白表達水平為100%,shNDY1-A2780細胞的NDY1蛋白表達下調(55.85±4.84)%(P=0.027),與shNC-A2780組相比亦有明顯下調,差異有統計學意義;而shNC-A2780組蛋白表達水平為(111.20±2.84)%,與未轉染組相比差異無統計學意義(P=0.581)。表明重組質粒轉染后,能有效降低NDY1蛋白表達(圖5)。

圖5 Western blot檢測各組細胞NDY1蛋白表達情況
3討論
表觀遺傳學是近年腫瘤研究領域的研究熱點,其包括DNA甲基化、染色質重塑、組蛋白修飾、非編碼RNA在內的多種調控形式。研究表明,表觀遺傳機制參與細胞增殖、細胞凋亡、干細胞更新以及腫瘤耐藥等多種生理病理過程[7-10]。Rebbani等[11]發現,肝細胞癌組織中抑癌基因位點DNA甲基化異常增加;對卵巢癌的研究證實,miR-130a、miR-374a在卵巢癌耐藥細胞中高表達,并通過調節MDR1 進而影響細胞耐藥性[12]。
NDY1是一種重要的表觀調控因子,其編碼產物包含具有去甲基化酶活性的JmjC結構域,通過催化組蛋白H3K36me2和H3K4me3去甲基化進而影響靶基因轉錄過程[1,3-4]。現已證實,NDY1在胰腺癌、乳腺癌、急性髓細胞白血病中呈現高表達,影響腫瘤的發生發展,因此被認為是一種促癌基因[4-6]。研究發現,NDY1通過下調p15Ink4b加速細胞周期進程,促進鼠胚胎成纖維(MEF)細胞增殖[13]。骨髓細胞NDY1上調能誘導Nsg2表達,干擾幼稚造血細胞的發育成熟,促進髓系及B淋巴細胞白血病的發生[14-15]。在胰腺癌中,過表達的NDY1與KrasG12D協同促進腫瘤的進程,且NDY1的表達水平與腫瘤分級、分期及遠處轉移密切相關;而沉默NDY1表達則能逆轉胰腺癌細胞的致瘤性[4],提示NDY1可能成為惡性腫瘤治療的新靶點。
盡管已有研究表明NDY1的異常表達可以影響腫瘤的發生發展,但NDY1和卵巢癌的關系卻尚未見報道。為了探索NDY1對卵巢癌發病的影響,尋找臨床治療卵巢癌的新靶點,本研究構建表達shNDY1的真核表達載體pGPU6/GFP/Neo-shNDY1,經酶切鑒定及DNA測序檢測證實目的質粒構建成功。脂質體法將目的質粒導入卵巢癌細胞A2780,經 G418加壓篩選成功獲得穩定表達shNDY1的陽性單克隆;RT-qPCR檢測轉染后NDY1 mRNA的抑制率達(72.89±4.83)%,其相應蛋白表達亦明顯下調。
綜上所述,本研究構建的真核表達載體能夠成功抑制卵巢癌細胞內源性NDY1基因表達,并在細胞水平為研究NDY1與卵巢癌的關系以及探索以NDY1為治療靶點的卵巢癌臨床治療新方法奠定實驗基礎。
參考文獻
[1]Tzatsos A,Pfau R,Kampranis SC,et al.Ndy1/KDM2B immortalizes mouse embryonic fibroblasts by repressing the Ink4a/Arf locus[J].Proc Natl Acad Sci U S A,2009,106(8):2641-2646.
[2]Blackledge NP,Farcas AM,Kondo T,et al.Variant PRC1 complex-dependent H2A ubiquitylation drives PRC2 recruitment and polycomb domain formation[J].Cell,2014,157(6):1445-1459.
[3]Ge R,Wang Z,Zeng Q,et al.F-box protein 10,an NF-κB-dependent anti-apoptotic protein,regulates TRAIL-induced apoptosis through modulating c-Fos/c-FLIP pathway[J].Cell Death Differ,2011,18(7):1184-1195.
[4]Tzatsos A,Paskaleva P,Ferrari F,et al.KDM2B promotes pancreatic cancer via Polycomb-dependent and-independent transcriptional programs[J].J Clin Invest,2013,123(2):727-739.
[5]Kottakis F,Foltopoulou P,Sanidas I,et al.NDY1/KDM2B functions as a master regulator of polycomb complexes and controls self-renewal of breast cancer stem cells[J].Cancer Res,2014,74(14):3935-3946.
[6]He J,Nguyen AT,Zhang Y.KDM2b/JHDM1b,an H3K36me2-specific demethylase,is required for initiation and maintenance of acute myeloid leukemia[J].Blood,2011,117(14):3869-3880.
[7]Zhang F,Xu L,Xu L,et al.JMJD3 promotes chondrocyte proliferation and hypertrophy during endochondral bone formation in mice[J].J Mol Cell Biol,2015,7(1):23-34.
[8]Haag T,Herkt CE,Walesch SK,et al.The apoptosis associated tyrosine kinase gene is frequently hypermethylated in human cancer and is regulated by epigenetic mechanisms[J].Genes Cancer,2014,5(9/10):365-374.
[9]Hasemann MS,Lauridsen FB,Waage J,et al.C/EBPIs required for Long-Term Self-Renewal and lineage priming of hematopoietic stem cells and for the maintenance of epigenetic configurations in multipotent progenitors[J].PLoS Genet,2014,10(1):e1004079.
[10]Zhang YW,Zheng Y,Wang JZ,et al.Integrated analysis of DNA methylation and mRNA expression profiling reveals candidate genes associated with cisplatin resistance in non-small cell lung cancer[J].Epigenetics,2014,9(6):896-909.
[11]Rebbani K,Marchio A,Ezzikouri S,et al.TP53 R72P polymorphism modulates DNA methylation in hepatocellular carcinoma[J].Mol Cancer,2015,14(14):74.
[12]Li N,Yang L,Wang H,et al.MiR-130a and MiR-374a function as novel regulators of cisplatin resistance in human ovarian cancer a2780 cells[J].PLoS One,2015,10(6):e0128886.
[13]He J,Kallin EM,Tsukada Y,et al.The H3K36 demethylase Jhdm1b/Kdm2b regulates cell proliferation and senescence through p15(Ink4b)[J].Nat Struct Mol Biol,2008,15(11):1169-1175.
[14]Ueda T,Nagamachi A,Takubo K,et al.Fbxl 10 overexpression in murine hematopoietic stem cells induces leukemia involving metabolic activation and upregulation of Nsg2[J].Blood,2015,125(22):3437-3446.
[15]Tzatsos A,Paskaleva P,Lymperi S,et al.Lysine-specific demethylase 2B (KDM2B)-let-7-enhancer of zester homolog 2 (EZH2) pathway regulates cell cycle progression and senescence in primary cells[J].J Biol Chem,2011,286(38):33061-33069.
Construction of NDY1 shRNA eukaryotic expression plasmid and its stable expression in ovarian cancer cell line A2780*
Lu Fangfang,Kuang Yan△,Xu Chaohuan,Wang Qi,Li Meiyi
(Department of Obstetrics and Gynecology,First Affiliated Hospital of Guangxi Medical University,Nanning,Guangxi 530021,China)
[Abstract]ObjectiveTo construct NDY1 shRNA eukaryotic expression plasmid and to obtain shNDY1-stably expressed ovarian cancer cell line A2780 cell.MethodsBased on the NDY1 gene nucleotide sequence provided by GenBank database,a short hairpin RNA (shRNA) targeted NDY1 gene was designed and synthesised,and the expression vector was inserted for obtaining recombination plasmid pGPU6/GFP/Neo-shNDY1.After identification by sequencing,then liposome mediated transfection to A2780 cell was conducted,stable transfected cells were obtained through G418 selection and limited dilution.NDY1 mRNA and protein expression level were detected by the real time quantitive RT-qPCR and Western blot,respectively.ResultsThe sequencing of recombinant plasmid was correct.After shNDY1transfection,mRNA and protein expression level of A2780 cells were decreased by(72.89±4.83)% and (55.85±4.84)%,the difference in the comparison with the control group was statistically significant.ConclusionEukaryotic expression plasmid pGPU6/GFP/Neo-shNDY1 is successfully constructed,and the stably transfected A2780 cell line is obtained,which lays the foundation for studying the relation of NDY1 ovarian cancer in cellular level.
[Key words]ovarian neoplasms;NDY1;plasmid construction;A2780 cell
doi:論著·基礎研究10.3969/j.issn.1671-8348.2016.08.002
* 基金項目:國家自然科學基金資助項目(81360389);廣西自然科學基金資助項目(2012GXNSFAA053086);廣西壯族自治區衛生廳自籌經費科研課題資助項目(Z2013026);2013年廣西研究生教育創新計劃資助項目(YCSZ2014101)。
作者簡介:盧芳芳(1990-),在讀碩士,主要從事婦科腫瘤方面的研究。△通訊作者,E-mail:kuangyan2004@sina.com。
[中圖分類號]R737.31
[文獻標識碼]A
[文章編號]1671-8348(2016)08-1012-04
(收稿日期:2015-10-19修回日期:2015-12-10)

