尿道上皮細胞/片狀多孔絲素蛋白支架復合物修復兔尿道缺損的實驗研究*
林陽彥王 沫楊 勇邱春明歐群雄何 佩李炳坤. 佛山市南海區第三人民醫院泌尿外科(廣東佛山 5844);. 南方醫科大學珠江醫院泌尿外科
?
尿道上皮細胞/片狀多孔絲素蛋白支架復合物修復兔尿道缺損的實驗研究*
林陽彥1王 沫1楊 勇1邱春明1歐群雄1何 佩1李炳坤2
1. 佛山市南海區第三人民醫院泌尿外科(廣東佛山258244);2. 南方醫科大學珠江醫院泌尿外科
摘要目的 探索用尿道上皮細胞/片狀多孔絲素蛋白支架復合物修補長段尿道缺損的可行性及效果。方法 取雄性新西蘭兔(2.5kg)27只,隨機分成3組: 實驗組:尿道上皮細胞/多孔絲素蛋白支架復合物組(n=9);對照組Ⅰ:假手術組(n=9);對照組Ⅱ:尿道缺損組(n=9)。三組共同飼養4周和16周后,分別對手術部位行病理學檢查,8周后分別進行膀胱尿道造影、尿動力檢測(尿道測壓)和病理檢測。結果 27只兔實驗過程中無一例死亡。對照組Ⅰ術后4、8及16周,尿道組織結構無明顯區別,尿道上皮細胞均勻覆蓋,層數約4~5層,排列規則,未見炎癥細胞。對照組Ⅱ術后4、8及16周瘢痕形成,組織質地堅韌,腔壁纖維化形成,可見大量的纖維組織及成纖維細胞,黏膜缺損;實驗組術后4周時可見較多炎癥細胞,材料表面細胞黏附,層數約6~8層,絲素蛋白復合體發生扭曲,術后8周片狀多孔絲素蛋白支架降解成碎片狀,組織均勻覆蓋;術后16周尿道上皮細胞排列均勻,層數約4~5層,無明顯炎癥細胞浸潤,可見較多血管,與對照組Ⅰ相似。術后8周,對照組I膀胱尿道造影顯示尿道黏膜連續性好,管腔光滑,管徑均勻。對照組Ⅱ造影片顯示尿道黏膜連續性的中斷,管腔毛糙,尿道管徑變細,呈現尿道狹窄的表現。實驗組膀胱尿道造影提示尿道黏膜的連續性良好,管腔稍毛糙,管徑與對照組I基本一致。尿道測壓:實驗組術后8周手術部位的尿道阻力平均值(15.25±1.72)cmH2O,對照組I尿道阻力的平均值為(14.85±1.96)cmH2O,兩組對比無統計學差異(P>0.05),對照組II尿道阻力平均值為(27.83±3.71)cmH2O,阻力明顯增高,與實驗組及對照組Ⅰ相比均有明顯的統計學差異(P<0.05)。結論 尿道上皮細胞/多孔絲素蛋白支架復合物可以作為尿道修復的支架,具有促進尿道缺損修復的能力。
關鍵詞組織工程; 尿道狹窄;絲素蛋白質類;上皮細胞
尿道狹窄是泌尿外科的常見病,但是目前尿道狹窄的治療仍然是泌尿外科醫生的巨大挑戰,尤其是>3cm的長段狹窄,目前的常用的修補方法,再狹窄率仍然很高,所以目前泌尿外科的學者們都在尋求價廉物美、效果良好、并發癥少的尿道修補材料。絲素蛋白是目前組織工程學的一種重要材料,其無毒性、無刺激作用,組織相容性好,同時來源豐富,價格低廉,具有巨大的潛力和優勢,目前已嘗試應用于多種組織修補,本文嘗試應用尿道上皮細胞/多孔絲素蛋白支架復合物修補尿道,以明確尿道上皮細胞/片狀多孔絲素蛋白支架復合物修補長段尿道缺損的可行性及效果。
材料與方法
一、材料
雄性新西蘭兔27 只(2.5±0.5)kg (南方醫科大學動物實驗中心) 絲素蛋白支架孔徑80μm。
二、尿道上皮細胞/多孔絲素蛋白支架復合物的制備
1. 用 75%酒精溶液的浸泡消毒多孔絲素蛋白支架,取出后干燥24h。
2. 將絲素蛋白支架置于環氧乙烷氣體中滅菌12h。
3. 將絲素蛋白支架修剪為1.5cm×1.0cm,用含10%胎牛血清的DMEM培養基浸泡24h后,將支架材料轉移到細胞培養板孔內。
4. 將原代分離的兔尿道上皮細胞傳代3次后加入至放置有支架材料的24孔板內,每孔加入1mL,注意要使支架材料浸沒在培養基中。
5. 將支架材料在37℃、5% CO2培養箱內培養24h,取出,用含10%胎牛血清的低糖DMEM培養基,在37℃、5% CO2培養箱內培養48h。
三、動物分組
27只兔隨機分成3 組:實驗組(9只); 對照組Ⅰ(9只); 對照組Ⅱ(9只)。
四、方法
(一)手術方法
1. 實驗組切開兔陰莖皮膚及皮下組織 游離出尿道海綿體,切開尿道海綿體,將尿道黏膜切除1.5 cm,用1.5 cm 尿道上皮細胞/多孔絲素蛋白支架復合物修復尿道缺損,以7-0 腸線縫合兩端兩吻合口分別選取3點、 9點及12點,以5-0 絲線作為標記,術后留置8F 導尿管1周后拔除。
2. 對照組Ⅰ行尿道海綿體切開后,即逐層縫合海綿體、皮下組織及皮膚,術后留置8F 導尿管,1周后拔除。
3. 對照組Ⅱ操作同實驗組,切除尿道中段1.5cm尿道黏膜,逐層縫合切口,依靠尿道自體組織再生修復缺損,術后留置8F 導尿管,1周后拔除。
(二)檢測方法
1. 對3組實驗兔分別在戊巴比妥鈉靜脈麻醉下進行尿動力學檢測(尿道測壓)。
2. 對3組組織增生情況觀察及逆行尿道造影 在術后8 周行逆行尿道造影,然后取材行HE 染色、Van Gieson VG染色及免疫組織化學染色觀察組織再生情況。
結 果
27只兔實驗過程中無一例死亡。術后8周,對照組Ⅱ造影片顯示尿道黏膜連續性中斷,管腔毛糙,尿道管徑變細,呈現尿道狹窄的表現。對照組Ⅰ膀胱尿道造影顯示尿道黏膜連續性好,管腔光滑,管徑均勻。實驗組膀胱尿道造影提示尿道黏膜的連續性良好,管腔稍毛糙,管徑與對照組Ⅰ基本一致(圖1)。
對照組Ⅰ術后4、8及16周尿道組織結構無明顯區別,尿道上皮細胞均勻覆蓋,層數約4~5層,排列規則,未見炎癥細胞,黏膜下可見較多的平滑肌細胞,間有少量膠原纖維;VG染色可見膠原纖維呈鮮紅色,數量較少,平滑肌細胞呈黃色,膠原纖維分散分布于平滑肌之間(圖2)。對照組Ⅱ術后4及8周時均見腔壁纖維化形成,可見大量的纖維組織及成纖維細胞,其間可見炎癥細胞,大部分區域上皮細胞缺失,少數區域可見少量上皮細胞,排列混亂;16周仍以纖維組織為主,瘢痕化形成,可見陳舊性纖維組織,上皮細胞增多,層數約4~5層,排列混亂,偶可見少量平滑肌細胞,VG染色示修復區大量膠原纖維(圖3)。

圖11 AA、BB、CC 分別是對照組Ⅰ、對照組Ⅱ及實驗組術后8周逆行尿道造影對照組I尿道黏膜連續性好,官腔光滑,對照組II尿道黏膜連續性中斷,官腔毛糙,實驗組尿道黏膜連續性好,管腔稍毛糙

圖22 AA、BB分別是對照組Ⅰ術后1166周尿道組織切片HHEE染色和VVGG染色(×400)尿道組織結構無明顯區別,尿道上皮細胞均勻覆蓋,層數約4~5層,排列規則,未見炎癥細胞

圖33 A、BB、CC、DD 分別是對照組Ⅱ術后8周、1166周尿道組織切片HHEE染色和術后8周、1166周VVGG尿道組織切片染色(×200)4及8周時均見壁纖維化形成,可見大量的纖維組織及成纖維細胞,其間可見炎癥細胞,大部分區域上皮細胞缺失,16周仍以纖組織為主,瘢痕化形成,可見陳舊性纖維組織
實驗組術后4周時可見較多炎癥細胞,材料表面細胞黏附,層數約6~8層,排列不均勻,絲素蛋白支架網狀結構進一步發生扭曲,可見部分網狀結構裂解;8周時鏡下難于辨認絲素蛋白膜支架,表面細胞層數約5~7層,排列較4周時均勻,漸趨向規則,炎癥細胞較前明顯減少,可見較多的成纖維細胞及膠原纖維,排列不規則,同時可見少量的平滑肌細胞及小口徑血管;16周尿道上皮細胞排列均勻,完全覆蓋,層數約4~5層,平滑肌細胞明顯增多,成纖維細胞及膠原纖維數量減少、排列規則,無明顯炎癥細胞浸潤,可見較多管徑粗大的血管,與對照組Ⅰ相似(圖44,圖5)。
尿道測壓:實驗組術后8周手術部位的尿道阻力平均值(15.25±1.72)cmH2O,對照組I尿道阻力的平均值為(14.85±1.96)cmH2O,兩組對比無統計學差異(P>0.05);對照組Ⅱ尿道阻力平均值為(27.83±3.71)cmH2O,阻力明顯增高,與實驗組及對照組Ⅰ相比均有明顯的統計學差異(P<0.05)。
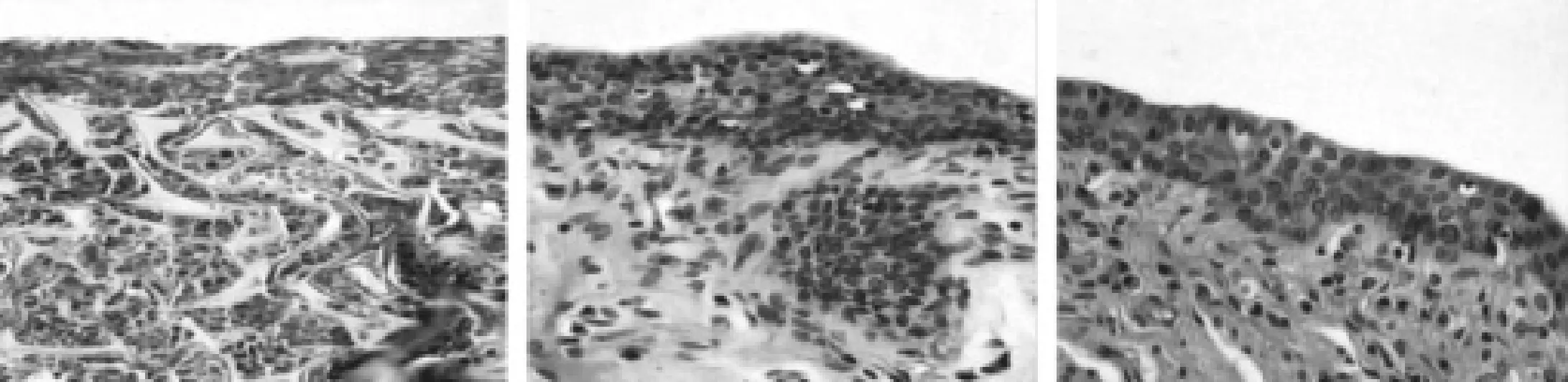
圖44 AA、BB、CC 分別是實驗組術后4、88、1166周尿道組織切片HHEE染色(×400)絲素蛋白支架逐漸吸收,表面細胞逐漸增多,細胞層數逐漸增至4~5層,排列整齊,滑肌細胞明顯增多,成纖維細胞及膠原纖維數量逐漸減少
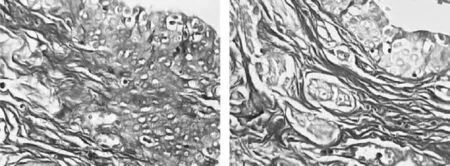
圖55 AA、BB實驗組術后8周及1166周實驗組尿道組織切片VVGG染色(×400)絲素蛋白支架消失,表面細胞逐漸增多,細胞層數逐漸增至4~5層,排列整齊,滑肌細胞明顯增多,成纖維細胞及膠原纖維數量逐漸減少,可見較多管徑粗大的血管
討 論
尿道狹窄(urethral strictures,US)是臨床泌尿外科較為常見的一類疾病, 對于泌尿外科醫生來說,尿道狹窄仍然是一個重大的挑戰,尤其是對超過3cm的長段尿道狹窄,目前臨床常用的治療方法效果均不甚理想[1]。對于長段的尿道狹窄,目前主要的治療方法是替代材料尿道成形術,所面臨的主要問題就是尋找替代材料。過去10多年,臨床上的替代材料從自體皮膚黏膜、膀胱黏膜、口腔黏膜到移植物[2]。對于自身材料,這些方法均以犧牲自體正常組織為代價,造成額外的創傷,一旦效果不好,造成雙重損失。另外,有學者嘗試應用程序化凍存同種異體膀胱黏膜作為修補材料,但僅限于實驗階段[3,4]。而組織工程材料為長段尿道缺損帶來的新的希望,但是大多數組織工程材料價格相對昂貴,限制了其廣泛應用。
絲素蛋白以組織相容性好,理化特性穩定,在體內可降解等優勢作為組織工程學良好的支架材料得到大家的肯定。另外,絲素蛋白是由蠶繭繅絲脫膠而得的纖維狀蛋白質,所以來源豐富[5,6]。隨著制備技術的進步,制備絲素蛋白的成本也越來越低,所以絲素蛋白有可能成為被廣泛應用的尿道修補材料。
我們的前期實驗,嘗試用單純多孔絲素蛋白支架修復1.5cm的新西蘭大白兔尿道缺損,術后8周,尿道上皮細胞和平滑肌細胞逐漸修復尿道缺損區,術后16周,尿道上皮細胞和平滑肌細胞排列有序,與正常對照組無明顯差異[7]。但是,有報道認為,由于絲素蛋白的吸收速度問題,在尿道完全修復前,絲素蛋白已經吸收,會導致修復段尿道的攣縮;而應用細胞支架復合物修復尿道,盡管相對復雜,并且周期較長;但由于存在尿道上皮種子細胞的再生作用,修復較快,能夠有效縮短尿道修復時間,降低修復段尿道的攣縮發生率。所以理論上說,細胞/支架復合物要比單純支架修復缺損的尿道效果更好。至于多孔絲素蛋白的孔徑多大為最優,目前也在探索階段。
本實驗嘗試應用80μm的尿道上皮細胞/片狀多孔絲素蛋白支架復合物修復1.5cm的新西蘭大白兔尿道缺損,實驗結果表明,術后無論是影像學的尿道通暢程度,還是尿動力學的尿道壓力,均與正常對照無明顯差異。初步說明應用尿道上皮細胞/片狀多孔絲素蛋白支架復合物作為長段尿道缺損的修補替代材料,是有效的。但是本實驗也存在一定局限性,包括隨訪時間較短而且僅僅應用于新西蘭大白兔,所以,應用于需要進一步的實驗進行驗證。今后我們進一步實驗將尿道上皮細胞/片狀多孔絲素蛋白支架復合物應用于較大的動物,比如比格犬等動物。另外,嘗試應用于不同長度的尿道狹窄的修補,證實其適合修復的尿道長度。最后,需要延長實驗時間,明確其長期療效。
參 考 文 獻
1 Peterson AC, Webster GD. Management of urethral stricture disease: developing options for surgical intervention. BJU Int 2004; 94(7): 971-976
2 Singh O, Gupta SS, Arvind NK. Anterior urethral strictures: a brief review of the current surgical treatment. Urol Int 2011; 86(1): 1-10
3 Lu Y, Li B, Wang X, et al. The effect of programmed cryopreservation on immunogenicity of bladder mucosa in New Zealand rabbits. Cryobiology 2012; 64(1): 27-32
4 Li B, Lu Y, Liu C, et al. Urethral reconstruction using allogenic frozen-thawed bladder mucosa: an experimental study. Urol Int. 2013; 90(4): 422-429
5 Altman GH, Diaz F, Jakuba C, et al. Silk-based biomaterials. Biomaterials. 2003; 24(3): 401-416
6 Dal Pra I, Freddi G, Minic J, et al. De novo engineering of reticular connective tissue in vivo by silk fibroin nonwoven materials. Biomaterials. 2005; 26(14): 1987-1999
7 劉春曉, 林陽彥, 李虎林, 等. 絲素蛋白膜修復兔尿道缺損的實驗研究. 南方醫科大學學報 2007; 27(2): 184-187
(2016-01-08收稿)
doi:10.3969/j.issn.1008-0848.2016.03.003
中圖分類號R 695.4
*基金項目資助:2013年廣東省自然科學基金項目(S2013040016823);2014年度佛山市衛生局醫學科研立項(2014293)
Application of urethral epithelial cells/Silk Fibroin composite in rabbit urethral defect repairing*
Lin Yangyan1, Wang Mo1, Yang Yong1, Qiu Chunming1, Ou Qunxiong1, He Pei1, Li Bingkun2
1. Department of Urology, the Third People's Hospital of Nanhai District, Foshan 258244, Guangdong, China 2. Department of Urology, Zhujiang Hospital, Southern Medical University
AbstractObjectiveTo explore the feasibility and effect of urethral epithelial cells/porous silk fi broin composite in long-segment urethral defect repairing. Metthhooddss Total of 27 male New Zealand rabbits (2.5Kg) were randomly divided into 3 groups such as the experimental group (urethral epithelial cells/porous silk fi broin composite group, n=9); the control group I (sham-operated group, n=9); the control group Ⅱ (Urethral defect group, n=9). Pathology was performed in three groups after 4 and 16 weeks feeding. Cystourethrography, urodynamics (urethral pressure) and pathology were detected after 8 weeks feeding. RessuullttssNo rabbit died during the experiment. In 4, 8 and 16 weeks after operation, the urethral organization of control groupⅠhad no obvious difference, about 4~5 layers urethral epitheliums covered uniformly andregularly. There was no infl ammatory cell. In the control groupⅡ, scar tissue was formed, a large amount of fi brous tissue and mucosa defect was showed in the urethra. In 4 weeks after the operation, there were lots of infl ammatory cells, about 6~8 layers of cells were adhered on the material, and urethral epithelial cells/porous silk fi broin composite were distorted. In 8 weeks after the operation, urethral epithelial cells/porous silk fi broin composite degraded into chips and uniform tissue was cover on the urethral epithelial cells/porous silk fi broin composite; In 16 weeks after the operation, urethral epithelial cells arranged in uniform layers, about 4~5 layers, no obvious infl ammatory cells infi ltered, there were lots of blood vessels,similar to the control group I. The cystourethrography of the control group Ⅱ showed the interruption of urethral mucosa,narrowing of the urethral lumen. The cystourethrography of the control group I revealed good continuity of urethral lumen. The cystourethrography of experimental group was similar to the control group I. Urethral pressure-the urethral resistance 8 weeks after the operation: the average urethral pressure of experimental group was (15.25±1.72) cm H2O, and the control group I was (14.85±1.96) cm H2O, no signifi cant difference was found between two groups (P>0.05). The average urethral pressure of control group II was (27.83±3.71)cm H2O, a signifi cant difference was found compared with the experimental group and the control group I (P<0.05). ConclussiioonnUrethral epithelial cells / porous silk fi broin composite can be used as scaffold for urethral repair, and have the ability to promote the urethral defect repair.
Key wordstissue engineering;urethral stricture;fi broins;epithelial cells

