MPO-AAV患者臨床特點及其肺部受累預后危險因素分析
孔秀芳 紀宗斐 閆 焱 陳慧勇 馬莉莉 張卓君 姜林娣
(復旦大學附屬中山醫院風濕免疫科 上海 20032)
?
MPO-AAV患者臨床特點及其肺部受累預后危險因素分析
孔秀芳紀宗斐閆焱陳慧勇馬莉莉張卓君姜林娣△
(復旦大學附屬中山醫院風濕免疫科上海20032)
【摘要】目的分析髓過氧化物酶陽性的抗中性粒細胞胞漿抗體相關性血管炎 (myeloperoxidase anti-neutrophil cytoplasmic antibody-associated vasculitis,MPO-AAV)患者臨床特點并探討肺部受累患者呼吸衰竭、肺部感染和死亡的危險因素。方法收集復旦大學附屬中山醫院2005年2月至2013年12月初診入院的MPO-AAV患者基線時臨床資料,截至2014年8月或死亡,應用Logistic多因素回歸分析肺部受累患者不同預后的獨立危險因素。結果共納入98例確診的MPO-AAV患者,早期系統型13例,全身型50例,重型28例,難治型7例。呼吸系統以咳嗽咳痰、胸悶氣促為主要表現;胸部X線和高分辨CT(high resolution computed tomography,HRCT)示以滲出 (36例)、肺間質改變 (35例)常見;肺活檢示8例肺組織病理學見肺泡間隔破壞、慢性炎性細胞浸潤。糖皮質激素治療92例,免疫抑制劑治療79例,兩種球蛋白治療19例,免疫吸附5例。治療后改善者71例,復發者17例。發生急性呼吸衰竭者16例,死亡9例,肺部感染者35例;分別以急性呼吸衰竭、死亡和肺部感染為終點,Logistic回歸分析肺部受累患者臨床資料發現:肺部感染、肺間質病變、Scr>500 μmol/L以及ALB<30 g/L是急性呼吸衰竭的危險因素;發病年齡≥65歲、急性呼吸衰竭是患者死亡的危險因素;急性呼吸衰竭是患者肺部感染的危險因素。結論MPO-AAV患者多有肺部受累,同時伴有全身及血液、腎臟等其他系統受累的異常表現。肺部感染是MPO-AAV肺部受累患者發生急性呼吸衰竭的主要誘發因素,且二者相互促進增加患者死亡風險;發病年齡>65歲是呼吸衰竭患者死亡的危險因素。
【關鍵詞】髓過氧化物酶陽性的抗中性粒細胞胞漿抗體相關性血管炎;呼吸衰竭;肺部感染;死亡;危險因素
髓過氧化物酶陽性的抗中性粒細胞胞漿抗體相關性血管炎 (myeloperoxidase anti-neutrophil cytoplasmic antibody-associated vasculitis,MPO-AAV)是抗中性粒細胞胞漿抗體(anti-neutrophil cytoplasmic antibody,ANCA)相關性血管炎 (ANCA-associated vasculitis,AAV)的一種類型,其代表性疾病是顯微鏡下多血管炎 (microscopic polyangiitis,MPA),以患者血清中出現抗髓過氧化物酶 (myeloperoxidase,MPO)抗體為主要標志,是一種主要累及小血管的系統性壞死性血管炎,可侵犯腎臟、皮膚和肺等臟器的小動脈、微動脈、毛細血管和小靜脈。常表現為壞死性腎小球腎炎和肺毛細血管炎,在歐洲南部以及亞洲國家多見[1]。
目前關于AAV的臨床研究均是包括MPO-AAV和蛋白酶3(proteinase 3,PR3)陽性的抗中性粒細胞胞質抗體相關性血管炎(PR3-AAV)的總體研究,尚無單獨針對MPO-AAV的系統報道,且相比于PR3-AAV, MPO-AAV相關研究較少。MPO-AAV的診斷主要依賴具有致病性的抗MPO抗體,其受累器官最常見的是腎臟和肺。腎臟可表現為急進型腎小球腎炎,組織學上為寡免疫復合物沉積的壞死性新月形腎小球腎炎[2]。既往對MPA的研究多集中在腎臟器官,但臨床實踐發現,MPA患者肺部受累也較常見,且其發生呼吸衰竭和死亡的風險明顯增加,導致患者預后不佳。曾有報道指出,MPA患者肺部受累時以肺間質改變為主,可表現為彌漫性肺泡出血和肺纖維化,胸部高分辨CT(high resolution computed tomography,HRCT)表現為尋常型間質性肺炎或非特異性間質性肺纖維化,同時可伴有肺氣腫、蜂窩肺以及磨玻璃影[3-4]。根據歐洲血管炎研究組建議,AAV的治療分為誘導緩解期和維持治療期,長期維持緩解是治療AAV患者的關鍵[5]。
在日本,73.7%的MPA患者有肺部受累,其中11.3% 的患者表現為肺泡出血[6],預后較差。目前在國內肺部受累僅局限于少數案例分析的報道,尚無系統性臨床特點的研究,也無相關肺部受累時預后危險因素分析。劉育佳等[7]曾對AAV患者臨床特點及相關肺部表現進行分析,結果表明AAV的發病率逐漸升高,其臨床表現多變,病變部位廣泛,腎臟和肺臟是 AAV 最易受累的器官,對于長期發熱及多器官受損的患者應盡早進行 ANCA 檢查及診斷,及時治療,改善預后。 王勇等[8]通過對AAV相關肺部影像學表現分析表明,肺部影像學表現與腎臟病理相關,且肺出血合并I型急進型腎小球腎炎者進展迅速,病情兇險,重視影像學分析有助于AAV的診斷。張娟等[9]對AAV相關的肺部感染進行危險因素分析,發現老年、MPA、低蛋白血癥和合并肺間質病變的AAV患者發生肺部感染的風險高,臨床中應給予重視。
X線和HRCT是診斷AAV肺部受累的重要手段,但由于AAV患者肺部受累時無特異性表現,常被誤診為感染性肺炎、狼瘡性肺炎以及肺結核等,導致患者治療延誤[10-11]。因此,關注患者的臨床特點、治療效果及肺部受累相關預后是AAV臨床診斷和治療中重要的環節。本研究在系統收集患者臨床資料的基礎上,分析總結了患者的臨床特點、治療方案、效果及其肺部受累時不同結局的危險因素,以期為患者的臨床診斷和治療提供理論依據。
資 料 和 方 法
臨床資料
病例選擇本研究納入復旦大學附屬中山醫院2005年2月至2013年12月期間初診入院的MPO-AAV患者98例,初診入住腎內科55例、呼吸內科9例、風濕免疫科32例及其他科2例;其中男性47例,女性51例,平均發病年齡為(60.67±13.66)歲,平均病程為(0.76±1.8)年(0.08~10年)。所有納入患者均滿足2012年CHCC (Chapel Hill)分類標準以及美國風濕病學會的分類標準[12],或由風濕免疫專科醫師診斷,除外結締組織病、感染、腫瘤、藥物等繼發的血管炎患者。
截至患者死亡或2014年8月31日,回顧性收集98例患者的臨床癥狀、體征、實驗室檢查、病理學及影像學檢查資料,其中1人自動出院、1人失訪未納入本研究。所有入組患者均在入院后完成胸部HRCT。
臨床分型參照歐洲血管炎研究組分型標準[13]對AAV患者的進行臨床分型,包括局限型、早期系統型、全身型及重型。
定義
肺部受累在AAV診斷明確的基礎上,排除感染病原體引起的肺炎,X線或肺部CT提示肺部病變(如間質性肺炎、肺泡出血、肺氣腫以及肺結節等),伴或不伴肺部臨床癥狀如咳嗽、咳痰、咯血等。
肺部感染診斷依據: (1)發熱、咳嗽、咳黃痰、咳黏稠拉絲痰、呼吸困難,伴或不伴胸痛; (2)痰病原微生物學檢查有明確病原菌>2; (3)HRCT提示肺部炎癥。肺部HRCT為必備條件。采用西門子雙源64層螺旋CT行肺部HRCT檢查,囑患者仰臥位,常規掃描層厚為10 mm、螺距為8 mm,HRCT選層厚1~2 mm,120~140 kV,100~230 mAs,Matrix 1 024×1 024,囑患者深吸氣后屏氣掃描。觀察肺窗寬1 000~1 400 HU,中心(-700)~(-800) HU,縱隔窗寬為300~400 HU,中心34~50 HU。肺部掃描共分為3個部分:肺尖、主動脈弓下至肺門以及膈上部分。
呼吸衰竭由血管炎肺部受累引起的呼吸功能障礙,引起動脈血氧分壓 (PaO2)降低,伴或不伴有動脈血二氧化碳分壓 (PaCO2)增高而出現一系列病理生理紊亂的臨床綜合征。
死亡因疾病本身或疾病并發癥引起的死亡。
實驗室檢查就診患者入院后常規進行血、尿、血沉 (erythrocyte sedimentation rate,ESR)、C-反應蛋白 (C-reactive protein,CRP)、肝腎功能及ANCA等相關免疫學指標的檢查。ANCA檢測采用歐蒙MPO以及PR3的抗體IgG檢測試劑盒分別檢測血清中的MPO及PR3抗體。
組織病理學檢查8例患者行支氣管鏡下肺組織活檢并進行組織病理學檢查;55例患者行腎臟穿刺并進行光鏡和電鏡的病理學檢查;2例患者行皮膚病理學檢查。
結果
臨床表現患者臨床資料見表1。其中肺部受累75例 (76.53%),腎臟受累80例 (81.63%),肺腎同時受累58例 (59.18%);全身癥狀中發熱者59例 (60.20%);呼吸系統表現中,患者初次就診時有咳嗽咳痰癥狀者69例 (70.41%),有胸悶氣促者38例 (38.78%),伴咯血者18例 (18.37%),有胸痛者8例 (8.16%)。對所納入患者按照歐洲血管炎研究組分型標準[13]進行分型,其中早期輕型13例、全身型50例、重型28例、難治型7例。
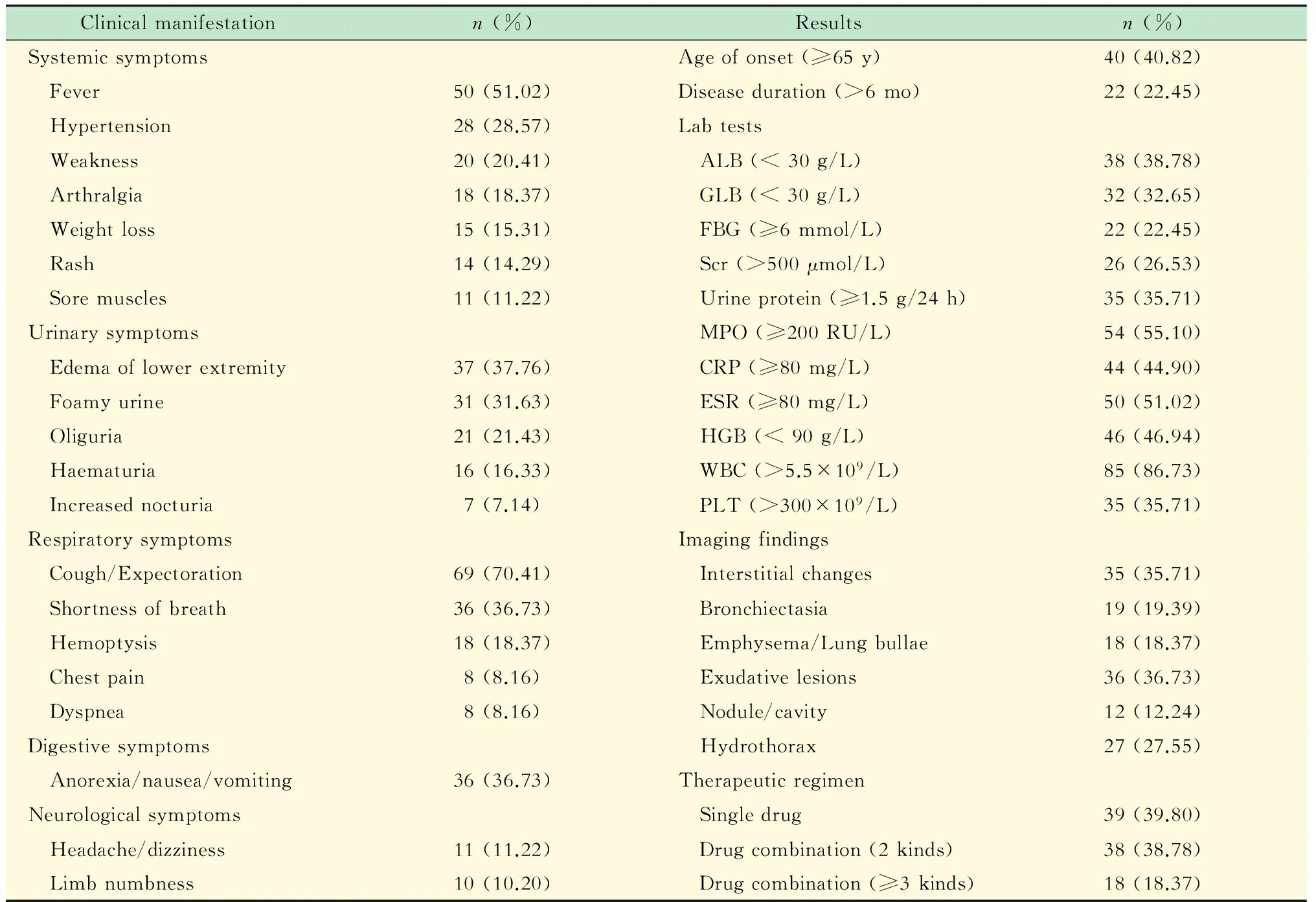
表1 患者主要臨床特點
ALB:Albumin;GLB:Globulin;Scr:Serum creatinine;FBG:Fasting blood glucose;HGB:Haemoglobin;WBC:White blood cell;PLT:Platelet.
實驗室檢查血尿常規、ESR、CRP、肝腎功能以及相關免疫學主要指標結果見表1,可發現部分患者血紅蛋白下降、白細胞和血小板升高、白蛋白下降、肌酐升高,MPO抗體滴度均大于20 RU/mL。
胸部HRCT炎癥滲出者36例;肺間質炎癥或間質纖維化改變者35例,多為彌漫性;胸腔積液27例,多為兩側少量胸腔積液;支氣管擴張19例;肺氣腫/肺大皰18例;結節/空洞12例。此外,病程較長者可伴有胸膜增厚、鈣化。
病理腎活檢55例,其中新月體腎炎49例;肺組織活檢8例,6例可見纖維組織增生伴慢性炎性細胞浸潤,以漿細胞、淋巴細胞為主,2例可見肺泡塌陷,肺泡纖維素滲出,1例肺泡腔出血;皮膚活檢2例,1例見真皮層膠原纖維增生、淋巴細胞及漿細胞浸潤,1例見皮下小血管內皮細胞增生。
治療糖皮質激素 (glucocorticoids,GCs)治療92例 (93.88%),其中初始沖擊治療者39例 (39.80%,相當于潑尼松劑量500 mg及以上);免疫抑制劑治療79例 (80.61%),包括環磷酰胺 (cyclophosphamide,CTX)、霉酚酸酯 (mycophenolate mofetil,MMF)、環孢素A (cyclosporin A)、硫唑嘌呤 (azathioprim,AZA)以及甲氨蝶呤 (methotrexate,MTX);同步應用丙種球蛋白治療19例 (19.39%);免疫吸附5例 (5.1%)。在維持治療過程中,用藥方案可分為單藥、2種藥物聯合、3種及以上聯合用藥,單藥治療者39例 (39.80%),GCs治療37例 (37.76%),AZA治療2例 (2.04%));二聯方案治療38例(38.78%),均以GCs為基礎聯合免疫抑制劑的應用,后者包括MMF (20例)、CTX (15例)、AZA (5例)和MTX (2例);三聯及以上治療者18例 (18.37%)。隨訪時間平均為(2.67±1.97)年。
轉歸與死亡治療有效者且敏感者54例(55.1%),難治或復發者44例(44.9%)。治療有效者均應用GCs治療,其中沖擊治療者20例,單用者6例,聯合免疫抑制劑治療者48例,其中聯合1種免疫抑制劑者35例(CTX 20例、MMF 11例、AZA 3例、MTX 1例),聯合2種免疫抑制劑者10例[CTX加用另外1種免疫抑制劑(AZA 7例、MMF 2例、MTX 1例)],聯合3種及以上免疫抑制劑者3例。在復發或難治性患者中,GCs治療者38例,免疫抑制劑應用者30例。 在治療有效組與無效組中GCs的初始用量差異有統計學意義[(434.41±217.30) mgvs. (325.46±249.45) mg,P=0.03],維持計量無明顯差異[(7.8±3.6) mgvs.(8.8±4.0) mg,P=0.34],兩組之間激素沖擊治療用量差異無統計學意義[(616.25±12.23) mgvs. (617.11±11.94) mg,P=0.46];聯合的免疫抑制劑用藥方案:CTX (32例) 累計用藥劑量平均為(3.68±2.97) g;15例MMF治療者中11例由初始計量0.5 g(每日2次)減至0.25 g (每日1次),其余2例7.5 g (每日2次),2例2.5 g (每日3次);12例AZA治療者均為50 mg (每日1次);5例MTX治療者2例每周10 mg、2例每周15 mg、1例每周7.5 mg。治療有效組與無效組之間免疫抑制劑用藥方案及用藥劑量無明顯差異。
在肺部受累患者中,發生急性呼衰者16例 (16.33%)、肺部感染者35例 (35.71%)、死亡者9例 (9.18%)。死亡患者中,5例肺部感染后呼吸衰竭,1例呼吸循環衰竭,1例腎臟衰竭,1例消化道出血,1例心肺腎多器官功能衰竭,呼吸衰竭者均為Ⅰ型呼吸衰竭。死亡患者平均發病年齡為71.56歲,明顯高于非死亡患者發病年齡 (59.57歲,P<0.05)。
不同結局影響因素分析以急性呼衰、死亡和肺部感染為終點,將75例肺部受累MPO-AAV病例的臨床特點納入Logistic回歸進行多因素分析,包括性別、年齡、病程、實驗室檢查、肺部感染、呼吸衰竭以及肺間質病變。急性呼吸衰竭、肺部感染和死亡3種不同結局的危險因素見表2。
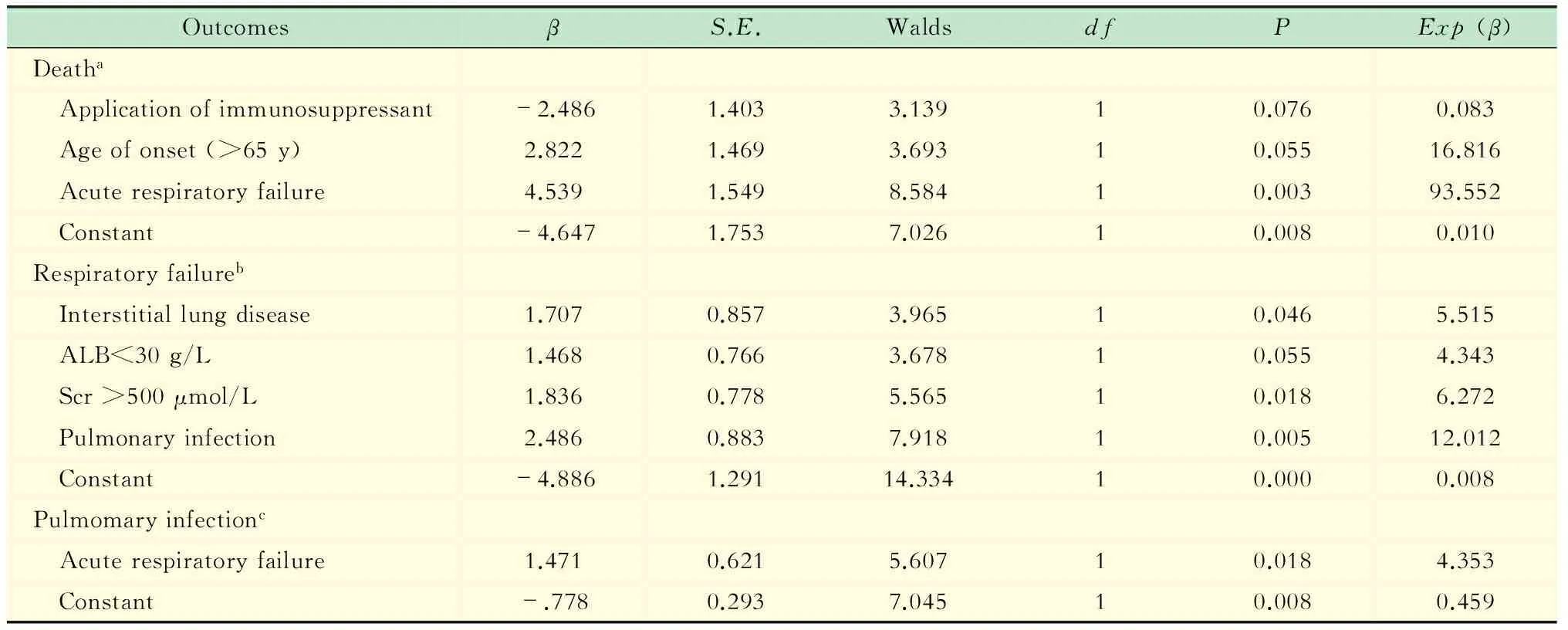
表2 MPO-AAV中肺部受累患者不同結局的Logistic多因素分析
aY1 = -4.674-2.486× (application of immumosuppressant) +2.822×(age of onset >65 years)+4.539× (acute respiratory failure);bY2 = -4.886+1.707×(interstitial lung disease) +1.468× (ALB<30 g/L) +1.836× (Scr>500 μmol/L) +2.486× (pulmonary infection);cY3 = -0.778+1.471×(acute respiratory failure).
討論
AAV是一種發病率較低的纖維素樣壞死性小血管炎,可累及全身各個系統,以腎臟和肺部受累為主,其次是消化和神經系統。本研究98例MPO-AAV患者中,肺部受累占76.53%,腎臟受累占81.63%,腎臟受累比例高于肺臟受累。單中心研究發現:MPO-AAV患者肺部受累時,呼吸系統癥狀主要表現為咳嗽咳痰、胸悶氣促和咯血,少數患者出現呼吸困難;腎臟受累時下肢浮腫、尿異常;全身系統的表現則主要為發熱、高血壓和乏力;此外,消化系統和神經系統也常常受累。這些臨床表現與既往臨床特點分析類似,也證實了AAV是一種多系統損害、臨床表現多樣、無特異性的血管炎性疾病。
根據實驗室檢查結果可知,MPO-AAV患者常有血液系統的異常,主要表現為血紅蛋白降低、白細胞以及血小板增多。血紅蛋白降低可能與患者腎臟受累有關,促紅細胞生成素合成減少可導致紅細胞生成下降,而白細胞及血小板增多可能與疾病的應激狀態有關。發病過程中,與ANCA結合的白細胞過度激活、凋亡異常與疾病進展密切相關。此外,當血管受到損傷時,內皮細胞可分泌血小板活化因子,促進血小板活化,使循環系統處于高凝狀態。Chen等[14]報道426例系統性血管炎患者中89%有貧血,其中大部分為中度貧血,43.6%的患者有白細胞增多,28.7%有血小板增多。Basnet等[15]報道MPO-AAV患者可合并嗜血細胞性淋巴組織細胞增生癥,當患者出現全血細胞減少、肝脾腫大而骨髓增殖正常時應警惕該疾病的發生。
X線及HRCT是AAV肺部受累時重要的影像學檢查手段。從本研究中可看出,MPO-AAV患者肺部受累時多表現為炎性滲出、彌漫性間質病變,合并支氣管擴張、胸腔積液、肺氣腫/肺大皰以及結節、空洞者也較多,整體表現復雜多樣,病程較長、病灶靠近胸膜下時可有胸膜增厚以及鈣化。對患者進行隨訪觀察發現,AAV患者肺部受累時最初可只表現為片狀炎性浸潤,此時若患者得到及時治療則可逆轉炎性滲出,避免后期慢性間質纖維化改變。當患者肺部受累為隱匿性進展時,由于肺泡間隔慢性受損,最終可導致慢性間質纖維化改變。此外,由于AAV多發于中老年男性,肺泡彈性較差,當局部肺泡破壞嚴重時,病灶旁肺組織常有代償性通氣過度現象,導致肺大泡的發生。而肺泡受損嚴重部位則導致肺泡塌陷,在致纖維化因子的作用下最終發生肺實變。因此,對有肺部癥狀的AAV患者應及時評估肺功能并進行藥物治療。
根據既往AAV相關肺部受累的病例特點分析,AAV患者肺部受累多發于中老年男性,同時合并全身以及其他系統的癥狀,如發熱、乏力、關節痛、皮膚及腎臟受累等[16]。因此,當患者以肺部多處受累為首要表現、伴隨其他系統癥狀且抗生素治療無效時應及時行ANCA檢測,以便確診后早期治療。肺活檢進行病理檢查有助于AAV肺部受累診斷。根據病理檢查可知,肺部局部病變以慢性炎性浸潤、肺泡破壞及纖維素滲出為主要表現,其中慢性炎性細胞以淋巴細胞和漿細胞為主。
在AAV治療中,GCs是基礎治療藥物,當患者起病較重時,可選用甲潑尼龍沖擊聯合免疫抑制劑減輕急性炎性反應;CTX是免疫抑制劑中最常用的藥物,AZA、MTX、CyA以及MMF可作為CTX不耐受者的備選藥物;羥氯喹是常用的輔助用藥,具有抗炎和免疫調節功能,不良作用較少。MPO-AAV患者治療分為誘導緩解期和維持治療期。AAV誘導緩解的標準方案為CTX (15 mg/kg每2周1次,3個療程后繼以每3周1次)聯合GCs (醋酸潑尼松1 mg/kg每天;重型可用甲潑尼龍1 g每天,連續3天)。維持治療時間為18個月,常用藥物為AZA,MTX可作為替代藥物[17-18]。有研究提示MMF在誘導緩解治療中作用不亞于CTX[19],但確切的效果仍需驗證;單獨應用CD20單抗 (利妥昔單抗)誘導緩解且無維持治療,可與CTX誘導緩解聯合AZA維持治療18個月達到相同的治療效果[20]。因此,B細胞失調在AAV發病及疾病進展中具有重要作用。針對B淋巴細胞的其他治療藥物也在臨床試驗中。治療方案的改進有助于減少患者GCs和免疫抑制劑的用量及其引起的不良反應。由本研究統計結果可知,納入AAV患者的治療尚規范,用藥劑量和方案在治療有效和無效組無明顯差異,因此其與患者的結局無明顯相關性。
多因素分析顯示肺部感染、肺間質病變、ALB<30 g/L以及Scr >500 μmol/L是患者發生呼吸衰竭的危險因素。其中,肺部感染占主導地位,提示AAV患者在日常生活中應避免感染,以減少呼吸衰竭的發生率。既往對AAV的研究也提示患者第一年死亡的主要原因為感染。ALB代表身體基礎狀態,當白蛋白下降時機體基礎代謝紊亂,可促進呼吸衰竭的發生。Scr水平反映了腎臟基本功能,當腎臟受累嚴重時,機體代謝廢物增加、酸堿失衡以及電解質代謝紊亂,可增加肺循環負荷,促進呼吸功能衰竭。年齡>65歲、急性呼吸衰竭是MPO-AAV肺部受累患者死亡的獨立危險因素,呼吸衰竭者發生死亡的風險是同年齡段AAV患者未發生呼吸衰竭者的93.52倍,而患者發生呼吸衰竭時免疫抑制劑的應用可延緩病情進展、降低患者死亡率。Hogan等[21]報道,MPA患者以肺部彌漫性肺泡出血為首發表現時,患者死亡風險增加8.65倍。而在以肺部感染為結局變量的多因素分析中,呼吸衰竭是重要的影響因素。既往研究提示年齡 (>60歲)、MPA、低蛋白血癥、合并肺間質病變患者更容易合并肺部感染[9],而肺部感染和年齡又是AAV患者死亡的獨立危險因素[22-23]。由此可知,年齡、低蛋白血癥以及肺間質病變在MPO-AAV肺部受累患者發生肺部感染和呼吸衰竭中具有重要作用;呼吸衰竭和肺部感染是互為促進的不良預后因素;肺部感染是MPO-AAV肺部受累患者病情惡化的重要誘因;年齡和呼吸衰竭極大增加了MPO-AAV肺部受累患者死亡的風險。
綜上所述,患者轉歸或不良結局與治療方案以及治療藥物劑量無明顯相關性。而肺部感染、肺間質病變、腎臟受累等并發癥以及機體基礎條件則與患者不良預后有密切的聯系。對于初始病情較重的患者,GCs沖擊治療仍為常用選擇。在維持緩解期,小劑量GCs與免疫抑制劑長期使用可避免患者疾病復發。目前AAV的治療難題主要在于患者不能堅持長期用藥,以及如何合理應用GCs和CTX或未來替代藥物,在誘導或維持緩解疾病的同時減少藥物不良作用。
MPO-AAV患者多有肺部受累,同時伴有全身及血液、腎臟等其他系統受累的異常表現。MPO-AAV患者肺部受累時影像學以彌漫性肺間質病變為主,可伴隨滲出、支氣管擴張、肺大泡及肺實變等非特異性改變。以GCs為基礎聯合免疫抑制劑是目前治療AAV的主要方案,早期及時治療可改善肺部預后。肺部感染是誘發呼吸衰竭的主要因素,年齡>65歲的MPO-AAV患者發生呼吸衰竭時死亡風險增加,而免疫抑制劑的應用則可改善患者病情,是呼吸衰竭患者發生死亡的保護因素。
參考文獻
[1]KATSUYAMA T, SADA KE, MAKINO H. Current concept and epidemiology of systemic vasculitides[J].AllergolInt, 2014, 63(4):505-513.
[2]KALLENBERG CG. The diagnosis and classification of microscopic polyangiitis[J].JAutoimmun. 2014(48-49):90-93.
[3]HERVIER B, PAGNOUX C, AGARD C, et al. Pulmonary fibrosis associated with ANCA-positive vasculitides. Retrospective study of 12 cases and review of the literature[J].AnnRheumDis,2009, 68(3):404-407.
[4]SAKAE H, AIKA S,KEITA S. Pulmonary involvement in ANCA-associated vasculitis from the view of the pulmonologist[J].ClinExpNephrol, 2013, 17(5):667-671.
[5]LALLY L, SPIERA R. Current landscape of antineutrophil cytoplasmic antibody-associated vasculitis:classification,diagnosis, and treatment[J].RheumDisClinNorthAm, 2015,41(1):1-19.
[6]SUGIYAMA K, SADA KE, KUROSAWA M,etal. Current status of the treatment of microscopic polyangiitis and granulomatosis with polyangiitis in Japan[J].ClinExpNephrol, 2013, 17(1):51-58.
[7]李曉轅, 劉佳育,徐偉. ANCA相關性血管炎肺部表現[J]. 中國老年學雜志,2011,31(20):3941-3943.
[8]王勇, 蔣瑾,鐘智,等. 抗中性粒細胞胞質抗體相關性血管炎肺部影像學的表現與診斷意義[J]. 實用醫院臨床雜志,2014, 11(3):214-216.
[9]張娟, 楊程德. 抗中性粒細胞胞質抗體相關性血管炎肺部感染的危險因素分析[J]. 中華風濕病學雜志, 2014, 18(5):321-324.
[10]曹然, 汪東方. ANCA相關性小血管炎性肺炎的影像學表現及預后[J]. 中國醫學影像技術,2004,20(S1):30-31.
[11]郭明好, 劉向東,劉云,等. ANCA相關性小血管炎的肺部表現特點及誤診分析[J]. 中國航天醫藥雜志, 2003,5(3):40-42.
[12]JENNETTE JC. Overview of the 2012 revised International Chapel Hill Consensus Conference nomenclature of vasculitides[J].ClinExpNephrol, 2013, 17(5):603-606.
[13]MUKHTYAR C, GUILLEVIN L, CID MC,etal. EULAR recommendations for the management of primary small and medium vessel vasculitis[J].AnnRheumDis, 2009, 68(3): 310-317.
[14]CHEN M, YU F, ZHANG Y,etal. Clinical [corrected] and pathological characteristics of Chinese patients with antineutrophil cytoplasmic autoantibody associated systemic vasculitides:a study of 426 patients from a single centre[J].PostgradMedJ,2005, 81(961):723-727.
[15]BASNET A, CHOLANKERIL MR. Hemophagocytic lymphohistiocytosis in a patient with Goodpasture's syndrome: a rare clinical association[J].AmJCaseRep, 2014, 15:431-436.
[16]徐虹, 李偉峰, 杜海堅, 等. 以肺部表現首發的抗中性粒細胞胞漿抗體相關性小血管炎臨床分析[J]. 臨床肺科雜志, 2009, 14(1):29-30.
[17]JAYNE D, RASMUSSEN N, ANDRASSY K,etal. A randomized trial of maintenance therapy for vasculitis associated with antineutrophil cytoplasmic autoantibodies[J].NEnglJMed, 2003,349(1):36-44.
[18]HOFFMAN GS. L52. Vasculitis treatment: is it time to change the standard of care for ANCA-associated vasculitis? [J].PresseMed, 2013, 42(4 Pt 2):643-650.
[19]JONES R, HARPER L, BALLARIN J,etal. A randomized trial of mycophenolate mofetil versus cyclophosphamide for remission induction of ANCA-associated vasculitis[J].PresseMed,2013, 42(4 pt 2):678-679.
[20]SPECKS U, MERKEL PA, SEO P,etal. Efficacy of remission-induction regimens for ANCA-associated vasculitis[J].NEnglJMed, 2013, 369(5):414-427.
[21]HOGAN SL, NACHMAN PH, WILKMAN AS,etal. Prognostic markers in patients with anti-neutrophil cytoplasmic autoantibody associated microscopic polyangiitis and glomerulonephritis[J].JAmSocNephrol, 1996, 7(1):23-32.
[22]于峰, 陳曼,趙明輝,等.原發性ANCA相關小血管炎患者死因分析[J].北京醫學,2007, 29(4):196-199.
[23]CHEN M, YU F, ZHANG Y, et a1. Antineutrophilie cytoplasmic autoantibody-associated vasculitic in older patients[J].Medicine(Bahimore), 2008, 87(4):203-209.
Analysis of clinical characteristics in MPO-AVV patients and prognostic risk factors for Patients with lung involvement
KONG Xiu-fang, JI Zong-fei, YAN Yan, CHEN Hui-yong, MA Li-li, ZHANG Zhuo-jun, JIANG Lin-di△
(DepartmentofRheumatology,ZhongshanHospital,FudanUniversity,Shanghai200032,China)
【Abstract】ObjectiveTo analyze the clinical characteristics of myeloperoxidase anti-neutrophil cytoplasmic antibody-associated vasculitis (MPO-AAV) patients and explore risk factors for respiratory failure,lung infection and death respectively in patients with lung involvement.MethodsPatients admitted in Zhongshan hospital,Fudan University from Feb.,2005 to Dec.,2013 were enrolled in this study and followed up to 31st,Aug of 2014 or death.Clinical materials were collected in their first time and during their follow-up period.A multiple Logistic regression analysis was used to analyze risk factors for different outcomes.ResultsNinety-eight patients were recruited in this study,who was classified as early systemic (n=27),generalized (n=50),severe (n=28) and refractory disease (n=7).In patients with lung involvement,initial manifestations were cough and chest distress with inflammatory exudation (n=36) and interstitial changes (n=35) as mainly features in high resolution computed tomography (HRCT).Destroyed alveolar septum and chronic inflammatory cells infiltration can be seen in local lung tissues by lung biopsy in 8 patients.Patients were treated with glucocorticoids (n=92),immunosuppressive agents (n=79),IVIG (n=19) and immunoadsorption therapy (n=5).Seventy-one patients were improved,while 17 patients relapsed after treatment.Respiratory failure occurred in 16 patients,lung infection 35 occured in patients, and 9 patients were death during follow-up period.The multiple Logistic regression showed that risk factors for acute respiratory failure included pulmonary infection,interstitial lung disease,Scr>500 μmol/L and ALB<30 g/L.Age at onset ≥65 years and acute respiratory failure were risk factors for death in patients with lung involvement,while acute respiratory failure was a potential risk factor for pulmonary infection.ConclusionsPatients with MPO-AAV always have lung involved with other systems involvement such as urinary system and hematologic system.Pulmonary infection was a primary induction factor for acute respiratory failure in MPO-AAV patients with lung involvement.Respiratory failure may increase mortality risk in patients more than 65 years old.
【Key words】myeloperoxidase anti-neutrophil cytoplasmic antibody-associated vasculitis;respiratory failure;pulmonary infection;death;risk factors
【中圖分類號】R593.2; R563.9
【文獻標識碼】A
doi:10.3969/j.issn.1672-8467.2016.01.006
(收稿日期:2015-05-15;編輯:王蔚)
△Corresponding authorE-mail:zsh-rheum@hotmail.com

