發育性髖關節脫位閉合復位后股骨頭壞死自然演變過程的臨床及實驗觀察
裴新紅,莫越強,馬瑞雪
(復旦大學附屬兒科醫院骨科,上海 201102)
發育性髖關節脫位閉合復位后股骨頭壞死自然演變過程的臨床及實驗觀察
裴新紅,莫越強,馬瑞雪
(復旦大學附屬兒科醫院骨科,上海 201102)
目的 探討發育性髖關節脫位閉合復位術后股骨頭壞死的自然演變過程。方法 單側髖關節脫位閉合復位術后出現股骨頭壞死的患兒22例,平均復位年齡10.5月(5~23月)。K&M分型II型11例,III型8例,IV型3例。平均隨訪3.5年(2.5~5.5年),采用股骨頭高度同骺線寬度比(Height-Wild Ratio,HWR)計算股骨頭修復百分比。同時觀察了異常應力髖關節發育不良動物模型中,去除應力前后股骨頭的形態變化及其修復情況。結果 22例患兒,在去除外固定架后自然負重的情況下,股骨頭形態均有不同程度的修復。22例患兒壞死側股骨頭同健側對比,從(24.7±5.26)%修復至(80.3±17.9)%。出現股骨頭壞死后隨訪≤2年(n=10)股骨頭高寬比(HWR)修復為(72±2.7)%;隨訪>2年(n=12)股骨頭HWR修復(81.2±9.4)%。其中II型(n=11)HWR修復(78.3±4.2)%;III型(n=8) HWR修復(74.1±6.9)%;IV型(n=3) HWR修復(59.3±7.7)%。造模動物的股骨頭形態學觀察結果顯示,隨應力時間延長股骨頭形態改變越顯著,去除應力后均有不同程度修復。去除應力越早,日后發育越接近正常形態的股骨頭。結論 發育性髖關節脫位閉合復位后股骨頭壞死在自然負重狀態下具有逐步修復的趨勢;出現股骨頭壞死后可以繼續隨訪2~4年,以發揮DDH患兒股骨頭自我修復的最大潛能。
發育性髖關節脫位;股骨頭缺血壞死
發育性髖關節脫位(developmental dislocation of the Hips,DDH)的發現已近百年[1],病因仍未明確,治療方式也存在爭議[2]。目前公認的觀點強調早期診斷和治療[3]。早期通過閉合復位,約70%患兒的髖關節能夠接近正常髖,18%左右存在殘余髖臼發育不良[4],此外被認為治療后災難性的并發癥——股骨頭缺血壞死的發生率6%~48%[5]。閉合復位后股骨頭缺血壞死(avascular necrosis of femoral head,ANV)的主要可能因素之一是異常壓力的作用[6],目前對于發生ANV后是否需要早期干預以及治療時機均存在爭議[7]。表現ANV后即免負重、佩戴行走支架或通過股骨近端外翻截骨、骨盆截骨等手術方式,治療從3歲到青春期病例均有報道[8,9],本文擬通過臨床病例的隨訪觀察DDH閉合復位后發生的自然臨床轉歸,以及DDH動物模型中去除應力后股骨頭的生長情況,探討 “頭臼同心”后,壞死股骨頭在自然負重情況下的重新塑形能力。
1 資料及方法
1.1 一般資料 我院2012年1~12月收治22例單側髖關節脫位,閉合復位術后出現患側股骨頭壞死的患兒,平均復位年齡10.5月(5~23月)。女18例,男4例;左側12例,右側10例。實驗動物造模:Wistar孕鼠(復旦大學實驗動物科學部提供,動物生產合格證號SCXK(滬)2009-0019;動物使用合格證號SYXK(滬)2009-0082),體重200g。清潔級實驗室,溫度恒定25℃,濕度維持45%~55%。單籠喂養,基礎飼料,自由攝食及飲水。每12小時燈光開關周期。孕鼠產新生大鼠,生后6小時內雙后肢伸髖伸膝位移用膠帶固定,制備髖關節發育不良實驗動物模型。分別于固定后2天,4天,6天去除外固定,模擬去除異常應力狀態。繼續喂養至1個月,麻醉下處死觀察大體、組織形態。
1.2 方法 本組患兒閉合復位后行石膏固定3個月,外展支架固定3個月。所有病例術后均行三維CT檢測,均實現頭臼同心。去除支架后患兒開始負重行走,每3~6個月復查骨盆正位像,平均隨訪3.5年(2.5~5.5年)。三位測量者分別測量結果,取平均值。動物造模:雙髖雙膝并攏,醫用膠帶襁褓體位固定,每天更換一次固定膠帶,固定期間正常母乳喂養。造模組:分別在固定2、4、6天麻醉下處死,觀察大體、組織形態;去除應力組:固定2、4、6天后去除應力,在喂養至1月齡,麻醉下處死觀察大體及組織形態。同齡正常大鼠股骨頭作為對照。組織切片:采用組織學及免疫組化的方法觀察髖關節發育不良動物模型去除應力前后,股骨頭的形態變化。
1.3 療效評價標準 股骨頭壞死診斷標準依據Salter1969[10]:①復位后1年股骨頭骨骺核仍未出現;②復位后1年,現存骨骺核生長發育停滯;③復位后1年,股骨頸部變寬;④股骨頭變扁、密度增加后出現碎裂現象;⑤股骨頭殘余畸形,包括頭變大變扁、扁平髖、髖內翻、頸短寬。股骨頭壞死分型依據[11]:Kalamchi & MacEwen分型,復位后股骨頭骨骺核延遲出現,股骨頸受輕微影響,骨骺核高度少量丟失,偶爾出現髖內翻為Ⅰ型;骨骺核改變加上外側骺板破壞為Ⅱ型;骨骺核改變加上中央骺板破壞為Ⅲ型;股骨頭和骺板均破壞為Ⅳ型。本組病例中,II型11例,III型8例,IV型3例。股骨頭修復的評價方法:采用同健側對比,股骨頭高度同骺線寬度比(Height-Wild Ratio HWR)計算股骨頭修復百分比[12]。如圖1所示。
1.4 統計學方法 應用SPSS 19.0統計學軟件包進行數據處理。兩組比較采用t檢驗,P< 0.05為差異有統計學意義。
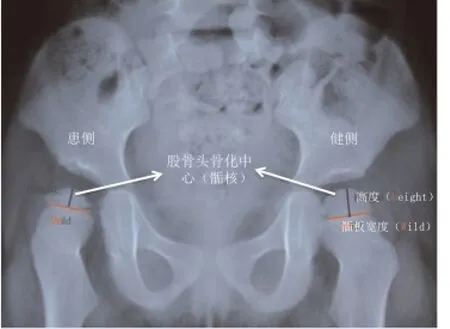
圖1 股骨頭高度同骺線寬度比(Height-Wild Ratio HWR)計算股骨頭修復百分比示意圖
2 結果
2.1 DDH閉合復位術后股骨頭缺血壞死及恢復情況 22例AVN平均隨訪3.5年,股骨頭HWR明顯改善(P= 0.0047),從開始出現ANV的(24.7±5.26)%修復至(80.3±17.9)%,修復后的HWR與健側比較,差異有統計學意義(P= 0.037),提示閉合復位后股骨頭AVN具有一定自我修復的趨勢,但隨訪期內股骨頭骨化中心高度與HWR仍未達到健側水平。
2.2 不同隨訪時間股骨頭缺血壞死恢復情況 出現ANV隨訪≤2年(n=10)股骨頭HWR修復為(72±2.7)%;隨訪>2年(n=12)股骨頭HWR修復(81.2±9.4)%,兩者之間差異有統計學意義(P= 0.023)。提示閉合復位后股骨頭ANV在2年內修復速度較快,但隨后仍有修復潛能。
2.3 不同分型股骨頭缺血壞死恢復情況 ANV中II型(n=11)HWR修復(78.3±4.2)%;III型(n=8) HWR修復(74.1±6.9)%;IV型(n=3) HWR修復(59.3±7.7)%。II、III型之間差異無統計學意義,但兩者與IV型之間的修復程度差異均有統計學意義(P= 0.0462)。提示閉合復位后骨骺核與骨骺全受累修復潛能較低,而其他部分骨骺受累的修復能力相對較強。
2.4 隨訪情況 單側發育性髖關節脫位術后發生股骨頭缺血壞死自然演變過程典型病例,見圖2和圖3。
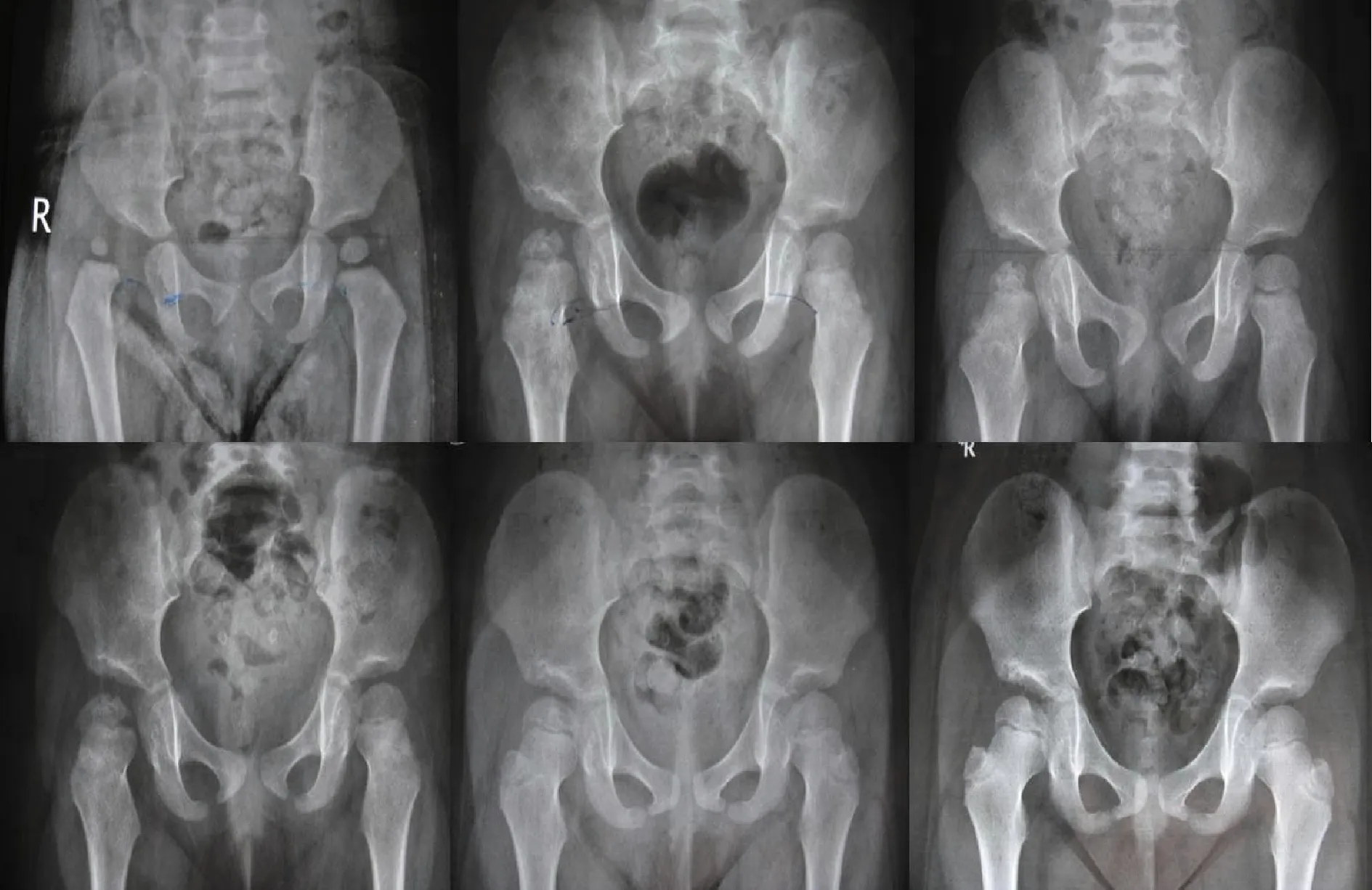
圖2 典型病例1 患者,女,右髖關節脫位,復位年齡13月,閉合復位后右股骨頭II型AVN,隨訪4.5年
圖3 典型病例2 患者,男,左髖關節脫位,復位年齡12月,閉合復位后左股骨頭III型AVN,隨訪5.5年
2.5 實驗動物模型的股骨頭形態觀察 利用髖關節發育異常動物模型,模擬復位后股骨頭恢復情況。結果顯示:大鼠髖關節及股骨頭出現形態改變。股骨頭骺板下陷,骨骺核變形,突入骺板。去除異常應力后,繼續生長至1月,髖關節組織形態結果顯示,隨造模時間的延長,髖臼及股骨頭均有形態失常,但較早期更接近于正常水平。股骨頭骺板修復水平,骨骺核修復至骺板方。提示,隨應力時間延長股骨頭形態改變越顯著,去除應力后均有不同程度修復。去除應力越早越能發育為接近正常形態的股骨頭。見圖4。
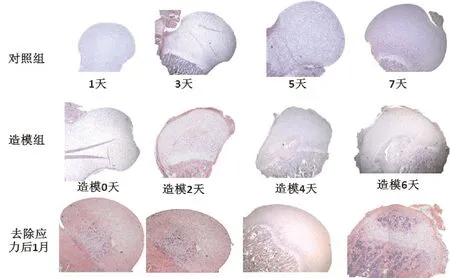
圖4 時序性伸髖伸膝位固定新生大鼠后肢觀察固定后及去除固定后股骨頭形態
3 討論
DDH自然病程或未治療病例中,幾乎不發生ANV[12,13]。在DDH治療過程中,為了達到“頭臼同心”,并盡量減小在成年的早期階段,過早的出現退行性變及殘疾,通過各種方式治療的過程中,難以避免發生ANV[14]。在不同年齡段和不同的治療方式中,ANV的發生率變異很大,從5%~50%[15]。DDH治療后股骨頭壞死的晚期并發癥包括有:由于“頭臼不匹配”引起的髖關節半脫位、由于股骨頸變短,導致的肢體不等長及外展受限[16]。由于ANV可能引起比DDH本身的病理改變更為嚴重的結局,因此也被稱為災難性的并發癥[17]。
目前廣泛應用的關于DDH治療后ANV的分類方式是KM分類[18],分為I~IV型。Read和Evans發表的關于DDH治療后ANV并發癥處理的綜述中指出[19],I型ANV基本可以修復,無需處理后遺畸形。II型主要的后遺畸形為髖外翻,通過內翻截骨治療。III型常出現大轉子高位及肢體不等長,可通過大轉子下移或對側肢體骨骺阻滯改善。IV型除III型的常見后遺畸形外還可能出現頭臼不匹配,可行Salter骨盆截骨術。但綜述中未提及對于DDH閉合復位后出現股骨頭壞死病例的干預時機以及早期是否可以負重等目前仍存在爭議的問題。本研究通過隨訪22例閉合復位后出現ANV DDH患兒,在自然負重情況下的自然病程,結果顯示壞死股骨頭均有不同程度恢復,且隨隨訪時間越長(>2年)恢復越多的趨勢。K&M IV型的恢復程度較其他差,在隨訪期間各型均未發生明顯的肢體不等長。以上的結果提示,閉合復位后股骨頭ANV具有一定自我修復的趨勢;閉合復位后股骨頭ANV在2年內修復速度較快,隨后仍有修復潛能,但隨訪間期內仍未達到健側水平;當骨骺核與股骨近端骺板全受累時,股骨頭形態的修復潛能減低,而其他部分骨骺受累的修復能力相對較強。
機械力在骨骼發育及骨量增加中發揮重要作用,骨組織通過對機械力反應,維持正常的穩態及損傷后的修復[20]。組織損傷后重新塑形的過程中,修復和機械應力之間的關系是“雙刃劍”,過小的機械應力和過于暴力的機械應力均可以導致骨骼重新塑形能力的減低[21]。體內外的實驗結果提示,適當的機械力盈利對骨骼重塑的保護性作用機制,可能是通過防止骨及軟骨細胞外基質中的膠原降解實現的[22]。盡管有些學者建議為防止股骨頭進一步塌陷,在發現股骨頭壞死后應盡量避免負重,本研究中,在實現穩定的頭臼同心復位后,患兒開始自然負重,盡量避免長時間劇烈活動,并鼓勵進行游泳等鍛煉,結果提示在負重的應力作用下壞死的股骨頭仍具有塑形能力。
伸髖伸膝位固定實驗動物后肢,是目前制備異常應力下髖關節發育不良及脫位的通用模型[8,9]。本研究通過時序性的觀察造模動物,在去除異常應力,修復負重后股骨頭及髖臼的形態改變,結果顯示:隨著異常應力時間延長,股骨頭及髖臼的形態失常越顯著,去除應力后,早期髖臼及股骨頭形態改變越小、修復越好;當異常應力持續存在一定的時期后,髖臼及股骨頭形態將不可逆,但較早期略有重新塑形的趨勢。為臨床早期診斷及治療提供了實驗證據。本研究的不足之處在于例數少,無多中心橫向資料比較。
綜上所述,發育性髖關節發育不良/髖關節脫位閉合復位后股骨頭壞死能夠在自然負重狀態下具有逐步修復的趨勢;建議在出現股骨頭壞死后,可以繼續隨訪2~4年以發揮股骨頭自我修復的最大潛能,以期用最簡單的方法使患兒獲得最佳的治療結局。
[1] De Hundt M,Vlemmix F,Bais JM,et al.Risk factors for developmental dysplasia of the hip:a meta-analysis[J].J Obstet Gynecol Reprod Biol,2012,165(1):8-17.
[2] Ortiz-Neira CL,Paolucci EO,Donnon T.A meta-analysis of common risk factors associated with the diagnosis of developmental dysplasia of the hip in newborns[J].European Journal Radiologist,2012,81(3):e344-351.
[3] Bo N,Peng W,Xinghong P,et al.Dual function of β-catenin in articular cartilage growth and degeneration at different stages of postnatal cartilage development[J].Int Orthop,2012,36(3):655-664.
[4] Xinhong P,Yueqiang M,Bo N,et al.The role of TGF-β1 stimulating ROCK I signal pathway to reorganize actin in a rat experimental model of developmental dysplasia of the hip[J].Molecular and Cellular Biochemistry,2014,391(1-2):1-9.
[5] Kim HW,Morcuende JA,Dolan LA,et al.Acetabular development in developmental dysplasia of the hip complicated by lateral growth disturbance of the capital femoral epiphysis[J].J Bone Joint Surg Am,2000,82-A(12):1692-1700.
[6] Hadley NA,Brown TD,Weinstein SL.The effects of contact pressure elevations and aseptic necrosis on the long-term outcome of congenital hip dislocation[J].J Orthop Res,1990,8(4):504-513.
[7] Bittersohl B,Hosalkar HS,Wenger DR.Surgical treatment of hip dysplasia in children and adolescents[J].Orthop Clin North Am,2012,43(3):301-315.
[8] Cech O,Vávra J,Zídka M.Management of ischemic deformity after the treatment of developmental dysplasia of the hip[J].J Pediatr Orthop,2005,25(5):687-694.
[9] Mehmet B,Murat G,Oktay B,et al.Management of developmental dysplasia of the hip in less than 24 months old children[J].Indian J Orthop,2013,47(6):578-584.
[10]Salter RB,Kostuik J,Dallas S.Avascular necrosis of the femoral head as a complication of treatment for congenital dislocation of the hip in young children:A clinical and experimental investigation[J].Can J Surg,1969,12:44-60,
[11]Kalamchi A,MacEwen GD.Avascular necrosis following treatment of congenital dislocation of the hip[J].J Bone Joint Surg,1980,62A:876-888.
[12]Gardner RO,Bradley CS,Howard A,et al.The incidence of avascular necrosis and the radiographic outcome following medial open reduction in children with developmental dysplasia of the hip[J].Bone Joint J,2014,96-B(2):279-286.
[13]Andreas R,Deborah R,Evangelia P,et al.Osteonecrosis complicating developmental dysplasia of the hip compromises subsequent acetabular remodeling[J].Clin Orthop Relat Res,2013,471(7):2318-2326.
[14]Wedge JH,Kelley SP.Strategies to improve outcomes from operative childhood management of DDH[J].Orthop Clin North Am,2012,43(3):291-299.
[15]Gardner RO,Bradley CS,Howard A,et al.The incidence of avascular necrosis and the radiographic outcome following medial open reduction in children with developmental dysplasia of the hip:a systematic review[J].Bone Joint J,2014,96 (2):279-286.
[16]Bhuyan BK.Outcome of one-stage treatment of developmental dysplasia of hip in older children[J].Indian J Orthop,2012,46(5):548-555.
[17]McGillion S,Clarke NM.Lateral growth arrest of the proximal femoral physis:a new technique for serial radiological observation[J].J Child Orthop,2011,5(3):201-207.
[18]Agus H,Omeroglu H,Bicimoglu A,et al.Is Kalamchi and MacEwen Group I avascular necrosis of the femoral head harmless in developmental dysplasia of the hip[J].Hip Int,2010,20(2):156-162.
[19]Sllamniku S,Bytyqi C,Murtezani A,et al.Correlation between avascular necrosis and the presence of the ossific nucleus when treating developmental dysplasia of the hip[J].J Child Orthop,2013,7(6):501-505.
[20]Hideki K,Keisuke K,Masahiko I,et al.Effect of cytokines on osteoclast formation and bone resorption during mechanical force loading of the periodontal membrane[J].Hindawi pulishing corporation The scientific world journal,2014,2014(5):1-7.
[21]Lee CS,Szczesny SE,Soslowsky LJ.Remodeling and repair of orthopedic tissue:role of mechanical loading and biologics:part II:cartilage and bone[J].Am J Orthop (Belle Mead NJ),2011,40(3):122-128.
[22]Saunders MM,Simmerman LA,Reed GL,et al.Biomimetic bone mechanotransduction modeling in neonatal rat femur organ cultures:structural verification of proof of concept[J].Biomech Model Mechanobiol,2010,9(5):539-550.
Clinical and experimental observation on the natural processes of the femoral head avascular necrosis in DDH patients after close reduction
PEI Xin-hong,MO Yue-qiang,MA Rui-xue
(Department of Orthopaedics,The Children’s Hospital of Fudan University,Shanghai 201102,China)
MARui-xue
Objective To explore the natural processes of the femoral head avascular necrosis in patients developmental dislocation of the hips (DDH) after close reduction.Methods Twenty-two DDH patients with single dislocation hip who presented femoral head avascular necrosis after close reduction were enrolled in this study.The average age was 10.5 months ranged from 5 to 23 months.Based on Kalamchi & MacEwen classification,there were 11 cases with K&M type II,8 cases with K&M type III,and 3 cases with type IV.The average follow-up was 3.5 years ranged from 2.5 years to 5.5 years.Height-Wild Ratio (HWR) of femoral head was used to calculate percentage of recovery.In the mean time,we also observed the morphologic feature in hip dysplasia animal model.Results In the 22 patients,the morphology of necrosis femoral head had all recovered partially with natural body weight loading after releasing brace.Compared with normal side,HWR of femoral head was changed from (24.7 ± 5.26)% to (80.3 ± 17.9)%.The HWR recovery was (72 ± 2.7)% (n= 10) when followed up for less than 2 years while HWR recovery was (81.2 ± 9.4)% (n= 12) when followed up for more than 2 years.Moreover,HWR recovery was (78.3 ±4.2)% in the type II patients,(74.1 ± 6.9)% in the type III and (59.3 ±7.7)% in the type IV.In animal model,we observed that the shape of femoral head changed dramatically in abnormal stress loading,somehow the morphology of the femoral head recovered partially after stress overloading removed.Conclusion The avascular necrosis of femoral head has capability to recover partially in DDH close reduction with natural body weight loading after releasing brace.The patients could be followed-up for 2~ 4 years after occurrence of femoral head necrosis in order to the patients play the biggest potential for femoral head self healing.
Developmental Dislocation of the Hips;Avascular necrosis of femoral head
馬瑞雪,女,博士,主任醫師。中華小兒外科學會骨科學組副組長,亞太地區骨科學會小兒骨科學組成員。研究方向:小兒骨科先天畸形、創傷、腫瘤、炎癥及小兒骨科疑難雜癥。
R726.8
A
1672-6170(2016)04-0035-04
2016-05-30;
2016-06-06)

