香蕉水通道蛋白SIP2-1基因的克隆和表達(dá)分析
許奕侯曉婉徐碧玉金志強(qiáng)胡偉宋順
(1. 中國(guó)熱帶農(nóng)業(yè)科學(xué)院海口實(shí)驗(yàn)站 海南省香蕉遺傳改良重點(diǎn)實(shí)驗(yàn)室,海口 570102;2. 中國(guó)熱帶農(nóng)業(yè)科學(xué)院熱帶生物技術(shù)研究所 農(nóng)業(yè)部熱帶作物生物學(xué)與遺傳資源利用重點(diǎn)實(shí)驗(yàn)室,海口 571101;3. 中國(guó)熱帶農(nóng)業(yè)科學(xué)院南亞熱帶作物研究所,湛江 524091)
香蕉水通道蛋白SIP2-1基因的克隆和表達(dá)分析
許奕1,2侯曉婉3徐碧玉2金志強(qiáng)1,2胡偉2宋順1
(1. 中國(guó)熱帶農(nóng)業(yè)科學(xué)院海口實(shí)驗(yàn)站 海南省香蕉遺傳改良重點(diǎn)實(shí)驗(yàn)室,海口 570102;2. 中國(guó)熱帶農(nóng)業(yè)科學(xué)院熱帶生物技術(shù)研究所 農(nóng)業(yè)部熱帶作物生物學(xué)與遺傳資源利用重點(diǎn)實(shí)驗(yàn)室,海口 571101;3. 中國(guó)熱帶農(nóng)業(yè)科學(xué)院南亞熱帶作物研究所,湛江 524091)
從香蕉中克隆了一個(gè)水通道蛋白(AQP)基因MaSIP2-1。序列分析表明,該基因存在一個(gè)完整的開(kāi)放閱讀框(ORF)717 bp,編碼 239個(gè)氨基酸。多序列比對(duì)和進(jìn)化樹分析表明,MaSIP2-1所編碼的蛋白與其他植物中AQP編碼的蛋白具有較高的一致性。其中與馬來(lái)西亞野生香蕉、油棕、麻風(fēng)樹、野茶樹的AQP編碼的氨基酸序列的同源性較高,分別為98%、74%、65%和63%。器官特異性分析表明,MaSIP2-1在香蕉的根、莖、葉片、花和果實(shí)中均有所表達(dá),其中在莖中表達(dá)量較高。通過(guò)對(duì)其在干旱、高鹽、低溫、澇害脅迫下的表達(dá)結(jié)果分析顯示,該基因響應(yīng)干旱、高鹽、澇害3種脅迫。
水通道蛋白;SIP;香蕉;生物信息學(xué);脅迫;熒光定量PCR
植物的生長(zhǎng)依賴植物的根系從土壤中吸取水分運(yùn)輸?shù)狡渌鞴僦校?]。然而,干旱、高鹽、寒冷等外界環(huán)境的脅迫會(huì)導(dǎo)致植物水分缺失而影響植物的生長(zhǎng)和產(chǎn)量。水分的運(yùn)輸是維持植物使其具有忍耐干旱和高鹽脅迫的一個(gè)重要過(guò)程[2-4]。水通道蛋白(AQP)能夠運(yùn)輸水分以及其他小分子物質(zhì),如甘油、CO2和硼等[5-7]。AQP在植物中的生物活性是多樣性的,包括種子萌發(fā)、氣孔運(yùn)動(dòng)、細(xì)胞伸長(zhǎng)及響應(yīng)外界脅迫等[8,9]。在許多植物中都已經(jīng)鑒定出了AQP蛋白,包括擬南芥中的35個(gè)[10],水稻種的33個(gè)[11],玉米種的36個(gè)[12]。水通道蛋白根據(jù)序列同源性分成4類,包括液泡膜內(nèi)在蛋白(tonoplast in-trinsic protein,TIPs)、質(zhì)膜內(nèi)在蛋白(plasma membrane intrinsic protein,PIPs)、NOD26-like內(nèi)在蛋白(NOD26-like intrinsic proteins,NIPs)和小的內(nèi)在蛋白(small and basic intrinsic proteins,SIP)[13]。這4類AQP具有高度保守結(jié)構(gòu),均有6個(gè)傾斜的右旋性跨膜結(jié)構(gòu)(TM1-TM6),并被5個(gè)環(huán)(Loop)所連接[12]。AQP在植物中涉及許多發(fā)育過(guò)程,如種子萌發(fā)、果實(shí)成熟、細(xì)胞伸長(zhǎng)等[9]。在Liu等[14]研究中,過(guò)表達(dá)OsPIP1;1能夠增加轉(zhuǎn)基因水稻種子產(chǎn)量,提高種子的發(fā)芽率。而GhPIP1;2 和 GhgammaTIP1能使水分快速進(jìn)入液泡,從而促進(jìn)棉花纖維細(xì)胞伸長(zhǎng)[15]。此外,關(guān)于AQP對(duì)植物抵御外界非生物脅迫的研究近年來(lái)成為研究其功能的一個(gè)熱點(diǎn),許多實(shí)驗(yàn)結(jié)果顯示,植物能夠通過(guò)調(diào)節(jié)AQP的活性響應(yīng)各種逆境的脅迫,如旱害、冷害、鹽害、機(jī)械損傷、滲透脅迫及重金屬脅迫等。本研究從香蕉中克隆出一個(gè)MaSIP2-1基因,并對(duì)其在非生物脅迫處理下的表達(dá)模式做了研究,旨在為進(jìn)一步研究該基因的功能奠定基礎(chǔ)。
1 材料與方法
1.1 材料
2015年1 月初采集巴西香蕉(Musa acuminata L.AAA group‘Brazilian’)的根、莖、葉、花及果實(shí),用無(wú)菌水清洗后立即放置于液氮中速凍,于-70℃冰箱中保存?zhèn)溆谩?shí)驗(yàn)所用香蕉均采自中國(guó)熱帶農(nóng)業(yè)科學(xué)院儋州組培中心。
1.2 方法
1.2.1 目的基因的獲得 從香蕉A基因組測(cè)序數(shù)據(jù)庫(kù)中得到一個(gè)AQP家族基因MaSIP2-1,根據(jù)其序列設(shè)計(jì)一對(duì)引物S1,S2(表1),擴(kuò)增MaSIP2-1全長(zhǎng)序列。PCR擴(kuò)增程序?yàn)椋?5℃預(yù)變性5 s;94℃變性40 s,55℃退火40 s,72℃延伸1 min 30 s,共35個(gè)循環(huán)。按照分子克隆實(shí)驗(yàn)指南進(jìn)行PCR擴(kuò)增產(chǎn)物回收、連接、轉(zhuǎn)化和鑒定。對(duì)已鑒定的陽(yáng)性克隆進(jìn)行測(cè)序分析。
1.2.2 生物信息學(xué)分析 將基因MaSIP2-1的cDNA序列和開(kāi)放閱讀框(open reading frame,ORF)編碼的氨基酸序列在NCBI 數(shù)據(jù)庫(kù)中的BLASTx進(jìn)行同源性搜索和比對(duì),利用Clustal X1.81 和MEGA 3.1 軟件分析MaSIP2-1蛋白與其他植物的SIP2-1蛋白的進(jìn)化關(guān)系,構(gòu)建分子進(jìn)化樹。

表1 香蕉MaSIP2-1基因的克隆及實(shí)時(shí)熒光定量PCR所用引物
1.2.3 MaSIP2-1在香蕉不同器官中的表達(dá)分析 以香蕉五葉一心期的根、莖、葉片及花和果實(shí)采后當(dāng)天的cDNA為模板,采用RT-PCR 方法分析其組織特異性表達(dá)。以香蕉MaActin片段為內(nèi)參,引物為NCBI 上已登錄序列MaActin1和MaActin2,MaSIP2-1引物為P1和P2。PCR 反應(yīng)體系為25 μL。反應(yīng)程序:95℃預(yù)變性30 s;95℃ 7 s,56℃ 15 s,72℃ 20 s,40個(gè)循環(huán)后作熔解曲線(95-55℃,0.1℃· s-1)。
1.2.4 基因的表達(dá)分析
1.2.4.1 干旱脅迫處理 取20株五葉一心、心葉未展、生長(zhǎng)健壯的香蕉幼苗,分為4組,每組5株。測(cè)定各組中土壤水分含量并調(diào)整為一致。實(shí)驗(yàn)設(shè)計(jì)如下:第1組:正常生長(zhǎng)(作為對(duì)照),按規(guī)律澆水,土壤相對(duì)含水量保持在75%-80%;第2組:低度失水干旱脅迫,土壤相對(duì)含水量保持在55%-60%;第3組:中度失水干旱脅迫,土壤相對(duì)含水量保持在45%-50%;第4組:高度失水干旱脅迫,土壤相對(duì)含水量保持在30%-35%。將所有香蕉苗均放入恒溫人工氣候箱中培養(yǎng)。設(shè)定環(huán)境溫度為25-30℃,光照強(qiáng)度為2 000 lx,空氣相對(duì)濕度40%。利用烘干土法控制調(diào)節(jié)土壤相對(duì)含水量,每隔3 h進(jìn)行測(cè)定,達(dá)到不同脅迫標(biāo)準(zhǔn)后取出植株葉片置于液氮中迅速冷凍,提取RNA。
1.2.4.2 高鹽脅迫處理 在培養(yǎng)液(1/2Hoagland營(yíng)養(yǎng)液)中加入300 mmol/L NaCl進(jìn)行鹽脅迫處理。白天的平均溫度為33-35℃,夜間的平均溫度為26-28℃,光照充分,于0、2、4和6 h分別觀察和取樣。將材料的葉片置于液氮中冷凍,提取RNA。
1.2.4.3 低溫脅迫處理 選取生長(zhǎng)一致,長(zhǎng)勢(shì)健壯的香蕉幼苗,分為5組,置于人工氣候箱培養(yǎng)進(jìn)行低溫處理。處理方法如下:從25℃開(kāi)始降溫到15℃、10℃、7℃和5℃四個(gè)不同的溫度。第1組:對(duì)照組,將香蕉苗在25℃下連續(xù)培養(yǎng)12 h;第2組將香蕉苗從25℃降至15℃環(huán)境中并培養(yǎng)12 h;第3組:使香蕉苗從25℃降至10℃,并在10℃培養(yǎng)箱中生長(zhǎng)12 h;第4組:將培養(yǎng)箱溫度降至7℃,將香蕉苗置于其中生長(zhǎng)12 h;第5組:使香蕉苗從25℃降至在5℃,并在該低溫下處理材料12 h。處理期間光照強(qiáng)度均為2 000 lx,相對(duì)濕度為85%。處理完畢后,取各組材料心葉下第一片完全展開(kāi)葉立即置于液氮中冷凍,提取RNA。
1.2.4.4 水澇脅迫處理 選取長(zhǎng)勢(shì)一致的土栽苗,將根部全部浸入水中進(jìn)行澇害實(shí)驗(yàn),設(shè)置淹水0、12、24 和36 h 4個(gè)處理,每個(gè)處理重復(fù)3次。定期取樣:直徑為1 mm左右白色新嫩根,迅速吸干根表面水分,立即用液氮速凍,提取RNA。

圖1 MaSIP2-1編碼的氨基酸序列與其他植物SIP2-1蛋白氨基酸同源性分析
2 結(jié)果
2.1 MaSIP2-1的克隆及序列分析
以正常生長(zhǎng)的巴西蕉幼苗葉片cDNA為模板,MaSIP2-1 S1和MaSIP2-1 S2為引物,從香蕉栽培品種巴西蕉中克隆到一個(gè)AQP家族基因,其ORF為717 bp,編碼239個(gè)氨基酸。利用DNAman 將MaSIP2-1 cDNA 推導(dǎo)的氨基酸序列與NCBI中已登錄的其它高等植物的SIP氨基酸序列進(jìn)行同源關(guān)系比較,結(jié)果(圖1)顯示,各種植物SIP編碼的氨基酸序列存在較高的同源性,多數(shù)達(dá)63%以上。BLASTX分析表明,MaSIP2-1編碼的氨基酸序列與馬來(lái)西亞野生蕉MaSIP2-1-like(XP_009402451.1)、油棕EgSIP2-1(XP_010909819)、麻風(fēng)樹JcSIP2-1(XP_012079611)、野茶樹CsSIP2-1(AHE93339.1)編碼的氨基酸序列具有較高的一致性,分別為98%、74%、65%和63%。利用Clustal X1.81和MEGA 3.1軟件,將MaSIP2-1 cDNA推導(dǎo)的氨基酸序列與NCBI中已登錄的其它植物的SIP氨基酸序列進(jìn)行系統(tǒng)進(jìn)化樹的比對(duì)分析。結(jié)果(圖2)表明,本研究得到的 巴西蕉MaSIP2-1基因所編碼的氨基酸序列與馬來(lái)西亞野生蕉MaSIP2-1-like具有較近的親緣關(guān)系。

圖2 不同植物SIP2-1氨基酸序列的系統(tǒng)樹分析
2.2 MaSIP2-1在香蕉不同器官中的表達(dá)特性
MaSIP2-1在香蕉的根、莖、葉片、花和果實(shí)各器官中均有所表達(dá),其中在莖中表達(dá)量較高,是葉中表達(dá)量的12.22倍。在葉中的表達(dá)量最低為1,而在根、花和果實(shí)中表達(dá)量分別為3.83和1.3(圖3)。

圖3 MaSIP2-1在香蕉不同器官中的qPCR表達(dá)分析
2.3 MaSIP2-1基因在非生物脅迫處理下的表達(dá)分析
為了研究MaSIP2-1基因是否響應(yīng)外界非生物脅迫,利用qPCR對(duì)MaSIP2-1在干旱、高鹽、低溫、水澇脅迫處理下葉片中的表達(dá)模式進(jìn)行分析,如圖4所示,在干旱處理下,MaSIP2-1在土壤水分含量為60%是表達(dá)量最高,隨著水分含量降低,其表達(dá)量逐漸受到抑制。用300 mmol/L高鹽對(duì)香蕉幼苗進(jìn)行脅迫處理,于0、2、4 和6 h分別取樣,如圖5所示,MaSIP2-1在高鹽脅迫處理4 h時(shí)被高度誘導(dǎo)表達(dá),隨后其表達(dá)量又下降,呈現(xiàn)先升后降的趨勢(shì),其在4 h的表達(dá)量分別為0、2和6 h的12.72、6.10和1.71倍。
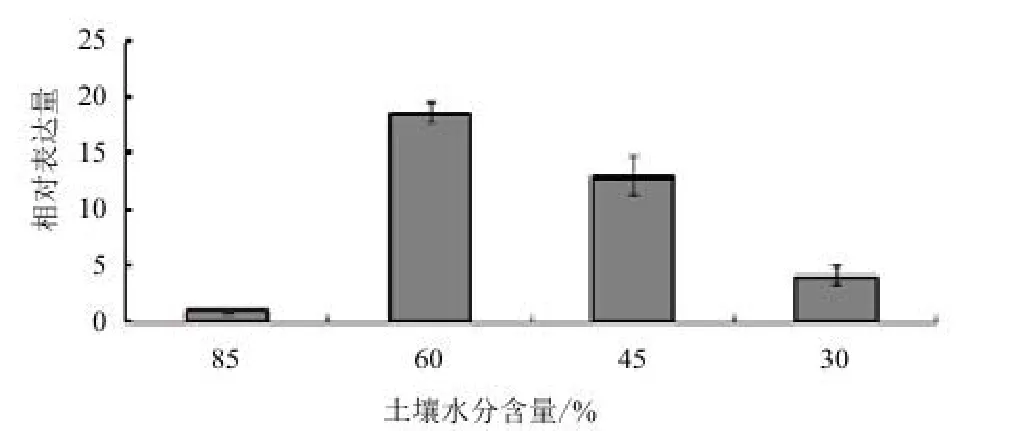
圖4 MaSIP2-1在干旱脅迫下的差異表達(dá)

圖5 MaSIP2-1在高鹽脅迫下的差異表達(dá)
對(duì)其進(jìn)行低溫脅迫處理,如圖6所示,隨著溫度的降低,MaSIP2-1的表達(dá)量均沒(méi)有呈現(xiàn)太大的變化,表達(dá)量均在1以下,其并未受到溫度的誘導(dǎo)表達(dá)。
在澇害脅迫處理下,如圖7所示,將香蕉苗淹水處理24 h后,其表達(dá)量達(dá)到最高值為2.13,而在處理36 h后其表達(dá)量反而達(dá)到最低值,說(shuō)明淹水處理24 h時(shí)能夠高度誘導(dǎo)MaSIP2-1的表達(dá)。
3 討論
許多研究表明,水通道蛋白基因的表達(dá)和生物活性受到包括非生物脅迫,植物激素等許多信號(hào)的影響[6,10,16-19]。其響應(yīng)非生物脅迫的調(diào)控及生物學(xué)功能是十分復(fù)雜的,在許多轉(zhuǎn)基因植株中,已經(jīng)證明了一些水通道蛋白能夠提高對(duì)非生物脅迫的耐受性[7,9,20-22]。例如,在擬南芥中過(guò)表達(dá)MaPIP1;1提高了轉(zhuǎn)基因擬南芥對(duì)干旱和高鹽脅迫的響應(yīng),而且轉(zhuǎn)基因株系的根系增長(zhǎng),根毛增多[23]。過(guò)表達(dá)TaAQP8使轉(zhuǎn)基因植株根系在高鹽脅迫下根系伸長(zhǎng)[24]。在高鹽脅迫下,煙草NtAQP1能使轉(zhuǎn)基因植株提高水分利用率[7]。在200 mmol/L NaCl的處理下,大麥 HvPIP2能夠調(diào)節(jié)水分的流失,在非洲爪蟾卵母細(xì)胞中表現(xiàn)出了較強(qiáng)的水轉(zhuǎn)運(yùn)活性[17]。在植物中過(guò)量表達(dá)一些AQP能夠提高轉(zhuǎn)基因植物對(duì)干旱脅迫的耐受性[7,9,22,24]。例如,過(guò)表達(dá)TaAQP7提高了轉(zhuǎn)基因煙草對(duì)干旱脅迫的耐受性[24]。在干旱脅迫時(shí),麻瘋樹根和莖中 JcPIP2被誘導(dǎo)表達(dá)[25]。在擬南芥中轉(zhuǎn)化大麥TaTIP2;2提高了轉(zhuǎn)基因擬南芥對(duì)干旱的響應(yīng),而且這種響應(yīng)是通過(guò)不依賴于ABA的信號(hào)途徑[26]。MusaPIP1;2轉(zhuǎn)香蕉植株中,表現(xiàn)出了較好的抗逆的特性[27]。在Sreedharan 的研究中,將MusaPIP1;2轉(zhuǎn)化香蕉,轉(zhuǎn)基因植株在干旱處理后復(fù)水,其恢復(fù)能力明顯強(qiáng)于野生型。同時(shí),對(duì)其生理生化指標(biāo)進(jìn)行測(cè)定,相對(duì)于對(duì)照其丙二醛含量降低,脯氨酸含量提高,相對(duì)水含量提高,說(shuō)明轉(zhuǎn)基因植株具有較強(qiáng)的抗旱性。
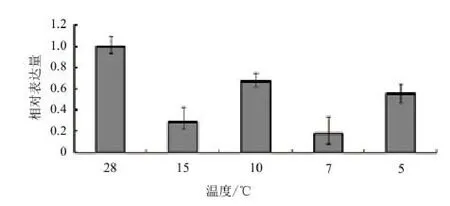
圖6 MaSIP2-1在低溫脅迫下的差異表達(dá)

圖7 MaSIP2-1在水澇脅迫下的差異表達(dá)
本實(shí)驗(yàn)從香蕉中克隆出香蕉水通道蛋白基因MaSIP2-1,為了進(jìn)一步研究MaSIP2-1能否響應(yīng)外界的非生物脅迫,本實(shí)驗(yàn)用干旱、高鹽、低溫以及水澇脅迫處理香蕉幼苗,結(jié)果表明,在干旱脅迫處理下,土壤水分含量為60%時(shí)MaSIP2-1被高度誘導(dǎo)表達(dá),當(dāng)土壤水分減少至45%和30%時(shí),MaSIP2-1表達(dá)下調(diào),說(shuō)明該基因響應(yīng)外界干旱脅迫。在高鹽脅迫處理下,當(dāng)處理2 h時(shí)其表達(dá)量升高,在4 h時(shí)達(dá)到峰值,處理6 h后表達(dá)反而下調(diào),呈現(xiàn)先升后降的趨勢(shì)。該實(shí)驗(yàn)結(jié)果表明MaSIP2-1受到高鹽脅迫的誘導(dǎo)表達(dá)。該結(jié)果與候曉婉等[28]報(bào)道的巴西蕉和粉蕉中MaPIP2-6在甘露醇和高鹽脅迫處理下的表達(dá)趨勢(shì)基本一致,在處理早期輕微下降,而后被誘導(dǎo)達(dá)到最大值,接著下降。結(jié)果表明,該基因在響應(yīng)滲透脅迫的過(guò)程中,可能在早期出現(xiàn)了一個(gè)‘Shock’,隨后呈現(xiàn)出被誘導(dǎo)的趨勢(shì)。而在低溫處理下,該基因的表達(dá)量變化差異不顯著,其表達(dá)量均在1以下,表明其并未受到低溫誘導(dǎo)表達(dá)。在擬南芥中,低溫脅迫能夠誘導(dǎo)AtPIP2;5和AtPIP2;6表 達(dá),卻抑制了AtPIP1;5和AtPIP2;3等基因的表達(dá)[29]。因此,AQP家族成員對(duì)低溫脅迫的響應(yīng)表現(xiàn)出不同的模式。在水澇脅迫處理時(shí),與對(duì)照相比,淹水處理12 h時(shí)MaSIP2-1表達(dá)下調(diào),而處理24 h時(shí)MaSIP2-1被高度誘導(dǎo)表達(dá),達(dá)到峰值,為對(duì)照的2.2倍,隨著處理時(shí)間的增加當(dāng)達(dá)到36 h時(shí),其表達(dá)量下調(diào)達(dá)到最低值,說(shuō)明MaSIP2-1能夠被水澇脅迫誘導(dǎo)表達(dá)。
4 結(jié)論
綜上所述,本實(shí)驗(yàn)中克隆到的香蕉MaSIP2-1屬于AQP家族中SIP亞類中的一個(gè),QPCR實(shí)驗(yàn)表明MaSIP2-1能夠參與非生物逆境脅迫應(yīng)答,響應(yīng)非生物脅迫包括干旱、高鹽和水澇脅迫。
[1]Aharon R, Shahak Y, Wininger S, et al. Overexpression of a plasma membrane aquaporin in transgenic tobacco improves plant vigor under favorable growth conditions but not under drought or salt stress[J]. Plant Cell, 2003, 15:439-447.
[2]Bray EA. Molecular responses to water deficit[J]. Plant Physiol, 1993, 103:1035-1040.
[3]Cheeseman JM. Mechanisms of salinity tolerance in plants[J].Plant Physiol, 1988, 8:547-550.
[4]Blumwald E. Sodium transport and salt tolerance in plants[J]. Curr Opin Cell Biol, 2000, 12:431-434.
[5]Uehlein N, Lovisolo C, Siefritz F. Kaldenhoff:the tobacco aquaporin NtAQP1 is a membrane CO2pore with physiological functions[J]. Nature, 2003, 425:734-737.
[6]Kaldenhoff R, Fischer M. Aquaporins in plants[J]. Acta Physiol, 2006, 187:169-176.
[7]Sade N, et al. The role of tobacco Aquaporin1 in improving water use efficiency, hydraulic conductivity, and yield production under salt stress[J]. Plant Physiol, 2010, 152:245-254.
[8]Eisenbarth DA, Weig AR. Dynamics of aquaporins and water relations during hypocotyl elongation in Ricinus communis L. seedlings[J]. J Exp Bot, 2005, 56:1831-1842.
[9]Gao Z, He X, Zhao B, et al. Overexpressing a putative aquaporin gene from wheat, TaNIP, enhances salt tolerance in tran sgenic Arabidopsis[J]. Plant Cell Physiol, 2010, 51:767-775.
[10]Johanson U, Karlsson M, Johansson I, et al. The complete set of genes encoding major intrinsic proteins in Arabidopsis provides a framework for a new nomenclature for major intrinsic proteins in plants[J]. Plant Physiol, 2001, 126:1358-1369.
[11]Sakurai J, Ishikawa F, Yamaguchi T, et al. Identification of 33 rice aquaporin genes and analysis of their expression and function[J]. Plant Cell Physiol, 2005, 46:1568-1577.
[12]Chaumont F, Barrieu F, Wojcik E, et al. Aquaporins constitute a large and highly divergent protein family in maize[J]. Plant Physiol, 2001, 12:1206-1215.
[13]Maurel C, Verdoucq L, Luu DT, et al. Plant aquaporins:membrane channels with multiple integrated functions[J]. Annu Rev Plant Biol, 2008, 59:595-624.
[14]Liu CW, Fukumoto T, Matsumoto T, et al. Aquaporin OsPIP1;1 promotes rice salt resistance and seed germination[J]. Plat Physiology and Biochemistry, 2013, 63:151-158.
[15]Yang S, Cui L. The action of aquaporins in cell elongation, salt stress and photosynthesis[J]. Sheng Wu Gong Cheng Xue Bao, 2009, 25(3):321-327.
[16]North GB, Nobel PS. Heterogeneity in water availability alters cellular development and hydraulic conductivity along roots of a desert succulent[J]. Ann Bot, 2000, 85:247-255.
[17]Horie T, Kaneko T, Sugimoto G, et al. Mechanisms of water transport mediated by PIP aquaporins and their regulation via phosphorylation events under salinity stress in barley roots[J]. Plant Cell Physiol, 2011, 52:663-675.
[18]Chaumont F, Moshelion M, Daniels MJ. Regulation of plant aquaporin activity[J]. Biol Cell, 2005, 97:749-764.
[19]Bienert GP, et al. Membrane transport of hydrogen peroxide[J]. Biochim Biophys Acta, 2006, 1758:994-1003.
[20]Lian HL, Yu X, Ye Q, et al. The role of aquaporin RWC3 in drought avoidance in rice[J]. Plant Cell Physiol, 2004, 45:481-489.
[21]Guo L, Wang ZY, Lin H, et al. Expression and functional analysis of the rice plasma-membrane intrinsic protein gene family[J]. Cell Res, 2006, 16:277-286.
[22]Zhou S, Hu W, Deng X, et al. Overexpression of the wheat aquaporin gene, TaAQP7, enhances drought tolerance in transgenic tobacco[J]. PLoS One, 2012, 7:e52439.
[23]Xu Y, Hu W, Liu JH, et al. A banana aquaporin gene, MaPIP1;1, is involved in tolerance to drought and salt stresses[J]. BMC Plant Biology, 2014, 14:59.
[24]Hu W, Yuan Q, Wang Y, et al. Overexpression of a wheat aquaporin gene, TaAQP8, enhances salt stress tolerance in transgenic tobacco[J]. Plant Cell Physiol, 2012, 53:2127-2141.
[25]Jang HY, Yang SW, Carlson JE, et al. Two aquaporins of Jatropha are regulated differentially during drought stress and subsequent recovery[J]. J Plant Physiol, 2013, 170(11):1028-1038.
[26]Xu CH, et al. Heterologous expression of the wheat aquaporin gene TaTIP2;2 compromises the abiotic stress tolerance of Arabidopsis thaliana[J]. PLoS One, 2013, 8(11):e79618.
[27]Sreedharan S, Shekhawat UK, Ganapathi TR. Transgenic banana plants overexpre ssing a native plasma membrane aquaporin MusaPIP1;2 display high tolerance levels to different abiotic stresses[J]. Plant Biotechnology Journal, 2013, 11:942-952.
[28]候曉婉, 胡偉, 顏彥, 等. 香蕉MaPIP2-6基因的克隆、亞細(xì)胞定位及表達(dá)分析[J]. 西北植物學(xué)報(bào), 2015, 35(3):427-433.
[29]Jang JY, Kim DG, Kim YO, et al. An expression analysis of a gene family encoding plasma membrane aquaporins in response to abiotic stresses in Arabidopsis thaliana[J]. Plant Molecular Biology, 2004, 54(5):713-725.
(責(zé)任編輯 狄艷紅)
Molecular Cloning and Expression Analysis of Aquaporins SIP2-1 Gene from Banana
XU Yi1,2HOU Xiao-wan3XU Bi-yu2JIN Zhi-qiang1,2HU Wei2SONG Shun1
(1. Hainan Key Laboratory of Banana Genetic Improvement,Haikou Experimental Station,Chinese Academy of Tropical Agricultural Sciences,
Haikou 570102;2. Key Laboratory of Biology and Genetic Resources of Tropical Crops,Institute of Tropical Bioscience and Biotechnology(Ministry of Agriculture),Chinese Academy of Tropical Agricultural Sciences,Haikou 571101;3. South Subtropical Crops Research Institute,Chinese Academy of Tropical Agricultural Sciences,Zhanjiang 524091)
In the present study,we isolated an aquaporin gene from banana,and designated as MaSIP2-1. MaSIP2-1’s complete ORF was 717 bp,and it encoded 239 amino acids. Alignment of amino acid sequences and phylogenetic analysis indicated that the protein encoded by MaSIP2-1 was in high similarity with AQP-encoding protein in the other known plants;and highly homologous with amino acid sequences in Musa acuminate,Elaeis guineensis,Jatropha curcas,and Camellia sinensis by 98%,74%,65%,and 63%,respectively. Organ-specific analysis showed that MaSIP2-1 constitutively expressed in roots,stems,leaves,flowers and fruits,and the highest in stems. Stress analysis demonstrated that MaSIP2-1 responded to the stress such as the drought,salt and waterlogging.
aquaporins;SIP;banana;bioinformatics;stress;real-time PCR
10.13560/j.cnki.biotech.bull.1985.2016.07.012
2015-10-22
國(guó)家自然科學(xué)基金項(xiàng)目(31071788,31501371),海南省自然科學(xué)基金項(xiàng)目(314099),現(xiàn)代農(nóng)業(yè)產(chǎn)業(yè)技術(shù)體系建設(shè)專項(xiàng)資金項(xiàng)目(CARS-32),“十二五”農(nóng)村領(lǐng)域國(guó)家科技計(jì)劃項(xiàng)目(2011AA10020605)
許奕,女,碩士,研究方向:作物遺傳育種;E-mail:lukydog163@163.com
宋順,男,碩士,研究方向:作物遺傳育種;E-mail:sss1984006@163.com

