赤霉素在非生物脅迫中的作用
蔣超盧天成李毅丹姚丹
(1. 吉林農業大學生命科學學院,長春 130118;2. 吉林省農業科學院農業生物技術研究所,長春 130033)
赤霉素在非生物脅迫中的作用
蔣超1盧天成1李毅丹2姚丹1
(1. 吉林農業大學生命科學學院,長春 130118;2. 吉林省農業科學院農業生物技術研究所,長春 130033)
赤霉素作為重要的植物激素,在植物種子萌發、葉片伸展、莖和根的伸長、開花調控和果實形成等方面均起到了調控的作用。近年來,越來越多的研究證實赤霉素還參與了植物耐受諸多非生物脅迫的過程。在低溫、高鹽、干旱和高滲等環境脅迫下,植物可通過赤霉素減少的方式使生長減緩從而適應外界環境;與此相反,植物也會通過赤霉素的增加產生逃離機制,從而擺脫水淹等環境脅迫。另外,赤霉素信號途徑中的DELLAs會與ABA信號通路中的某些組分共同參與了植物耐受非生物脅迫的調控過程。對赤霉素調控參與非生物脅迫響應過程的研究成果進行了整理和匯總,試圖通過討論相關機理機制,明確赤霉素與非生物脅迫響應的未來研究方向。
赤霉素;非生物脅迫;合成代謝;信號傳導;調控基因
赤霉素(gibberellins,GAs)是一類以四環二萜結構為主體的植物激素,20世紀初由日本學者發現[1]。GAs在植物生長發育中具有十分重要的作用,不僅能夠促進植物組織的生長發育[2],而且還能影響某些生長發育關鍵階段的啟動。例如,種子休眠狀態向萌發狀態的改變[3],幼苗階段向成熟階段的轉變[4],以及營養發育向生殖發育的過渡[5]等。具有生物活性的GAs在生物體中的主要存在形式是GA1/GA3/GA4/GA7,它們通常存在于發育旺盛的組織中,如莖尖、根尖分生區和種子中,而在成熟的組織中含量較少[6]。
最近對GAs的研究發現,GAs合成與信號途徑中的相關基因及調控蛋白與植物的抗逆性有著密切的關聯。植物可通過對赤霉素相關代謝基因的表達調控來適應外界不利的環境,如合成代謝相關基因GA20oxs、GA3oxs和GA2oxs及DELLAs等GAs信號傳導相關蛋白等[4,7,8]。本文將近年來GAs調控參與植物耐受非生物脅迫的相關研究結果進行匯總,對已發現和闡明的相關機理進行整理和討論,期望進一步明確GAs參與植物耐受非生物脅迫的未來研究方向。
1 赤霉素的生物合成與信號傳導
GAs的生物合成起始于葉綠體前體中,由合成前體GGPP(trans-geranylgeranyl diphosphate)經過CPS(ent-copalyl diphosphate synthase)和KS(entkaurene synthase)催化的兩步酶促反應生成entkaurene,而后ent-kaurene進入內質網中并由細胞色素P450單加氧酶KO(ent-kaurene oxidase)和KAO(ent-kaurenoic acid oxidase)氧化形成GA12,并由GA12通過雙加氧酶GA 13-oxidase(GA13ox)催化形成GA53,之后GA53在GA 20-oxidase(GA20ox)作用下產生活性赤霉素的前體GA20,GA20通過GA 3-oxidase(GA3ox)分別生成GA1和GA3;另一條途徑是GA12經過GA20ox生成GA4的前體GA9之后在GA3ox作用下生成GA4。GAs合成過程中,GA20ox和GA3ox是關鍵合成酶,并且GA3ox是使GAs具有活性的作用酶[6]。除了合成途徑之外,GAs還需要通過失活途徑來調節植物體內GAs的水平,從而保證植物正常生長。已確定的赤霉素失活機制中最普遍的就是2-β羥基化。與此相關的酶是2ODDs(2-oxoglutarate-dependent dioxygenases)家族中的GA 2-oxidases(GA2oxs)。GA2oxs通過對GAs及其前體的2β羥基化最終影響GAs的合成。另有研究發現,GA20ox和GA3ox受到活性GA水平的負反饋調節,而GA2ox受到GA水平的正反饋調節[6,9-11]。
GAs的生物學作用是通過GA-GID1-DELLAs信號傳遞過程最終實現的,其中DELLAs蛋白作為生長抑制蛋白會抑制植物生長,而赤霉素信號途徑則可通過復合物之間的相互作用最終影響DELLAs,從而影響植物生長。具體過程如下,活性GAs通過與 GID1(GIBBERELLIN INSENSITIVE DWARF 1)受體結合,導致受體蛋白構象的改變,GAs-GID1復合物再與DELLA的N端保守區域相結合,進而GID1-DELLA復合物與SCF泛素化連接酶反應,使DELLA泛素化,并被26S蛋白酶降解,DELLA對植物生長的抑制得以解除。
2 GAs與逆境脅迫
2.1 鹽脅迫
Na+形成的鹽類物質所造成的鹽脅迫會嚴重影響植物的生長發育,致使植物生長速率減慢,含水量降低,葉面積減少,光合作用受到影響[12,13]。有研究發現赤霉素合成及信號傳導途徑參與了植物感知與抵御鹽脅迫的過程。在水稻中的研究發現,GA2ox5過表達會增強水稻的耐鹽性。而當外施GA3后,其耐鹽性消失。這一結果證明了植物可通 過減少活性GAs的方法來提高耐鹽性[14]。在擬南芥的研究中也發現,在過表達ddf1基因的擬南芥中,GA2ox7基因的表達水平增加,從而導致植物矮小,鹽耐性提高[15]。在對擬南芥線粒體磷酸轉移體(MPT)的研究中發現,過表達MPT的擬南芥對鹽的敏感程度升高。進一步研究發現轉基因組控制GAs合成的GA20ox1/2/3和GA3ox1/4的表達量上升,而控制GAs分解的GA2oxs的表達量下降[16]。這些結果證明了GAs合成代謝的關鍵酶GA20ox、GA3ox和GA2ox參與到了植物的耐鹽響應中,編碼這些酶的基因的表達情況會影響植物對鹽脅迫的耐受程度。另有研究發現擬南芥中DELLA蛋白的積累,會減少鹽脅迫誘導的ROS所產生的生理傷害。分析原因是由于DELLAs蛋白會誘導一系列解毒酶的表達,其中包括Cu2+/Zn2+超氧化物歧化酶、過氧化氫酶、氧化物酶和谷胱甘肽S基轉移酶。該研究還發現GAI蛋白(DELLA蛋白亞家族的一種)的過量表達對ROS具有抵御作用[17]。在鹽脅迫條件下,擬南芥della突變體材料則更容易受到鹽環境的影響[18]。這一研究表明,GAs的信號傳導途徑也參與了植物的耐鹽響應過程,并且在植物耐鹽應答中起到了關鍵的作用。
2.2 干旱脅迫
植物對干旱脅迫的應答是一個復雜的機制,多種調控因子、功能基因及植物激素均參與其中。ABA一直是植物耐旱響應研究中的重點[19,20]。而最近一系列對GAs及其相關基因在耐旱響應中作用的研究,有助于人們更加清楚的了解植物耐受干旱脅迫的激素調控和應答網絡。
番茄中過表達轉錄調控因子SlDREB,發現轉基因材料對干旱脅迫的抗性增強。進一步研究發現轉基因材料中赤霉素的合成酶基因SlCPS、SlKS、SlGA20ox1、SlGA20ox2和SlGA20ox4的表達量均下降,活性GAs含量也明顯降低,同時伴有植株矮小、葉片伸展及莖長減少等表型變化[21]。另有研究發現,擬南芥中CBF/DREB2轉錄因子對AtGA2ox7基因的表達有正向調節作用,過表達轉錄因子可同時促進AtGA2ox7基因的表達,進而導致活性GAs的含量降低,達到提高抗旱性的作用[22]。最新的研究發現赤霉素合成途徑中的P450單加氧酶家族的CYP96B4/ SD37與水稻的耐旱性有關,該基因突變體dss1的耐旱性要明顯強于野生型,其原因是由于體內GA1含量減少造成的[23]。目前,我們對玉米的研究中也發現了干旱脅迫下的一些GAs相關合成代謝基因轉錄水平上的變化,其中ZmGA2ox3、ZmGA2ox6、ZmGA2ox7和ZmGA2ox10基因,在葉片中轉錄水平上調,而在根中則出現轉錄下調(未發表數據)。根據相關研究結果推測,在玉米葉片中干旱脅迫引起GA2ox類基因表達上調,促進GAs分解,使葉片長度以及葉面積減少,從而減少水分散失;而在根中干旱脅迫引起GA2ox類基因的轉錄下調,減少GAs分解,促進了根的伸長,從而有機會獲取更多水分。這與水稻和小麥中的研究結果非常相似[24,25]。不僅GAs合成代謝調控基因參與了植物耐旱響應,GAs的信號傳導途徑也參與了該過程,并且與ABA信號途徑形成了聯系。對擬南芥中耐旱相關基因XERICO的研究發現,XERICO基因不但參與ABA代謝,而且還是DELLA蛋白的下游目的基因之一[26]。除此之外,MYB和WRKY27等ABA信號中應對干旱等非生物脅迫的關鍵元件,也受DELLA蛋白調控[6,9]。這就說明DELLA蛋白可能作為植物干旱脅迫的調控節點,在GAs信號與ABA信號間起聯系作用。
2.3 低溫脅迫
植物應答低溫脅迫是個復雜的過程。近期的研究發現赤霉素相關基因也參與了植物耐低溫的調控過程。CBF/DREB1是植物對低溫脅迫適應過程中的最重要元件[27]。研究發現,在過表達CBF1基因的擬南芥中,CBF1誘導的COR15b發生過量表達提高了植物耐寒性,但也減緩了植物的生長,造成植株矮小。這種植株矮小表型,可通過外施GAs得到消除[28]。基于這些結果進一步分析發現CBF1的表達使DELLA蛋白家族中的GAI和RGA產生積累。而DELLA蛋白作為赤霉素信號通路中的重要元件,其量的積累會造成植株矮化。由于外施GAs可以消除矮化表型,因此DELLA的積累應該源于GAs合成量的降低。對GAs合成相關基因的分析發現CBF1轉基因材料中,GA2ox3和GA2ox6基因表達出現了上調,抑制了活性GAs的合成[29]。這一研究說明,在植物耐低溫的響應中,赤霉素合成代謝和信號傳導過程緊密參與其中,并直接影響了植物表型。
2.4 水淹脅迫
水稻面臨水接受時的生存策略證明了GA信號在水淹脅迫中的作用[25]。水稻水淹條件下的應答模式分為兩種,即逃離模式和耐受模式[30]。通常在淺灘或短期水淹的環境下,會誘發水稻的逃離機制,節間會快速伸長生長。這種應答使得地上部分露出水面。節間的伸長是由SNORKAL1和SNORKAL2應答乙烯積累引起的[31]。這兩個基因的表達直接或間接的提高了活性GAs的水平。與此相對,Sub1A介導的耐受策略則適用于長時間的水淹環境[32]。在此模式中,水淹脅迫限制了乙烯的水平,低濃度的乙烯誘導Sub1A基因的表達。它的表達抑制了轉基因水稻地上部分生長,這樣糖類大量積累以便于水淹退去時的恢復生長。進一步研究發現,Sub1A的表達正調控了水稻DELLA蛋白SLR1的表達,使該蛋白表達水平上升。SLR1屬于GAs抑制蛋白,它們的積累使水稻活性GAs減少,從而抑制水稻節間伸長[33,34]。這些研究說明,植物耐受水淹脅迫過程,是通過赤霉素合成和信號傳導途徑與乙烯信號傳導途徑共同參與完成的。
3 總結
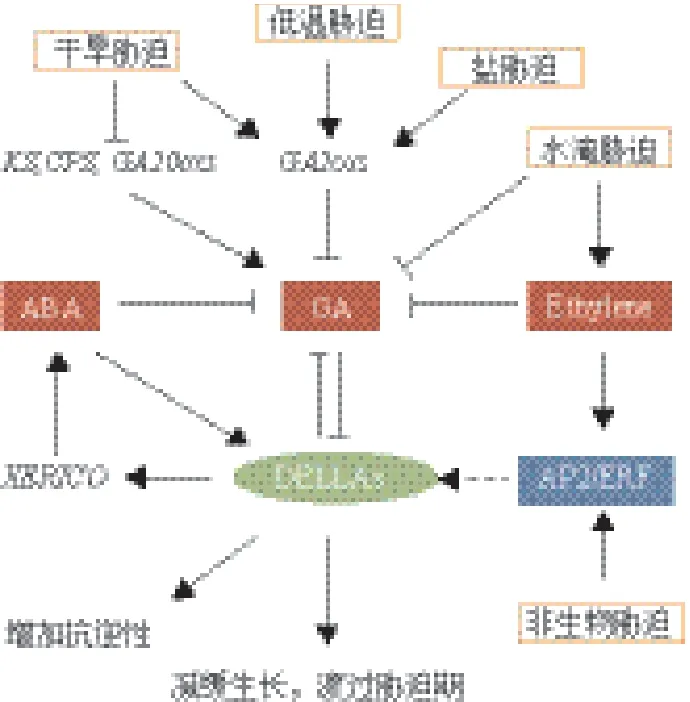
圖1 赤霉素應答非生物脅迫示意圖
植物生長過程中經常要經歷鹽、干旱、低溫等環境脅迫。植物需要通過自身調節來適應周圍環境,這其中就包括植物體內激素的調節。赤霉素作為一類重要的植物激素,已有越來越多的研究發現其合成代謝和信號傳導途徑參與到了植物耐受環境脅迫的過程中,并且處于耐受環境脅迫響應的調控網絡節點位置(圖1)。文中列舉了一系列轉錄因子和功能基因,通過直接或間接的方式與赤霉素代謝相關基因GA2ox、GA3ox和GA20ox,以及赤霉素信號傳導途徑中的DELLA蛋白發生作用,最終影響植物對環境脅迫的耐受性。通過匯總相關研究結果,我們還發現GAs與ABA、乙烯在耐受非生物脅迫過程中有著緊密的聯系。但植物激素還包括生長素、細胞分裂素和茉莉酸等。植物耐受非生物脅迫過程中,赤霉素與這些激素間是否也存在著聯系尚有待深入研究。另外,赤霉素相關基因在不同植物中其基因數量差別較大。以GA2ox基因為例,擬南芥中有8個,水稻中有6個,而在玉米中發現了13個。基因數量的差別造成了基因功能的分化和特化,最終影響不同基因在植物耐受非生物脅迫過程中對赤霉素的調控作用。這方面的研究也有待進一步的加強。
通過本文的匯總和整理,我們初步了解赤霉素在植物耐受非生物脅迫過程中的作用。但由于目前研究有限,仍無法對調控網絡進行精確的詮釋。希望隨著相關研究的深入開展,最終獲知赤霉素參與植物耐受非生物脅迫的應答機制。除此之外,隨著對赤霉素與非生物脅迫相關基因與蛋白的研究還有望應用于作物育種,在明確與植物抗逆相關的候選基因/位點后,可利用分子育種和轉基因手段培育抗逆植物新材料。
[1]李保珠, 趙翔, 安國勇. 赤霉素的研究進展[J]. 中國農學通報, 2011, 27(1):1-5.
[2]Achard P, Gusti A, Cheminant S, et al. Gibberellin signaling controls cell proliferation rate in Arabidopsis[J]. Current Biology:CB, 2009, 19(14):1188-1193.
[3]Seo M, Nambara E, Choi G, et al. Interaction of light and hormone signals in germinating seeds[J]. Plant Molecular Biology, 2009, 69(4):463-472.
[4]Sun TP. Gibberellin-GID1-DELLA:a pivotal regulatory module for plant growth and development[J]. Plant Physiology, 2010, 154(2):567-570.
[5]Eriksson S, Bohlenius H, Moritz T, et al. GA4 is the active gibberellin in the regulation of LEAFY transcription and Arabidopsis floral initiation[J]. The Plant Cell, 2006, 18(9):2172-2181.
[6]Hedden P, Thomas SG. Gibberellin biosynthesis and its regulation[J]. The Biochemical Journal, 2012, 444(1):11-25.
[7]Sakamoto T, Miura K, Itoh H, et al. An overview of gibberellin metabolism enzyme genes and their related mutants in rice[J]. Plant Physiology, 2004, 134(4):1642-1653.
[8]Javid MG, Sorooshzaeh A, Moradi F, et al. The role of phytohormones in alleviating salt stress in crop plants[J]. AJCS, 2011, 5(6):726.
[9]Zentella R, Zhang ZL, Park M, et al. Global analysis of della direct targets in early gibberellin signaling in Arabidopsis[J]. The Plant Cell, 2007, 19(10):3037-3057.
[10]Middleton AM, Ubeda-Tomas S, Griffiths J, et al. Mathematical modeling elucidates the role of transcriptional feedback in gibberellin signaling[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(19):7571-7576.
[11]Rieu I, Eriksson S, Powers SJ, et al. Genetic analysis reveals that C19-GA 2-oxidation is a major gibberellin inactivation pathway in Arabidopsis[J]. The Plant Cell, 2008, 20(9):2420-2436.
[12]楊少輝, 季靜, 王罡. 鹽脅迫對植物的影響及植物的抗鹽機理[J]. 世界科技研究與發展, 2006, 28(4):70-76.
[13]王東明, 賈媛, 崔繼哲. 鹽脅迫對植物的影響及植物鹽適應性研究進展[J]. 中國農學通報, 2009, 25(4):124-128.
[14]Shan C, Mei Z, Duan J, et al. OsGA2ox5, a gibberellin metabolism enzyme, is involved in plant growth, the root gravity response and salt stress[J]. PLoS One, 2014, 9(1):e87110.
[15]Magome H, Yamaguchi S, Hanada A, et al. The DDF1 transcriptional activator upregulates expression of a gibberellindeactivating gene, GA2ox7, under high-salinity stress in Arabidopsis[J]. The Plant Journal:For Cell and Molecular Biology, 2008, 56(4):613-626.
[16]Zhu W, Miao Q, Sun D, et al. The mitochondrial phosphate transporters modulate plant responses to salt stress via affecting ATP and gibberellin metabolism in Arabidopsis thaliana[J]. PloS One, 2012, 7(8):e43530.
[17]Achard P, Renou JP, Berthome R, et al. Plant DELLAs restrain growth and promote survival of adversity by reducing the levels of reactive oxygen species[J]. Current Biology:CB, 2008, 18(9):656-660.
[18]Colebrook EH, Thomas SG, Phillips AL, et al. The role of gibberellin signalling in plant responses to abiotic stress[J]. The Journal of Experimental Biology, 2014, 217(Pt 1):67-75.
[19]Huang XY, Chao DY, Gao JP, et al. A previously unknown zinc finger protein, DST, regulates drought and salt tolerance in rice via stomatal aperture control[J]. Genes & Development, 2009, 23(15):1805-1817.
[20]Bari R, Jones JD. Role of plant hormones in plant defe nce responses[J]. Plant Molecular Biology, 2009, 69(4):473-488.
[21]Li J, Sima W, Ouyang B, et al. Tomato SlDREB gene restricts leaf expansion and internode elongation by downregulating key genes for gibberellin biosynthesis[J]. Journal of Experimenta l Botany, 2012, 63(18):6407-6420.
[22]Kang HG, Kim J, Kim B, et al. Overexpression of FTL1/DDF1, an AP2 transcription factor, enhances tolerance to cold, drought, and heat stresses in Arabidopsis thaliana[J]. Plant Science:An international Journal of Experimental Plant Biology, 2011, 18 0(4):634-641.
[23]Tamiru M, Undan Jr Fau-Takagi H, Takagi H Fau-Abe A, et al. A cytochrome P450, OsDSS1, is involved in growth and drought stress responses in rice(Oryza sativa L. )[J]. Plant M olecular Biology, 2015, 88(1):85-99.
[24]Krugman T, Peleg Z, Quansah L, et al. Alteration in expression of hormone-re lated genes in wild emmer wheat roots associated with drought adaptation mechanisms[J]. Funct Integr Genomics, 2011, 11(4):565-583.
[25]Wang D, Pan Y, Zhao X, et al. Geno me-wide temporal-spatial gene expression profiling of drought responsiveness in rice[J]. BMC Genomics, 2011, 12:149.
[26]Ko JH, Yang SH, H an KH. Upregulation of an Arabidopsis RING-H2 gene, XERICO, confers drought tolerance through increased abscisic acid biosynthesis[J]. The Plant Journal:For Cell And Mol ecular Biology, 2006, 47(3):343-355.
[27]Maibam P, Nawkar GM, Park JH, et al. The Influence of light quality, circadian rhythm, and photoperiod on the cbf-mediated freezing tolerance[J]. International Journal of Molecular Sciences, 2013, 14(6):11527-11543.
[ 28]Kurepin LV, Dahal KP, Savitch LV, et al. Role of CBFs as integrators of chloroplast redox, phytochrome and plant hormone signaling during cold acclimation[J]. International Journal of Molecu lar Sciences, 2013, 14(6):12729-12763.
[29]Achard P, Gong F, Cheminant S, et al. The cold-inducible CBF1 factor -dependent signaling pathway modulates the accumulation of the growth-repressing DELLA proteins via its effect on gi bberellin metabolism[J]. The Plant Cell, 2008, 20(8):2117-2129.
[30]Bailey-Serres J, Voesenek LA. Life in the balance:a signaling network controlling survival of flooding[J]. Curre nt Opinion in Plant Biology, 2010, 13(5):489-494.
[31]Hattori Y, Nagai K, Furukawa S, et al. The ethylene response factors SNORKEL1 and SNORKEL2 allow rice to adapt to deep water[J]. Nature, 2009, 460(7258):1026-1030.
[32]Xu K, Xu X, Fukao T, et al. Sub1A is an et hylene-response-factorlike gene that confers submergence tolerance to rice[J]. Nature, 2006, 442(7103):705-708.
[33]Fukao T, Xu K, Ronald PC, et al. A variable cluster of ethylene response factor-like genes regulate s metabolic and developmental acclimation responses to submergence in rice[J]. The Plant Cell, 2006, 18(8):2021-2034.
[34]Hirano K, Asano K, Tsuji H, et al. Characterization of the molecular mechanism un derlying gibberellin perception complex formation in rice[J]. The Plant Cell, 2010, 22(8):2680-2696.
(責任編輯 狄艷紅)
The Function of Gibberellins Signaling in Responses to Abiotic Stresses
JIANG Chao1LU Tian-cheng1LI Yi-dan2YAO Dan1
(1. School of Life Sciences,Jilin Agricultural University,Changchun 130118;2. Agro-biotechnology Research Institute,Jilin Academy of Agricultural Sciences,Changchun 130033)
Bioactive gibberellins(GAs)as critical plant hormones,play a regulatory role in the diverse aspects of seed germination,leaf expansion,stem and root elongation,flowering,and seed development. Recently,growing research results confirmed that GAs are involved in the response to abiotic stress. Reduction of GA levels and signaling lead to plant growth slowing on exposure to several stresses,including cold,salt,drought,and osmotic stress,which allows plants to adapt to living environment. Conversely,increased GA biosynthesis and signaling happen in plant escape responses to submergence. Additionally,DELLA in GA signaling pathway and some compositions in ABA signal pathway co-regulate the process of plant resisting to abiotic stresses. Here,we sort and summarize the research achievements on the regulation process of GAs in the response to abiotic stresses. The future direction of study on GAs in the response to abiotic stress is attempted to be clarified by discussing the relevant mechanisms.
gibberellins;abiotic stresses;bio-synthesis;signaling;regulatory genes
10.13560/j.cnki.biotech.bull.1985.2016.05.002
2015-08-10
吉林省農業科技創新工程(吉林省科技廳20140204021NY)
蔣超,男,碩士研究生,研究方向:玉米赤霉素代謝調控基因與玉米耐旱相關性;E-mail:hujintao9438@163.com
盧天成,男,博士,副教授,研究方向:作物生理調控、生物免疫;E-mail:xijinping438@163.com

