人體端粒G4-DNA穩定劑的研究進展
鄭小輝,劉海英,夏立新,毛宗萬
(1. 深圳大學醫學院,廣東 深圳 518060;2. 中山大學生命科學學院,廣東 廣州 510006;3. 中山大學化學與化學工程學院,廣東 廣州 510275)
?
人體端粒G4-DNA穩定劑的研究進展
鄭小輝1,2,3,劉海英2,夏立新1,毛宗萬3
(1. 深圳大學醫學院,廣東 深圳518060;2. 中山大學生命科學學院,廣東 廣州510006;3. 中山大學化學與化學工程學院,廣東 廣州510275)
摘要:端粒長度的維持在腫瘤細胞的永生化過程中起到至關重要的作用。約85%的人體腫瘤細胞通過端粒酶延伸端粒,從而獲得持續的增殖能力。另外,15%的人體腫瘤細胞通過端粒替代延伸機制(alternative lengthening of telomeres,ALT)延伸端粒。這兩種機制對于維持腫瘤細胞中端粒的長度具有同等重要的意義。人體端粒由富含鳥嘌呤(G)的DNA重復序列組成, 該序列在特定的條件下可以形成G-四鏈體(G4)的結構。此結構的形成可以從根本上抑制端粒酶和ALT對端粒的延伸而達到抗腫瘤的目的。因此,人體端粒G4-DNA作為抗腫瘤靶點的研究是近年來抗腫瘤研究的重要前沿領域之一。該文重點綜述人體端粒G4-DNA穩定劑研發的最新研究進展。
關鍵詞:癌癥;端粒;端粒酶;端粒替代延伸機制(ALT);G-四鏈體 DNA;有機小分子;金屬配合物
端粒是染色體末端的特異結構,在人類細胞中它是由DNA重復單位(TTAGGG/AATCCC)和結合于其上的端粒結合蛋白(shelterin)組成[1]。端粒保護著染色體末端免受各種酶的攻擊,避免染色體與染色體之間的末端融合,抑制染色體的末端重組,在維持染色體結構和功能的穩定性、完整性方面起著至關重要的作用[1]。但是,由于線性DNA半保留復制中存在的“末端復制問題(end replication problem)”,端粒DNA在細胞分裂的每一個周期都會丟失一小段。在人類細胞中,細胞每分裂一次端粒DNA就會縮短50~300 bp[1]。當端粒DNA縮短到極限長度時,它就失去了保護染色體的功能,從而激活細胞內的DNA損傷信號,細胞進入衰老或凋亡程序。癌細胞的重要特征是能無限分裂,為了避免由端粒縮短引起的細胞衰老、凋亡,約85%癌細胞高表達端粒酶。端粒酶由逆轉錄酶hTERT及RNA模板hTR組成,能以自身RNA為模板合成TTAGGG的序列,添加到端粒末端,從而延長端粒(圖 1A)[2]。Elizabeth、Carol和Jack 3位美國科學家因在關于端粒和端粒酶如何保護染色體方面的發現分享了2009年的諾貝爾生理學和醫學獎。另外大約15%的癌細胞不表達端粒酶(端粒酶陰性腫瘤細胞),它們通過被稱為端粒替代延伸機制(alternative lengthening of telomeres, ALT)來延伸端粒(圖 1B),從而維持端粒長度[3]。
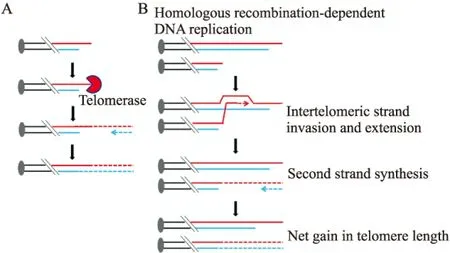
Fig 1 Telomere extension mechanisms of cancer cells
A: Telomerase; B: Alternative lengthening of telomeres (ALT)
1962年,美國科學家Gellert和Davies等發現, 人體端粒富含鳥嘌呤(G)的3′-overhang DNA單鏈,在一定條件下可以由自身4個G通過Hoogsteen氫鍵自組裝成G-四分體 (Fig 2A),多個G-四分體通過π-π堆積作用進而形成G-四鏈體DNA(G4-DNA)(Fig 2B)。與此同時,大量的研究表明,無論是端粒酶還是ALT,在延伸端粒時均需要以鏈狀的端粒DNA序列為模板。這種G4-DNA的形成對端粒酶或ALT活性均具有明顯的抑制作用。因此人體端粒G4-DNA被認為是潛在的抗癌藥物重要新靶點[4]。自從人們發現人體端粒G4-DNA是潛在的抗癌靶點以來,該領域吸引了越來越多科研工作者的重視:大量的研究工作證實,體內G4-DNA的存在并具有非常重要的生物相關性,除了端粒保護外,可能還與 DNA 復制相關的疾病以及染色體的排列重組等有一定的關系[5]。同時許多能穩定該結構的小分子化合物被設計和合成[5-8]。這些小分子化合物能通過誘導端粒G4-DNA的形成并進一步的穩定該結構,從而抑制端粒酶/ALT活性和腫瘤細胞生長,最終達到抗癌效果。該文將結合我們的研究工作,對人體端粒G4-DNA穩定劑作為抗腫瘤藥物的研究進展進行綜述。
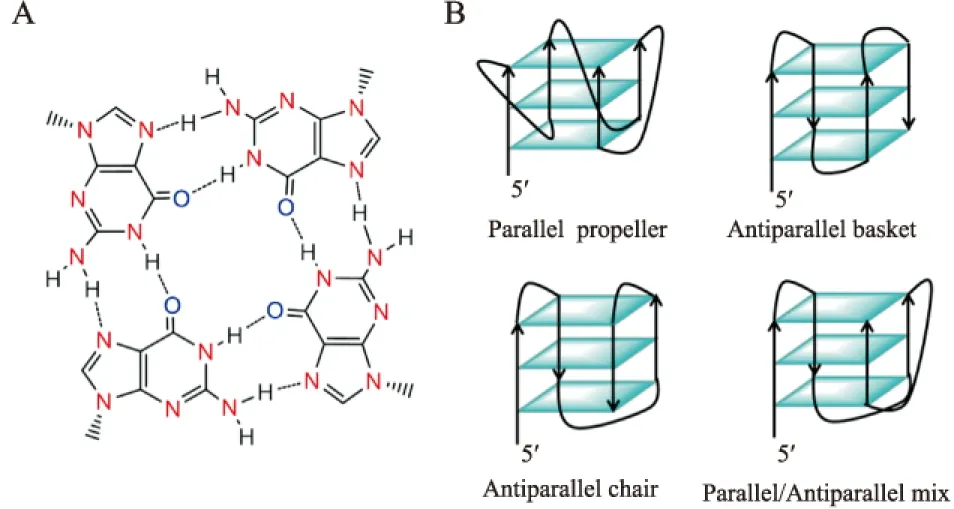
Fig 2 G - tetrad (A) and different conformations of G-quadruplex (B)
1有機小分子化合物
近年來,根據人體端粒G4-DNA 的結構特點及G4-DNA 與小分子相互作用時可能采取的作用模式,很多小分子化合物被設計和開發出來作為人體端粒G4-DNA的穩定劑。2,6-二酰胺蒽醌衍生物(2,6-diamidoanthraquinone)是第1例人體端粒G4-DNA穩定劑,并能有效地抑制端粒酶的活性(IC50≈23 μmol·L-1)[9]。從環圈鏈霉菌(streptomyces anulatus) 3533-SV4分離出來的天然產物端粒酶抑制素(telomestatin)不但對人體端粒G4-DNA具有很強的穩定能力,而且是目前最強的端粒酶活性抑制劑(IC50≈5 nmol·L-1)[10]。隨后,越來越多的有機合成小分子化合物作為人體端粒G4-DNA穩定劑,進而發揮抗腫瘤效果被報道(圖3)[5-8]。例如:triazine12459 通過穩定人體端粒G4-DNA能夠加速端粒長度的縮短[11];BRACO19通過誘導人體端粒3' G-overhang 形成穩定的G4結構,進而抑制端粒酶的活性(IC50≈0.06 μmol·L-1),同時能引起癌細胞快速的復制性衰老和相關DNA的斷裂[12];吖啶類衍生物RHPS4能夠誘導強烈的端粒DNA的損傷,動物實驗表明,當其與紫杉醇聯合用藥時,可以有效地治療小鼠的子宮癌[13]。360A能夠有效地穩定人體端粒G4-DNA,雖然它不能有效地促使端粒的縮短,但是用360A處理ALT細胞時能夠造成端粒末端的融合,導致癌基因的不穩定,進而達到抗腫瘤的效果[14];Pyridostatin 是一個非常優秀的人體端粒G4-DNA穩定劑,它能靶向性地穩定人體端粒G4-DNA,同時能夠定點地在端粒處產生大量的DNA損傷,進而加速端粒的縮短速率,最終導致癌細胞的死亡[15];卟啉衍生物TMPyP4,對多種G4-DNA都具有很強的親和力,但選擇性不強:TMPyP4既能穩定端粒G4-DNA也能穩定c-myc啟動子區域G4-DNA。TMPyP4對乳腺癌細胞MX-1和前列腺癌細胞PC-3表現出很好的抗癌活性和端粒酶活性抑制能力(IC50≈6.5 μmol·L-1)[16]。

Fig 3 The representative compounds of small organic molecules which act as G-quadruplex stabilizers
通過對這些已報道的人體端粒G4-DNA穩定劑的結構的研究,我們發現除了天然產物端粒酶抑制素外,這些有機小分子大部分具有以下特征[5]:(1)一個較大的芳香性的平面,這有利于和G-四分體之間的π-π堆積作用; (2)帶有末端是胺基(包括季胺鹽)的短烷基側臂,在生理pH條件下帶正電荷,這有利于與G4-DNA上的溝槽區或loop區結合;(3)分子體積較小和分子本身均具有一定的柔韌性,因此化合物在與G4-DNA的作用過程中就可以適當地調整自身構象與之匹配,從而達到特異性識別人體端粒 G4-DNA,甚至對不同G4-DNA拓撲構型之間也有一定的識別。
2無機金屬配合物
人體端粒G4-DNA 的誘導劑除了有單純的有機小分子化合物 (占絕大部分)外,還有少量的金屬配合物[7]。盡管與有機小分子相比較來說,金屬化合物作為人體端粒G4-DNA 的穩定劑的研究開始比較晚,但是由于金屬配合物具有很多有機小分子難以比擬的優點:更易獲得,更豐富的幾何結構及電化學性質,同時還具有光學、磁學以及催化等多種性能;其次在結合模式方面,除了常規的π-π 堆積作用之外,金屬配合物還能通過與堿基或者磷酸骨架形成共價鍵的方式穩定 G4結構[17]。金屬配合物所擁有的這些優勢,使得無機金屬配合物在人體端粒G4-DNA的穩定劑中占據了不容忽視的地位。G4-DNA 的金屬穩定劑主要可以分為以下幾大類:(1) 以大環化合物為配體的金屬配合物,如金屬-卟啉化合物、金屬-酞菁化合物和金屬-可咯(Corrole)化合物等;(2)以非大環平面分子為配體的金屬配合物,如金屬-salphen 配合物、金屬-多吡啶配合物、金屬-雙喹啉配合物等;(3)金屬超分子化合物;(4)與G4-DNA 共價結合的金屬配合物;(5)能通過氧化還原反應損傷G4-DNA 的金屬配合物等。其中卟啉類金屬配合物(圖 4A)(作為以大環化合物為配體的金屬配合物中的一個典型代表)作為第一個被開發出來作為 G4-DNA 的穩定劑的金屬配合物,通過大量的科研實驗和計算機模擬實驗發現該類配合物與G4-DNA的相互作用的方式主要為末端 π-π 堆積(與其配體卟啉相似)[18],且經過修飾(如連接上一些帶正電荷的基團)的卟啉能增加金屬卟啉對人體端粒G4-DNA的結合力和選擇性之外,還能增加體外抑制端粒酶活性的能力。另一大類金屬G4-DNA的穩定劑是以非大環類平面型化合物為配體的金屬配合物,以Vilar R 課題組發表的 Ni-salphen 配合物為代表(圖 4B)[19]。從結構上可知,該配合物除了具有良好的中心缺電子平面外還帶有兩個正電荷側臂,實驗數據顯示,該配合物除了具有較優異的人體端粒G4-DNA 的穩定能力(ΔTm=33 ℃,1 μmol·L-1)外,同時還擁有不錯的G4-DNA 的選擇能力,其對G4-DNA的選擇能力是雙鏈 DNA 的50倍,此外還具有不錯的體外端粒酶活性的抑制能力 (IC50=0.12 μmol·L-1)。隨著越來越多的無機金屬配合物被開發作為 G4-DNA 的穩定劑,除了普通的金屬離子外,一些貴金屬離子 (如Pt2+)也逐漸被采用。其中單邊修飾鄰菲咯啉鉑(Ⅱ) 配合物(圖 4C)是由Vilar R課題組報道的,盡管該配合物不但帶有一個正電荷側臂而且中心也擁有不錯的平面性,但是總體來說:其擁有不錯的體外G4-DNA 穩定能力 (ΔTm=20 ℃, 1 μmol·L-1),較差的端粒酶活性抑制能力(IC50=49.5 μmol·L-1)[20]。除此之外,三聯吡啶類化合物(圖 4D)也是比較常見的多吡啶類 G4-DNA 的穩定劑,實驗數據表明該配合物修飾了一個帶正電荷的環狀胺基側鏈之后,不但增強了該配合物的水溶性,而且大大提高了配合物對 G4-DNA 的相互作用能力;實驗結果表明,該配合物能有效地穩定人體端粒 G4-DNA和啟動子c-myc G4-DNA,但是其對G4-DNA 和雙鏈DNA之間的選擇性并不高。金屬超分子化合物則是利用超分子自組裝的方法來構建能做為G4-DNA 的穩定劑的金屬配合物[21]。圖 4E是1例非常優秀的人體端粒G4-DNA的穩定劑——四核鉑(Ⅱ)配合物,該配合物是Sleiman課題組通過 4′,4-聯吡啶和乙二胺構建的四核鉑(II)配合物,計算機擬合和實驗數據均表明該配合物能通過π-π末端堆積的方式很好的穩定端粒G4結構,同時具有優異的體外端粒酶活性抑制能力(IC50=0.2 μmol·L-1)[22]。除了Pt2+配合物外,Ru2+配合物也廣泛的應用于G4-DNA穩定劑的研究[23]。圖 4F 是國內計亮年教授課題組早年報道過的具有八面體構型的Ru(II)多吡啶配合物,實驗結果表明,在沒有金屬離子存在的情況下,該配合物能有效的誘導富G序列形成反平行結構的G4-DNA,熒光光譜證實該配合物對G4-DNA具有一定的選擇性 (其對人體端粒G4-DNA 的結合常數要比雙鏈DNA 高出一個數量級左右),計算機模擬推測該配合物與G4-DNA 是以1 ∶1 的末端堆積方式結合的。
Fig 5中的一系列單核、雙核、三核及四核鉑(II)配合物則是由我們課題組報道的,實驗研究發現,通過改變橋聯配體的尺寸以及側臂輔助配體的親疏水性,不但可以有效地提高此類配合物對人體端粒G4-DNA 的親和力以及選擇性,而且還可以有效地提高該類配合物對端粒酶活性的抑制能力。其中我們課題組報道的鄰菲羅啉(II)配合物能有效地穩定人體端粒G4-DNA[24]。緊接著我們課題組報道了1例帶1個正電荷側臂的鉑(Ⅱ)三聯吡啶配合物, 該配合物對人體端粒G4-DNA具有很強的作用力, 但是相對于雙鏈DNA其選擇性不高,所帶的季銨鹽側鏈一方面增強了配合物的水溶性,另外其正電荷促進了配合物和G4-DNA之間的相互作用[25]。然后我們課題組合成了2個V形雙核鉑(II)配合物,它們具有較強的人體端粒G4-DNA穩定能力(ΔTm=34.5℃, 0.5 μmol·L-1)和較高的端粒酶活性抑制能力(IC50=360 nmol·L-1)[26]。為了進一步提高鉑(II)配合物對G4-DNA選擇和穩定能力,我們還設計合成了一系列三核和四核鉑(II)配合物。結果表明,多核鉑(Ⅱ)配合物擁有更高的抗腫瘤活性和更強的G4-DNA結合能力,特別是它們通過末端π-π堆積、溝槽和loop 的結合模式能有效地誘導人體端粒G4-DNA構型的轉變;無論是對人體端粒G4-DNA的選擇和穩定能力(ΔTm>34℃, 0.2 μmol·L-1和Kb=108mol·L-1·s-1),還是對端粒酶活性的抑制能力(IC50=25 nmol·L-1), 都要遠強于已報道的大多數配合物,具有良好的抗腫瘤活性[27-30]。以上只是例舉了幾種比較典型的金屬配合物作為G4-DNA的穩定劑,除此之外,還有許多金屬配合物被研究出來作為人體端粒G4-DNA的穩定劑。

Fig 4 The representative complexes of metal complexes which act as G-quadruplex stabilizers
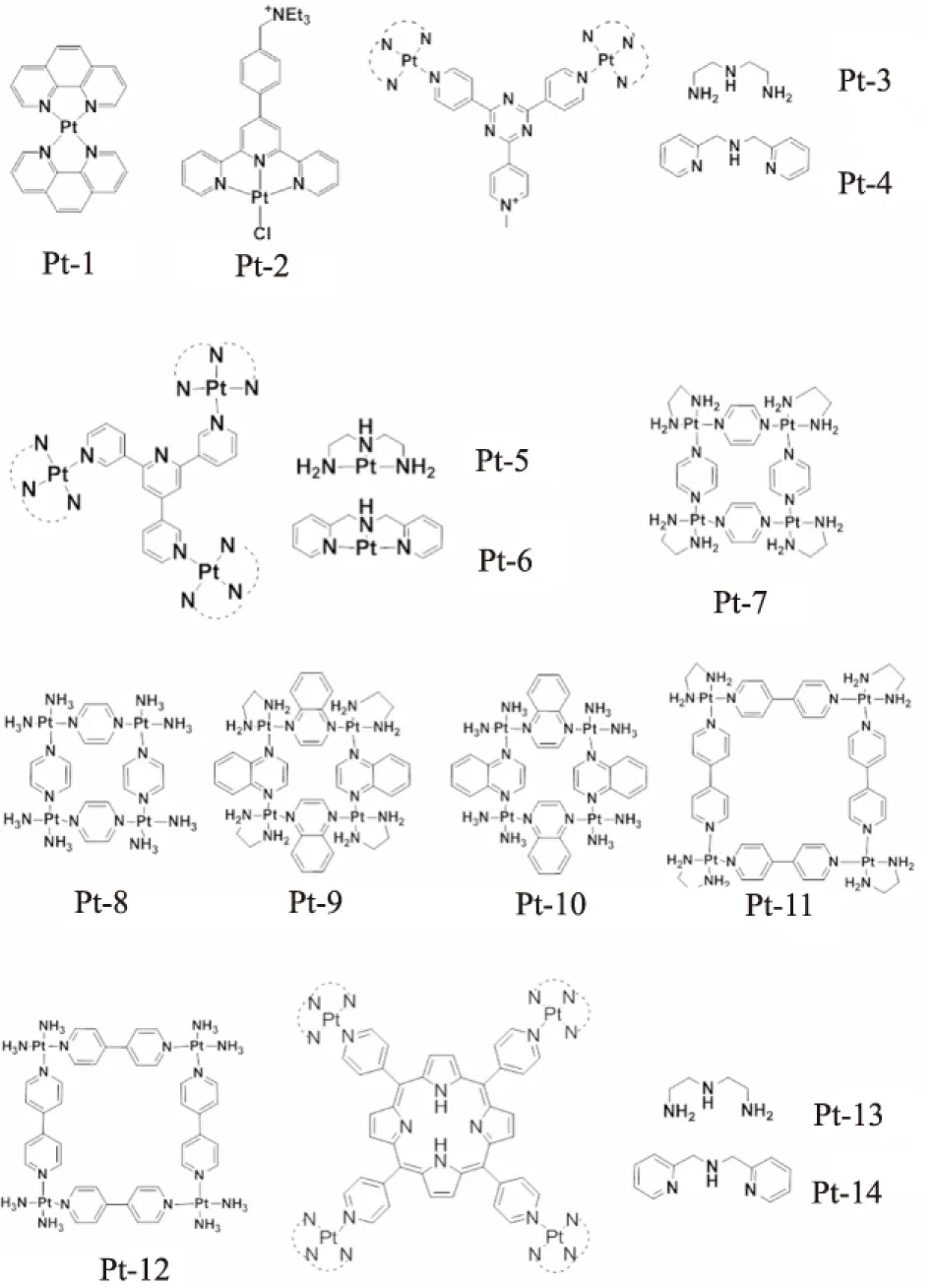
Fig 5 A series of multinuclear Pt(II) complexes as G-quadruplex stabilizers
3總結與展望
人體端粒G4-DNA的出現與許多重要的生理過程密切相關,以G4-DNA為抗腫瘤藥物作用靶點對化合物進行篩選和結構設計是目前化學家和生物學家密切關注的熱點。人體端粒G4-DNA是一種以核酸為基礎的調控機制,調節端粒的長度和穩定性,同時還參與基因的轉錄、復制和翻譯過程。因此以人體端粒G4-DNA為靶點的抗癌藥物應該是最具發展前景的抗癌藥物,因為此類藥物可以從根本上抑制癌細胞的產生、 發展和增殖。與此同時,人體端粒G4-DNA作為具有特殊生物功能的DNA二級結構,以它為靶點來設計新的抗癌藥物具有一定的合理性與優越性,主要體現在以下幾方面:① 獨特的生物學功能:不同于雙鏈DNA是遺傳信息的攜帶者,端粒G4-DNA具有其特殊的生物學功能,小分子化合物通過穩定、 解旋或改變其拓撲結構等,可以達到特異性的靶向腫瘤細胞,進而發揮抗腫瘤的效果;② 獨一無二的結構:G4-DNA具有其結構的特殊性,使之可以很好的與普遍存在的雙鏈DNA區別開來,如此特殊的結構可以為有選擇性的小分子化合物提供良好的設計平臺;③ G4-DNA的結構普遍存在于人體端粒末端。隨著廣大科研工作者對人體端粒G4-DNA及其相關領域的研究,人體端粒G4-DNA的結構的多樣性以及不可缺少的生物學功能得到了不斷的詮釋和闡明。更重要的是,人體端粒G4-DNA在體內的真實存在及其重要的生物學功能已被大量的實驗所證實,且已有少數以人體端粒G4-DNA為靶點設計的小分子作為新一代潛在的抗癌藥物進入了臨床研究。盡管現在針對人體端粒G4-DNA 的穩定劑的研究,絕大部分還停留在體外,但是隨著人體端粒 G4-DNA結構和功能的不斷詮釋以及化合物與人體端粒G4-DNA 相互作用的探討和研究方法的進步,人們有望開展更多的體內研究便于進一步研究開發出專一性的 G4-DNA的穩定劑,從而為發展新型抗腫瘤藥物奠定了基礎,同時也提供了機遇。
參考文獻
[1]Muller S, Rodriguez R. G-quadruplex interacting small molecules and drugs: from bench toward bedside [J].ExpertRevClinPharmacol, 2014, 7(5): 663-79.
[2]Greider C W, Blackburn, E H. Identification of a specific telomere terminal transferase activity in Tetrahymena extracts[J].Cell, 1985, 43(2): 405-13.
[3]Dunham M A, Neumann A A, Fasching C L, Reddel R R.Telomere maintenance by recombination in human cells[J].NatGenet, 2000, 26(4): 447-50.
[4]Bidzinska J, Cimino-Reale G, Zaffaroni N, Folini M. G-quadruplex structures in the human genome as novel therapeutic targets[J].Molecules, 2013, 18(3): 12368-95.
[5]Il'inskii N S, Varizhuk A M, Beniaminov A D, et al. G-quadruplex ligands: mechanisms of anticancer action and target binding[J].MolBiol, 2014, 48(6): 891-907.
[6]李燕梅, 沈曉燕. 具抑制端粒酶活性的G-四鏈體小分子配體研究進展[J]. 中國藥理學通報,2010,26(1):17-20.
[6]Li Y M, Shen X Y. Progress in the study of G-quadruplex telomerase inhibitors[J].ChinPharmacolBull, 2010, 26(1): 17-20.
[7]孫靜, 陳嘉曦, 陳伙炎, 毛宗萬. 金屬配合物與 G-四鏈體作用的研究進展[J]. 中國藥理學通報,2012,28(4):469-72.
[7]Sun J, Chen J X, Chen H Y, Mao Z W. Interaction of metal complexes with G-quadruplex[J].ChinPharmacolBull, 2012, 28(4): 469-72.
[8]鄭小輝, 穆舸, 譚彩萍,等. G-四鏈體DNA穩定劑的研究進展[J]. 中國科學:化學,2014,44(4):484-94.
[8]Zheng X H, Mu G, Tan C P, Cao Q, et al. The study of G-quadruplex stabilizers[J].SciChina,SerB, 2014, 44(4): 484-94.
[9]Sun D, Thompson B, Cathers B E, et al. Inhibition of human telomerase by a G-quadruplex-interactive compound[J].JMedChem, 1997, 40(14): 2113-6.
[10] Temime-Smaali N, Guittat L, Sidibe A, et al. The G-quadruplex ligand telomestatin impairs binding of topoisomerase IIIalpha to G-quadruplex-forming oligonucleotides and uncaps telomeres in ALT cells[J].PLoSOne, 2009, 4(9): e6919.
[11] Gomez D, Aouali N, Londono-Vallejo A, et al. Resistance to the short term antiproliferative activity of the G-quadruplex ligand 12459 is associated with telomerase overexpression and telomere capping alteration[J].JBiolChem, 2003, 278(50): 50554-62.
[12] Gunaratnam M, Greciano O, Martins C, et al. Mechanism of acridine-based telomerase inhibition and telomere shortening[J].BiochemPharmacol, 2007, 74(5): 679-89.
[13] Salvati E, Leonetti C, Rizzo A, et al. Telomere damage induced by the G-quadruplex ligand RHPS4 has an antitumor effect[J].JClinInvest, 2007, 117(11): 3236-47.
[14] Granotier C, Pennarun G, Riou L, et al. Preferential binding of a G-quadruplex ligand to human chromosome ends[J].NucleicAcidsRes, 2005, 33(13): 4182-90.
[15] Lee Y R, Yu D S, Liang Y C, et al. New approaches of PARP-1 inhibitors in human lung cancer cells and cancer stem-like cells by some selected anthraquinone-derived small molecules[J].PLoSOne, 2013, 8(2): e56284.
[16] Seenisamy J, Rezler E M, Powell T J, et al. The dynamic character of the G-quadruplex element in the c-MYC promoter and modification by TMPyP4[J].JAmChemSoc, 2004, 126(28): 8702-9.
[17] Ma D L, Che C M, Yan S C. Platinum(II) complexes with dipyridophenazine ligands as human telomerase inhibitors and luminescent probes for G-quadruplex DNA[J].JAmChemSoc, 2009, 131(5): 1835-46.
[18] Shi D F, Wheelhouse R T, Sun D, Hurley L H. Quadruplex-interactive agents as telomerase inhibitors: synthesis of porphyrins and structure-activity relationship for the inhibition of telomerase[J].JMedChem, 2001, 44(26): 4509-23.
[19] Reed J E, Arnal A A, Neidle S, Vilar R. Stabilization of G-quadruplex DNA and inhibition of telomerase activity by square-planar nickel(II) complexes[J].JAmChemSoc, 2006, 128(18): 5992-3.
[20] Reed J E, Neidle S, Vilar R. Stabilisation of human telomeric quadruplex DNA and inhibition of telomerase by a platinum-phenanthroline complex[J].ChemCommun, 2007, 43(42): 4366-8.
[21] Suntharalingam K, White A J, Vilar R. Synthesis, structural characterization, and quadruplex DNA binding studies of platinum(II)-terpyridine complexes[J].InorgChem, 2009, 48(19): 9427-35.
[22] Kieltyka R, Englebienne P, Fakhoury J, et al. A platinum supramolecular square as an effective G-quadruplex binder and telomerase inhibitor[J].JAmChemSoc, 2008, 130(31): 10040-1.
[23] 趙曉瓏, 劉曉媛, 楊瑞波, 等. 釕配合物與G-四鏈體DNA 的相互作用研究進展[J]. 化學通報, 2015, 78(10): 873-81.
[23] Zhao X L, Liu X Y, Yang R B, et al. Research Progress in Interaction between Ruthenium Complexes and G-quadruplex DNA[J].ChemOnline, 2015, 78(10): 873-81.
[24] Wang J T, Zheng X H, Xia Q, et al. 1,10-Phenanthroline platinum(II) complex: a simple molecule for efficient G-quadruplex stabilization[J].DaltonTrans, 2010, 39(31): 7214-6.
[25] Wang J T, Li Y, Tan J H, et al. Platinum(II)-triarylpyridines complexes with electropositive pendants as efficient G-quadruplex binders[J].DaltonTrans, 2011, 40(3): 564-6.
[26] Xu C X, Zheng Y X, Zheng X H, et al. V-shaped dinuclear Pt(II) complexes: selective interaction with human telomeric G-quadruplex and significant inhibition towards telomerase[J].SciRep, 2013, 3: 2060.
[27] Xu C X, Shen Y, Hu Q, et al. Stabilization of human telomeric G-quadruplex and inhibition of telomerase activity by propeller-shaped trinuclear Pt(II) complexes[J].ChemAsianJ, 2014, 9(9): 2519-26.
[28] Zheng X H, Cao Q, Ding Y L, et al. Platinum(II) clovers targeting G-quadruplexes and their anticancer activities[J].DaltonTrans, 2015, 44(1): 50-3.
[29] Zheng X H, Zhong Y F, Tan C P, et al. Pt(II) squares as selective and effective human telomeric G-quadruplex binders and potential cancer therapeutics[J].DaltonTrans, 2012, 41(38): 11807-12.
[30] Zheng X H, Chen H Y, Tong M L, et al. Platinum squares with high selectivity and affinity for human telomeric G-quadruplexes[J].ChemCommun, 2012, 48(61): 7607-9.
Study of human telomere G4-DNA stabilizers
ZHENG Xiao-hui1,2,3, LIU Hai-ying2, XIA Li-xin1, MAO Zong-wan3
(1.MedicalSchool,ShenzhenUniversity,ShenzhenGuangdong518060,China;2.SchoolofLifeSciences,
SunYat-senUniversity,Guangzhou510006,China;3.SchoolofChemistryandChemicalEngineering,SunYat-SenUniversity,Guangzhou510275,China)
Abstract:Telomere maintenance plays a critical role in cancer progression. Approximately 85% human cancer cells maintain their telomere length through activation of telomerase. Other 15% of cancers maintain telomere length independently of telomerase by alternative lengthening of telomeres (ALT) pathway. Both events are equally important for telomere length maintenance of cancer cells. Human telomere consists of a series of G rich DNA sequences, which could form G-quadruplex. The formation of this structure can block the extension of telomeres by telomerase or ALT, resulting in cancer cell death. Thereby, G-quadruplex has been one of the focuses of anticancer therapy in recent years. This review focuses on the latest progress of G-quadruplex stabilizers.
Key words:cancer;telomere;telomerase;alternative lengthening of telomeres (ALT);G-quadruplex DNA; small organic molecules; metal complexes
收稿日期:2016-02-01,修回日期:2016-03-11
基金項目:國家自然科學基金資助項目(No 31271472, 31322033, 81273275);博士后基金資助項目(No 2014M562208);深圳市科技計劃項目(No JCYJ20150525092941055)
作者簡介:鄭小輝(1986-),女,博士后,研究方向:金屬配合物的藥物化學及其與生物大分子的作用,Tel:020-39943401,E-mail:zhengxh6@mail2.sysu.edu.cn;
doi:10.3969/j.issn.1001-1978.2016.06.003
文獻標志碼:A
文章編號:1001-1978(2016)06-0751-05
中國圖書分類號:R-05;R329.24;R342.3;R730.5
網絡出版時間:2016-5-25 15:39網絡出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160525.1539.006.html
毛宗萬(1962-),男,博士,教授,博士生導師,研究方向: 金屬酶結構與功能的關系及其模擬、疾病診斷試劑及金屬藥物等,通訊作者,Tel:020-84113788,E-mail: cesmzw@mail.sysu.edu.cn

