表皮生長因子對牦牛卵丘細胞低氧誘導因子-1α表達的影響及與凋亡的關聯性分析
張譯夫,潘陽陽,溫澤星,余四九
(甘肅農業大學 動物醫學院 甘肅省牛羊胚胎工程技術研究中心,蘭州 730070)
?
表皮生長因子對牦牛卵丘細胞低氧誘導因子-1α表達的影響及與凋亡的關聯性分析
張譯夫,潘陽陽,溫澤星,余四九*
(甘肅農業大學 動物醫學院 甘肅省牛羊胚胎工程技術研究中心,蘭州 730070)
旨在研究EGF是否通過調控HIF-1α抑制牦牛卵丘細胞凋亡。本研究在牦牛卵丘細胞體外培養時加入不同濃度的EGF,運用qRT-PCR和免疫熒光技術檢測HIF-1α、Bcl-2和Bax的表達,用一步法TUNEL檢測不同處理組卵丘細胞的凋亡情況。結果表明:(1)牦牛卵丘細胞體外培養液中添加不同濃度的EGF后,卵丘細胞HIF-1α和BaxmRNA的相對表達量降低,Bcl-2 mRNA的相對表達量增加,且具有濃度依賴性;當EGF濃度為50 ng·mL-1時,HIF-1α和BaxmRNA的相對表達量最低,Bcl-2 mRNA的相對表達量最高。(2)向其體外培養液中添加不同濃度的EGF后,卵丘細胞HIF-1α和Bax蛋白的相對表達量降低,Bcl-2蛋白的相對表達量增加,且具有濃度依賴性;當EGF濃度為50 ng·mL-1時,HIF-1α和Bax蛋白的相對表達量最低,Bcl-2蛋白的相對表達量最高。(3)TUNEL凋亡檢測表明,對照組中卵丘細胞凋亡率最高,當EGF濃度為25 ng·mL-1時,細胞凋亡率顯著降低(P<0.05);當EGF濃度為50 ng·mL-1時,細胞凋亡率最低(P<0.05),但隨著EGF濃度的增加,卵丘細胞的凋亡率又升高。本研究結果表明,EGF可通過調控HIF-1α抑制卵丘細胞凋亡,其作用可能與線粒體介導的Bax和Bcl-2凋亡途徑相關。
表皮生長因子(EGF);低氧誘導因子-1α(HIF-1α);凋亡;卵丘細胞;牦牛
哺乳動物卵巢上存在數百萬的各級卵泡,但在卵泡生長過程中,除少量卵泡可以發育成熟排卵外,其余大部分卵泡都將閉鎖退化[1-2]。多數動物胎兒的原始卵泡、初級卵泡閉鎖主要是由卵母細胞凋亡引起,而成體卵泡閉鎖主要是卵丘細胞凋亡誘導的結果,卵丘細胞的凋亡程度與卵母細胞的成熟狀態和發育潛能呈正相關[3-4]。成熟的卵母細胞是體外受精、體細胞核移植胚胎生產的先決條件[5-6],而卵丘細胞(Cumulus cells,CCs)在卵母細胞成熟過程中發揮著重要的生物學作用[7]。研究發現,CCs可通過與卵母細胞的縫隙連接,以旁分泌的方式將其他蛋白或生物學分子傳遞于卵母細胞進而影響其發育和成熟[6,8]。CCs的擴散程度、細胞數量、細胞質量及形態均會影響到卵母細胞發育能力[7,9]。卵母細胞和卵丘細胞之間的關系是相互的,卵母細胞分泌的一些重要的因子,通過旁分泌作用促進卵丘細胞增生、分化及調節其功能,二者之間相互作用共同調節卵泡的發育[10]。由于卵母細胞與卵丘細胞之間的密切關系,有研究表明,卵丘細胞凋亡引起的卵泡閉鎖會影響到卵母細胞的后期發育潛能[11],卵母細胞的發育成熟情況影響后續胚胎的卵裂率及囊胚率[12]。
表皮生長因子(Epidermal growth factor,EGF)最早是從小鼠頜下腺中分離出來的一種多肽類物質,在細胞增殖和分化中起重要作用。EGF可通過多種信號途徑調節相關基因轉錄表達,抑制多種類型細胞凋亡,促進細胞增殖和分化,從而發揮抑制凋亡的生物學效應,細胞凋亡途徑很多,如線粒體介導的細胞凋亡途徑中的B-細胞淋巴瘤/白血病-2原癌基因(B-cell lymphoma/Leukemia-2,Bcl-2)。Bcl-2作為抗凋亡蛋白重要成員,在細胞中主要結合B細胞淋巴瘤/白血病基因伴隨x蛋白(B-cell lymphoma/Leukemia associated x protein,Bax)而抑制凋亡發生[13]。目前發現低氧誘導因子-1α(Hypoxia inducible factor-1α,HIF-1α)的靶基因有100多個。P.Carmeliet等[14]研究發現,HIF-1α與Bcl-2、p53因子的表達存在密切關系,由于低氧應激可以導致許多生物障礙,HIF-1α在調控細胞生長和凋亡可能具有普遍的病理生理學意義。G.L.Wang等[15]研究發現,HIF-1是通過抑制Bcl-2表達的信號途徑來促進神經細胞凋亡的。HIF-1α也可能在心肌Bcl-2、Bax的表達調節中發揮作用,進而調節細胞凋亡的發生[16]。
牦牛是生活在海拔最高處的哺乳動物,主要產于中國青藏高原海拔3 000 m以上地區。牦牛生產能力低下,繁殖活動具有明顯的季節性,妊娠期為250~260 d,本具有一年產一胎的能力,但是由于生存環境等相關因素的影響,牦牛的實際繁殖能力一般僅為兩年一胎或三年兩胎[17]。因此,本研究以牦牛卵丘細胞為研究對象,檢測不同濃度EGF對其凋亡的影響,并分析了EGF對HIF-1α及凋亡相關基因Bax、Bcl-2表達的影響,以探討EGF抑制牦牛卵丘細胞凋亡的相關分子機制,為進一步闡明EGF在卵母細胞成熟及早期胚胎發育機制中的作用提供理論依據。
1 材料及方法
1.1主要試劑
DMEM/F12、胎牛血清(FBS)、PBS及雙抗(PS)購自Gibco公司(美國);表皮生長因子(EGF)、胰蛋白酶購自Sigma公司(美國);HIF-1α抗體(bs-0737R)、Bax抗體(bs-0127R)、Bcl-2抗體(bs-0032R)及熒光二抗(bs-0295G-FITC)購自博奧森(北京);微量RNA提取試劑盒、兩步法反轉錄試劑盒及PCR Mix購自Promega(美國);SYBR Green Ⅱ熒光定量PCR試劑盒(TaKaRa,大連);一步法TUNEL細胞凋亡檢測試劑盒(產品編號:C1088)、免疫熒光檢測所用試劑均購自南京碧云天生物公司;其他試劑均為國產分析純。
1.2樣品采集
牦牛卵巢樣品采自青海省西寧市樂家灣屠宰場,采樣時間為9~11月份,將采集的卵巢置于30~35 ℃的含PS的無菌生理鹽水中,于6 h內帶回實驗室。
1.3卵丘細胞的分離及培養
參照潘陽陽等[18]的方法,并適當修改。將采集回來的卵巢用預先37 ℃平衡2 h的生理鹽水清洗3次,用12號針頭抽取卵巢表面直徑2~10 mm卵泡中的卵泡液,體視顯微鏡下挑選出胞質均勻且含3層以上卵丘層的卵丘卵母細胞復合體(COC);震蕩器震蕩2 min后,收集分散的卵丘細胞,1 000 r·min-1離心5 min,棄上清。然后用培養液(90%DMEM/F12 +1% PS+9% FBS)離心洗滌2次,置25 mm2的培養瓶懸浮培養。
1.4EGF作用卵丘細胞
取第2代卵丘細胞,培養至指數生長期,用0.05%的胰蛋白酶消化,臺盼藍染色檢測細胞存活率達80% 以上時,調整細胞密度為4×105個,接種到六孔板中于5% CO2、37 ℃培養,待細胞生長穩定后,撤除血清,加入EGF。分別設陰性對照組(不加EGF,即0 ng·mL-1)和EGF處理組(EGF終濃度分別為25、50、100和200 ng·mL-1),重復5次,EGF處理時間根據預試驗確定為24 h,分別收集處理細胞用于后續試驗。
1.5總RNA提取,反轉錄及PCR擴增
每個處理組隨機收集4孔,PBS清洗3次后,微量RNA提取試劑盒提取總RNA,兩步法反轉錄試劑盒合成第一鏈cDNA。PCR反應體系為20 μL:1 μL cDNA(200 ng·μL-1),上下游引物各0.5 μL(0.2 μmol·mL-1),PCR Mix 10 μL,ddH2O 8 μL。取10 μL PCR產物,用1%瓊脂糖凝膠電泳檢測(120 V,20 min),紫外燈下觀察,并利用凝膠成像系統采集圖像,確定引物特異性。
1.6qRT-PCR 檢測HIF-1α、Bax和Bcl-2 mRNA的表達
根據GenBank公布的牛HIF-1α、Bax和Bcl-2的mRNA序列設計引物,引物具體信息見表1,引物序列由上海生工生物工程股份有限公司合成。反應體系為1 μL cDNA(200 ng·μL-1),上下游引物各0.4 μL(0.2 μmol·mL-1),2×SYBR Green II PCR mix 10 μL,Passive Reference Dye II 0.4 μL,ddH2O 7.8 μL,總反應體系為20 μL。反應條件:95 ℃預變性10 s;95 ℃變性10 s、退火10 s(退火溫度見表1 )、72 ℃延伸 10 s,共34個循環,每個樣品重復5次。根據熔解曲線判斷反應的特異性,獲得每個樣品的CT值,采用2-ΔΔCT法計算目的基因的相對表達量,試驗重復5次。
表1引物信息
Table 1The information of primers
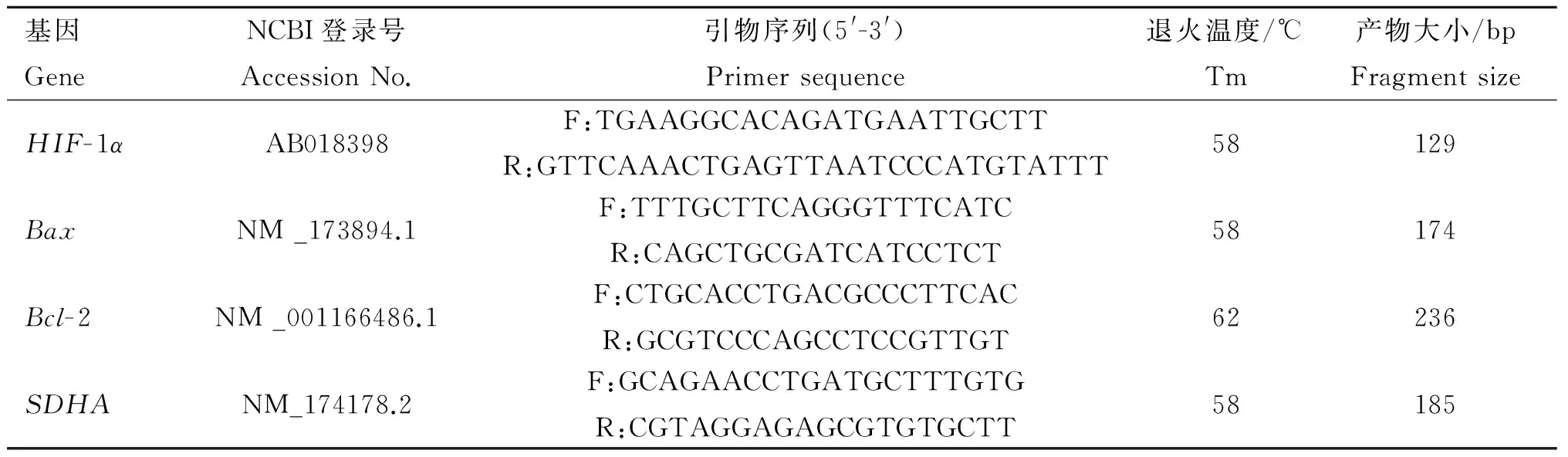
基因GeneNCBI登錄號AccessionNo.引物序列(5'-3')Primersequence退火溫度/℃Tm產物大小/bpFragmentsizeHIF-1αAB018398F:TGAAGGCACAGATGAATTGCTTR:GTTCAAACTGAGTTAATCCCATGTATTT58129BaxNM_173894.1F:TTTGCTTCAGGGTTTCATCR:CAGCTGCGATCATCCTCT58174Bcl-2NM_001166486.1F:CTGCACCTGACGCCCTTCACR:GCGTCCCAGCCTCCGTTGT62236SDHANM_174178.2F:GCAGAACCTGATGCTTTGTGR:CGTAGGAGAGCGTGTGCTT58185
HIF-1α、Bax和Bcl-2.目的基因;SDHA.內參基因
HIF-1α,BaxandBcl-2.The purpose genes;SDHA.Reference gene
1.7 免疫細胞熒光染色檢測HIF-1α、Bax及Bcl-2蛋白的分布
將細胞用PBS 清洗3 遍后,加入固定液室溫固定30 min,然后用免疫染色洗滌液洗3遍,用含0.2% TritonX-100免疫染色封閉液封閉1 h,加入一抗,4 ℃孵育過夜(對照組用PBS代替一抗),洗3遍后,置于FITC 標記的二抗中,室溫避光孵育1 h,清洗3 遍后,DAPI染色3~5 min。熒光顯微鏡觀察并拍照。使用Imagepro-Plus 6.0對熒光照片進行平均光密度(Mean density)分析,選擇測量參數IOD和area,讀取IOD SUM及area SUM數據,根據mean density=(IOD SUM)/(area SUM),即為圖片中細胞的平均熒光強度值。
1.8一步法TUNEL細胞凋亡檢測
將貼壁的細胞用PBS洗滌1次,4%多聚甲醛固定30~60 min后,PBS再洗滌1次,0.1%TritonX-100冰浴2 min,PBS洗滌2次。每個樣品加入50 μL的TUNEL檢測液,37 ℃避光孵育60 min,PBS洗滌3次后,置于熒光顯微鏡下拍照。
1.9數據分析
采用SPSS 19.0統計軟件對數據進行單因素方差分析,每組至少重復3次。P<0.05表示差異顯著。
2 結 果
2.1引物特異性的確定
對PCR產物進行1% 瓊脂糖凝膠電泳檢測,HIF-1α、Bax、Bcl-2及內參基因SDHA均出現與目的片段大小相同的片段(圖1)。擴增效率曲線表明擴增效果良好,經熔解曲線分析HIF-1α、Bax、Bcl-2及內參基因SDHA分別出現單一產物峰(圖2)。
圖1 EGF不同作用濃度組牦牛卵丘細胞HIF-1α、Bax、Bcl-2及SDHA 的PCR電泳產物檢測Fig.1 The PCR products of HIF-1α,Bax,Bcl-2 and SDHA in yak cumulus cells in different groups
圖2 HIF-1α、Bax、Bcl-2及SDHA基因的熔解曲線Fig.2 The melting curves of HIF-1α,Bax,Bcl-2 and SDHA genes
2.2EGF對牦牛卵丘細胞HIF-1α、Bax和Bcl-2 mRNA表達的影響
如圖3所示,加入不同濃度的EGF后,HIF-1αmRNA的相對表達量發生顯著變化。其中50 ng·mL-1EGF處理組,HIF-1αmRNA相對表達量最低,且與25 ng·mL-1EGF組差異不顯著;100 ng·mL-1EGF處理組與0 ng·mL-1EGF處理組的相對表達量差異不顯著,200 ng·mL-1EGF處理組的相對表達量最高。不同EGF濃度處理組Bax、Bcl-2 mRNA相對表達量檢測顯示(圖3),對照組中,Bax的相對表達量最高,而Bcl-2的相對表達量最低;EGF作用濃度為25 ng·mL-1時,Bax的相對表達量較低,而Bcl-2的相對表達量較高;在EGF作用濃度為50 ng·mL-1時,Bax的相對表達量最低,而Bcl-2的相對表達量最高;EGF作用濃度為100 ng·mL-1時,Bax和Bcl-2的相對表達量與50 ng·mL-1濃度的相對表達量差異不顯著;200 ng·mL-1EGF作用濃度組,Bax的相對表達量顯著高于100 ng·mL-1組(P<0.05),Bcl-2的相對表達量顯著低于100 ng·mL-1組,都與對照組差異不顯著。
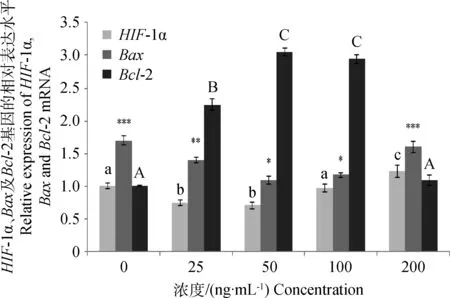
組間比較,不同上標表示差異顯著(P<0.05)Comparison among groups,different superscripts mean significant difference (P<0.05)圖3 不同濃度EGF對牦牛卵丘細胞HIF-1α、Bax和Bcl-2基因表達的影響Fig.3 Effect of different concentration of EGF on HIF-1α, Bax and Bcl-2 mRNA expression
2.3EGF對牦牛卵丘細胞HIF-1α、Bax和Bcl-2蛋白表達的影響
對加入不同濃度EGF的牦牛卵丘細胞進行HIF-1α、Bax和Bcl-2蛋白免疫熒光染色檢測如圖4所示:所有的牦牛卵丘細胞均表達HIF-1α、Bax和Bcl-2蛋白,且主要位于細胞核中,而細胞質中熒光較弱。圖4的量化分析結果如圖5所示:HIF-1α蛋白在50 ng·mL-1EGF作用組相對表達量最低,且與100 ng·mL-1EGF組差異不顯著;25 ng·mL-1EGF處理組HIF-1α 蛋白的相對表達量顯著高于50 ng·mL-1EGF組(P<0.05);200 ng·mL-1EGF處理組HIF-1α 蛋白的相對表達量顯著高于其他組(P<0.05),但與對照組差異不顯著;對照組Bax蛋白相對表達量最高,25 ng·mL-1EGF組Bax蛋白相對表達量降低(P<0.05),在EGF為50 ng·mL-1濃度表達量最低(P<0.05),100 ng·mL-1EGF組Bax蛋白相對表達量與50 ng·mL-1EGF組差異不顯著,200 ng·mL-1EGF組與對照組差異不顯著;對照組Bcl-2蛋白相對表達量最低,25 ng·mL-1EGF組Bcl-2蛋白相對表達量顯著增加(P<0.05),Bcl-2在50 ng·mL-1EGF作用組蛋白相對表達量最高(P<0.05),100 ng·mL-1EGF組Bcl-2蛋白的相對表達量有所降低,但與50 ng·mL-1EGF組差異不顯著,200 ng·mL-1EGF處理組的相對表達量與對照組差異不顯著。
2.4EGF對牦牛卵丘細胞凋亡的抑制作用
對不同處理組細胞進行TUNEL凋亡檢測,如圖6、表2所示,對照組中卵丘細胞凋亡率最高,為(73.14±4.72)%;25 ng·mL-1EGF組細胞凋亡率顯著降低,為(62.85±4.38)% (P<0.05);50 ng·mL-1EGF組,細胞凋亡率最低,為(48.32±2.16)% (P<0.05),與100 ng·mL-1EGF組細胞凋亡率(51.25±1.84)%差異不顯著;200 ng·mL-1EGF組細胞凋亡率顯著高于100 ng·mL-1EGF組細胞凋亡率,為(71.06±3.63)%,與對照組凋亡率差異不顯著。
表2EGF對牦牛卵丘細胞凋亡的抑制作用
Table 2Effects of EGF on apoptosis of yak cumulus cells
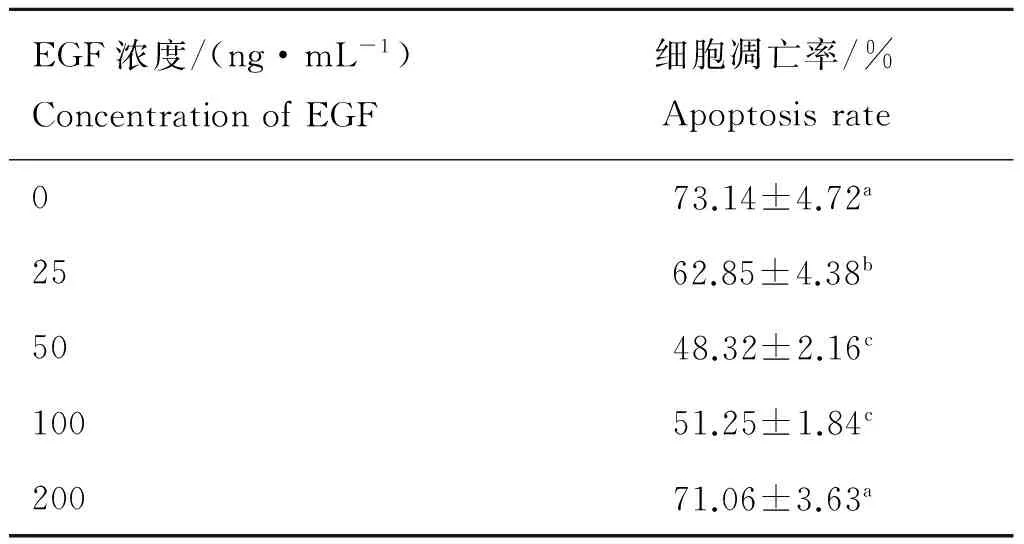
EGF濃度/(ng·mL-1)ConcentrationofEGF細胞凋亡率/%Apoptosisrate073.14±4.72a2562.85±4.38b5048.32±2.16c10051.25±1.84c20071.06±3.63a
同一列中不同字母表示差異顯著(P<0.05)
The different letters in the same column mean significant difference (P<0.05)
3 討 論
卵母細胞成熟過程中,包圍其周圍的卵丘細胞可通過分泌一系列蛋白調控卵母細胞質量,甚至影響后期胚胎的發育[19]。同時卵丘細胞在胚胎體外培養過程中,常作為共培養體系細胞,質量完好的卵丘細胞可提高胚胎的發育能力[20]。綜上表明,卵丘細胞的質量對卵母細胞的成熟和早期胚胎發育具有至關重要的作用。
EGF作為重要的細胞因子可促進細胞的分化和增殖[21]。研究發現,EGF對多數哺乳動物的卵母細胞成熟具有促進作用[22],包括牛[23]、水牛[24]和綿羊[25]。由于對卵母細胞進行裸卵培養時,添加EGF并未促進卵母細胞成熟,表明這種作用通過卵丘層細胞介導完成[21]。
牦牛長期生活在低氧的環境,其細胞體外培養必然對氧刺激更加敏感。HIF是缺氧應答中起核心作用的轉錄應答因子,目前發現,HIF-1α的靶基因有100多個。EGF可以抑制低氧導致的人胚胎滋養層細胞凋亡,且主要的調控基因為Bax和P53[23,26]。而Bax為Bcl-2家族促凋亡成員,其作用可導致細胞線粒體外膜造成損傷,并釋放凋亡蛋白進一步促進內質網釋放Ca2+[27]。Bax蛋白過表達加速細胞凋亡進程,Bcl-2 作為凋亡抑制基因,Bcl-2 蛋白表達能夠阻止多種刺激因素引起的細胞凋亡[28]。

A~E.0 、25、50、100和200 ng·mL-1;綠色熒光分別為HIF-1α、Bax和Bcl-2蛋白標記,DAPI為細胞核標記A-E.0,25,50,100 and 200 ng·mL-1;The HIF-1α,Bax and Bcl-2 protein were stained with green fluorescence,nuclei were stained with DAPI圖4 牦牛卵丘細胞HIF-1α、Bax和Bcl-2蛋白的免疫熒光染色結果(Bar=200 μm )Fig.4 The detection of HIF-1α,Bax and Bcl-2 protein on yak cumulus cells by method of immunofluorescence (Bar=200 μm )
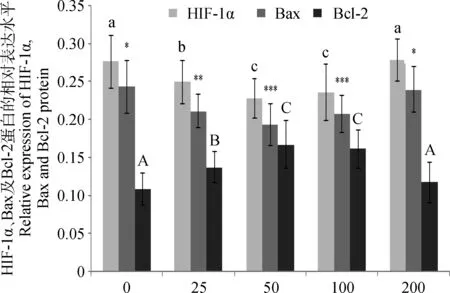
組間比較,不同上標表示差異顯著(P<0.05)Comparison among groups,different superscripts mean significant difference (P<0.05)圖5 不同濃度EGF對牦牛卵丘細胞HIF-1α、Bax及Bcl-2蛋白表達的影響Fig.5 Effect of different concentration of EGF on HIF-1α,Bax and Bcl-2 protein expression
本研究首次分析EGF對牦牛卵丘細胞的凋亡調控及機制,在牦牛卵丘細胞培養液中加入不同濃度的EGF后,HIF-1α、Bax和Bcl-2 mRNA和蛋白的相對表達均發生了改變,且與細胞凋亡程度密切相關,而HIF-1α、Bax和Bcl-2蛋白主要分布于卵丘細胞的胞核中。隨著EGF濃度的增加,HIF-1α和BaxmRNA及蛋白的相對表達量隨之降低,Bcl-2 mRNA和蛋白的相對表達量隨之升高,細胞的凋亡率也隨之降低;當EGF濃度為50 ng·mL-1時,HIF-1α和BaxmRNA及蛋白的相對表達量最低,而Bcl-2 mRNA和蛋白的相對表達量最高,細胞的凋亡率也最低;當EGF濃度增大后,其作用效果反而有所減弱。一步法TUNEL細胞凋亡檢測結果顯示,EGF可明顯降低細胞的凋亡率,且具有劑量依賴性,在50 ng·mL-1EGF組凋亡率最低,EGF濃度繼續增大后,凋亡率高于50 ng·mL-1EGF組,低于對照組的凋亡率。可見EGF可降低牦牛卵丘細胞HIF-1α的表達,降低Bax的表達,提高Bcl-2的表達,降低細胞凋亡率,最佳作用濃度為50 ng·mL-1,其結果將為闡明EGF對卵母細胞成熟及早期胚胎的發育機制提供理論依據。
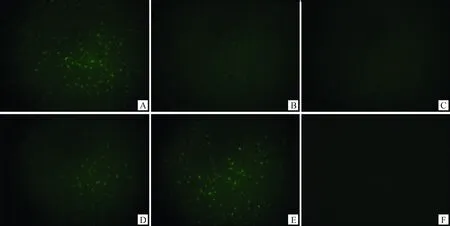
A~E.0、25、50、100和200 ng·mL-1;F.空白對照。綠色熒光為凋亡標記A-E.0,25,50,100 and 200 ng·mL-1;F.Blank control.Apoptotic marker was stained with green fluorescence圖6 不同處理組牦牛卵丘細胞凋亡檢測 (Bar=100 μm)Fig.6 Detection the apoptosis of yak cumulus cells in different groups (Bar=100 μm)
4 結 論
牦牛卵丘細胞體外培養中添加EGF可降低HIF-1α及Bax的表達,提高Bcl-2的表達,降低細胞凋亡率,且其作用濃度具有劑量依賴性,最佳濃度為50 ng·mL-1。證明EGF可通過調控HIF-1α抑制卵丘細胞凋亡,其作用可能是通過影響線粒體介導的Bax和Bcl-2凋亡途徑實現的。本研究為闡明EGF抑制卵丘細胞凋亡的分子機制提供了新的依據,為進一步揭示EGF在卵母細胞成熟及早期胚胎發育過程中的作用機制提供理論基礎。
[1]BAKER T G.A quantitative and cytological study of germ cells in the human ovaies [J].ProcRSocLondBBiolSci,1963,158:417-433.
[2]BYSKOV A G.Follicular at resia.In:Jones R E,ed.The vertebrate ovary [M].New York:Plenum Press,1978:533-562.
[3]李海軍,靳木子,張睿彪,等.卵丘細胞凋亡與增殖對牛卵母細胞體外發育的影響[J].中國農業科學,2011,44(8):1702-1709.
LI H J,JIN M Z,ZHANG R B,et al.Effect of cumulus cells apoptosis and proliferation on the bovine oocyte developmentinvitro[J].ScientiaAgriculturaSinica,2011,44(8):1702-1709.(in Chinese)
[4]HUGHES F M J R,GOROSPE W C.Biochemical identification of apoptosis (programmed cell death) in granulosa cells:evidence for a potential mechanism underlying follicular atresia [J].Endocrinology,1991,129(5):2415-2422.
[5]GILCHRIST R B,LANE M,THOMPSON J G.Oocyte-secreted factors:regulators of cumulus cell function and oocyte quality[J].HumReprodUpdate,2008,14(2):159-177.
[6]LOUREN?O B,SOUSA A P,ALMEIDA-SANTOS T,et al.Relation of cumulus cell status with single oocyte maturity,fertilization capability and patient age[J].JReprodInfertil,2014,15(1):15-21.
[7]UYAR A,TORREALDAY S,SELI E.Cumulus and granulosa cell markers of oocyte and embryo quality[J].FertilSteril,2013,99(4):979-997.
[8]LISLE R S,ANTHONY K,RANDALL M A,et al.Oocyte-cumulus cell interactions regulate free intracellular zinc in mouse oocytes[J].Reproduction,2013,145(4):381-390.
[9]YERUSHALMI G M,SALMON-DIVON M,YUNG Y,et al.Characterization of the human cumulus cell transcriptome during final follicular maturation and ovulation[J].MolHumReprod,2014,20(8):719-735.
[10]EPPIG J J.Growth and development of the mammalian oocyte granulosa cell complex in culture.In:Trounson A O & Gosden R G (eds).Biology and pathology of oocyte[M].Cambridge:CUP,2003:273-282.[11]H?ST E,GABRIELSEN A,LINDENBERG S,et al.Apoptosis in human cumulus cells in relation to zona pellucida thickness variation,maturation stage,and cleavage of the corresponding oocyte after intracytoplasmic sperm injection [J].FertilSteril,2002,77(3):511-515.
[12]MAKAREVICH A V,MARKKULA M.Apoptosis and cell proliferation potential of bovine embryos stimulated with insulin-like growth factor I duringinvitromaturation and culture [J].BiolReprod,2002,66(2):386-392.
[13]LEIBOWITZ B,YU J.Mitochondrial signaling in cell death via theBcl-2 family[J].CancerBiolTher,2010,9(6):417-422.
[14]CARMELIET P,DOR Y,HERBERT J M,et al.Role of HIF-1α in hypoxia-mediated apoptosis,cell proliferation and tumor angiogenesis[J].Nature,1998,394(6692):485-490.
[15]WANG G L,JIANG B H,RUE E A,et al.Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2tension [J].ProcNatlAcadSciUSA,1995,92(12):5510-5514.
[16]洪欣,董宏彬,杜宏偉,等.低氧及低氧預處理時心肌細胞HIF-1α與凋亡相關蛋白表達的變化[J].中國應用生理學雜志,2005,21(4):423-426.HONG X,DONG H B,DU H W,et al.Changes in expression of apoptosis correlative proteins and HIF-1 during acute hypoxia and hypoxic preconditioning in cultured cardiomyocyte of rat[J].ChineseJournalofAppliedPhysiology,2005,21(4):423-426.(in Chinese)[17]YU S J,HUANG Y M,CHEN B X.Reproductive patterns of the yak.III.Levels of progesterone and oestradiol-17 beta during pregnancy and the periparturient period[J].BrVetJ,1993,149(6):595-602.
[18]潘陽陽,崔燕,樊江峰,等.胰島素樣生長因子-1(IGF-1)對牦牛卵丘細胞熱休克蛋白70 (HSP70)表達的影響及其與細胞凋亡的關聯性分析[J].農業生物技術學報,2015,23(9):1208-1216.
PAN Y Y,CUI Y,FAN J F,et al.The effect of insulin-like growth factor (IGF-1) on heat shock protein 70 (HSP70) expression of yak (Bosgrunniens) cumulus cells and its relation with apoptosis [J].JournalofAgriculturalBiotechnology,2015,23(9):1208-1216.(in Chinese)
[19]LOLICATO F,BROUWERS J F,VAN DE LEST C H A,et al.The cumulus cell layer protects the bovine maturing oocyte against fatty acid-induced lipotoxicity[J].BiolReprod,2015,92(1):1-16.
[20]趙學明,杜衛華,郝海生,等.卵丘細胞在牛卵母細胞體外受精生產胚胎中的作用[J].農業生物技術學報,2011,19(2):375-380.
ZHAO X M,DU W H,HAO H S,et al.Effects of cumulus cells on bovine embryo produced byinvitrofertilization [J].JournalofAgriculturalBiotechnology,2011,19(2):375-380.(in Chinese)
[21]HARDY K,SPANOS S.Growth factor expression and function in the human and mouse preimplantation embryo[J].JEndocrinol,2002,172(2):221-236.
[22]YU Y,YAN J,LI M,et al.Effects of combined epidermal growth factor,brain-derived neurotrophic factor and insulin-like growth factor-1 on human oocyte maturation and early fertilized and cloned embryo development[J].HumReprod,2012,27(7):2146-2159.
[23]WARZYCH E,PEIPPO J,SZYDLOWSKI M,et al.Supplements toinvitromaturation media affect the production of bovine blastocysts and their apoptotic index but not the proportions of matured and apoptotic oocytes[J].AnimReprodSci,2007,97(3-4):334-343.[24]馮貴雪,卞桂華,王曉麗,等.表皮生長因子對水牛卵母細胞體外培養核質成熟的影響[J].中國畜牧獸醫,2007,34(1):75-78.
FENG G X,BIAN G H,WANG X L,et al.Influence of epidermal growth facror on the nuclear and cytoplasm maturation of buffalo oocytesinvitroculture[J].ChineseJournalofVeterinaryMedicine,2007,34(1):75-78.(in Chinese)
[25]劉丑生,陸會寧,張利平,等.EGF 和 IGF-I 對綿羊卵母細胞體外成熟和卵裂的影響[J].畜牧獸醫學報,2008,39(5):588-593.
LIU C S,LU H N,ZHANG L P,et al.Effect of EGF,IGF-1 oninvitromaturation and cleavage of ovine oocytes [J].ActaVeterinariaetZootechnicaSinica,2008,39(5):588-593.(in Chinese)
[26]LEVY R,SMITH S D,CHANDLER K,et al.Apoptosis in human cultured trophoblasts is enhanced by hypoxia and diminished by epidermal growth factor[J].AmJPhysiolCellPhysiol,2000,278(5):C982-C988.[27]LI B,YADAV R K,JEONG G S,et al.The characteristics of Bax inhibitor-1 and its related diseases[J].CurrMolMed,2014,14(5):603-615.
[28]CHEN R M,CHEN T L,CHIU W T,et al.Molecular mechanism of nitric oxide-induced osteoblast apoptosis[J].JOrthopRes,2005,23(2):462-468.
(編輯程金華)
The Effect of Epidermal Growth Factor on the Expression of Hypoxia Inducible Factor-1α in Cumulus Cells of Yak (Bosgrunniens) and Its Correlation Analysis with Apoptosis
ZHANG Yi-fu,PAN Yang-yang,WEN Ze-xing,YU Si-jiu*
(TechnologyandResearchCenterofGansuProvinceforEmbryonicEngineeringofBovineandSheep&Goat,CollegeofVeterinaryMedicine,GansuAgriculturalUniversity,Lanzhou730070,China)
The present study was carried out to verify whether EGF inhibited the apoptosis of cumulus cells of yak by regulating the expression of HIF-1α.The cumulus cells of yak were culturedinvitrowith the supplement of different concentration of EGF.The expression levels of HIF-1α,Bax and Bcl-2 in different groups were detected by qRT-PCR and immunofluorescence.TUNEL was used to evaluate apoptosis rate.Results showed that:(1) After the addition of different concentration of EGF to the cumulus cells,there would be found a declined mRNA relative expression ofHIF-1αandBaxand an increased mRNA relative expression ofBcl-2,with a characteristic manner of concentration-dependent.When the concentration of EGF was as high as 50 ng·mL-1,the mRNA relative expressions ofHIF-1αandBaxwere the lowest,while that ofBcl-2 was the highest.(2) The protein relative expressions of HIF-1α and Bax were decreased and that of Bcl-2 was increased,with a characteristic manner of concentration-dependent.When the concentration of EGF was as high as 50 ng·mL-1,the protein relative expressions of HIF-1α and Bax were the lowest,while that of Bcl-2 was the highest.(3) Apoptosis detection shown that the apoptosis rate from control group was the highest.It was extremely declined when the concentration of EGF was 25 ng·mL-1(P<0.05),and down to its lowest level when EGF was 50 ng·mL-1(P<0.05),while rose again when EGF was continues to increase.It is concluded from this study that EGF can inhibit the apoptosis of cumulus cells by regulating HIF-1α and may be related to mitochondrial Bax and Bcl-2 apoptotic pathway.
epidermal growth factor (EGF);hypoxia inducible factor-1α (HIF-1α);apoptosis;cumulus cells;yak
10.11843/j.issn.0366-6964.2016.06.010
2015-12-09
國家自然科學基金(31272616;31472244)
張譯夫(1991-),女,山西運城人,碩士,主要從事哺乳動物生殖內分泌相關研究,E-mail: 1240219609@qq.com
余四九,教授,E-mail:sjyu@163.com
S823.8+5.2
A
0366-6964(2016)06-1154-08

