STATs蛋白家族在口腔黏膜下纖維化及其并存口腔扁平苔蘚中的表達及意義
萬英明,齊 玲,田 晶,劉麗梅
(1.吉林醫藥學院附屬醫院口腔科 132021;2.吉林醫藥學院 132021)
?
STATs蛋白家族在口腔黏膜下纖維化及其并存口腔扁平苔蘚中的表達及意義
萬英明1,齊玲2,田晶2,劉麗梅1
(1.吉林醫藥學院附屬醫院口腔科132021;2.吉林醫藥學院132021)
[摘要]目的比較口腔黏膜下纖維化(OSF)、OSF并存扁平苔癬(OLP)及正常口腔黏膜組織中STATs蛋白家族的表達差異,探討STATs蛋白家族在OSF并存OLP發生、發展中的作用機制。方法收集臨床OSF病例21例 (OSF組)、OSF并存OLP13例(OSF并存OLP組),以及NBM組織10例(對照組),分離組織RNA,采用RT-PCR分析STATs蛋白家族(Stat1、Stat2、Stat3、Stat4、Stat5a、Stat5b、Stat6)在OSF不同分期組織及OSF并存OLP組織中的表達差異。篩選表達差異較大的基因,進行免疫印跡雜交檢測驗證,并分析其磷酸化變化,探討STATs蛋白家族在OSF并存OLP發生、發展中的作用機制。結果Stat1、Stat3、Stat5a的表達量與OSF分型呈正相關,即在OSF組中晚期黏膜組織樣本中的表達量明顯高于對照組(P<0.05),而Stat2、Stat4、Stat5b、Stat6在不同OSF分型中的表達量變化不顯著(P>0.05)。Stat1和p-Stat1在OSF并存OLP組中的表達水平與對照組比較顯著增加(P<0.05),Stat3和p-Stat3(Ser727)在OSF并存OLP組中的表達水平與對照組比較明顯上調(P<0.05)。與對照組比較,Stat5a在OSF并存OLP組中顯著上調,而p-Stat5a在各組中變化不顯著。結論STATs蛋白家族成員Stat1、Stat3、Stat5a在OSF及其并存OLP中表達上調。
[關鍵詞]口腔黏膜下纖維化;扁平苔蘚;STATs
口腔黏膜下纖維化(oral submucous fibrosis,OSF) 是一種慢性口腔黏膜疾病,主要病理過程包括固有層的纖維組織變性和上皮萎縮,從而引起黏膜硬化,形成條索,最終引起牙關緊閉,妨礙口腔各種功能的發揮,并成為癌前狀態[1]。口腔扁平苔癬(oral lichen planus,OLP)是一種慢性、淺在性炎癥的角化性病變,臨床表現包括上皮過度不全角化、上皮釘突形態不一,甚至伴有糜爛、饋蕩。目前OLP的發病機制尚不完全明確,研究表明可能與免疫因素有關[2-3]。OSF和OLP都被WHO列為口腔癌前狀態[4-5]。Pindbrog報道了OSF與OLP并存[6]。在我國目前OSF并存OLP的發病率約為6.5%[7]。OSF與OLP并存發生、發展機制的研究并不多見,而OSF與OLP并存可以導致患者張口受限、舌運動障礙甚至吞咽困難,同時OSF與OLP并存也是一種癌前狀態,因此研究OSF與OLP并存的發生機制具有一定的臨床意義。
STATs蛋白家族由是一種存在于細胞質,激活后能夠轉入核內,通過分子末端的DNA結合域與DNA結合的蛋白家族,能夠與酪氨酸磷酸化信號通道耦聯,發揮信號轉導和轉錄調控作用。STATs異常表達或激活將導致細胞增殖和凋亡調節障礙,進而促進腫瘤的發生[8-9]。已經有大量研究表明,STATs的過度表達或激活存在于多種不同的人類腫瘤組織及細胞系。
本研究通過收集OSF、OLP病例,采用實時熒光定量PCR(RT-PCR)分析STATs蛋白家族在OSF不同分期組織及OSF并存OLP病例組織中的表達差異,探討STATs蛋白家族在OSF并存OLP發生、發展中的作用機制,現報道如下。
1資料與方法
1.1一般資料
1.1.1臨床組織樣本按照Pindborg病理學標準及臨床表現,選擇收集吉林醫藥學院附屬醫院2013年4月至2015年8月就診,并經過兩名病理科醫師光鏡下確診分期病例,OSF病例21例 (OSF早、中、晚期各7例,OSF組)、OSF并存OLP13例(OSF并存OLP組),以及正常口腔黏膜組織10例(對照組),組織樣本釆集前均經吉林醫藥學院附屬醫院醫學倫理學委員會批準,并獲得患者簽署知情同意書。患者性別及年齡分布見表1。
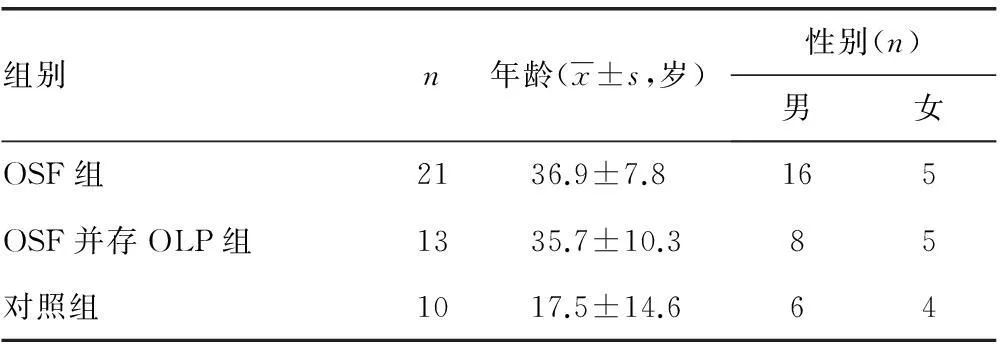
表1 臨床資料年齡、性別分布
1.1.2藥物試劑及儀器設備RNA提取試劑盒:購自Ambion(美國)-12183-555;逆轉錄試劑盒:購自Applied Biosystems(美國)-4366597;RT-PCR試劑盒:購自Bio-Rad(美國)-172-5264;Ready Prep蛋白質萃取試劑盒:購自Bio-Rad(美國);BCA蛋白質定量試劑盒:購自Vazyme Biotech(中國);Stat1、p-Stat1、Stat3、p-Stat3、Stat5a、p-Stat5a單克隆抗體:購自Santa Cruz Biotechnology(美國);辣根過氧化物酶(HRP)標記的二抗:購自北京中杉金橋生物;ECL Chemiluminescent Substrate Reagent Kit:購自Novex (美國)-WP20005;核酸定量分析儀:Qubit Fluorometer;RT-PCR 檢測系統:Bio-rad-CFX96 Touch。
1.2方法
1.2.1RT-PCR測定收集的臨床組織樣本,經PBS(Rnase free)清洗并標記后儲存于液氮。提取組織總RNA(按照RNA提取試劑盒說明進行)。Qubit Fluorometer檢測RNA水平及純度,按逆轉錄試劑盒說明書,將總RNA逆轉錄cDNA,RT-PCR檢測相關基因。在NCBI數據庫中查詢Stat1、Stat2、Stat3、Stat4、Stat5a、Stat5b、Stat6基因的mRNA序列,設計RT-PCR引物,引物委托上海生工合成。通過測定每個基因擴增的Ct值,Ct值與DNA起始拷貝數呈負相關性,以雙△Ct 值法計算靶基因的相對表達水平:3次平行重復實驗的平均值作為每個樣本的CT值,△CT =CT(Target Gene)-CT(內參),△△CT= △CT(sample)-△CT (control),因此目的基因相對表達水平=2-△△CT,對照組的相對表達量即為20=1[10]。
1.2.2免疫印跡雜交口腔黏膜組織用RIPA裂解液裂解(加入蛋白酶抑制劑cocktail),吹打混勻。超聲波裂解細胞,探針型超聲冰上進行適當頻率的短促沖擊,裂解混合物于4 ℃,13 000 r/min離心20 min。吸取上清液于新的離心管中,用Protein Assay Kit測定蛋白水平。蛋白樣品經十二烷基-聚丙烯酰胺凝膠電泳(SDS-PAGE),電泳后的凝膠浸于轉移緩沖液中平衡10 min,裝配轉移“三明治”,100 V,45~60 min。轉膜結束后,用TBS漂洗PVDF膜10~15 min;將膜置入含5%(w/v) 脫脂牛奶的TBS/T封閉緩沖液中,室溫搖動1 h,加入合適稀釋度的一抗[用含1%(w/v)脫脂牛奶的TBST稀釋],室溫孵育2 h,TBST漂洗膜3次,每次5~10 min;用含0.05%(w/v)脫脂牛奶的TBST稀釋的二抗(1∶10 000,HRP標記)孵育膜,室溫孵育1 h;TBST漂洗膜3次,每次5~10 min。曝光,照相保存實驗結果。Quantity One v4.62軟件分子條帶灰度值(條帶軌跡定量法),以目的蛋白/內參蛋白的半定量數值作為定量根據,并作統計分析。
2結果
2.1STATs蛋白家族在不同分期OSF、OSF并存OLP病例中表達的差異Stat1、Stat3、Stat5a的表達量與OSF分型呈正相關,即在OSF組中晚期黏膜組織樣本中的表達量明顯高于對照組(P<0.05),而Stat2、Stat4、Stat5b、Stat6在不同OSF分型中的表達量變化不顯著(P>0.05)。Stat1、Stat2、Stat3、Stat4、Stat5a、Stat5b、Stat6在OSF并存OLP組中表達均高于對照組,其中Stat1、Stat3、Stat5a、Stat5b變化顯著(P<0.05),見圖1。
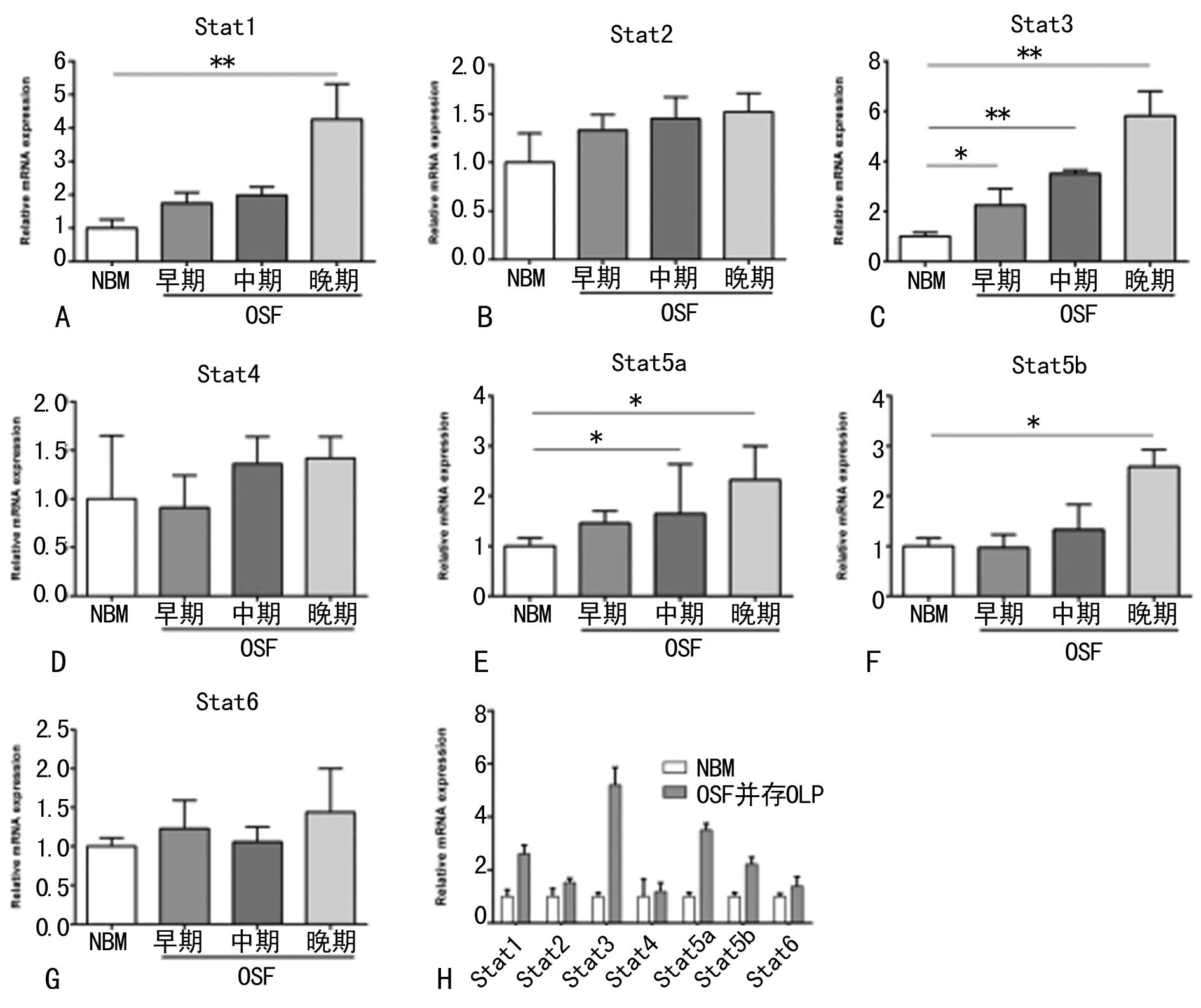
圖1 STATs蛋白家族的表達差異分析
2.2OSF并存OLP組中Stat1、Stat3、Stat5a的活化狀態比較根據RT-PCR試驗結果,筆者篩選出OSF并存OLP組與對照組相比,變化顯著的分子(Stat1、Stat3、Stat5a),免疫印跡雜交檢測蛋白水平上述分子的變化情況,并進一步檢測其活化形式-磷酸化水平在各組病例中的表達情況。結果表明Stat1和p-Stat1在OSF并存OLP組中的表達水平與對照組相比顯著增加(P<0.01),Stat3和p-Stat3(Ser727)在OSF并存OLP組中的表達水平與對照組相比明顯上調,差異有統計學意義(P<0.05)。Stat5a在OSF并存OLP組中顯著上調(與對照組比較),而p-Stat5a在各組中變化不顯著(圖2)。
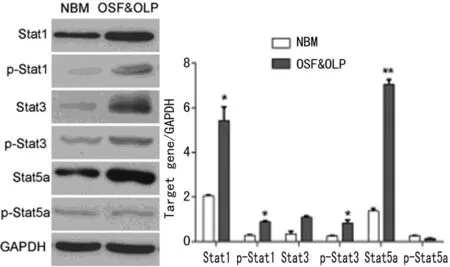
圖2 Stat1、Stat3、Stat5a的磷酸化變化
3討論
OSF是一種慢性、隱匿性的口腔黏膜病,易發于頰、軟腭、唇、舌、口底、咽等部位,具有癌變傾向,臨床表現主要包括,口腔黏膜上皮增生或萎縮、黏膜下層膠原的堆積和變性,在OSF中、后期出現血管閉塞、開口困難。OSF的具體機制目前尚不清楚,但咀嚼檳榔、遺傳、免疫反應等因素被認為是導致OSF的綜合因素,這些因素共同作用導致了OSF的發生[11-12]。OLP也是常見的慢性口腔黏膜病之一,臨床上可以表現為多種復雜的聯合病損,比如丘疹樣的、斑塊樣的以及潰瘍性的病變[13-14]。Pindbrog于1970年報道OSF與OLP并存[6],我國目前OSF并存OLP的發病率約為6.5%。由于OSF、OLP都被WHO列為癌前狀態,因此,了解OSF、OLP的具體發生機制,對于預防治療口腔腫瘤具有一定的指導意義。
從病理改變角度出發,細胞外基質的降解/合成平衡的紊亂是導致OSF的主要原因,主要的病理改變表現為上皮細胞形態學變化和結締組織成分和結構的改變兩個部分[15]。在OSF早期,炎性反應是重要的病理表現,隨著病程延續,大量炎性分子的異常表達引起核轉錄因子κB(NF-κB)、轉錄因子AP-1(TFAP-1)及信號轉導子和轉錄激活因子STATs的異常激活,并最終引起細胞凋亡調控異常[16-17]。上皮過度角化、上皮下固有層淋巴細胞帶狀浸潤及基底層細胞液化變性是OLP的主要病理特征。研究表明,OLP的發生與轉錄因子的異常表達或激活具有相關性。臨床研究表明OSF并存OLP的病理改變可以同時具有OSF、OLP的一些基本病理改變,例如在一些部位可以觀察到在OSF病理改變的基礎上出現了如固有層淋巴細胞浸潤帶、基底細胞液化變性等OLP的特征性病理改變[18-19]。
STATs蛋白家族由Stat1、Stat2、Stat3、Stat4、Stat5a、Stat5b、Stat6 7個成員組成,由750~850個氨基酸組成,成員分子均含有N端結構域、DNA結構域,以及SH2/SH3結構域,以及具有轉錄活性功能的結構域。在生長因子、細胞因子等信號分子刺激激活后改變構型形成二聚體,并在核內聚集,結合特定的靶DNA啟動子序列,促進相應的基因的轉錄,發揮調節細胞的生長、分化、凋亡等生物學效應,是腫瘤發生信號通路中非常的調控因子,處于持續激活狀態的STATs在腫瘤的發生、發展中起著重要作用[20-21]。本研究表明,Stat1、Stat2、Stat3、Stat4、Stat5a、Stat5b、Stat6在各組病例黏膜組織中的表達有差異。Stats各成員分子羧基端差異較大,因此具有相對特異的功能,Stat1、Stat2主要參與了干擾素的信號傳導,而Stat4和Stat6則主要調節T細胞的分化過程,Stat3、Stat5可以被多種細胞因子激活,發揮更加復雜的生物學效應。實驗結果表明,Stat1、Stat3、Stat5a的表達量與OSF分型呈正相關,即在OSF組中晚期黏膜組織樣本中的表達量明顯高于對照組(P<0.05),而Stat2、Stat4、 Stat5b、Stat6在不同OSF分型中的表達量變化不顯著(P>0.05)。進一步研究OSF并存OLP組及對照組中STATs的表達變化,Stat1、Stat2、Stat3、Stat4、Stat5a、Stat5b、Stat6在OSF并存OLP組中的表達量均高于對照組,其中Stat1、Stat3、Stat5a、Stat5b變化顯著(P<0.05)。
磷酸化修飾是Stats家族蛋白重要的翻譯后修飾,JAK-STST信號通路的激活正是通過磷酸化過程來實現的[22]。因此,筆者選擇表達水平變化較大的分子考察其磷酸化變化的水平。與RT-PCR結果一致,即Stat1在OSF并存OLP組中的表達水平與對照組比較顯著增加(P<0.05),同時其活化形式p-Stat1在OSF并存OLP組中也顯著上調,說明在OSF并存OLP狀態下,Stat1處于異常活化的狀態。Stat3和p-Stat3(Ser727)在OSF并存OLP組中的表達水平與對照組相比明顯上調,差異有統計學意義(P<0.05)。與對照組比較,Stat5a在OSF并存OLP組中顯著上調,而p-Stat5a在各組中變化不顯著。對于這一結果,筆者認為可能的原因是Stat5a在OSF或OLP過程中表達量上調,但其活化過程存在組織特異性,在口腔黏膜組織中發生磷酸化水平較低。而Stats家族蛋白活化過程在OSF、OLP過程中的具體作用機制,將是下一步的研究方向。
參考文獻
[1]Kamath VV.Surgical interventions in oral submucous fibrosis:a systematic analysis of the literature[J].J Maxillofac Oral Surg,2015,14(3):521-531.
[2]Krupaa RJ,Sankari SL,Masthan KM,et al.Oral lichen planus:An overview[J].J Pharm Bioallied Sci,2015,7(Suppl 1):S158-S161.
[3]李敏.MMP-9在口腔黏膜下纖維化及其并存口腔扁平苔蘚中的表達及意義[D].長沙:中南大學,2012.
[4]Shivakumar HR,Batra J,Upasi AP,et al.Evaluation of elongated styloid process in patients with oral submucous fibrosis using panoramic radiographs[J].J Maxillofac Oral Surg,2014,13(4):556-559.
[5]Yanjia H,Xinchun J.The role of epithelial-mesenchymal transition in oral squamous cell carcinoma and oral submucous fibrosis[J].Clin Chim Acta,2007,383(1/2):51-56.
[6]Keshav R,Narayanappa U.Expression of proliferating cell nuclear antigen (PCNA) in oral submucous fibrosis:an immunohistochemical study[J].J Clin Diagn Res,2015,9(5):ZC20-ZC23.
[7]孟慶玉,彭解英.OSF并存OLP患者臨床資料分析及病理研究[J].中國實用口腔科雜志,2011,4(2):43-45.
[8]Meier JA,Larner AC.Toward a new STATe:the role of STATs in mitochondrial function[J].Semin Immunol,2014,26(1):20-28.
[9]Qi ZL,Yin F,Lu LA,et al.Baicalein reduces lipopolysaccharide-induced inflammation via suppressing JAK/STATs activation and ROS production[J].Inflamm Res,2013,62(9):845-855.
[10]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2[-Delta Delta C(T)] method[J].Methods,2001,25(4):402-408.
[11]Franchi A,Gallo O,Paglierani M,et al.Inducible nitric oxide synthase expression in laryngeal neoplasia:correlation with angiogenesis[J].Head Neck,2002,24(1):16-23.
[12]李明,彭解英.微血管病變與口腔黏膜下纖維性變[J].臨床口腔醫學雜志,2006,22(10):635-636.
[13]馬哲.口腔扁平苔蘚發病及其惡變機理的探討[D].石家莊:河北醫科大學,2008.
[14]Alves MG,Do Carmo Carvalho BF,Balducci I,et al.Emotional assessment of patients with oral lichen planus[J].Int J Dermatol,2015,54(1):29-32.
[15]胥紅,劉蜀凡,沈子華,等.口腔粘膜下纖維性變組織中Ⅰ型和Ⅲ型膠原免疫組化及定量分析[J].實用口腔醫學雜志,2000,16(1):52-54.
[16]Kaur J,Jacobs R.Proinflammatory cytokine levels in oral lichen planus,oral leukoplakia,and oral submucous fibrosis[J].J Korean Assoc Oral Maxillofac Surg,2015,41(4):171-175.
[17]Khan I,Kumar N,Pant I,et al.Activation of TGF-β pathway by areca nut constituents:a possible cause of oral submucous fibrosis[J].PLoS One,2012,7(12):e51806.
[18]謝迪.MC及MCT在口腔黏膜下纖維化及其并存口腔扁平苔蘚中的表達研究[D].長沙:中南大學,2012.
[19]Que GY,Peng JY.Oral submucous fibrosis complicated with lichen planus disease[J].Hunan Yi Ke Da Xue Xue Bao,2000,25(2):200.
[20]Yang J,Chatterjee-Kishore M,Staugaitis SM,et al.Novel roles of unphosphorylated STAT3 in oncogenesis and transcriptional regulation[J].Cancer Res,2005,65(3):939-947.
[21]劉瑋瑋.STATs蛋白家族在口腔黏膜白斑癌變中的作用研究[D].廣州:南方醫科大學,2011.
[22]Kile BT,Schulman BA,Alexander WS,et al.The SOCS box:a tale of destruction and degradation[J].Trends Biochem Sci,2002,27(5):235-241.
作者簡介:萬英明(1974-),副主任醫師,碩士,主要從事口腔修復學、口腔種植醫學、口腔生物力學研究工作。
doi:·經驗交流·10.3969/j.issn.1671-8348.2016.16.032
[中圖分類號]R246.83
[文獻標識碼]B
[文章編號]1671-8348(2016)16-2254-04
(收稿日期:2015-12-15修回日期:2016-02-26)

