關于中考中氫氧化鈉變質問題的示例與解析
劉家亮
氫氧化鈉暴露在空氣中極易潮解和變質,但變質的情況我們肉眼無法直接觀察,需要設計實驗來證明。這類題目的綜合型很強,考點也比較多,對學生的分析問題、解決問題的要求比較高,導致多數學生束手無策。以下是筆者將氫氧化鈉變質的問題進行剖析過程,以便給予廣大師生幫助。
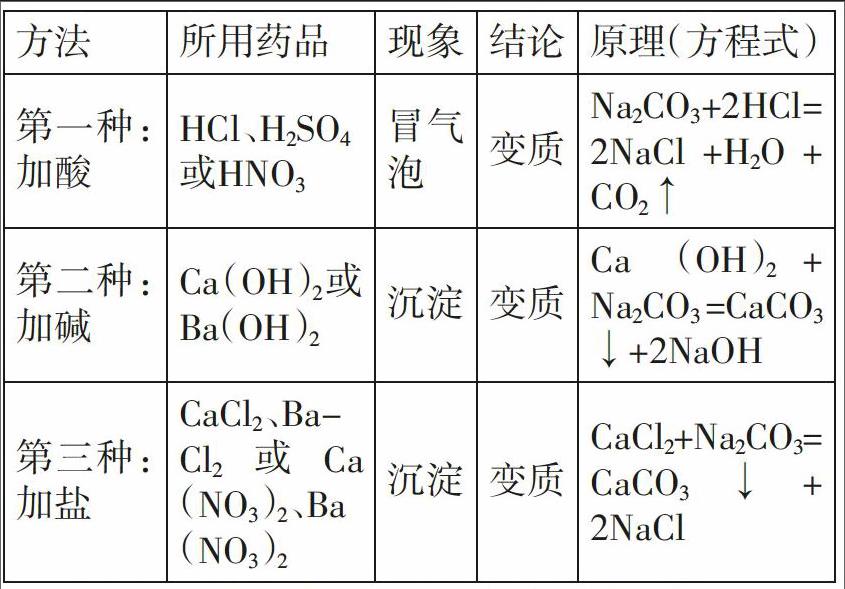
一、氫氧化鈉變質的證明
證明:氫氧化鈉暴露在空氣中會變質,原理是:2NaOH+CO2=Na2CO3+H2O,根據反應原理證明變質的關鍵,在于要證明最終固體混合物中是否有碳酸鈉,所以證明氫氧化鈉變質有以下幾種方法:
二、氫氧化鈉部分還是全部變質的證明
前面的已經探究證明,氫氧化鈉變質的情況有兩種部分變質和全部變質。根據變質的原因分析變質后的成分是:部分變質的成分為NaOH和Na2CO3;全部變質為Na2CO3。所以判斷的關鍵在于是否有NaOH的存在。此時學生容易產生三種誤區:第一種是直接用酸堿指示劑來檢驗;第二種是直接加可溶性的銅鹽或者鐵鹽根據是否有沉淀來判斷;第三種是先加Ca(OH)2溶液或Ba(OH)2溶液,再加銅鹽或者鐵鹽根據是否有沉淀來判斷。出現這三種誤區的根本原因,學生并沒有弄清楚碳酸鈉的存在,對于檢驗氫氧化鈉的產生了極大地干擾。第一種誤區的原因是碳酸鈉溶液也顯堿性;第二種誤區的原因是銅鹽和鐵鹽與碳酸鈉溶液也可以產生沉淀;第三中誤區存在的原因是先加氫氧化鈣溶液或者氫氧化鋇溶液,雖然除去了碳酸鈉,但除去碳酸鈉的同時生成氫氧化鈉,后續就無法證明氫氧化鈉是生成的還是原有的,因此證明氫氧化鈉之前先要徹底的除去碳酸鈉,再進一步證明氫氧化鈉的存在。
操作流程:
變質后的物質→加足量的中性鹽(CaCl2、Ca(NO3)2、BaCl2、Ba(NO3)2溶液,完全除去碳酸鈉,過濾)→證明氫氧化鈉存在
例題:化學課后,化學興趣小組的同學在整理實驗桌時,發現有一瓶氫氧化鈉溶液沒有塞橡皮塞,征得老師同意后,開展了以下探究:
探究問題:該氫氧化鈉溶液是全部變質還是部分變質呢?
猜想與假設:1:氫氧化鈉溶液部分變質。猜想2:氫氧化鈉溶液全部變質。
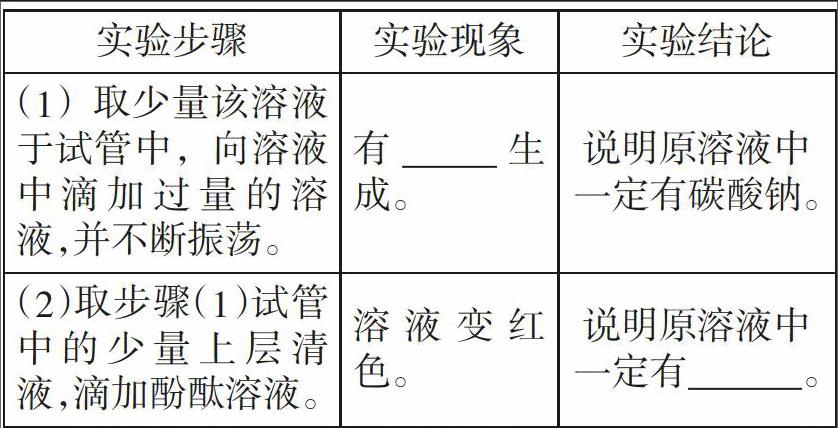
實驗方案
實驗結論:該氫氧化鈉溶液_____________(填“部分”或“全部”)變質。
反思與評價:
(1)氫氧化鈉溶液露置于空氣中容易變質,請寫出相關反應的化學方程式:_______。
(2)在上述【實驗探究】中,小明提出可用氫氧化鈣溶液代替氯化鈣溶液,你認為該方案__________(填“可行”或“不可行”)。
解析:氫氧化鈉溶液由于吸收空氣中的CO2氣體而變質成為Na2CO3,因此該白色固體的成分可能為Na2CO3或者Na2CO3和NaOH的混合物。
全部變質:白色固體是Na2CO3。
方案:取樣,足量的水,使其完全溶解。再取少量溶液于試管中,并加入過量的CaCl2溶液,過濾后向濾液中滴加CuCl2溶液(或FeCl3溶液)。
結論:產生白色沉淀,證明有Na2CO3;滴加CuCl2溶液(或FeCl3溶液),無現象,證明無NaOH。由此證明該白色固體為Na2CO3。
部分變質:白色固體是NaOH和Na2CO3的混合物。
方案:取樣,足量的水,使其完全溶解。再取少量溶液于試管中,并加入過量的CaCl2溶液,過濾后向濾液中滴加CuCl2溶液(FeCl3或酚酞試液)溶液。
結論:有白色沉淀生成,證明有Na2CO3;滴加CuCl2溶液(或FeCl3溶液或酚酞指示劑),有藍色沉淀(或紅褐色沉淀或變紅)生成,證明有NaOH。由此證明該白色固體是含有NaOH和Na2CO3的混合物。
有關氫氧化鈉的變質的問題,在中考化學試題中是常考的重要考點,其考題在中考中頻頻出現,答題情況并不理想,學生出錯率較高。在教學中,氫氧化鈉是酸堿鹽中重點學習和掌握的化合物之一,屬于酸堿鹽教學中的重點,學生難以掌握。從學生的能力培養來說,通過以上的示例與解析,可以培養學生的觀察能力、實驗能力、思維能力、和知識拓展能力。

