大麥β-淀粉酶基因在大腸桿菌中的異源表達
朱培,李崎,朱林江,賀鵬宇,李永仙*
1(江南大學 釀酒科學與工程研究室,江蘇 無錫,214122) 2(江南大學 生物工程學院,江蘇 無錫,214122)
?
大麥β-淀粉酶基因在大腸桿菌中的異源表達
朱培1,李崎2,朱林江3,賀鵬宇4,李永仙1*
1(江南大學 釀酒科學與工程研究室,江蘇 無錫,214122)2(江南大學 生物工程學院,江蘇 無錫,214122)
摘要大麥來源的β-淀粉酶具有穩定性高和工業應用效果好的優點,被廣泛應用于食品、釀造以及糧食加工,但是其制備成本高,價格較昂貴。該研究使用大腸桿菌異源表達大麥來源的β-淀粉酶。首先通過基因合成技術獲得密碼子優化的大麥來源的β-淀粉酶基因,將該基因通過質粒pET28a(+)在大腸桿菌BL21(DE3)中過量表達獲得重組β-淀粉酶。其次,對重組表達的β-淀粉酶和大麥中直接提取的β-淀粉酶進行酶學性質比較分析。結果表明,重組表達的β-淀粉酶其分子質量大小與大麥中β-淀粉酶一致,即59 kDa,重組的β-淀粉酶比酶活由大麥來源的588 U/mg降為285.5 U/mg,最適作用溫度降低了10 ℃,最適pH保持一致。所以,大麥β-淀粉酶能夠在細菌中高效表達,但是其酶學性質發生較大改變。
關鍵詞大麥;β-淀粉酶;異源表達;大腸桿菌
淀粉酶是水解淀粉和糖原的一類酶的總稱,主要存在于動物、植物以及微生物中[1],一般作用于可溶性淀粉、糖原、α-1,4-葡聚糖等,水解其中的α-1,4-糖苷鍵。根據氨基酸序列的同源性,分屬糖苷水解酶類的14族[2]。根據淀粉酶對淀粉的不同催化水解方式,可將其分為4種淀粉酶,即α-淀粉酶、β-淀粉酶、葡萄糖淀粉酶和脫支酶。其中β-淀粉酶,又稱α-1,4-葡聚糖麥芽糖水解酶(EC3.2.1.2),是一種外切型淀粉酶。它從淀粉的非還原性末端開始,依次切開間隔的α-1,4糖苷鍵,生成麥芽糖和β-極限糊精[3],其在啤酒釀造、糖漿制造、紡織與醫療中具有重要應用[4-5]。
現有β-淀粉酶酶制劑主要來源于植物提取和微生物發酵生產。其中植物來源β-淀粉酶酶制主要提取于大麥、甘薯、大豆等糧食作物中[6],而微生物生產β-淀粉酶酶制主要是通過枯草芽孢桿菌等表達生產。相比于微生物來源的β-淀粉酶,植物來源的β-淀粉酶具有酶活高、熱穩定性好、pH作用范圍廣等特點[7],所以受工業應用的偏愛,其中應用最廣泛的是大麥來源的β-淀粉酶酶制劑。但是,大麥β-淀粉酶經過提取獲得,不但消耗大量的大麥[8],而且制備成本偏高,其價格高居不下。雖然微生物產β-淀粉酶可實現高酶活發酵,而且誘變后可提高其酶活力和熱穩定性[9],但是根據工廠應用經驗,比如在制糖過程中,微生物產β-淀粉酶仍難以達到大麥來源酶制劑的使用效果。因此本論文將大麥β-淀粉酶基因導入大腸桿菌中進行異源表達[8,10],研究大腸桿菌重組的β-淀粉酶的性質,同時將其與大麥來源的β-淀粉酶進行比較。
1材料與方法
1.1材料
1.1.1β-淀粉酶基因來源
通過NCBI查得大麥來源β-淀粉酶基因序列(GenBank:D21349.1),交付蘇州金唯智生物科技有限公司合成,獲得完整的密碼子優化的大麥β-淀粉酶基因序列,預設計酶切位點為XhoI與NdeI。
1.1.2質粒以及其他試劑
質粒pMD19T-simple購自TaKaRa生物工程有限公司,表達載體pET28a(+)質粒,大腸桿菌JM109與BL21(DE3)均由本研究室保藏。TaqDNA polymerase、克隆載體pMD19T-simple、Mini BEST基因組提取試劑盒、感受態細胞制作試劑盒、T4DNA連接酶、限制性內切酶XhoI和NdeI購自TaKaRa生物工程有限公司;San prep柱式DNA膠回收試劑盒購自上海生工生物工程有限公司。
1.2方法
1.2.1重組表達載體的構建
大麥β-淀粉酶基因amyB首先插入到pMD19T-simple載體進行亞克隆以方便基因后續插入到pET28a(+)中,將重組質粒交由上海生工公司測序。雙酶切獲得目的基因,將目的基因與雙酶切后的pET28a(+)質粒連接后,涂布與含硫酸卡那霉素的LB平板于37 ℃培養過夜,挑選陽性pET28a(+)-amyB重組表達質粒單菌落于50 mL LB培養基后,提取質粒進行雙酶切驗證。所有限制性酶切反應體系均參照試劑盒說明書配制。
1.2.2大腸桿菌的誘導表達
挑取含pET28a(+)-amyB重組表達質粒單菌落于含有硫酸卡納霉素的LB液體培養基中,37 ℃ 200 r/min過夜培養;以4%的接種量轉接到含硫酸卡納霉素的50 mL的新鮮LB液體培養基中,37 ℃ 200 r/min培養至OD600≈1.0時加入誘導劑IPTG至終濃度為0.06 mmol/L;轉移至24 ℃ 150 r/min培養6 h后于4 ℃ 8 000 r/min離心10 min,收集菌體及上清液;上清液經透析后使用蛋白超濾管濃縮,于4 ℃保存,同時培養含有空pET28a(+)質粒的宿主菌,誘導培養作為陰性對照。
1.2.3重組蛋白的收集與純化鑒定[11-12]
菌液離心去其上清液,加入磷酸緩沖液懸浮后在冰浴條件下利用超聲細胞破碎儀破碎細胞,使超聲時間累積15 min(工作時間:4 s;間隙時間:6 s;工作次數:90)后4 ℃ 8 000 r/min離心10 min,收集上清液,作為粗蛋白樣品。用pH 7.0磷酸鹽緩沖液稀釋10倍后,采用鎳柱純化和AKTA蛋白純化系統進行分離,其中AKTA蛋白純化選擇陰離子交換色譜Mono Q。純化結束后收集吸收峰,進行SDS-PAGE電泳檢測。
1.2.4大麥來源β-淀粉酶的純化
用pH 6.0磷酸緩沖液稀釋大麥來源的β-淀粉酶酶制劑,采用AKTA蛋白純化系統進行分離,選擇凝膠柱Superdex G75。過柱完成后收集吸收峰,經過SDS-PAGE電泳進行檢測。
1.2.5β-淀粉酶的酶學性質分析[13-14]
使用Megazyme公司的Beta-Amylase Assay Procedure試劑盒分別測定β-淀粉酶的最適溫度(溫度范圍40~70 ℃)、50 ℃溫度穩定性、最適pH(pH范圍4.0~8.0)與pH 6.0時的穩定性。
2結果與分析
2.1pET28a(+)-amyB表達載體的構建與在大腸桿菌中的誘導表達
pET28a(+)-amyB的XhoI與NdeI雙酶切結果如圖1A所示,圖中大小在1 600 bp左右為目的基因,測序結果證實重組質粒構建正確。將其重組質粒轉化到大腸桿菌BL21(DE 3)中進行誘導表達。誘導表達后,收集破碎細菌液上清后經SDS-PAGE分析,由圖1B可見,與誘導表達空pET28a(+)質粒的宿主菌相比較,重組載體誘導表達后在60 kDa左右處有明顯的特異條帶,說明新載體在誘導表達后有新蛋白產生,而大麥來源的β-淀粉酶的蛋白分子質量在59 kDa左右。此外,對該蛋白條帶進行回收純化,用于質譜鑒定,其肽段匹配結果與蛋白NCBI ID為gi|113786相似度最大,分子質量為59 609,為大麥β-淀粉酶來源。
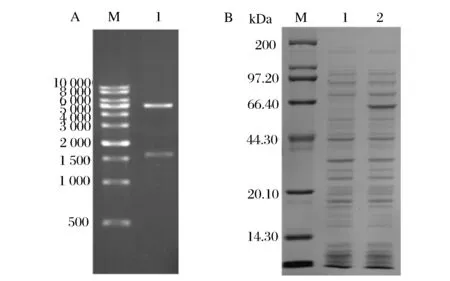
(A)重組質粒pET28a(+)-amyB的XhoI與NdeI雙酶切核酸電泳圖M-DNAMarker;1-XhoI和NdeI雙酶切)(B)重組質粒pET28a(+)-amyB大腸桿菌中的誘導表達β-淀粉酶電泳圖M-蛋白質標準分子量;1-誘導含空質粒pET28a(+)的大腸桿菌胞內蛋白;2-誘導含質粒pET28a(+)-amyB的胞內蛋白圖1 重組質粒pET28a(+)-amyB的雙酶切驗證與重組β-淀粉酶的誘導表達電泳圖Fig.1 Digestion of recombinant plasmid and induced expression of recombinant β-amylase
2.2重組β-淀粉酶的純化[15]
由于重組β-淀粉酶含有組氨酸標記,因此首選鎳柱純化粗酶液。多次重復試驗表明目的蛋白與雜蛋白同時被洗脫,重組β-淀粉酶無法與鎳柱結合。如圖2A所示,目的蛋白隨著雜蛋白在50 mmol/L咪唑濃度下一起被洗脫下來(箭頭所示為目的蛋白)。因此改用AKTA蛋白純化系統來純化重組表達的β-淀粉酶。收集的上清液經過透析,超濾濃縮后,選擇陰離子交換色譜柱Mono Q進一步純化β-淀粉酶,通過預實驗,采用含有0.15 mol/L NaCl pH 7.4的磷酸鹽緩沖液洗脫,收集洗脫峰經過SDS-PAGE鑒定其中峰A6是BL21(DE3)異源表達的大麥β-淀粉酶,如圖2C所示,純化的最終結果得到1條單一的蛋白條帶,大小在59 kDa左右。
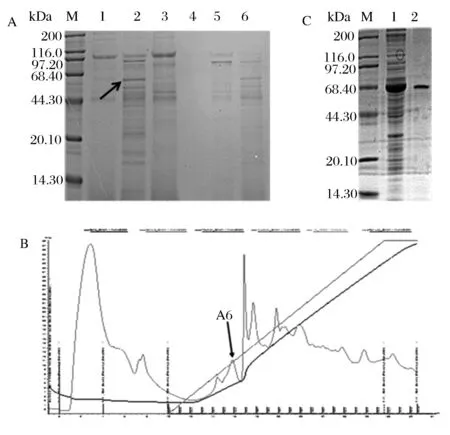
(A)粗酶液的鎳柱洗脫結果的SDS-PAGE電泳比較M-蛋白質標準分子量;1~6-洗脫液咪唑濃度分別為:20、50、100、150、200、250 mmol/L(B)粗酶液的MonoQ純化峰圖(C)重組β-淀粉酶的誘導表達電泳圖M-蛋白質標準分子量;1-純化前的重組蛋白;2-純化后的重組蛋白圖2 重組菌誘導表達β組淀粉酶的純化Fig.2 Purification of expressed β-amylase
2.3大麥來源的β-淀粉酶的純化
為了比較分析大腸桿菌中異源表達的β-淀粉酶性質,對同一大麥品種來源的β-淀粉酶制劑進行了純化。使用AKTA蛋白純化系統純化大麥來源β-淀粉酶酶制劑,選擇凝膠色譜柱Superdex G75純化大麥β-淀粉酶,以pH 6.0的PBS洗脫。凝膠過濾色譜Superdex G75峰圖見圖3A,SDS-PAGE鑒定結果為峰B6為β-淀粉酶,純化結果如圖3B所示,SDS-PAGE得到單一清晰條帶,蛋白分子質量在59 kDa附近。
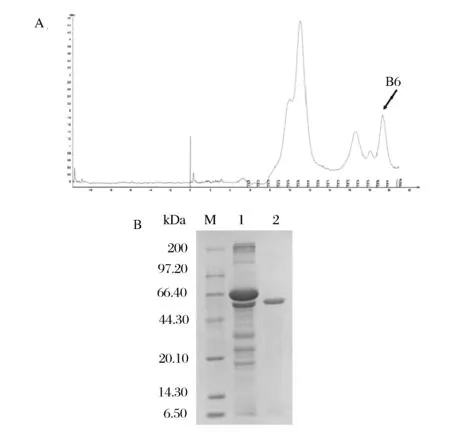
(A)β-淀粉酶Superdex G-75純化峰圖(B)大麥來源β-淀粉酶的SDS-PAGE結果M-蛋白質標準分子量;1-純化前的粗蛋白;2-純化后的β-淀粉酶圖3 大麥來源β-淀粉酶的純化Fig.3 Purification of β-amylase from Barley
2.4重組β-淀粉酶與大麥來源β-淀粉酶的酶學性質比較
取純化后的重組β-淀粉酶酶液(485.5 U/mL)與大麥來源純化的β-淀粉酶酶液(10 000 U/mL),使用愛爾蘭Megazyme公司的Beta-Amylase Assay Procedure試劑盒專一性測定β-淀粉酶的酶活,從而比較比酶活、最適溫度、溫度穩定性、最適pH與pH穩定性,結果如表1所示。

表1 不同來源β-淀粉酶酶學性質的比較
如圖4A所示,大麥來源的β-淀粉酶的最適溫度為55 ℃,大腸桿菌重組表達的β-淀粉酶的最適溫度變為45 ℃,與大麥來源β-淀粉酶相比,重組酶的最適溫度下降了10 ℃。
分別在50 ℃條件下處理大麥來源、大腸桿菌表達的β-淀粉酶,測其酶活,結果如圖4B所示。在50 ℃時,重組蛋白的半衰期相比原始β-淀粉酶減少了40 min,發現β-淀粉酶在大腸桿菌中重組表達后熱穩定性顯著下降。
使用不同pH的磷酸緩沖液比較β-淀粉酶酶活,在40 ℃條件下測其酶活,如圖4C所示,兩種β-淀粉酶的最適pH均為6.0。
在pH 6.0的磷酸緩沖液中,在40 ℃條件下測兩種β-淀粉酶的pH穩定性,如圖4D所示。兩種β-淀粉酶的半衰期大概都在6 h左右,下降趨勢差別不大,經過大腸桿菌的重組表達后,β-淀粉酶的pH穩定性與原大麥β-淀粉酶的pH穩定性相比基本保持不變。
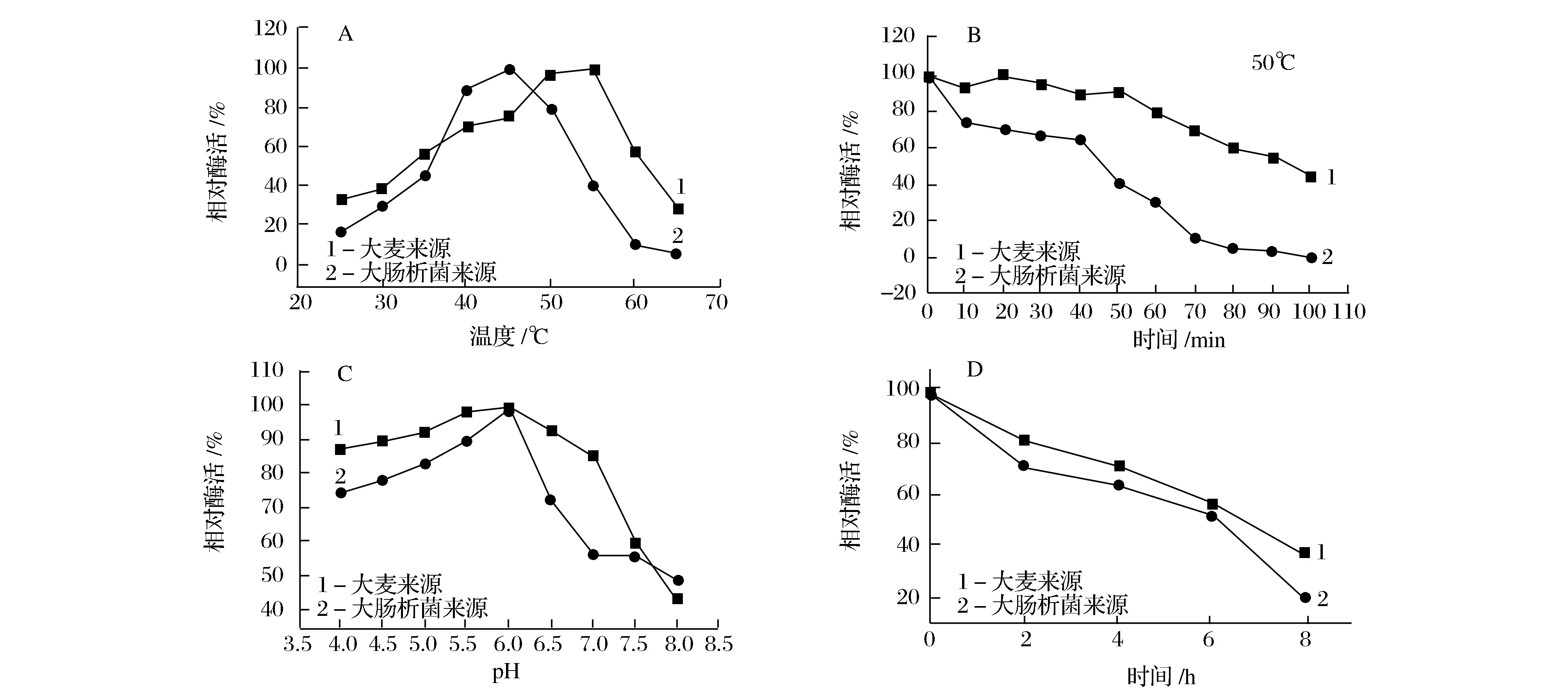
(A)最適溫度的比較;(B)50 ℃時的熱穩定性的比較;(C)最適作用pH的比較;(D)pH 6.0時的穩定性的比較圖4 重組β-淀粉酶與直接來源大麥的β-淀粉酶的酶學性質比較分析Fig.4 Comparative analysis of enzymatic properties between recombinant β-amylase and purified barley β-amylase
3討論
論文針對大麥來源的β-淀粉酶在大腸桿菌中異源表達進行了研究,結果表明經過密碼子優化的大麥β-淀粉酶能夠在大腸桿菌中高效表達,通過SDS-PAGE分析能夠清晰判斷,高于之前的研究報道[16]。但是,經過凝膠色譜柱和離子交換柱純化后的重組β-淀粉酶酶學性質與大麥中直接提取的β-淀粉酶具有一定差異。重組β-淀粉酶的熱穩定性下降了10 ℃,比酶活由大麥來源的588 U/mg降為285.5 U/mg;而重組表達對酶的最適作用pH和pH穩定性影響不大。重組的β-淀粉酶的熱穩定性和比酶活下降,這一研究結果與之前的報道不一致,可能是由于不同的β-淀粉酶基因、不同的E.coli菌株、不同的酶純化方法造成的。而本次研究重組β-淀粉酶的熱穩定性和比酶活均低于原大麥中純化的酶,這可能是由于真核來源的蛋白質在原核生物宿主中表達時,其三級結構的折疊以及蛋白的修飾不同造成的。大麥β-淀粉酶是來源于真核生物,通過糖基化修飾后可使其結構更加穩定[17],而大腸桿菌的表達系統并無糖基化修飾系統,糖基化或許是重組蛋白最適溫度與溫度穩定性下降的原因。
此外,對純β-淀粉酶的研究過程中發現,不管是重組表達的β-淀粉酶,還是直接從大麥中純化的β-淀粉酶,都是一種極不穩定的酶,容易失活。然而在自然狀態下,大麥提取的β-淀粉酶酶制劑可以較穩定的保持活性。因此,通過本次純的β-淀粉酶的比較研究,推測在大麥提取液中存在某些物質,能夠保護β-淀粉酶,提高其酶活半衰期,這也可能是植物來源的β-淀粉酶酶制劑具有更好地工業應用效果的原因之一。
參考文獻
[1]鄔顯章. 酶的工業生產技術[J]. 長春: 吉林科學技術出版桂, 1988: 40-41.
[2]Henrissat B, Davies G. Structural and sequence-based classification of glycoside hydrolases[J]. Current opinion in structural biology, 1997, 7(5): 637-644.
[3]王海明. β-淀粉酶與高輔料啤酒釀造[J]. 啤酒科技, 2000(6): 6-9.
[4]齊繼艷, 陳舟舟, 盧晗, 等. 植物 β-淀粉酶[J]. 植物生理學通訊, 2008, 44(2): 334-340.
[5]孫俊良, 梁新紅, 賈彥杰, 等. 植物 β-淀粉酶研究進展[J]. 河南科技學院學報:自然科學版,2011,39(6):1-4.
[6]Ventanas J, Córdoba J, Antequera T, et al. Hydrolysis and Maillard reactions during ripening of Iberian ham[J]. Journal of Food Science, 1992, 57(4): 813-815.
[7]Paris M, Jones M G, Eglinton J K. Genotyping single nucleotide polymorphisms for selection of barley β-amylase alleles[J]. Plant molecular biology reporter, 2002, 20(2): 149-159.
[8]夏巧玉, 江均平, 朱利泉, 等. 大豆耐熱 β-淀粉酶基因在大腸桿菌中的表達[J]. 西南農業大學學報, 2006, 28(4): 553-557.
[9]Reddy R M, Reddy P G, Seenayya G. Enhanced production of thermostable β-amylase and pullulanase in the presence of surfactants byClostridiumthermosulfurogenesSV2[J]. Process Biochemistry, 1999, 34(1): 87-92.
[10]陳軍營, 朱雪萍, 尹海燕, 等. 小麥高分子量谷蛋白亞基 1Dx5 基因在大腸桿菌中的表達[J]. 麥類作物學報, 2007, 27(4): 597-602.
[11]田亞平, 郭鴻飛, 肖光焰, 等. 一種麥芽 β-淀粉酶的純化和特性研究[J]. 食品工業科技, 2003, 24(9): 22-24.
[12]亞平. 生化分離技術[M].北京:化學工業出版社, 2006.
[13]MATHEWSON P R, Seabourn B W. A new procedure for specific determination of beta.-amylase in cereals[J]. Journal of Agricultural and Food Chemistry, 1983, 31(6): 1 322-1 326.
[14]Mccleary B V, Codd R. Measurement of β-amylase in cereal flours and commercial enzyme preparations[J]. Journal of Cereal Science, 1989, 9(1): 17-33.
[15]靳紀培. 麥芽中 β-淀粉酶的提取, 純化及應用研究[D].無錫:江南大學, 2009.
[16]YOSHIGI N, OKADA Y, SAHARA H, et al. Expression inEscherichiacoliof cDNA encoding barley β-amylase and properties of recombinant β-amylase[J]. Bioscience, Biotechnology, and Biochemistry, 1994, 58(6): 1 080-1 086.
[17]FONSECA-MALDONADO R, VIEIRA D S, ALPONTI J S, et al. Engineering the pattern of protein glycosylation modulates the thermostability of a GH11 xylanase[J]. Journal of Biological Chemistry, 2013, 288(35): 25 522-25 534.
Heterologous expression of β-amylase gene from barley inE.coli
ZHU Pei1,LI Qi2,ZHU Lin-jiang3,HE Peng-yu4,LI Yong-xian1*
1(Lab of Brewing Science and Technology, Jiangnan University, Wuxi 214122, China)2(School of Biotechnology, Jiangnan University, Wuxi 214122, China)
ABSTRACTBarley β-amylase is widely applied in food and brewing industries due to its high activities, good stability and performance. However, the low production rate and high price of barley β-amylase limit its application. In this study, the barley β-amylase was heterologously expressed in Escherich coli. The β-amylase gene was codon-optimized, inserted into plasmid pET28a (+) and over-expressed in E.coli BL21 (DE3) cells. After comparing the recombinant β-amylase with the native one from barley, the results showed that the molecular weight of the recombinant β-amylase was similar with that of the native barley β-amylase, which was about 59 kDa. Its specific activity was decreased to 285.5U/mg, which was lower than that of the enzyme from barley (588 U/mg). Furthermore, its optimum temperature was declined 10 ℃, while its optimum pH kept consistent. Therefore, barley β-amylase gene could be effectively over-expressed in bacterial cells, while its enzymatic properties altered greatly.
Key wordsbarley; β-amylase; heterologous expression; Escherichia coli
DOI:10.13995/j.cnki.11-1802/ts.201606006
基金項目:國家高技術研究發展計劃(863計劃);中央高校基本科研業務費資金和江蘇高校優勢學科建設工程項目
收稿日期:2015-12-09,改回日期:2016-01-20
第一作者:碩士研究生(李永仙為通訊作者,E-mail:yxli@jiangnan.edu.cn)。

