強化混凝對造幣廢水中鎳的去除研究
辛 成,譚 唯,王 群*,柴 彬,李 濤,劉亞淳
(1.四川省地質工程勘察院,四川成都610072; 2.西南交通大學地球科學與環境工程學院,四川成都610031)
強化混凝對造幣廢水中鎳的去除研究
辛 成1,譚 唯2,王 群2*,柴 彬2,李 濤2,劉亞淳2
(1.四川省地質工程勘察院,四川成都610072; 2.西南交通大學地球科學與環境工程學院,四川成都610031)
為了考察不同條件下強化混凝工藝對某造幣廢水中鎳的去除效果,采用預氧化及調節pH值的方法,得到鎳去除效果的最佳條件.結果表明:采用氫氧化鈉調節pH值對鎳的去除效果優于用氫氧化鈣調節pH值時鎳的去除效果;采用氫氧化鈉調節pH=9.5時,可以達到很好的去除效果,其去除率可達99.95%;芬頓試劑預氧化能力要強于次氯酸鈉的預氧化能力,當pH=8.5及pH=9.5時,隨著芬頓投加量的增加,鎳的去除率有所增加,其最佳實驗條件是pH=8.5,硫酸亞鐵的投加量為78.4 mg/L,過氧化氫投加量為52.8 mg/L,鎳去除率可達93.82%;以及pH=9.5時,硫酸亞鐵的投加量為58.8 mg/L,過氧化氫投加量為39.6 mg/L,鎳去除率可達99.95%.
強化混凝;預氧化;造幣廢水;鎳
造幣廠是國家指定的專門從事法定貨幣生產的特殊企業,造幣的獨有工藝往往會帶來一系列環境問題,其中重金屬的污染問題尤為值得關注.造幣廢水中常見的重金屬有銅、鋅、鎳等.鎳是人體必需的生命元素,但過量的鎳會對人體造成危害,可引起炎癥、癌癥、神經衰弱癥、系統紊亂、降低生育能力、致畸和致突變等[1].
根據GB8978-1996《綜合污水排放標準》中規定,總鎳的最高允許排放質量濃度為1.0 mg/L[2].造幣廢水中的鎳以離子態和絡合態的形勢存在,如果對含鎳廢水不加處理任意排放,就會對人體和環境帶來極大的危害[3-4],其處理主要采用化學沉淀法[5]、電滲析[6]、反滲透[7]及離子交換樹脂吸附[8]等方法.當造幣廢水中含有絡合態鎳時,鎳就很難去除.因此在這種情況下,便要對廢水進行預處理措施,在破絡后再進行廢水中游離鎳離子的去除與分離.絡合重金屬廢水的預處理方法常采用調節pH值、氧化還原法、化學置換法等[9].
本研究對比了調節pH值及化學預氧化等方法對造幣廢水中鎳的去除效果,得出最佳實驗條件,為造幣工業含鎳廢水處理提供參考和技術支持.
1 實驗部分
1.1 實驗材料 本實驗中采用的藥品有聚合氯化鋁(PAC);聚丙烯酰胺(PAM);硫酸亞鐵(FeSO4);過氧化氫(H2O2),上述藥品均為分析純.芬頓試劑分別由4種不同配比配制:(a)29.4 mg/L硫酸亞鐵和19.8 mg/L過氧化氫;(b)39.2 mg/L硫酸亞鐵和26.4 mg/L過氧化氫;(c)58.8 mg/L硫酸亞鐵和39.6 mg/L過氧化氫;(d)78.4 mg/L硫酸亞鐵和52.8 mg/L過氧化氫.
本實驗所用含鎳的廢水來源于某造幣工廠,無機廢水中鎳的初始質量濃度為284.00 mg/L,初始pH值為2.52.
1.2 實驗過程 取水樣1 L,在不調節pH值和不進行預氧化的條件下,在水樣中直接加入50 mg/L聚合氯化鋁和5 mg/L聚丙烯酰胺,快速攪拌1 min,慢速攪拌12 min,慢速攪拌時每隔3 min取上清液10 mL,過濾后測定混凝沉淀出水的鎳含量.攪拌完成后靜沉30 min,每隔5 min取上清液10 mL,過濾后測定混凝沉淀出水的鎳含量.
氫氧化鈣與氫氧化鈉調節pH值除鎳實驗:取1 L水樣,分別采用NaOH和Ca(OH)2調節其pH值至9.0、9.5、10.0、10.5.在上述水樣中加入50mg/L聚合氯化鋁和5 mg/L聚丙烯酰胺,快速攪拌1 min,慢速攪拌12 min,慢速攪拌時每隔3 min取上清液10 mL,過濾后測定混凝沉淀出水的鎳含量.攪拌完成后靜沉30 min,每隔5 min取上清液10 mL,過濾后測定混凝沉淀出水的鎳含量.
次氯酸鈉與芬頓試劑預氧化水樣除鎳實驗:取1 L水樣,分別加入0、10、20、30、40和50 mg/L Na-ClO,快速攪拌1 min,加入NaOH將pH值調至9.5;另向水樣中分別加入4種不同投加量的芬頓試劑,加入NaOH將水樣的pH值分別調至8.5和9.5后,投加50 mg/L聚合氯化鋁和5 mg/L聚丙烯酰胺,快速攪拌1 min,慢速攪拌12 min,慢速攪拌時每隔3 min取上清液10 mL,過濾后測定混凝沉淀出水的鎳含量,其中快速攪拌的轉速為180 r/min,慢速攪拌的轉速為60 r/min.實驗過程如圖1所示.

1.3 測定方法 鎳的質量濃度采用日本日立公司生產的日立Z-5000原子吸收分光光度計測定.當測定膜濾后水中鎳的質量濃度時,需將處理后的水樣上清液經過0.45 μm的濾膜過濾,再通過原子吸收分光光度計測定其鎳的質量濃度.鎳的原子吸收檢出限為0.01 mg/L.水樣的酸度采用PHS-4C智能酸度計(成都世紀方舟科技有限公司)測定.
2 實驗結果與分析
2.1 不經任何預處理直接添加混凝劑后鎳的去除效果 取水樣1 L,在不調節pH值和不進行預氧化的條件下,在水樣中直接加入50 mg/L聚合氯化鋁和5 mg/L聚丙烯酰胺,然后按照實驗步驟對每個時間點的水樣進行測定,如圖2所示.在不調節pH值以及不進行預氧化的情況下,直接加入混凝劑,對水樣中的鎳的去除率最高為35%.
2.2 氫氧化鈉和氫氧化鈣分別調節廢水水樣pH值后鎳的去除效果 分別采用氫氧化鈉、氫氧化鈣調節廢水水樣pH值至9.5,結果如圖3所示.由圖3可知,在反應初始階段,用氫氧化鈉調節水樣pH值后對鎳的去除效果要優于氫氧化鈣調節水樣pH值后對鎳的去除效果.當靜沉15 min后,用氫氧化鈣和氫氧化鈉調節pH值后對鎳的去除效果趨于相同,從經濟的角度考慮,氫氧化鈣的造價成本要低于氫氧化鈉,所以實際生產中,可選用氫氧化鈣調節水樣pH值.
2.3 氫氧化鈉調節廢水水樣pH值后鎳的去除效果氫氧化鈉調節pH值后鎳的剩余質量濃度和去除率隨時間的變化情況如圖4(a)和4(b)所示.從圖4(a)可以看出,隨著pH值的增大,鎳的質量濃度逐漸在降低,其原因是隨著pH值的增加,廢水水樣中的OH-含量增加,使絡合態的鎳變成游離態的鎳,并使離子態的鎳形成了難溶于水的沉淀物,導致廢水水樣中離子態鎳質量濃度減小.當pH值為9.5及以上時,鎳的去除已達到很好的效果,去除率均大于99.95%;當不調節pH值時,其鎳的去除率達35%左右,而調節 pH值后,其去除率達到99.95%,說明調節pH值后,對絡合態的鎳有一定的破絡作用,且隨著攪拌時間增加,形成的沉淀量增大,當不再產生沉淀時,鎳已基本完全形成沉淀.當pH值為10.5時,鎳的剩余質量濃度快速降低,達到較理想的鎳去除效果,當靜沉5 min時,去除率可達99.96%.當pH值分別為9.5和10時,隨時間變化,鎳的剩余質量濃度逐漸降低,當靜沉5 min時,鎳的去除率分別達到了99.95%和99.96%.從經濟的角度看,可選擇低成本高效果的方案,則用氫氧化鈉調節pH值去除鎳時最優pH值為9.5.所以,當實際生產時,可以根據實際情況選擇最優方案.
2.4 次氯酸鈉和芬頓試劑分別預氧化廢水水樣后鎳的去除效果 由于造幣廢水中通常含有絡合態鎳[10],采用預氧化方法可以將其進一步去除.為了便于生產應用,降低運行成本,本文采用預氧化與調節pH值相結合的方式來考察鎳的去除效果.將水樣調節至pH值為9.5時,投加不同量的次氯酸鈉和不同比例的芬頓試劑后,觀察鎳的剩余質量濃度隨時間的變化情況,結果如圖5所示.

圖5考察了NaClO和芬頓預氧化處理后鎳的剩余質量濃度隨時間變化情況,從圖中可以看出,芬頓預氧化后鎳的剩余質量濃度要明顯低于次氯酸鈉預氧化后鎳的剩余質量濃度,其明顯強化了鎳的去除效果.從(1)~(4)式中可知,在芬頓試劑反應過程中會產生一定量的羥基自由基、鐵離子[11-14],芬頓試劑反應如下:


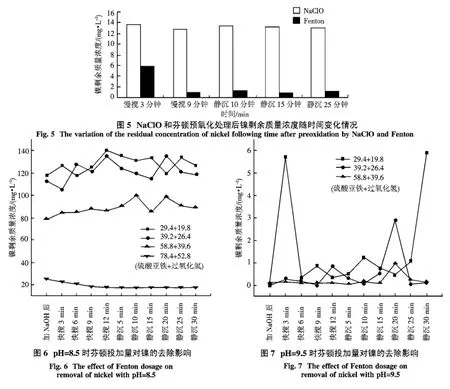
由于羥基自由基和鐵的共同作用,使鎳的去除效果較好.原因如下:1)羥基自由基氧化作用.反應過程中產生的羥基自由基將有機物氧化,使絡合態鎳釋放到水中,進而被沉淀去除;2)鐵絮體的混凝作用.在芬頓反應過程中,鐵會在加入堿后形成沉淀,而該沉淀具有很好的混凝、吸附作用,所以將水中鎳進一步去除.據江洪龍等[9]的研究表明,芬頓反應過程結束后,向其中加入氫氧化鈉,二價鐵離子與氫氧根生成黃褐色的沉淀物質,這些物質有很強的絮凝混凝效果,網捕金屬鎳沉淀物和大分子的絡合物沉淀并去除.
從圖6和圖7可以看出,當pH=8.5時,隨著芬頓投加量的增加,鎳的去除效果有所提高,當投加量為78.4 mg/L硫酸亞鐵和52.8 mg/L過氧化氫時,鎳的剩余質量濃度為17.57 mg/L,去除率達到了93.82%;當pH=9.5時,隨著芬頓投加量的增加,鎳的去除效果均達到了比較好的處理效果,鎳的剩余質量濃度為 0.14 mg/L,去除率可達99.95%.原因可能是pH值升高,對水中的絡合態鎳的破絡效果更佳,所以調節pH值在整個反應中起到了控制作用[15-17].因此pH值調節和芬頓試劑的預氧化不論是單獨使用還是聯合使用,對廢水中鎳的去除均有可觀的效果,并且在實際處理工作中,可根據實際情況(如pH值調節劑與芬頓試劑的價格)選擇最佳方案.
3 結論
1)用氫氧化鈉調節水樣pH值后對鎳的去除效果要優于用氫氧化鈣調節水樣pH值后對鎳的去除效果.用氫氧化鈉調節廢水pH值為9.5及以上時,鎳的去除已達到很好的效果,去除率均大于99.95%.
2)芬頓預氧化除鎳效果優于次氯酸鈉預氧化除鎳效果.隨著芬頓投加量的增加,鎳的去除效果均達到了比較好的處理效果,其最佳實驗條件是: (a)pH=8.5,硫酸亞鐵的投加量為78.4 mg/L,過氧化氫投加量為 52.8 mg/L,鎳去除率可達93.82%;(b)pH=9.5,硫酸亞鐵的投加量為58.8 mg/L,過氧化氫投加量為39.6 mg/L,鎳去除率可達99.95%.在實際生產過程中可根據實際情況選擇最優方案.
[1]陳爾余.天然沸石的改性及處理含鎳廢水的研究[D].金華:浙江大學,2006.
[2]國家環境保護局,國家技術監督局.污水綜合排放標準GB8978-1996[S].[1996-10-04].
[3]郭琳,查紅平,廖小剛,等.化學沉淀法處理線路板廠含鎳廢水[J].環境工程,2011(4):50-53.
[4]呂小梅.結晶沉淀法處理化學鍍鎳廢水的研究[D].哈爾濱:哈爾濱工業大學,2009.
[5]ANKRAH D A,SOSLASHGAARD E G.The applicability of iron and manganese precipitation bacteria in drinking water systems[J].Nanotechnology Perceptions,2009,5(3):209-216.
[6]PANDIAN G,RAMAKRISHNAN K,GANAPATHY S,et al.Oxidized multiwalled carbon nanotubes as adsorbent for the removal of manganese from aqueous solution[J].Environmental Science and Pollution Research,2013,20(2):987-996.
[7]LIM J L,PARK N S,KANG S,et al.Iron and manganese fouling in microfiltration as a pretreatment of seawater reverse osmosis processes[J].Desalination and Water Treatment,2011,33(1/2/3):323-328.
[8]楊勇.濕地系統處理重金屬廢水的應用研究[D].上海:同濟大學,2007.
[9]江洪龍,俞馬宏.含有機絡合劑的銅鎳廢水化學處理研究[D].南京:南京理工大學,2013.
[10]李巖.電鍍廢水處理的新工藝[D].武漢:中南民族大學,2009.
[11]FU F L,WANG Q,TANG B.Fenton and Fenton-like reaction followed by hydroxide precipitation in the removal of Ni(II) from Ni-EDTA wastewater:a comparative study[J].Chem Engineering J,2009,155(3):769-774.
[12]NGAHW S W,HANAFIAH M A K M.Removal of heavy metal ions from wastewater by chemically modified plant wastes as adsorbents:a review[J].Bioresource Technology,2008,99:3935-3948.
[13]NEYENS E,BAEYENS J.A review of classic Fenton’s per oxidation as an advanced oxidation technique[J].J Hazard Mater,2003,98(10):33-50.
[14]袁雪.化學沉淀-鐵氧體法處理重金屬離子廢水的實驗研究[D].重慶:重慶大學,2007.
[15]LINDSEY M E,TARR M A.Quantization of hydroxyl radical during Fenton oxidation following a single addition of iron and peroxide[J].Chemosphere,2000,41:409-417.
[16]KANG N,LEE S D,YOON J Y.Kinetic modeling of Fenton oxidation of phenol and monochlorophenols[J].Chemosphere,2002,47:915-924.
[17]LIN S H,LEU H G.Operating characteristics and kinetic studies of surfactant wastewater treatment by Fenton oxidation[J].Water Research,1999,33(7):1735-1741.
Study on Removal of Nickel from Mint Wastewater by Enhanced Coagulation
XIN Cheng1,TAN Wei2,WANG Qun2,CHAI Bin2,LI Tao2,LIU Yachun2
(1.Sichuan Institute of Geological Engineering Investigation,Chengdu 610072,Sichuan; 2.Faculty of Geosciences and Environmental Engineering,Southwest Jiaotong University,Chengdu 610031,Sichuan)
Preoxidation and coagulation sedimentation were used to remove the nickel of the inorganic wastewater from a mint,using calcium hydroxide and sodium hydroxide to adjust pH to select the optimal reaction condition.The results are as follows:the removal of nickel by using sodium hydroxide is better than that by using calcium hydroxide.The removal of nickel is the best when the pH is 9.5 by using the sodium hydroxide and the rate of removal is up to 99.95%.And the preoxidation ability of Fenton reaction is better than that of Sodium hypochlorite,when the pH is 8.5 and 9.5,respectively.The removal rate of nickel is increased with the increasing of Fenton’s quantity,and the removal rate of nickel is up to 93.82%when the pH is 8.5 with the concentration of ferrous sulfate of 78.4 mg/L and the concentration of hydrogen preoxide of 52.8 mg/L.Whst’s more,the removal rate of nickel is up to 99.95%when the pH is 9.5 with the concentration of ferrous sulfate of 58.8 mg/L,and the concentration of hydrogen preoxide of 39.6 mg/L.
enhanced coagulation;pre oxidation;mint wastewater;nickel
X703.1
A
1001-8395(2016)04-0576-05
10.3969/j.issn.1001-8395.2016.046.022
(編輯 李德華)
2015-11-11
國家自然科學基金(51178134)
*通信作者簡介:王 群(1980—),男,副教授,主要從事飲用水及污水處理技術的研究,E-mail:wangqun_hit@126.com

