利用正交試驗(yàn)法優(yōu)化團(tuán)花不定芽分化培養(yǎng)基
黃浩++蒙愛(ài)東


摘要:為了獲得團(tuán)花不定芽分化的最佳激素組合和外植體類(lèi)型,以團(tuán)花20~30 d無(wú)菌苗的子葉、下胚軸和真葉為外植體材料,采用L9(34)正交試驗(yàn)表,2,4-D、2-iP、6-BA為正交試驗(yàn)的3因素,進(jìn)行直接誘導(dǎo)不定芽分化試驗(yàn)。結(jié)果表明,以真葉為外植體,不定芽分化率最高,為73.3%,激素組合為MS+0.5 mg/L 2,4-D+1.0 mg/L 2-iP+1.5 mg/L 6-BA;下胚軸的不定芽分化率次之,最高為66.6%;子葉的不定芽分化率最低,最高值僅為40.0%。試驗(yàn)結(jié)果可為工廠(chǎng)化生產(chǎn)優(yōu)良團(tuán)花種苗,并可為團(tuán)花遺傳轉(zhuǎn)化研究奠定基礎(chǔ)。
關(guān)鍵詞:團(tuán)花;組織培養(yǎng);正交試驗(yàn);不定芽
中圖分類(lèi)號(hào): Q813.1文獻(xiàn)標(biāo)志碼: A文章編號(hào):1002-1302(2016)06-0078-03
收稿日期:2015-05-18
基金項(xiàng)目:廣西醫(yī)療衛(wèi)生重點(diǎn)科研課題(編號(hào):重200907)。
作者簡(jiǎn)介:黃浩(1972—),男,廣西柳州人,助理研究員,主要從事藥用植物育種和栽培研究。E-mail:hmouse@163.com。
通信作者:蒙愛(ài)東,教授,從事藥用植物育種和組織培養(yǎng)。E-mail:mengaidong@126.com。團(tuán)花[Neolamarckia cadamba(Roxb.)Bosser]為茜草科(Rubiaceae)團(tuán)花屬(Neolamarckia Bosser)植物,為亞洲熱帶十分罕見(jiàn)的闊葉速生樹(shù)種。由于團(tuán)花生長(zhǎng)迅速,樹(shù)干通直,因而被譽(yù)為“奇跡樹(shù)”,早在20世紀(jì)70年代就受?chē)?guó)內(nèi)外普遍關(guān)注。其木材淡黃色,紋理通直,不易開(kāi)裂和變形,是較好的家具、建筑裝飾等用材。早在印度古醫(yī)“阿優(yōu)吠陀”經(jīng)中,就有用樹(shù)皮治療疾病的記載;樹(shù)皮含有豐富的生物堿類(lèi),其中 3α-二氫卡丹賓和3β-二氫卡丹賓為治療高血壓藥物“鉤藤總堿”的有效成分,具有強(qiáng)而持久的降壓作用,其效價(jià)已經(jīng)接近利血平[1]。樹(shù)葉含較高蛋白質(zhì),可作動(dòng)物飼料;花是良好的蜜源。因用途廣泛而具有較高開(kāi)發(fā)價(jià)值和較大應(yīng)用前景[2-4]。
團(tuán)花在中國(guó)僅有1種[5],主要分布于廣東、廣西、云南海拔50~1 100 m的山谷溪旁或雜木林下;在云南省海拔 1 080 m 以下的亞熱帶地區(qū)有集中分布[5-6],喜溫不耐寒。國(guó)內(nèi)外學(xué)者主要開(kāi)展團(tuán)花的樹(shù)皮藥用成分[1,7-11]、引種和栽培[12-18]生物技術(shù)[19-21]研究,并取得較好的進(jìn)展。盡管利用大田苗頂芽或側(cè)芽通過(guò)以芽繁芽的組織培養(yǎng)方式[22-23]進(jìn)行團(tuán)花植株再生研究已獲得一定的成效,由于僅作為繁殖優(yōu)良植株的目的,無(wú)法利用該不再生體系進(jìn)行進(jìn)一步的分子試驗(yàn)如遺傳轉(zhuǎn)化研究。本試驗(yàn)擬利用正交試驗(yàn)設(shè)計(jì),通過(guò)器官直接分化方式對(duì)團(tuán)花3種不同外植體進(jìn)行不定芽誘導(dǎo)研究,以期優(yōu)化出較好的外植體和激素組合。本試驗(yàn)不僅可快速獲得大量健壯不定芽,也可為團(tuán)花遺傳轉(zhuǎn)化特別是轉(zhuǎn)抗寒或其他抗性基因的研究奠定基礎(chǔ)。
1材料與方法
1.1材料和試劑
成熟、飽滿(mǎn)的團(tuán)花種子,采自廣西藥用植物園本草綱目園。經(jīng)洗凈晾干后于低溫種子柜保存。
NaClO溶液500 mL塑料瓶包裝,天津市津宇精細(xì)化工有限公司生產(chǎn);滅菌工作溶液配制:將50 mL NaClO原液加入到950 mL無(wú)菌水中搖勻;2,4-D、2-iP、6-BA、瓊脂、蔗糖購(gòu)自北京鼎國(guó)昌盛生物技術(shù)有限責(zé)任公司。
1.2方法
1.2.1浸種和無(wú)菌幼苗的獲得用小袋包好種子,放入裝有約100 mL無(wú)菌水的250 mL玻璃組培瓶中,在37 ℃恒溫振蕩箱振蕩浸泡24 h。在無(wú)菌超凈臺(tái)上,將包著種子的小袋浸于NaClO工作溶液中滅菌15 min,再用無(wú)菌水徹底沖洗5次,最后將種子播于不含任何激素的MS培養(yǎng)基中(培養(yǎng)室溫度為(25±2)℃,誘導(dǎo)不定芽分化時(shí)前30 d采用暗培養(yǎng),之后進(jìn)行光培養(yǎng)(光周期為14 h),人工光照強(qiáng)度2 000 lx。)20~30 d后,即可得到含1對(duì)子葉和第1對(duì)真葉、高度為5~10 mm的無(wú)菌苗。
1.2.2外植體的獲得外植體分別為無(wú)菌苗子葉、真葉、下胚軸。在無(wú)菌超凈臺(tái)中,子葉、真葉(均含葉柄)可用鑷子從上述無(wú)菌幼苗小心剝下,不含子葉節(jié)的下胚軸直接用解剖刀切取。每種外植體均按L9(34)正交試驗(yàn)表進(jìn)行單獨(dú)的正交試驗(yàn)。
1.2.3試驗(yàn)設(shè)計(jì)正交試驗(yàn)設(shè)計(jì)采用L9(34)正交表,將培養(yǎng)基中的3個(gè)激素2,4-D、2-iP、6-BA設(shè)為正交試驗(yàn)的3因素,每因素設(shè)3水平,為避免在試驗(yàn)過(guò)程中人為因素導(dǎo)致的系統(tǒng)誤差,因素水平數(shù)(激素濃度)在試驗(yàn)表中不完全按數(shù)值大小遞增或遞減順序排列,而按隨機(jī)化方法排列,空列作為方差分析的誤差列[24]。試驗(yàn)因素和水平見(jiàn)表1,試驗(yàn)結(jié)果見(jiàn)表 2。
1.2.4培養(yǎng)基培養(yǎng)基均以MS作為基本培養(yǎng)基,添加瓊脂6 g/L,蔗糖30 g/L,添加激素后調(diào)整pH值內(nèi)5.8,然后在 0.1 MPa、121 ℃高溫滅菌20 min,自然冷卻凝固,放置1 d后使用。
1.3統(tǒng)計(jì)與數(shù)據(jù)處理
外植體接種后40 d,統(tǒng)計(jì)不定芽分化率,同時(shí)觀(guān)察不定芽的生長(zhǎng)情況。采用直觀(guān)分析和方差分析法對(duì)數(shù)據(jù)進(jìn)行分析。每種外植體重復(fù)3次,每次15個(gè)外植體,分化率為3次重復(fù)的平均值。
不定芽分化率=(長(zhǎng)出不定芽的外植體個(gè)數(shù)/外植體總數(shù))×100%。
數(shù)據(jù)處理和作圖用Excel 2007完成。
2結(jié)果與分析
2.1不定芽分化率和直觀(guān)分析
不同外植體的不定芽分化率結(jié)果見(jiàn)表 2。從極差項(xiàng)的結(jié)果可看出,在3個(gè)不同的外植體中,生長(zhǎng)素2,4-D極差項(xiàng)均為最大值,表明2,4-D對(duì)3個(gè)外植體的不定芽分化影響最大。影響子葉直接分化不定芽的主次因素依次為2,4-D、2-iP(或6-BA)、6-BA(或2-iP),最優(yōu)激素組合為0.5 mg/L 2,4-D+0.5 mg/L 2-iP+1.5 mg/L 6-BA,與試驗(yàn)號(hào)4吻合,子葉的不定芽分化率最高達(dá)40%。影響下胚軸直接分化不定芽的主次因素依次為2,4-D、2-iP、6-BA,最優(yōu)激素組合為0 mg/L 2,4-D+0.5 mg/L 2-iP+2.0 mg/L 6-BA,與試驗(yàn)號(hào)1吻合,下胚軸的不定芽分化率最高達(dá)40%。影響真葉直接分化不定芽的主次因素依次為2,4-D、6-BA、2-iP,最優(yōu)激素組合應(yīng)為0.5 mg/L 2,4-D+1.0 mg/L 2-iP+1.5 mg/L 6-BA,沒(méi)有試驗(yàn)號(hào)與其吻合。
2.2不同激素誘導(dǎo)不定芽分化率比較
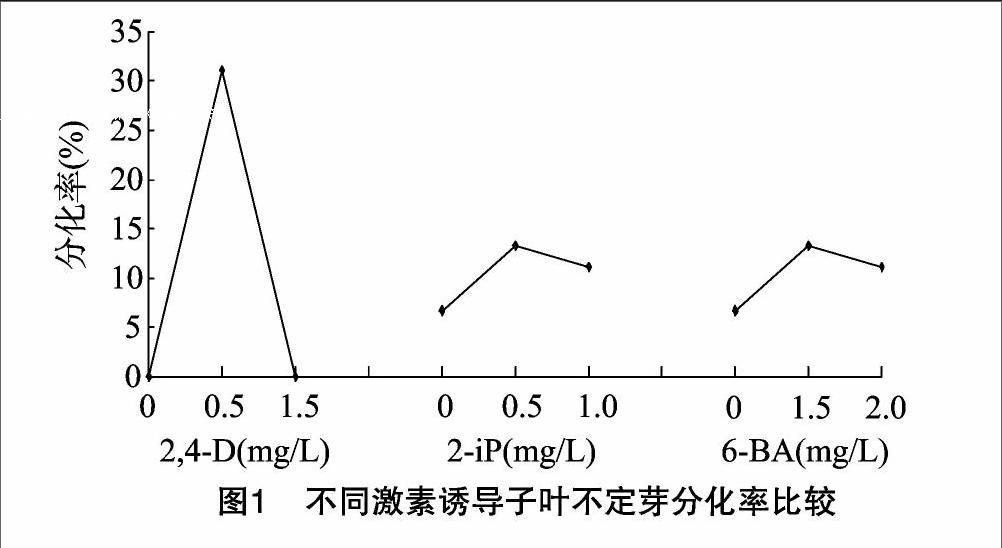
2.2.1不同激素誘導(dǎo)子葉不定芽分化率不同激素誘導(dǎo)子葉不定芽分化率見(jiàn)圖1。隨著2,4-D、2-iP、6-BA濃度升高,子葉誘導(dǎo)不定芽分化率均出現(xiàn)先增大后下降的趨勢(shì),當(dāng)2,4-D濃度為0.5 mg/L,2-iP濃度為0.5 mg/L,6-BA濃度為1.5 mg/L時(shí),不定芽分化的效果最佳。
2.2.2不同激素誘導(dǎo)下胚軸不定芽分化率不同激素誘導(dǎo)下胚軸不定芽分化率見(jiàn)圖2,隨著2,4-D、2-iP、6-BA濃度升高,下胚軸誘導(dǎo)不定芽分化率變化較大。當(dāng)2,4-D濃度為0 mg/L,2-iP濃度為0.5 mg/L,6-BA濃度為2.0 mg/L時(shí),不定芽分化效果最佳。此外,不定芽分化率有隨6-BA濃度升高而提高的趨勢(shì),適當(dāng)提高6-BA的濃度,有可能會(huì)得到更優(yōu)的誘導(dǎo)不定芽分化組合。
2.2.3不同激素引導(dǎo)真葉不定芽分化率不同激素引導(dǎo)真葉不定芽分化率見(jiàn)圖3,當(dāng)2,4-D濃度為0.5 mg/L,2-iP濃度為1.0 mg/L,6-BA濃度為1.5 mg/L時(shí),不定芽分化的效果最佳。不定芽分化率有隨2-iP濃度升高而提高的趨勢(shì),
適當(dāng)再提高2-iP的濃度,有可能會(huì)得到真葉誘導(dǎo)不定芽分化的更優(yōu)方案。與下胚軸誘導(dǎo)不定芽分化率隨6-BA濃度的升高而提高的趨勢(shì)不同。
2.3方差分析
方差分析結(jié)果見(jiàn)表3。
從表3看出,除了2,4-D對(duì)子葉誘導(dǎo)不定芽分化具有顯著影響外,2,4-D對(duì)其他2個(gè)外植體的不定芽誘導(dǎo)無(wú)顯著影響;2-iP、6-BA對(duì)3種外植體不定芽誘導(dǎo)均無(wú)顯著影響。
3討論與結(jié)論
從試驗(yàn)的總體結(jié)果來(lái)看,子葉誘導(dǎo)不定芽分化率較低;從試驗(yàn)號(hào)1到試驗(yàn)號(hào)6,下胚軸誘導(dǎo)分化率最低為33%,最高為66.7%,誘導(dǎo)分化的總體狀況較好;而真葉除了在試驗(yàn)號(hào)4和試驗(yàn)號(hào)6的誘導(dǎo)分化率較高外,其余試驗(yàn)均低于30%。另外,無(wú)論是從子葉、下胚軸還是真葉誘導(dǎo)分化出來(lái)的不定芽,生長(zhǎng)均較健壯,生長(zhǎng)狀況無(wú)明顯差異(圖4)。
不同外植體的最佳不定芽分化率并不出現(xiàn)在同一個(gè)激素組合(即同一個(gè)試驗(yàn)號(hào)),可能是不同外植體組織(或細(xì)胞)在相同生長(zhǎng)時(shí)期具不同生長(zhǎng)特性,導(dǎo)致對(duì)相同激素組合的響應(yīng)不同。
當(dāng)2,4-D濃度為 0 mg/L 時(shí),下胚軸的不定芽分化率較好;當(dāng)2,4-D濃度為0.5 mg/L時(shí),子葉和真葉的不定芽分化率較好;當(dāng)2,4-D濃度為1.5 mg/L時(shí),不論2-iP、6-BA濃度如何變化,3個(gè)不同外植體不定芽分化的誘導(dǎo)率均很低,可能是高濃度2,4-D對(duì)這些幼嫩的外植體產(chǎn)生一定的傷害,導(dǎo)致組織或細(xì)胞較難直接分化甚至死亡;而2-iP、6-BA對(duì)不定芽分化率影響不如2,4-D的變化顯著。
在誘導(dǎo)真葉直接分化試驗(yàn)中,從直觀(guān)分析和趨勢(shì)中均可看出,最好的激素組合應(yīng)為0.5 mg/L 2,4-D+1.0 mg/L 2-iP+1.5 mg/L 6-BA,理論上應(yīng)比試驗(yàn)號(hào)6的分化率(即最大值73.3%)高,但此激素組合并不在本試驗(yàn)的激素組合中。在下一步試驗(yàn)中可對(duì)主要因素(主要是2,4-D)的水平作適當(dāng)調(diào)整,選取更優(yōu)水平,以期獲得更高的誘導(dǎo)分化率。
本試驗(yàn)研究結(jié)果表明,為獲得質(zhì)量較好的不定芽,可用MS+0 mg/L 2,4-D+0.5 mg/L 2-iP+2.0 mg/L 6-BA作為下胚軸的誘導(dǎo)培養(yǎng)基;或用MS+0.5 mg/L 2,4-D+1.0 mg/L 2-iP+1.5 mg/L 6-BA作為真葉的誘導(dǎo)培養(yǎng)基。這2種方法均可通過(guò)直接分化的方式獲得健壯的不定芽,避免通過(guò)愈傷組組再分化的途徑獲取再生芽而產(chǎn)生的變異苗的可能;在獲得不定芽后,按鄧小梅等的方法[22-23]選取健壯的芽,進(jìn)行擴(kuò)繁、生根和移栽,即可獲得再生小苗。移栽1年后,經(jīng)與初生種子苗對(duì)比,在生長(zhǎng)性狀上無(wú)明顯差異。通過(guò)直接分化獲得不定芽,在很大程度上減少了培養(yǎng)周期、人力和物力,也為進(jìn)一步進(jìn)行團(tuán)花遺傳轉(zhuǎn)化研究奠定基礎(chǔ)。
參考文獻(xiàn):
[1]鐘紀(jì)育,王文端. 卡丹賓——團(tuán)花莖皮的主要生物堿[J]. 云南植物研究,1985,7(3):359-360.
[2]林協(xié). 速生樹(shù)木——團(tuán)花[J]. 浙江林業(yè)科技,1974(2):9.
[3]祁承經(jīng),湯庚國(guó). 樹(shù)木學(xué)[M]. 北京:中國(guó)林業(yè)出版社,2005:521.
[4]鐘紀(jì)育,王文端,張壯鑫,等. 團(tuán)花樹(shù)皮的化學(xué)成分[J]. 云南植物研究,1990,12(4):453-456.
[5]中國(guó)科學(xué)院中國(guó)植物志編輯委員會(huì).中國(guó)植物志:第71卷第1分冊(cè)被子植物門(mén)雙子葉植物綱茜草科(一)[M]. 北京:科學(xué)出版社,1999.
[6]楊正杰. 淺談團(tuán)花育苗及造林技術(shù)[J]. 云南林業(yè),1984(1):20.
[7]劉玲麗,朱鋒,邸迎彤,等. 團(tuán)花樹(shù)中一個(gè)新的環(huán)烯醚萜苷[J]. 云南植物研究,2010,32(4):378-380.
[8]張雪. 銹毛千斤拔根及團(tuán)花樹(shù)皮化學(xué)成分研究[D]. 西雙版納:中國(guó)科學(xué)院研究生院,西雙版納熱帶植物園,2008.
[9]韋宏. 團(tuán)花樹(shù)皮的吲哚生物堿成分[J]. 廣西科學(xué)院學(xué)報(bào),1999,15(2):52-55.
[10]陳耀武,鄧萬(wàn)華,沈鎮(zhèn)德,等. 團(tuán)花(Anthocephalus chinensis)種子和果實(shí)中抑制物質(zhì)的研究[J]. 植物生理學(xué)報(bào),1985,11(1):93-100.
[11]趙瑤金. 印度團(tuán)花(Anthocephalus indicus Rioh.)樹(shù)皮的化學(xué)研究 第2部分生物堿類(lèi)成分[J]. 南藥譯叢,1962(1):19.
[12]耿云芬,邱瓊,楊德軍. 團(tuán)花容器苗的育苗期施肥試驗(yàn)[J]. 西部林業(yè)科學(xué),2010,39(1):73-76.
[13]蘇光榮,易國(guó)南,楊清. 團(tuán)花生長(zhǎng)特性研究[J]. 西北林學(xué)院學(xué)報(bào),2007,22(5):49-52.
[14]李秀全. 團(tuán)花在平和縣引種試驗(yàn)研究初報(bào)[J]. 安徽農(nóng)學(xué)通報(bào),2007,13(7):103-104.
[15]陶永強(qiáng). 團(tuán)花育苗及造林技術(shù)[J]. 云南林業(yè),2005,26(4):25-26.
[16]楊德軍,邱瓊,王達(dá)明,等. 團(tuán)花育苗技術(shù)研究[J]. 廣西林業(yè)科學(xué),2004,33(2):93-95,101.
[17]任盤(pán)宇,鄒壽青. 熱帶速生樹(shù)種團(tuán)花的造林技術(shù)[J]. 林業(yè)實(shí)用技術(shù),2004(6):6-8.
[18]鄒壽青. 團(tuán)花北移試種情況調(diào)查報(bào)告[J]. 熱帶植物研究,1977(11):26-35.
[19]歐陽(yáng)昆唏. 黃梁木α擴(kuò)展蛋白的基因克隆及功能研究[D]. 北京:北京林業(yè)大學(xué),2013:133.
[20]馬圣俊. 團(tuán)花樹(shù)形成層X(jué)ET基因的克隆及功能初步分析[D]. 北京:北京林業(yè)大學(xué),2010.
[21]李偉,李娜,陳曉陽(yáng). 團(tuán)花樹(shù)木葡聚糖轉(zhuǎn)葡糖苷酶cDNA克隆及序列分析[J]. 北京林業(yè)大學(xué)學(xué)報(bào),2010,32(5):45-49.
[22]鄧小梅,詹艷玲,張倩,等. 黃梁木組培快繁技術(shù)研究[J]. 華南農(nóng)業(yè)大學(xué)學(xué)報(bào),2012,33(2):216-219,224.
[23]林碧珍,張樹(shù)河,林加耕. 團(tuán)花樹(shù)組培快繁技術(shù)研究[J]. 中國(guó)熱帶農(nóng)業(yè),2009(3):46-47.
[24]李云雁,胡傳榮. 試驗(yàn)設(shè)計(jì)與數(shù)據(jù)處理[M]. 北京:化學(xué)工業(yè)出版社,2005:257.

