白粉病菌對不同抗性辣椒品種防御酶活性的影響及其互作超微結構分析
莫熙禮++蔣選利++武華文++江厚成


摘要:為了探索白粉病菌對不同抗性辣椒品種防御酶活性的影響及其互作機制,采用酶標儀法測定病原菌對辣椒葉片防御酶活性的影響;用掃描電子顯微鏡和熒光顯微鏡對辣椒-白粉病菌互作過程進行超微結構觀察。試驗表明:接種白粉病菌后,抗性材料(花溪辣椒)的POD、PPO活性表現為峰值出現最早,感病材料(西安8819和遵義辣椒)表現為活性變化幅度大、峰值出現較晚;抗病材料和感病材料的PAL酶活性都在處理3 d到達峰值,抗病材料活性變化幅度大于感病材料;花溪辣椒(抗病)和遵義辣椒(感病)的幾丁質酶和β-1,3-葡聚糖酶迅速上升,而西安8819(感病)的幾丁質酶和β-1,3-葡聚糖酶活性上升速度較慢。接種白粉病菌后12 h,分生孢子萌發產生芽管和附著胞,24 h 形成菌絲,菌絲周邊的蠟質組織開始被溶解,120 h菌絲從葉表面氣孔伸出,形成為分生孢子梗,未見有從氣孔侵入的跡象。從而可以得出結論:接種白粉病菌后,辣椒葉片防御酶活性均有不同程度的提高,不同辣椒品種的防御酶活性變化不同。
關鍵詞:白粉病菌;辣椒;防御酶;超微結構
中圖分類號: S436.418.1+9文獻標志碼: A文章編號:1002-1302(2016)06-0229-04
收稿日期:2016-01-04
基金項目:貴州省黔西南州科技局計劃(編號:2015-05)。
作者簡介:莫熙禮(1982—),男,廣西梧州人,碩士,講師,從事植物病蟲害防治教學和科研工作。E-mail:moxili1982@163.com。辣椒白粉病是辣椒重要病害之一,病原菌的有性世代為子囊菌亞門內絲白粉菌屬的韃靼內絲白粉菌,無性世代為半知菌亞門擬粉孢霉真菌。辣椒白粉病主要危害辣椒葉片,影響光合作用,從而導致辣椒產量和品質降低。貴州是我國辣椒主產區之一,氣候溫暖濕潤,非常適宜辣椒種植,且辣椒品種資源豐富。隨著病菌多年的積累,辣椒白粉病在貴州各辣椒產地大面積發生,大大降低了辣椒的產量和品質,這給當地農業生產的發展和農民的脫貧致富造成了嚴重威脅。因此,對辣椒白粉病的系統研究迫在眉睫。目前,人們對辣椒白粉病方面的研究主要集中在病菌的鑒定[1]、分類以及化學藥劑防治[2]等方面,而在辣椒與白粉病菌互作方面還不清楚。為此,本研究通過室內試驗,測定白粉病菌侵染后辣椒POD等防御酶活性的變化以及利用電子顯微鏡和熒光顯微鏡進行白粉病菌-辣椒互作的超微結構觀察,以期從生理生化和組織病理角度探討白粉病菌-辣椒互作機制,為今后有效、綠色控制辣椒白粉病提供參考。
1材料與方法
1.1供試辣椒品種
供試辣椒品種為花溪辣椒、西安8819、遵義辣椒,其中花溪辣椒為抗病品種、西安8819和遵義辣椒為感病品種。消毒后,將種子播種在直徑約6 cm、高約15 cm的塑料杯中,待幼苗長到8~10片真葉時,將植株移栽在直徑約20 cm、高約 25 cm 的花盆中,保持每盆2~3株,置于溫室培養。
1.2供試菌源
菌源為辣椒白粉病菌,孢子采自花溪區湖潮鄉磊莊辣椒基地自然發病的植株,配制成孢子懸浮液(1×105個/mL)。
1.3接種方法
待供試辣椒長至25片真葉時,對每個辣椒品種的葉片進行噴菌接種處理,孢子濃度為1×105個/mL,每個材料接種20株,以清水噴霧為對照(CK)。接種后,馬上取樣進行防御酶活性測定,之后連續6 d同一時間取樣檢測。每個處理進行3次重復。
1.4粗酶液的提取
PPO和POD酶粗液的提取參照李靖等的方法[3];PAL酶粗提液的提取參考薛應龍等的方法[4];β-1,3-葡聚糖酶和幾丁質酶粗提液的提取參考車海彥等的方法[5]。
1.5酶活性的測定
PPO和POD活性的測定參照李保聚等的方法[6];PAL 活性測定參照考薛應龍等的方法[4];β-1,3-葡聚糖酶活性測定參照車海彥等的方法[5];幾丁質酶活性測定:膠態幾丁質的制備采用陳鵬等的方法[7],幾丁質酶活性的測定參照湯章城的方法[8]。
1.6白粉菌侵染超微結構分析
1.6.1材料辣椒品種:花溪辣椒。
1.6.2接種方法方法同“1.3”節,待辣椒長至25片真葉時,對辣椒葉片進行噴菌接種處理,孢子濃度為1×105個/mL,在處理后12 h、1 d、2 d、8 d剪取葉片進行以下觀察。
1.6.3掃描電子顯微鏡和熒光顯微鏡觀察(1)器材:掃描電子顯微鏡(S-3400N)。(2)方法:①取材:剪取辣椒葉片,長和寬1~2 cm;②清洗:用 5%碳酸鈉沖洗辣椒葉片表面常細胞碎片、雜質。并粘在樣品臺上;③觀察:將樣品臺放置冷凍臺內,打開掃描電子顯微鏡觀察、拍照。
1.6.4熒光顯微鏡觀察(1)器材:熒光顯微鏡(Olympus 13X51T)、數碼相機(佳能A640);(2)方法:采用Calcofluor熒光染色法進行染色觀察。
2結果與分析
2.1白粉病菌對不同抗性辣椒品種防御酶活性的影響
2.1.1POD活性的變化由圖1可見,花溪辣椒接種白粉病菌后,植株的POD活性明顯增加,并在接種1 d達到高峰。西安8819接種白粉病菌后,植株的POD活性明顯增加,并在接種5 d達到高峰。遵義辣椒接種白粉病菌后,接種植株的POD活性也迅速增加,并在接種4 d達到高峰。接種白粉病菌會促進辣椒植株POD酶活性的增強,抗病較強品種花溪辣椒的POD峰值出現較早,感病品種 (西安8819和遵義辣椒)的POD酶活性峰峰值出現較遲。由此推斷出,辣椒抗病品種的POD酶對白粉病菌的敏感性較強。
2.1.2PPO活性的變化由圖2可見,花溪辣椒接種白粉病菌后,PPO酶活性在接種2 d和接種4 d出現2個高峰期,分別比對照高58.6%和60.4%。西安8819辣椒植株在接種白粉病菌后,PPO酶活性在接種3 d出現高峰期,其值高于對照1003%。遵義辣椒仔接種白粉病菌后,PPO酶活性在接種 3 d 出現高峰期,也明顯高于對照。感病品種挑戰接種白粉菌后,PPO酶活性高于感病品種,但峰值出現的時間較晚。
2.1.3PAL活性的變化由圖3可見,花溪辣椒接種白粉菌后,PAL酶活性在接種3 d達到最大,比CK高出23%。西安8819接種白粉病菌后,PAL酶活性均在處理后接種3 d達到高峰期,比CK高出35%。遵義辣椒接菌處理和CK的PAL酶活性在接種3 d和5 d出現2個高峰期,但差別不明顯。由此推斷出,抗病品種的PAL酶對白粉病菌敏感,接菌后活性迅速上升,而感病品種的PAL酶反應較慢,變化幅度不大。
2.1.4β-1,3-葡聚糖酶活性變化由圖4可見,花溪辣椒接種白粉病菌后,植株的β-1,3-葡聚糖酶活性明顯增加,高于CK處理。西安8819接種白粉病菌后,β-1,3-葡聚糖酶活性在接種3 d達到峰值,隨后逐漸下降,在接種5 d與CK處于同一水平。遵義辣椒接菌處理和CK在接種后β-1,3-葡聚糖酶活性逐漸上升,接菌處理升高的幅度高于CK處理。
4 d時,接菌處理和CK的β-1,3-葡聚糖酶活性無明顯差別。在整個檢測期內,抗病品種(花溪辣椒)的β-1,3-葡聚糖酶活性低于感病品種。
2.1.5幾丁質酶活性的變化由圖5可知,接種白粉菌后,3個辣椒品種的幾丁質酶活性均上升,只是增長的速度不同。花溪辣椒接種白粉病菌后,幾丁質酶活性迅速升高,接種2 d 到達峰值,隨后下降,接種5 d與CK無明顯差別。西安8819接種白粉病菌后,幾丁質酶活性在接種2 d和接種4 d出現2個峰值。遵義辣椒接種白粉病菌后,幾丁質酶接種1 d就出現了峰值,隨后逐漸下降。在整個檢測期內,接菌處理的活性明顯高于CK。
2.2辣椒與白粉菌互作超微結構分析
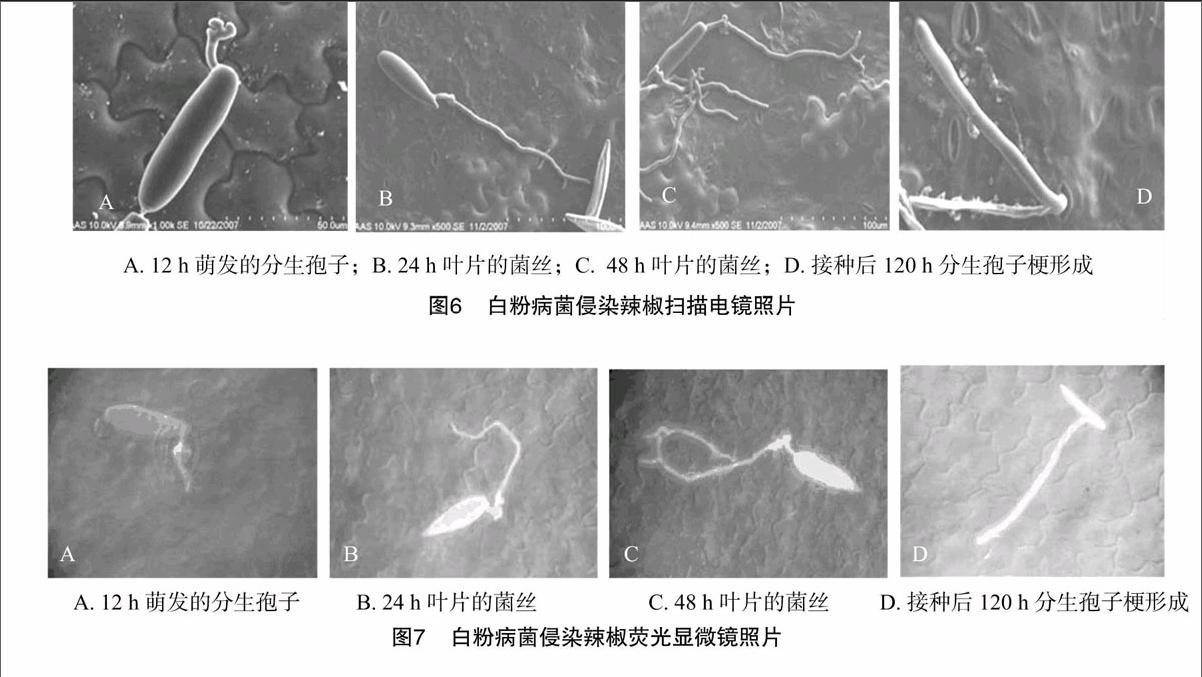
接種白粉病菌后12 h,辣椒葉片表面上的分生孢子萌發產生芽管,孢子萌發只產生1個芽管,可觀察到芽管頂端形成圓形附著孢,并且附著孢開始產生菌絲,少數的孢子可以在側面產生附著孢(圖6-A、圖7-A),主要起附著作用。接菌后24 h,菌絲形成后不立即侵入葉組織,而是在葉表面上擴展伸長,不斷產生分枝(圖6-B、圖7-B)。從圖6-B發現,菌絲周邊的蠟質組織開始被溶解。接菌后48 h,掃描電鏡觀察發現,菌絲從氣孔旁穿行而過,未見有從氣孔侵入的跡象(圖6-C、圖7-C)。接菌后120 h,辣椒葉片表面產生許多褪綠斑,可發現葉片內菌絲從葉表面氣孔伸出,形成為分生孢子梗,少部分還觀察到分生孢子梗上產生孢子(圖6-D、圖7-D)。掃描電子顯微鏡和熒光顯微鏡觀察,未發現菌絲從氣孔侵入,且菌絲從氣孔旁穿行而過,未見有從氣孔侵入的跡象。
3討論
國內外許多學者對防御酶活性與植物抗病性的關系進行了深入研究,寄主-病原物體系不同,得出的研究結果不盡相同[9-10]。以往研究認為:POD 參與形成對真菌孢子萌發具有直接抑制作用的物質——H2O2,且參與木質素和木栓質的合成;PPO酶可以催化植物產生對病原菌菌絲生長有毒性的物質(醌和單寧),參與催化酚類物質合成木質素的反應,促進細胞壁木質化以抵抗病原菌的侵害;PAL酶活性升高會促進木質素的積累、酚類物質和植保素的合成,增加細胞壁的厚度,形成抵抗病原入侵的機械屏障[11];幾丁質酶和β-1,3-葡聚糖酶也是許多真菌細胞壁的主要組分之一,在植物的抗病性方面具有重要作用,能夠降解真菌的細胞壁和抑制真菌的生長[11]。病原菌和化學因子都能誘導植物體內的POD、PPO、PAL、幾丁質酶和β-1,3-葡聚糖酶酶活性的升高。
研究結果表明:與對照相比,接菌處理的辣椒葉片防御酶活性均有不同程度的提高,辣椒品種不同,防御酶活性的變化量不同。接種白粉病菌后,抗性材料花溪辣椒的POD、PPO活性表現為峰值出現最早,感病材料表現為活性變化量大、峰值出現較晚。由此認為,接種白粉病菌后,抗病材料的POD、PPO活性迅速到達峰值,形成抑菌物質和有毒物質,促進木質化抵抗白粉病菌的侵染,感病材料則反應較慢,沒有迅速抵抗病菌的侵入。接種白粉病菌后,抗病材料和感病材料的PAL酶活性都在3 d時到達峰值,抗病材料活性變化幅度大于感病材料,這可能是抗病材料PAL酶活性上升幅度大,大量積累了木質素,并迅速合成酚類物質和植保素,增加細胞壁的厚度,形成病原入侵的機械屏障,從而表現出來抗性,而感病材料PAL活性上升速度慢,沒有迅速形成機械屏障阻礙病原菌的侵入表現為感病。接種白粉病菌后,花溪辣椒(抗病)和遵義辣椒(感病)的幾丁質酶和β-1,3-葡聚糖酶活性迅速上升,而西安8819(感病)的幾丁質酶和β-1,3-葡聚糖酶活性上升速度較慢,這可能是由于辣椒品種不同而出現的差異,似乎這2種酶活性與辣椒的抗病性無相關性,與許多學者的研究結果不一樣,其原因需要進一步研究。
組織病理學研究發現,辣椒葉片接種白粉病菌后24 h,菌絲周邊的蠟質層被溶解,筆者認為這是菌絲分泌角質酶迅速降解辣椒葉片的角質,降低其防御能力,以達到侵害的目的。掃描電子顯微鏡和熒光顯微鏡觀察均未發現菌絲從氣孔侵入,且菌絲從氣孔旁穿行而過,未見有從氣孔侵入的跡象。其侵入方式有2種可能性,一是孢子產生附著孢后,附著孢產生吸器或侵染菌絲直接侵入植物組織;二是孢子產生附著孢后,并不產生吸器或侵染菌絲,而是附著孢在組織表面產生菌絲,以菌絲的側枝侵入到植物組織里面。這需要以后的透射電鏡的觀察確定。
參考文獻:
[1]白濱,胡冠芳. 甘肅省辣椒病害新記錄——辣椒白粉病[J]. 甘肅農業科技,2002(7):46.
[2]莫熙禮,蔣選利,彭赫. 10%世高水分散粒劑防治辣椒白粉病藥效試驗[J]. 山地農業生物學報,2007,26(1):39-42.
[3]李靖,利容千,袁文靜. 黃瓜感染霜霉病菌葉片中一些酶活性的變化[J]. 植物病理學報,1991,21(4):278-283.
[4]薛應龍,歐陽光察,澳紹根. 植物苯丙氨酸解氨酶的研究Ⅳ. 水稻幼苗中PAL活性的動態變化[J]. 植物生理學報,1983,9(3):301-305.
[5]車海彥,吳云鋒,楊英,等. 植物源病毒抑制劑WCT-Ⅱ控制煙草花葉病毒(TMV)的作用機理初探[J]. 西北農業學報,2004,13(4):45-49.
[6]李保聚,李鳳云. 黃瓜不同抗性品種感染黑星病菌后過氧化物酶和多酚氧化酶的變化[J]. 中國農業科學,1998,31(1):86-88.
[7]陳鵬,李振岐. BTH對小麥葉片防衛相關酶的系統誘導作用[J]. 西北植物學報,2006,26(12):2468-2472.
[8]湯章城. 現代植物生理學實驗指南[M]. 北京:科學出版社,1999.
[9]劉會寧,姚曉雯. 葡萄霜霉病抗性與葉片生理生化指標的關系[J]. 江蘇農業科學,2015,43(11):180-182.
[10]王雅雅,付瑞敏,于烽,等. 植物土傳疾病拮抗菌的篩選及其生防潛力評價[J]. 江蘇農業科學,2015,43(7):102-106.
[11]Sekizawa Y,Harayawa T,Kano M,et al. Dependence on ethylene of induction of peroxidase and lipoxygenase activity in rice leaf infecled with blast fungus[J]. Agric Bio Chem,1990,54:471-478.

