臺灣泡桐體細胞同源四倍體的誘導及鑒定
張變莉++王楊++劉榮寧++范國強



摘要:將臺灣泡桐葉片愈傷組織放置于含有不同質量濃度秋水仙素的液體培養基上進行四倍體植株的誘導,采用根尖細胞染色體計數和葉片單細胞DNA含量測定的方法進行倍性分析。結果表明,在27個試驗組合中,用 30 mg/L秋水仙素處理預培養6 d的臺灣泡桐葉片48 h時,四倍體誘導率最高,為5.83%。根尖染色體壓片結果也表明,臺灣泡桐二倍體染色體數為2n=2x=40,四倍體為2n=4x=80。此外,與二倍體相比,誘變出的四倍體植株,具有生長慢、莖加粗、葉片增寬、單個氣孔面積增大、氣孔密度減少等特征。
關鍵詞:臺灣泡桐;葉片;秋水仙素;四倍體
中圖分類號: S792. 430.4文獻標志碼: A文章編號:1002-1302(2016)06-0290-04
收稿日期:2016-04-21
基金項目:河南省杰出人才創新基金(編號:321001700);河南省高校杰出科研人才工程基金(編號:2002KYC-003);河南省鄭州市普通科技攻關項目(編號:153PKJGG423)。
作者簡介:張變莉(1982—),女,河南通許人,碩士,講師,主要從事園林綠化及林木生物技術的教學和科研工作。E-mail:kfzbl@163.com。
通信作者:范國強,博士,教授,主要從事泡桐豐產栽培理論與生物技術研究。E-mail:gqfan@ henau.edu.cn。植物多倍體具有抗逆性和適應性強等特點,能滿足生產上高產、優質、抗病蟲害等要求,而且作為遺傳橋梁,對開展目的基因漸滲和轉移研究具有重要意義。目前,人工誘導植物多倍體已在楊樹、桑樹等林木樹種[ 1-12]上取得突破。泡桐在我國有著悠久的栽培歷史,由于其生長快、用途廣,廣受栽培者的歡迎。然而,泡桐叢枝病的頻發及“久治不愈”嚴重影響了其大面積栽植和應用。近年來,范國強等[13-18]成功誘導了同源四倍體蘭考、白花、南方、豫雜一號等植株,但目前有關臺灣泡桐四倍體誘導研究鮮見報道。本試驗以臺灣泡桐組培苗葉片為材料,采用不同質量濃度秋水仙素對其進行了同源四倍體誘導,為豐富泡桐四倍體種質資源奠定基礎。
1材料與方法
1.1試驗材料
本試驗所用材料為河南農業大學林業試驗站的臺灣泡桐種子,采集后,先用70%乙醇消毒30 s,再用0.1% HgCl2 消毒 5 min,取出后,無菌水沖洗3~5次,之后將種子晾干,置于裝有40 mL MS 培養基 ( 含3.0 g/L瓊脂粉、25 g/L蔗糖) 的三角瓶中,在培養箱 [溫度(25±2) ℃,光照時間為 16 h/d,光照度為130 μmol/(m2·s)]內培養。將生長 80 d 的同一株臺灣泡桐組培苗上部2片完全展開葉片置于其器官直接發生的培養基[19]上增殖后,取其葉片待用。
1.2試驗方法
1.2.1臺灣泡桐葉片的預培養取臺灣泡桐組培苗自頂部向下數的第 2~4 對葉片,剪成1.0 cm×1.0 cm小塊,分別置于裝有40 mL的MS+0.1 mg/L NAA+16.0 mg/L 6-BA的培養基[19] 的三角瓶中,在20 ℃的黑暗條件下進行不同時間(表1)的預培養。
1.2.2秋水仙素誘導臺灣泡桐四倍體植株將上述預培養不同時間的外植體(臺灣泡桐葉塊)分別接種于含有秋水仙素液體培養基[19]的三角瓶中,并按照設計組合(表1)置于 20 ℃ 的黑暗條件下進行四倍體誘導。 誘導結束后,無菌水沖洗葉片3~5次,再將葉片表面水分用無菌濾紙吸干,之后轉入不含秋水仙素的MS+0.1 mg/L NAA+16.0 mg/L 6-BA的培養基上,于光照度為130 μmol/(m2·s) 、光照時間為 16 h/d、溫度為25 ℃的培養室內進行芽誘導,每處理30瓶,每瓶2個葉塊。15 d后,統計臺灣泡桐外植體存活數,30 d后統計外植體出芽數,并計算其存活率[(存活的外植體個數/接種外植體總數)×100%]和芽誘導率[(誘導出芽外植體數/接種外植體總數)×100%]。 將誘導后長至2 cm的幼芽剪下,接種于1/2 MS 培養基上誘導生根,每30 d 繼代培養1次,共繼代5次。
第5次繼代苗培養后,幼芽根長至1.5~2.0 cm時,先剪其根尖制成壓片[20]用于觀察染色體的加倍情況,再用流式細胞儀[21]確認秋水仙素誘變的臺灣泡桐幼苗的倍性,并計算其四倍體誘導率( 流式細胞儀檢測四倍體幼芽數/外植體誘導出的總芽數) 。 每組試驗重復2次,數據采用 SPSS 軟件處理,并進行F檢驗。
1.2.3臺灣泡桐四倍體植株的鑒定(1)幼苗根尖染色體計數。臺灣泡桐二倍體幼苗及秋水仙素誘導變異幼苗的根尖細胞染色體觀察參照舒壽蘭等[ 20]的方法。在尼康TS-100熒光倒置顯微鏡(2 000×)下,觀察上述根尖臨時壓片中的染色體條數并拍照。(2)葉片單細胞DNA相對含量測定。分別將染色體加倍的及普通二倍體的臺灣泡桐葉片各50 mg置于2 mL緩沖液Ⅰ(0.5%T ween 和濃度為0.1 mol/L的檸檬酸) 中,然后用剪刀或鋒利的刀片將其切碎,用300目尼龍網過濾至BD專用試管中,重復過濾2次去除雜質。留取1 mL濾液置于轉速為1 500 r/min的離心機中4 ℃離心5 min,棄除上清液,并加入1 mL鞘液輕微搖勻,然后再置入上述轉速離心機中4 ℃離心5 min。倒掉上清液,在沉淀中加入 0.5 mL 儀器所帶熒光染色液,輕微振蕩搖勻后避光放置 30 min,以便充分染色。然后用300目濾網過濾1次至試管中,用于測定葉片單細胞DNA相對含量。
1.2.4植株形態特征比較觀察并記錄上面生長30 d第5次繼代的四倍體和二倍體臺灣泡桐幼苗葉形、葉色等差異。每一指標測定10個樣品,求其平均值。
1.2.5表皮細胞氣孔器的比較取苗齡60 d的四倍體和二倍體臺灣泡桐組培苗成熟葉片,放置于質量分數5% 的KOH溶液中煮沸3~5 min,然后置于冷水中。先在載玻片上滴一滴清水,再用鑷子挑取其表皮并展平放于載玻片的水滴上,用濾紙吸去過多的水分。然后蓋上蓋玻片并用目鏡中帶有測微尺鏡頭的顯微鏡觀察,在100×10的油鏡下觀察測量每個氣孔器的長度、寬度和氣孔器個數,計算氣孔器密度,3次重復,取平均值。
張變莉 王楊 劉榮寧 范國強

摘要:將臺灣泡桐葉片愈傷組織放置于含有不同質量濃度秋水仙素的液體培養基上進行四倍體植株的誘導,采用根尖細胞染色體計數和葉片單細胞DNA含量測定的方法進行倍性分析。結果表明,在27個試驗組合中,用 30 mg/L秋水仙素處理預培養6 d的臺灣泡桐葉片48 h時,四倍體誘導率最高,為5.83%。根尖染色體壓片結果也表明,臺灣泡桐二倍體染色體數為2n=2x=40,四倍體為2n=4x=80。此外,與二倍體相比,誘變出的四倍體植株,具有生長慢、莖加粗、葉片增寬、單個氣孔面積增大、氣孔密度減少等特征。
關鍵詞:臺灣泡桐;葉片;秋水仙素;四倍體
中圖分類號: S792. 430.4文獻標志碼: A文章編號:1002-1302(2016)06-0290-04
收稿日期:2016-04-21
基金項目:河南省杰出人才創新基金(編號:321001700);河南省高校杰出科研人才工程基金(編號:2002KYC-003);河南省鄭州市普通科技攻關項目(編號:153PKJGG423)。
作者簡介:張變莉(1982—),女,河南通許人,碩士,講師,主要從事園林綠化及林木生物技術的教學和科研工作。E-mail:kfzbl@163.com。
通信作者:范國強,博士,教授,主要從事泡桐豐產栽培理論與生物技術研究。E-mail:gqfan@ henau.edu.cn。植物多倍體具有抗逆性和適應性強等特點,能滿足生產上高產、優質、抗病蟲害等要求,而且作為遺傳橋梁,對開展目的基因漸滲和轉移研究具有重要意義。目前,人工誘導植物多倍體已在楊樹、桑樹等林木樹種[ 1-12]上取得突破。泡桐在我國有著悠久的栽培歷史,由于其生長快、用途廣,廣受栽培者的歡迎。然而,泡桐叢枝病的頻發及“久治不愈”嚴重影響了其大面積栽植和應用。近年來,范國強等[13-18]成功誘導了同源四倍體蘭考、白花、南方、豫雜一號等植株,但目前有關臺灣泡桐四倍體誘導研究鮮見報道。本試驗以臺灣泡桐組培苗葉片為材料,采用不同質量濃度秋水仙素對其進行了同源四倍體誘導,為豐富泡桐四倍體種質資源奠定基礎。
1材料與方法
1.1試驗材料
本試驗所用材料為河南農業大學林業試驗站的臺灣泡桐種子,采集后,先用70%乙醇消毒30 s,再用0.1% HgCl2 消毒 5 min,取出后,無菌水沖洗3~5次,之后將種子晾干,置于裝有40 mL MS 培養基 ( 含3.0 g/L瓊脂粉、25 g/L蔗糖) 的三角瓶中,在培養箱 [溫度(25±2) ℃,光照時間為 16 h/d,光照度為130 μmol/(m2·s)]內培養。將生長 80 d 的同一株臺灣泡桐組培苗上部2片完全展開葉片置于其器官直接發生的培養基[19]上增殖后,取其葉片待用。
1.2試驗方法
1.2.1臺灣泡桐葉片的預培養取臺灣泡桐組培苗自頂部向下數的第 2~4 對葉片,剪成1.0 cm×1.0 cm小塊,分別置于裝有40 mL的MS+0.1 mg/L NAA+16.0 mg/L 6-BA的培養基[19] 的三角瓶中,在20 ℃的黑暗條件下進行不同時間(表1)的預培養。
1.2.2秋水仙素誘導臺灣泡桐四倍體植株將上述預培養不同時間的外植體(臺灣泡桐葉塊)分別接種于含有秋水仙素液體培養基[19]的三角瓶中,并按照設計組合(表1)置于 20 ℃ 的黑暗條件下進行四倍體誘導。 誘導結束后,無菌水沖洗葉片3~5次,再將葉片表面水分用無菌濾紙吸干,之后轉入不含秋水仙素的MS+0.1 mg/L NAA+16.0 mg/L 6-BA的培養基上,于光照度為130 μmol/(m2·s) 、光照時間為 16 h/d、溫度為25 ℃的培養室內進行芽誘導,每處理30瓶,每瓶2個葉塊。15 d后,統計臺灣泡桐外植體存活數,30 d后統計外植體出芽數,并計算其存活率[(存活的外植體個數/接種外植體總數)×100%]和芽誘導率[(誘導出芽外植體數/接種外植體總數)×100%]。 將誘導后長至2 cm的幼芽剪下,接種于1/2 MS 培養基上誘導生根,每30 d 繼代培養1次,共繼代5次。
第5次繼代苗培養后,幼芽根長至1.5~2.0 cm時,先剪其根尖制成壓片[20]用于觀察染色體的加倍情況,再用流式細胞儀[21]確認秋水仙素誘變的臺灣泡桐幼苗的倍性,并計算其四倍體誘導率( 流式細胞儀檢測四倍體幼芽數/外植體誘導出的總芽數) 。 每組試驗重復2次,數據采用 SPSS 軟件處理,并進行F檢驗。
1.2.3臺灣泡桐四倍體植株的鑒定(1)幼苗根尖染色體計數。臺灣泡桐二倍體幼苗及秋水仙素誘導變異幼苗的根尖細胞染色體觀察參照舒壽蘭等[ 20]的方法。在尼康TS-100熒光倒置顯微鏡(2 000×)下,觀察上述根尖臨時壓片中的染色體條數并拍照。(2)葉片單細胞DNA相對含量測定。分別將染色體加倍的及普通二倍體的臺灣泡桐葉片各50 mg置于2 mL緩沖液Ⅰ(0.5%T ween 和濃度為0.1 mol/L的檸檬酸) 中,然后用剪刀或鋒利的刀片將其切碎,用300目尼龍網過濾至BD專用試管中,重復過濾2次去除雜質。留取1 mL濾液置于轉速為1 500 r/min的離心機中4 ℃離心5 min,棄除上清液,并加入1 mL鞘液輕微搖勻,然后再置入上述轉速離心機中4 ℃離心5 min。倒掉上清液,在沉淀中加入 0.5 mL 儀器所帶熒光染色液,輕微振蕩搖勻后避光放置 30 min,以便充分染色。然后用300目濾網過濾1次至試管中,用于測定葉片單細胞DNA相對含量。
1.2.4植株形態特征比較觀察并記錄上面生長30 d第5次繼代的四倍體和二倍體臺灣泡桐幼苗葉形、葉色等差異。每一指標測定10個樣品,求其平均值。
1.2.5表皮細胞氣孔器的比較取苗齡60 d的四倍體和二倍體臺灣泡桐組培苗成熟葉片,放置于質量分數5% 的KOH溶液中煮沸3~5 min,然后置于冷水中。先在載玻片上滴一滴清水,再用鑷子挑取其表皮并展平放于載玻片的水滴上,用濾紙吸去過多的水分。然后蓋上蓋玻片并用目鏡中帶有測微尺鏡頭的顯微鏡觀察,在100×10的油鏡下觀察測量每個氣孔器的長度、寬度和氣孔器個數,計算氣孔器密度,3次重復,取平均值。
2結果與分析
2.1不同濃度秋水仙素處理對臺灣泡桐四倍體誘導的影響
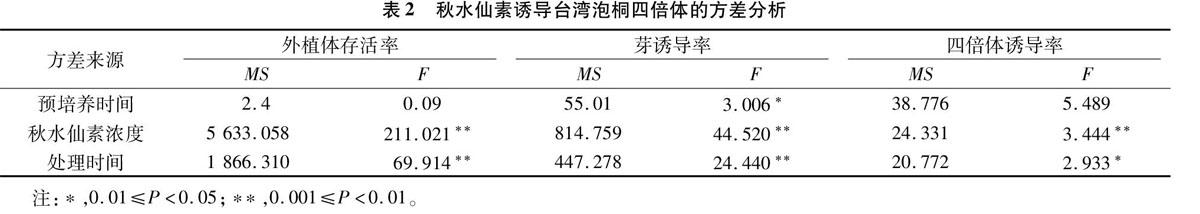
從表1試驗數據及統計結果可以看出,不同預培養時間及不同濃度、不同處理時間的秋水仙素誘導對臺灣泡桐四倍體誘導率、芽誘導率和外植體存活率均有不同影響。 當秋水仙素濃度是10 mg/L時,伴隨預培養時間和秋水仙素誘導時間的延長,四倍體誘導率、芽誘導率和外植體存活率均表現出明顯不同。其中,組合11的四倍體誘導率、芽誘導率和外植體存活率分別為6.90%、20.58%及49.11%。當秋水仙素濃度為 20 mg/L 時,組合13的四倍體誘導率、芽誘導率及外植體存活率均達到最高。當秋水仙素濃度為30 mg/L時,組合16的四倍體誘導率、芽誘導率和外植體存活率達到最大,分別為345%、11.94%及32.83%。綜上所述,當秋水仙素濃度不斷增大,臺灣泡桐葉片(外植體)的最高四倍體誘導率及芽誘導率、存活率基本呈現下降趨勢,并且秋水仙素濃度對四倍體誘導率、芽誘導率及外植體存活率的影響均極顯著;秋水仙素處理外植體的時間對外植體存活率、芽誘導率的影響均極顯著;外植體的預培養時間對芽誘導率的影響顯著,而對四倍體誘導率的影響則不顯著(表2 )。這表明,臺灣泡桐最高四倍體誘導率的產生是外植體預培養時間、處理時間及秋水仙素濃度共同作用的結果。因此,選擇組合11(6 d預培養+10 mg/L 秋水仙素+48 h處理),作為臺灣泡桐四倍體誘導的最佳組合。
2.2四倍體臺灣泡桐植株的鑒定
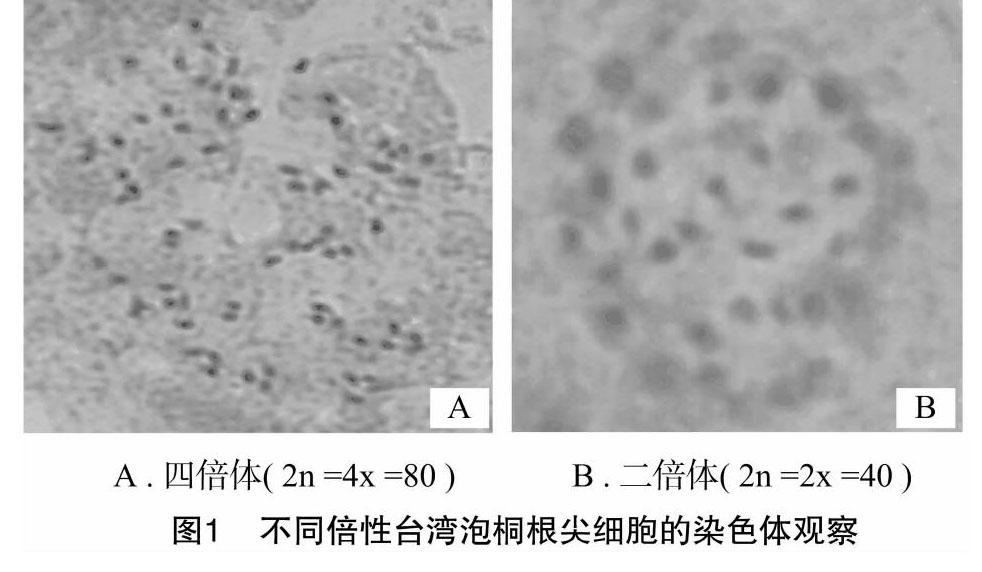
2.2.1根尖染色體觀察觀察顯微鏡下根尖臨時壓片顯示,變異的臺灣泡桐幼苗根尖細胞染色體為2n= 4x=80,正常臺灣泡桐二倍體的根尖細胞染色體為2n=2x=40( 圖1) 。染色體觀察結果顯示,秋水仙素誘變的臺灣桐幼苗細胞中,染色體數均是正常二倍體的2倍。
2.2.2葉片單細胞DNA含量檢測流式細胞儀檢測繼代5次的臺灣泡桐變異幼苗和二倍體幼苗葉片單細胞DNA相對含量的檢測結果(圖2)表明,臺灣泡桐二倍體幼苗只在相對熒光強度值為50的位置上出現1個單峰,而經秋水仙素處理后也僅在接近100的位置上出現1個單峰,即變異幼苗葉片單細胞 DNA含量為其二倍體葉片的2倍。綜上所述,秋水仙素誘導獲得的臺灣泡桐變異幼苗為其同源四倍體幼苗。
2.3臺灣泡桐二倍體與同源四倍體幼苗的形態比較
由圖3和表3可知,四倍體較二倍體幼苗葉色變深,葉片變厚、增大,長寬比變小。另外,與二倍體相比,臺灣泡桐四倍體葉片的氣孔變大,但其葉片的氣孔器密度變小。
3討論
眾所周知,當今植物多倍體誘導中效果最好、應用最廣泛的化學誘變劑是秋水仙素,它在植物多倍體誘導中具有非常重要的作用[22-23]。本試驗結果表明,組合11是臺灣泡桐四倍體誘導率最高的組合,即將臺灣泡桐葉片預培養6 d后,再在濃度為10 mg/L秋水仙素的液體培養基上誘導48 h,四倍體誘導率達到最高,為 6.90%。這與在蘭考泡桐、白花泡桐和南方泡桐等葉片上得到的情況[13-18]有一定差異,臺灣泡桐四倍體誘導率有顯著下降。這可能是將臺灣泡桐葉片直接浸泡于秋水仙素液體培養基中,造成其在較短時間內對外植體產生毒害作用,降低了外植體的存活率和芽誘導率,因而造成四倍體誘導率的顯著下降。但是,與其他種類泡桐四倍體誘導所采用的雙層培養基法相比,上述方法減少了一定的工作量,加快了誘導的速度,對于需要快速獲得四倍體植株的植物種類,液體浸泡的方法是比較好的選擇。此外,在本試驗中,采用組合11處理后獲得的誘變植株大部分為四倍體,并且這些四倍體能夠穩定地遺傳,其原因可能是用10 mg/L秋水仙素處理預培養6 d的臺灣泡桐葉片48 h時,由于葉片較薄,細胞分裂旺盛、分裂的同步性好,此時秋水仙素易抑制紡錘絲的形成,從而導致大量的細胞染色體加倍,這樣,獲得變異植株中出現嵌合體的概率就小。
參考文獻:
[1]劉榮寧,何佳,趙改麗,等. 三球懸鈴木體細胞同源四倍體誘導及鑒定[J]. 沈陽農業大學學報,2013,44(1):47-51.
[2]魯敏. 響葉楊三倍體和四倍體誘導技術研究[D]. 北京:北京林業大學,2013.
[3]羅曉丹. 四倍體刺槐誘導及其體外植株再生的研究[D]. 長沙:中南林業科技大學,2009.
[4]穆懷志. 多倍體白樺的誘導及其光合特性的分析[D]. 哈爾濱:東北林業大學,2010.
[5]聶琳. 楸樹體外植株再生及其同源四倍體誘導的研究[D]. 鄭州:河南農業大學,2011.
[6]聶琳,彭杰,常軍,等. 四倍體刺槐研究現狀及進展[J]. 中國農學通報,2013,29(4):1-4.
[7]孫日彥,粱明芝,宋慧貞,等. 秋水仙堿處理成齡桑誘導四倍體研究[J]. 蠶業科學,1997,23(1):55-56.
[8]童俊,葉要妹,馮彪,等. 秋水仙素誘導三種紫薇多倍體的研究[J]. 園藝學報,2009,36(1):127-132.
[9]張海鳳,郭寶林,張成合,等. 杜仲四倍體的誘導與鑒定[J]. 園藝學報,2008,35(7):1047-1052.
[10]周玉麗,任士福,張成合.連翹多倍體誘導與鑒定[J]. 河北農業大學學報,2011,34(1):73-77.
[11]祝澤兵. 山楊和小黑楊多倍體誘導及生長與光合特性分析[D]. 哈爾濱:東北林業大學,2010.
[12]李麗琴,付春華,王圣,等. 紅豆杉離體細胞四倍體的誘導[J]. 廣西植物,2008,28(1):121-125.
[13]范國強,楊志清,曹艷春,等. 秋水仙素誘導蘭考泡桐同源四倍體[J]. 核農學報,2006,20(6):473-476,547.
[14]范國強,曹艷春,趙振利,等. 白花泡桐同源四倍體的誘導[J]. 林業科學,2007,43(4):31-35,插1.
[15]范國強,魏真真,楊志清.南方泡桐同源四倍體的誘導及其體外植株再生[J]. 西北農林科技大學學報:自然科學版,2009(10):83-90.
[16]范國強,楊志清,曹艷春,等. 毛泡桐同源四倍體的誘導[J]. 植物生理學通訊,2007,43(1):109-111.
[17]范國強,翟曉巧,魏真真,等. 豫雜一號泡桐體細胞同源四倍體誘導及其體外植株再生[J]. 東北林業大學學報,2010,38(12):22-26.
[18]趙振利,何佳,趙曉改,等. 泡桐9501體外植株再生體系的建立及體細胞同源四倍體誘導[J]. 河南農業大學學報,2011,45(1):59-65.
[19]韓同麗. 四種泡桐體外植株再生體系建立[D]. 鄭州:河南農業大學,2013.
[20]舒壽蘭. 四種泡桐染色體數目的初步研究[J]. 河南農業大學學報,1985,19(1):48-50.
[21]Hiicini K,Walker D J,Bouzid S,et al. Determination ploidy level and nuclear DNA content in Tunisian populations of Atriplex halimus L.[J]. Gen Res Crop Evol,2006,53(1):1-5.
[22]王玉英,李光宏,李志敏,等. 野生黃蟬蘭多倍體誘導初報[J]. 江蘇農業科學,2014,42(4):132-134.
[23]劉露穎,趙喜亭,李明軍. 秋水仙堿誘導藥用植物多倍體的研究進展[J]. 江蘇農業科學,2014,42(4):178-181.

