不同飼料對諸氏鯔蝦虎魚生長和利用效果的影響
魏遠(yuǎn)征,林忠婷,李建軍,葉惠欣
(廣東省實(shí)驗(yàn)動物監(jiān)測所,廣東省實(shí)驗(yàn)動物重點(diǎn)實(shí)驗(yàn)室,廣州 510663)
?
不同飼料對諸氏鯔蝦虎魚生長和利用效果的影響
魏遠(yuǎn)征,林忠婷,李建軍,葉惠欣
(廣東省實(shí)驗(yàn)動物監(jiān)測所,廣東省實(shí)驗(yàn)動物重點(diǎn)實(shí)驗(yàn)室,廣州510663)
【摘要】目的初步探討過渡期諸氏鯔蝦虎魚的營養(yǎng)需求,為專用配合飼料的開發(fā)及相關(guān)標(biāo)準(zhǔn)的制定提供數(shù)據(jù)參考。方法分別采用鹵蟲無節(jié)幼體(Arternia nauplii, CK)和7種商業(yè)化配合飼料 (P30L8,P35L8,P50L8,P55L8;P50L12,P53L12,P55L12) 飼喂過渡期蝦虎魚幼魚,8周生長實(shí)驗(yàn)以測定存活率(survival rate,SR)、增重率(weight gain, WG)、特定生長率(specific growth rate, SGR)和攝食率(feeding rate, FR)、飼料系數(shù)(feed conversion ratio, FCR) 等生長指標(biāo),并測定不同營養(yǎng)水平下蝦虎魚全魚(除去內(nèi)臟)的基本組份。結(jié)果SR飼料組SR (51.78±8.98~68.22±4.95) 較對照組CK (58.22±6.51) 均無顯著差異(P>0.05);WG除P30L8 (130.76±23.67)、P50L12組 (220.86±16.9) 外,各實(shí)驗(yàn)組均優(yōu)于對照組CK (206±41.91, P<0.05),且飼料粗脂肪含量相同(8%,12%;能量值相差不大)時(shí),WG隨飼料粗蛋白含量的升高而上升; SGR在粗脂肪含量相同時(shí)SGR也隨飼料粗蛋白含量的升高而上升;FR,F(xiàn)CR P50L8,P55L8;P50L12,P53L12,P55L12組均優(yōu)于對照組CK (1.74±0.36),且飼料粗脂肪含量8%時(shí)隨粗蛋白含量上升而下降。此外蝦虎魚魚體基本組份均與飼料中粗蛋白、粗脂肪含量關(guān)系不大 (P<0.05)。結(jié)論配合飼料飼替代生物餌料是可行的,且能取得較好的生長效果;飼料粗蛋白、粗脂肪含量對蝦虎魚魚體基本組份影響不顯著 (P<0.05);飼料粗蛋白50%,粗脂肪8%時(shí),飼料利用率最好且過渡期蝦虎魚可獲得較好的生長效果。
【關(guān)鍵詞】諸氏鯔蝦虎魚; 配合餌料; 過渡期生長; 飼料利用; 魚體基本組份
近年來斑馬魚 (Daniorerio)、劍尾魚 (Xiphophorushellerii) 等水生實(shí)驗(yàn)動物已發(fā)展成模式生物,在遺傳學(xué)、環(huán)境毒理學(xué)、藥理學(xué)、分子發(fā)育生物學(xué)、免疫學(xué)研究等方面發(fā)揮著越來越重要的作用[1-2]。諸氏鯔蝦虎魚 (Mugilogobiuschulae),即朱拉氏鯔蝦虎魚,屬于鱸形目 (Perciformes)、蝦虎魚亞目 (Gobioide)、蝦虎魚科 (Gobiidae)、鯔蝦虎魚屬 (Mugilogobius);該魚個體小,繁殖周期短,繁殖力強(qiáng),是一種暖水性底層小型海水魚類,廣泛分布于香港、菲律賓、日本、泰國及西太平洋海域[3]。本實(shí)驗(yàn)室已開展室內(nèi)全人工繁育、生長遺傳特性分析、毒力分析等一系列實(shí)驗(yàn),初步結(jié)果表明其具備良好的魚類實(shí)驗(yàn)動物開發(fā)潛力[4-10]。同時(shí)諸氏鯔蝦虎魚的生物餌料替代實(shí)驗(yàn)表明配合飼料部分替代鹵蟲無節(jié)幼體也能獲得較好的生長效果[11],這為其飼養(yǎng)的規(guī)范化提供了可能。
實(shí)驗(yàn)動物是“活的精密儀器”,其區(qū)別于其他動物最顯著的特征是實(shí)驗(yàn)動物實(shí)施標(biāo)準(zhǔn)化的質(zhì)量控制[12],其中實(shí)驗(yàn)用魚飼料營養(yǎng)的質(zhì)量是實(shí)驗(yàn)動物質(zhì)量標(biāo)準(zhǔn)體系的重要組成部分,其標(biāo)準(zhǔn)的制定關(guān)系到實(shí)驗(yàn)動物研究的科學(xué)性和準(zhǔn)確性。由于生物餌料營養(yǎng)成份存在差異,且存在攜帶病原等不可控因素,因此從質(zhì)量可控的角度考慮,優(yōu)質(zhì)適宜的配合飼料飼喂實(shí)驗(yàn)動物更有優(yōu)勢。目前哺乳動物已制定實(shí)施了針對實(shí)驗(yàn)動物的飼料標(biāo)準(zhǔn) (GB 14924.1-2001)。截止2012年農(nóng)業(yè)部已發(fā)布實(shí)施了21項(xiàng)水產(chǎn)飼料行業(yè)標(biāo)準(zhǔn),涵蓋了我國主要的水產(chǎn)養(yǎng)殖品種[13];主要代表性經(jīng)濟(jì)魚類蛋白質(zhì)、脂肪等的營養(yǎng)需要參數(shù)已初步確立[13],個別地方也制定了實(shí)驗(yàn)用魚類質(zhì)量控制系列標(biāo)準(zhǔn) (DB11/T 1053.5-2013)[12],但實(shí)驗(yàn)用魚特別是海水性實(shí)驗(yàn)魚對蛋白質(zhì)、脂肪、碳水化合物、維生素等的營養(yǎng)需求及飼料方面的研究十分有限。實(shí)驗(yàn)魚的飼料營養(yǎng)的標(biāo)準(zhǔn)化問題已經(jīng)是影響實(shí)驗(yàn)用魚質(zhì)量的一個亟待解決的問題[14]。國內(nèi)外關(guān)于蝦虎魚營養(yǎng)需求的研究數(shù)據(jù),不足以支持諸氏鯔蝦虎魚專用配合飼料的開發(fā)。本實(shí)驗(yàn)在力求原料組份相同的前提下,研究了7種商業(yè)化配合飼料 (8%粗脂肪含量,4蛋白水平;12%粗脂肪含量,3蛋白水平) 對諸氏鯔蝦虎魚生長和利用效果的影響,旨在探討飼料營養(yǎng)成份對蝦虎魚過渡期 (80~120 d) 生長和飼料利用的影響,以期為諸氏鯔蝦虎魚專用配合飼料的開發(fā)及相關(guān)標(biāo)準(zhǔn)制定提供數(shù)據(jù)支持,并為進(jìn)一步營養(yǎng)需求的研究提供參考。
1材料和方法
1.1實(shí)驗(yàn)魚與養(yǎng)殖條件
實(shí)驗(yàn)諸氏鯔蝦虎魚為本實(shí)驗(yàn)室引種馴化(原種群為深圳大鵬灣沿岸),選用80日齡幼魚,體重 0.08~0.12 g。實(shí)驗(yàn)條件下集中馴養(yǎng)2周,每天投喂等量混合的實(shí)驗(yàn)飼料。實(shí)驗(yàn)開始前將暫養(yǎng)魚集中禁食24 h,選擇體質(zhì)健壯、規(guī)格均勻的蝦虎魚隨機(jī)分為8組,每組3個重復(fù),每缸75尾。。
飼喂實(shí)驗(yàn)在室內(nèi)加裝循環(huán)水系統(tǒng)的塑料水族箱 (90 cm×45 cm×15 cm)中進(jìn)行,水溫為24~26 ℃、鹽度22 ‰~28 ‰,pH 7.5左右,氨氮≤0.5 mg/L,余氯≤0.05 mg/ L,12 : 12 h光照周期。
1.2飼料與投喂
分別選取2水平粗脂肪 (8%,4個蛋白水平;12%,3個蛋白水平)的7種商業(yè)化配合飼料(即P30L8,P35L8,P50L8,P55L8;P50L12,P53L12,P55L12)和鹵蟲無節(jié)幼體(Arternianauplii, CK)進(jìn)行投喂實(shí)驗(yàn)。飼料基本生化組成見表1。依據(jù)過渡期蝦虎魚的口徑,手工碾磨并過篩處理,以獲得最佳粒徑的飼料(80 d:0.5 mm;94~110 d:0.8 mm;≥110 d:1~1.5 mm)。
實(shí)驗(yàn)投喂時(shí)間為每天9:00和16:00,每次投喂量以實(shí)驗(yàn)魚20 min內(nèi)吃完為宜。每天吸污并補(bǔ)充定量海水,觀察水質(zhì)和魚活動情況。投喂實(shí)驗(yàn)結(jié)束后,稱15 g飼料放入實(shí)驗(yàn)缸中,10 min后回收。同時(shí)70 ℃烘干稱重,計(jì)算飼料的溶失率以校正實(shí)際攝食量。
1.3魚體及飼料取樣、樣品分析
8周實(shí)驗(yàn)結(jié)束時(shí)分別取對照組CK和各實(shí)驗(yàn)組蝦虎魚每組約160尾進(jìn)行全魚成份的測定。具體方法如下:魚體成份測定方法參照GB/T18654.10-2008方法[5],去除鰭和內(nèi)臟,搗碎,混勻,制備樣品。
每組200 g飼料樣品,均機(jī)械碾磨后混勻后稱重取樣。飼料樣品中粗蛋白、粗脂肪、水分和灰分等的測定方法參照國標(biāo)方法 (GB 5009.5-2010、GB 5009.6-2003、GB 5009.3-2010和GB 5009.4-2010) 進(jìn)行。具體如下:粗蛋白測定采用凱氏定氮法;粗脂肪的測定采用乙醚索氏抽提法進(jìn)行;水分含量通過在105℃烘箱中烘至恒重進(jìn)行測定;樣品灰分含量通過在馬弗爐中550℃充分灼燒測定,每個樣品重復(fù)測定2次,結(jié)果取偏差小于2%的兩個平均數(shù),當(dāng)誤差大于5%時(shí)重復(fù)測定。
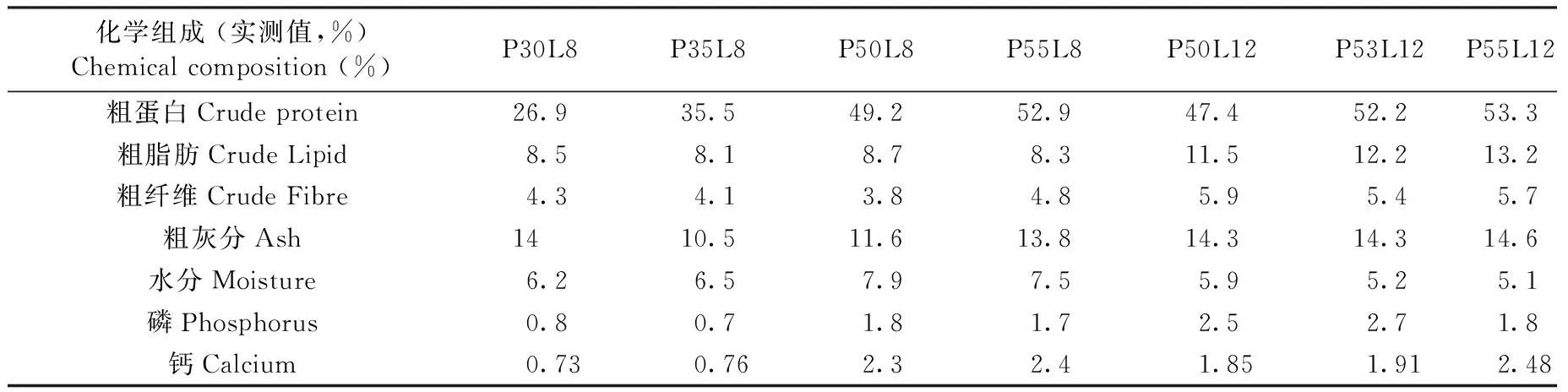
表1 飼料成份分析
注:以上7種配合飼料均為原料基本相同(白魚粉,磷蝦粉,啤酒干酵母,小麥粉,螺旋藻,魚油,蝦青素,復(fù)合維生素和礦物質(zhì)),且粗蛋白、粗脂肪來源確定,呈梯度變化的商業(yè)化飼料;P、L分別代表飼料粗蛋白和粗脂肪水平,例如:P30L8表示飼料粗蛋白含量30%,粗脂肪8%。
Note:The ingredients of 7 diet are exactly the same (white fish meal, krill meal, yeast, weatmeal, spirulina, fish oil, astaxanthin, compound vitamins and minerals) and the source of crude protein and crude lipid are confirmed. P: crude protein level; L: crude lipid level, for example, P30L8: 30% protein and 8% lipid.
1.4數(shù)據(jù)處理及統(tǒng)計(jì)分析
飼喂實(shí)驗(yàn)前2周,每周統(tǒng)計(jì)各處理組存活率。飼喂實(shí)驗(yàn)持續(xù)8周(80~150 d),結(jié)束前停食24 h,計(jì)算總存活率及其它數(shù)據(jù)。實(shí)驗(yàn)魚存活率(survival rate SR)、增重率(weight gain, WG)、攝食率(feeding rate, FR)、特定生長率(specific growth rate, SGR)、飼料系數(shù)(feed conversion ratio, FCR)、肥滿度(fullness, FUL)的計(jì)算如下:
1)存活率(%)=終尾數(shù)/初尾數(shù)
2)攝食率(%)=攝食量/[養(yǎng)殖天數(shù) ×(初體重+末體重)/2]
3)增重率(%)=(終體重-初體重)/初體重
4)特定生長率(%)=(ln終體重 - ln初體重)/投喂天數(shù)
5)飼料系數(shù)=攝食量/(終體重 - 初體重)
6)肥滿度 (%)=(W / L3)W,體重(g);L,體長(cm)
采用SPSS軟件進(jìn)行單因素方差(One-way ANOVA)分析,計(jì)算不同飼料投喂對蝦虎魚生長的影響,差異顯著時(shí)進(jìn)行Duncan’s 多重比較。
2結(jié)果
2.1存活與生長
8 周飼喂實(shí)驗(yàn),蝦虎魚幼魚經(jīng)過渡期 (80~120 d) 至成魚期 (120~250 d)[4],平均體重增加至0.295~0.513 g。采用單因素方差分析實(shí)驗(yàn)組與對照組 (鹵蟲投喂組) 存活率 (SR)、增重率 (WG)、特定生長率 (SGR) 和飼料利用率 (FCR) 等的差異 (表3);同時(shí)為探究最優(yōu)的飼料飼喂效果,以指標(biāo)最優(yōu)的實(shí)驗(yàn)組為參考,進(jìn)行組間多重比較,以分析不同飼料對蝦虎魚的生長及利用率的效果。結(jié)果顯示:不同營養(yǎng)水平的配合飼料對蝦虎魚幼魚存活、攝食和生長的影響存在差異。
2.1.1存活率(SR)
飼料組SR較鹵蟲組CK,均無顯著差異 (P>0.05);其中P55L12 SR最高 (68.22%),其次為P55L8 (66.67%),P30L8 (51.78%)SR最低。組間差異分析表明:P55L8、P55L12 組SR顯著高于P30L8 (P<0.05),且與其它實(shí)驗(yàn)組均無顯著差異 (P>0.05)。
飼料粗脂肪含量相同時(shí) (8 %,12 %),SR與飼料粗蛋白含量無線性相關(guān),即SR不隨粗蛋白含量的變化 (30%~55%;50%~55%) 而出現(xiàn)線性上升,且粗蛋白含量超過50 %時(shí),實(shí)驗(yàn)組間均無顯著差異 (P>0.05)。說明配合飼料可替代鹵蟲作為蝦虎魚過渡期的生長飼料,且粗蛋白含量50%左右時(shí)能獲得較高的存活率。
2.1.2增重率(WG)
P50L8組WG最大 (473.1±52.9) 且顯著大于其它實(shí)驗(yàn)組 (P<0.05),其次為P35L8、P55L12和 P55L8,WG最小的為P30L8組 (130.76±23.67);P30L8與鹵蟲組CK無顯著差異 (P>0.05)。這說明低粗蛋白、粗脂肪含量的配合飼料與鹵蟲均不能滿足蝦虎魚過渡期生長的營養(yǎng)需求。
粗蛋白、粗脂肪含量最高的P55L12組 (53.3%、13.2%) 蝦虎魚WG反而小于低水平的P35L8組 (35.5%、8.1%),說明適當(dāng)粗蛋白、粗脂肪含量的飼料就能獲得較好的生長效果;過高蛋白、脂肪含量的飼料反而造成能量浪費(fèi)。
2.1.3特定生長率(SGR):P50L8組過渡期SGR最大,且除P50L12外各實(shí)驗(yàn)組較對照組CK均有顯著差異 (P<0.05,表2)。同時(shí)P50L8組特定生長率較其它實(shí)驗(yàn)組有顯著差異(P<0.05)。
飼料粗脂肪含量相同(8%,12%)時(shí),SGR與飼料粗蛋白含量呈線性相關(guān)(圖1, 2),即SGR隨粗蛋白含量的升高而出現(xiàn)線性上升,但粗蛋白含量超過50%時(shí),實(shí)驗(yàn)組間均無顯著差異(P>0.05)。同時(shí),粗蛋白、粗脂肪含量最高的P55L12組SGR小于低水平的P35L8、P50L8,說明配合飼料粗蛋白含量在一定范圍內(nèi)對生長有顯著影響。
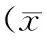

飼料Diet存活率/%survivalrate增重率/%weightgain,WG攝食率/%feedingrate,FR特定生長率/%specificgrowthrate,SGR飼料系數(shù)feedconversionratio,FCR肥滿度/%fullness,FULP30L851.78±8.98a130.76±23.67a2.5±0.19b0.92±0.12b2.93±0.63b1.99±0.18abP35L862.00±12.4a358.00±41.29b1.89±0.14a1.69±0.01b1.33±0.15a2.23±0.16aP50L859.11±14.48a473.10±52.9b1.38±0.11b1.93±0.11b0.89±0.11b2.2±0.11aP55L866.67±8.3a354.20±50.58b1.25±0.12b1.68±0.12b0.89±0.13b2.31±0.13aP50L1261.78±5.38a220.86±16.9a1.39±0.05b1.29±0.06a1.16±0.83ab2.28±0.13aP53L1257.33±11.09a312.08±33.2b1.27±0.09b1.57±0.01b0.94±0.11b2.19±0.01aP55L1268.22±4.95a355.60±50.6b1.5±0.29b1.66±0.27b1.1±0.35b2.34±0.22aCK58.22±6.51a206.00±41.91a1.92±0.19a1.24±0.02a1.74±0.36a2.22±0.01a
注:以鹵蟲投喂組CK為對照進(jìn)行顯著性分析,同一列上不同字母表示差異顯著:ab代表差異顯著(P<0.05),b表示差異極其顯著(P<0.01)。
Note:CK,Arternianauplii; means with different superscripts are significantly different (P<0.05), ab means significant different (P<0.05); b means extremely significant different (P<0.01).
2.2飼料利用
2.2.1攝食率(FR)
7種配合飼料與鹵蟲投喂組CK相比,除P35L8組外均有顯著差異 (P<0.05);P30L8組FR最大 (2.5±0.19),P55L8組最小 (1.25±0.12)。組間比較結(jié)果顯示:FR最小的P55L8組與P30L8 和P35L8 均存在顯著差異 (P<0.05),且其與P55L12也有顯著差異 (P<0.05),這說明雖然飼料經(jīng)手工磨制、過篩(粒徑0.8 mm~1.0 mm)達(dá)到要求,但飼料粗蛋白、粗脂肪含量對FR仍有決定作用。
2.2.2飼料系數(shù) (FCR)
蝦虎魚FCR最大的為P30L8組 (2.93±0.63),其次為鹵蟲飼喂對照組CK,蛋白含量較高的P50L8和P55L8組FCR最小。飼料粗脂肪含量8%時(shí),F(xiàn)CR隨飼料中蛋白含量的增加而下降(圖1)。
飼料組與對照組CK相比,除P35L8組外均差異顯著 (P<0.05) (表2)。P50L8、P55L8組FCR相等且最低,其顯著小于P30L8、P35L8組 (P<0.05)。粗蛋白、粗脂肪含量最高的P55L12 (53.3%、13.2%) FCR大于P50L8、P55L8組 (49.2%、8.7%;52.9%、8.3%),這說明飼料中粗蛋白、粗脂肪含量過高時(shí),營養(yǎng)物質(zhì)不易被魚體充分利用,反而造成能量浪費(fèi),甚至可能影響魚體健康。
2.3飼料粗蛋白質(zhì)、粗脂肪含量對蝦虎魚肥滿度及魚體基本組份的影響
2.3.1肥滿度
P55L12組蝦虎魚肥滿度最高 (2.34±0.22),肥滿度最小的為P30L8 (1.99±0.18);其中P30L8組蝦虎魚較對照組CK有顯著差異 (P<0.05,表2),其它實(shí)驗(yàn)組均無顯著差異 (P>0.05)。這可能是由飼料營養(yǎng)水平不同造成的:飼料粗脂肪、粗蛋白含量過低不利于生長,過高易造成脂肪的積累,但對與魚體健康的影響仍需進(jìn)一步研究。
2.3.2魚體組份
為分析飼料粗蛋白、粗脂肪含量對蝦虎魚魚體組份的影響,選用除去內(nèi)臟后的鹵蟲飼喂組CK和配合飼料組蝦虎魚進(jìn)行魚體組份分析。結(jié)果表明:不同粗蛋白、粗脂肪含量的配合飼料對蝦虎魚魚體基本組份 (表3) 無顯著影響 (P>0.05),即魚體粗蛋白、粗脂肪和灰分與飼料中粗蛋白、粗脂肪含量關(guān)系不大(P<0.05)。
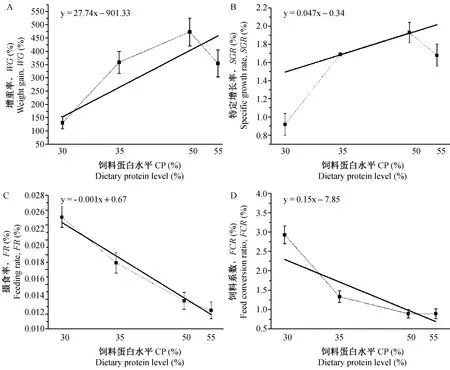
注:圖中橫坐標(biāo)30、35、50、55分別代表4種粗蛋白含量的飼料,即P30L8(26.9%)、P35L8(35.5%)、P50L8(49.2%)、P55L8(52.9%);其中實(shí)線代表線性分析結(jié)果,虛線為各個點(diǎn)實(shí)際值的連接線。圖1 飼料粗蛋白含量(8%粗脂肪)對蝦虎魚生長及利用率的影響Note:Abscissa 30, 35, 50, 55: 4 different compound feeds P30L8 (26.9%), P35L8 (35.5%), P50L8 (49.2%) and P55L8 (52.9%); full line means the linear analysis of differnet protein levels; imaginary lines means connecting line of the actual value. Fig.1 Effect of different protein level (8% lipid) on growth performance and feed conversion of Mugilogobius chulae
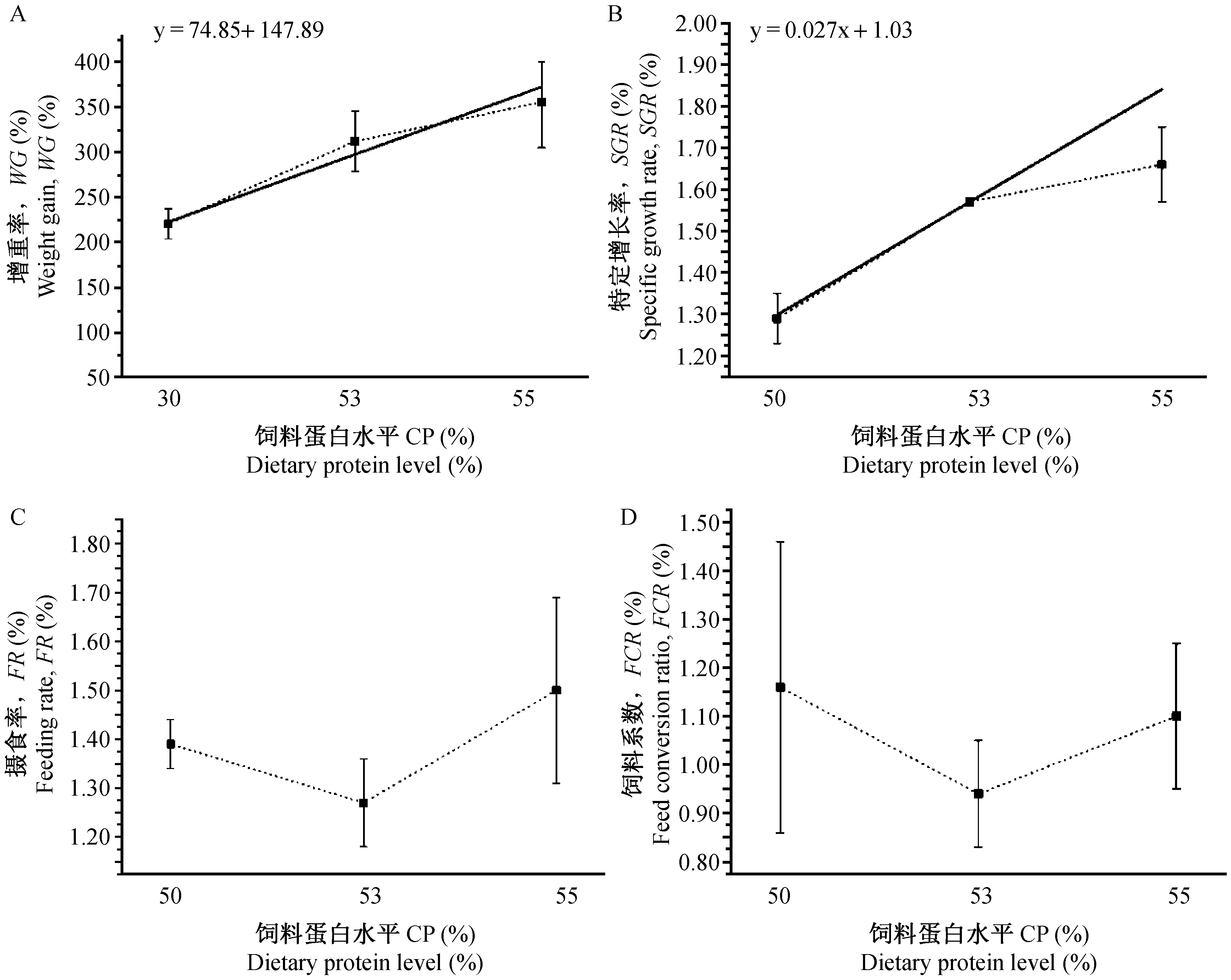
注:圖中橫坐標(biāo)50、53、55分別代表3種粗蛋白含量的飼料,即P50L12(47.4%)、P53L12(52.2%)、P55L12(53.3%);其中實(shí)線代表線性分析結(jié)果,虛線為各個點(diǎn)實(shí)際值的連接線,粗脂肪含量12% 時(shí)FR、FCR均無線性關(guān)系。圖2 飼料粗蛋白含量(12%粗脂肪)對蝦虎魚生長及利用率的影響Note:Abscissa 50, 53, 55: 3 different compound feeds P50L12(47.4%)、P53L12(52.2%) and P55L12(53.3%); full line means the linear analysis of differnet protein levels; imaginary lines means connecting line of the actual value; FR and FCR have no linear relationships with differnet protein levels.Fig.2 Effect of different protein level (12%lipid) on growth performance and feed conversion of Mugilogobius chulae
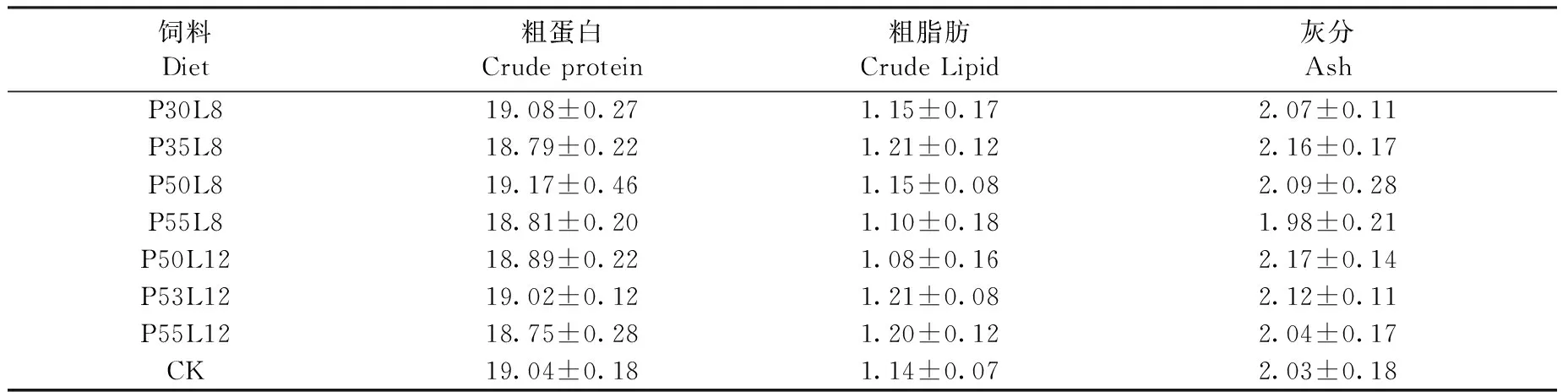
飼料Diet粗蛋白Crudeprotein粗脂肪CrudeLipid灰分AshP30L819.08±0.271.15±0.172.07±0.11P35L818.79±0.221.21±0.122.16±0.17P50L819.17±0.461.15±0.082.09±0.28P55L818.81±0.201.10±0.181.98±0.21P50L1218.89±0.221.08±0.162.17±0.14P53L1219.02±0.121.21±0.082.12±0.11P55L1218.75±0.281.20±0.122.04±0.17CK19.04±0.181.14±0.072.03±0.18
注:各實(shí)驗(yàn)處理平均值間均無顯著差異(P>0.05)
Note: There were no significantly difference between the means of treatments (P>0.05)
3討論
適宜的餌料配方受魚種類、發(fā)育階段、養(yǎng)殖環(huán)境等的影響。諸氏鯔蝦虎魚的胚后發(fā)育根據(jù)其形態(tài)和性腺發(fā)育程度,可分為仔魚期 (0~25日齡)、稚魚期 (25~35日齡)、幼魚期 (35~80日齡)、過渡期 (80~120日齡)、成魚期和衰老期[4];其中過渡期作為幼魚至成魚的關(guān)鍵期,飼料營養(yǎng)關(guān)系到其生長和能否作為實(shí)驗(yàn)動物進(jìn)行標(biāo)準(zhǔn)化管理。目前斑馬魚已開展了較多的相關(guān)實(shí)驗(yàn),研究了飼料營養(yǎng)水平對斑馬魚開口、生長、繁殖等各個時(shí)期的影響[15-21],為其室內(nèi)標(biāo)準(zhǔn)化飼養(yǎng)奠定了基礎(chǔ)。劍尾魚標(biāo)準(zhǔn)化配合飼料的研究也取得了一定的成果[22-24]。諸氏鯔蝦虎魚的初步研究證實(shí)配合飼料可替代生物餌料[11],本研究選用的7種配合飼料均為商品化飼料且原料基本相同,由于飼料粗脂肪含量為12%時(shí),多項(xiàng)生長指標(biāo)組間無顯著差異且FR、FCR均無線性相關(guān)(圖2),因此本實(shí)驗(yàn)主要以粗脂肪含量8%的4個粗蛋白水平進(jìn)行討論分析,12%粗脂肪含量的飼料僅作相同粗蛋白含量的對照。鑒于糖類、礦物鹽和維生素等對生長的影響,該討論存在一定局限性,但可為進(jìn)一步飼料最適營養(yǎng)范圍的研究提供數(shù)據(jù)參考。
本實(shí)驗(yàn)中7個飼料組SR較鹵蟲組均無顯著差異 (P>0.05),而之前研究表明投喂鹵蟲的成活率高于配合餌料 (P<0.05)[11]。這可能與投喂時(shí)間點(diǎn)的選擇有關(guān):之前研究選擇稚魚期 (30日齡) 蝦虎魚進(jìn)行實(shí)驗(yàn);本研究為過渡期蝦虎魚 (80日齡)。魚類(特別是肉食性魚類)的消化酶活性與日齡相關(guān),在馴化過程中呈現(xiàn)動態(tài)變化:瓦氏黃顙魚稚魚 (45日齡) 時(shí),活餌組與飼料組脂肪酶活性均無顯著差異 (P>0.05);而50日齡時(shí),活餌組與飼料組間差異顯著(P<0.05)[25]。真鯛 (Pagrosomumajor)[26]、歐洲黑鱸 (Dicentrachuslabrax)[27]等的研究也證實(shí)其消化酶活性與此類似。蝦虎魚作為肉食性魚類,在長期進(jìn)化過程中形成了特定的消化酶表達(dá)活性,與自然環(huán)境中其特定的食物組成相適應(yīng)。研究顯示:活餌料的某些微量活性物質(zhì)是仔稚魚酶分泌的誘導(dǎo)因子[28]。其存在可促進(jìn)稚魚蛋白酶分泌量的增加,而配合飼料雖富含魚類所需的營養(yǎng)成分,但由于誘導(dǎo)因子的缺乏,導(dǎo)致消化酶活性低于活餌料。因此消化酶的活性差異導(dǎo)致營養(yǎng)攝入不同,進(jìn)而影響其存活率。
一定粗蛋白、粗脂肪含量的配合餌料 (P35L8、P50L8、P55L8,以及P53L12、P55L12) WG和SGR均顯著高于鹵蟲組CK (P<0.05),說明配合飼料促進(jìn)蝦虎魚過渡期生長的效果優(yōu)于生物餌料組。同時(shí)飼料粗脂肪含量8%時(shí),蝦虎魚WG與SGR未隨蛋白水平的升高而一直上升(圖1),當(dāng)飼料粗蛋白含量超過50%時(shí)均出現(xiàn)下降,且與飼料組蛋白含量線性相關(guān)性較差;同時(shí)粗蛋白含量55%時(shí),P55L8、P55L12組WG與SGR均無差異 (P>0.05);飼料粗脂肪含量12%時(shí),增加粗蛋白含量 (50%~55%),P53L12組WG與SGR均顯著優(yōu)于P50L12組。這說明飼料粗蛋白含量對蝦虎魚過渡期生長的影響大,且粗脂肪含量相同時(shí),粗蛋白含量是其生長的限制因素。這與之前的研究結(jié)果相同:飼料粗蛋白含量對劍尾魚WG、SGR有顯著影響,但粗脂肪含量對其生長參數(shù)無顯著影響[24]。
此外分析顯示:飼料粗脂肪含量相同 (8%) 時(shí),實(shí)驗(yàn)組P30L8 FR要顯著大于P35L8、P50L8和P55L8 (P<0.05),F(xiàn)R隨飼料粗蛋白含量的上升而降低(圖1)。這說明飼料粗蛋白含量低的實(shí)驗(yàn)組,其較高的攝食率可能是為了滿足魚體對營養(yǎng)的需求而做出的補(bǔ)償性調(diào)節(jié)。同時(shí),飼料粗蛋白含量在一定范圍內(nèi) (30%~55%),F(xiàn)CR隨粗蛋白含量的升高而下降(圖1),飼料粗蛋白含量高的實(shí)驗(yàn)組表現(xiàn)出較低的FCR,說明魚類對高蛋白飼料具有較好的利用效率。飼料系數(shù)是衡量飼料品質(zhì)最重要的指標(biāo),在一定程度內(nèi)提高飼料蛋白水平可獲得較低的FCR,進(jìn)而達(dá)到較好的生長效果。對FR、GR、SGR和FCR進(jìn)行線性分析時(shí),發(fā)現(xiàn)除FCR外,GR、SGR和FR的擬合度并不高(R2均在0.6左右),蛋白水平超過50%時(shí)GR、SGR和FR隨蛋白水平線性變化的可信度不高,僅在粗蛋白含量30%、35%和50%時(shí)有較高的可信度。這說明當(dāng)飼料蛋白水平達(dá)到一定量時(shí),其它因素往往成為生長的限制因素,因此在飼料的配制過程中應(yīng)綜合考慮各組份的比例。美鳊(Notemigonuscrysoleucas)[29]、石斑魚(EpinephelusCoioides)[30]等的研究表明:當(dāng)魚體攝入過高的飼料蛋白質(zhì)后,過量的蛋白質(zhì)會通過脫氨基作用造成能量浪費(fèi),進(jìn)而導(dǎo)致生長降低。
之前研究表明飼料營養(yǎng)水平影響魚體基本組份:羅非魚魚肉蛋白含量與飼料粗蛋白水平正相關(guān)[31];飼料營養(yǎng)水平會影響斑馬魚全魚肌肉及脂肪含量[21]。蝦虎魚魚體全魚(除去內(nèi)臟)基本組份(粗蛋白、粗脂肪和灰分)的測定結(jié)果表明,較對照組CK,飼料組魚體組份無顯著差異 (P>0.05,表3)。這與大多數(shù)的研究結(jié)果相同,例如:大菱鲆(ScophthalmusmaximusL.)[32]、銀漢魚(Menidiaestor)[33]等的體蛋白和灰分含量與飼料中蛋白水平無顯著差異。劍尾魚除去內(nèi)臟的全魚組份也不受飼料中蛋白水平的影響[34]。這提示適當(dāng)配比的配合飼料在滿足多數(shù)魚健康生長需求時(shí),并不改變其特性。
總之本研究比較了不同配合飼料飼喂下,諸氏鯔蝦虎魚的生長參數(shù)、魚體組份的差異,并初步探討配合飼料粗蛋白、粗脂肪含量對其過渡期生長的影響。但蝦虎魚飼料的標(biāo)準(zhǔn)化配制及飼料中蛋白、脂肪等的最適范圍仍需進(jìn)一步研究。
參考文獻(xiàn):
[1]賈順姬, 孟安明. 中國斑馬魚研究發(fā)展歷程及現(xiàn)狀[J]. 遺傳, 2012, 34(9): 1082-1088.
[2]楊笑波, 李建軍, 劉繼芳. 水生動物的實(shí)驗(yàn)研究與應(yīng)用[J]. 中國比較醫(yī)學(xué)雜志, 2005, 15(1): 48-50.
[3]伍漢霖, 鐘俊生等. 中國動物志硬骨魚綱鱸形目(五)蝦虎魚亞目[M]. 北京:科學(xué)出版社. 2008,497-498.
[4]李建軍, 陳小曲, 林忠婷, 等. 諸氏鯔蝦虎魚的形態(tài)與生長特性分析[J]. 實(shí)驗(yàn)動物與比較醫(yī)學(xué), 2012, 32(4): 334-340.
[5]李建軍, 鄭偉強(qiáng), 陳小曲, 等. 諸氏鯔蝦虎魚含肉率及肌肉營養(yǎng)成分分析[J]. 中國比較醫(yī)學(xué)雜志, 2013, 23(12): 35-39.
[6]李建軍, 吳美慧, 葉惠欣, 等. 不同發(fā)育期諸氏鯔蝦虎魚對鉆井液的敏感性比較[J]. 中國比較醫(yī)學(xué)雜志, 2013, 23(4): 48-51.
[7]蔡磊, 陳小曲, 鄭偉強(qiáng), 等. 諸氏鯔蝦虎魚多態(tài)性微衛(wèi)星標(biāo)記的開發(fā)及評價(jià)[J]. 中國實(shí)驗(yàn)動物學(xué)報(bào), 2015, 23(1): 57-62.
[8]李建軍, 林忠婷, 陳小曲, 等. 四種重金屬離子對諸氏鯔蝦虎魚的單一和聯(lián)合毒性[J]. 海洋環(huán)境科學(xué), 2014, (2): 236-241.
[9]陳小曲, 黃韌, 李建軍. 諸氏鯔蝦虎魚染色體組型分析[J]. 熱帶海洋學(xué)報(bào), 2013, (6): 88-95.
[10]李建軍, 黃韌. 不同發(fā)育階段諸氏鯔蝦虎魚對水污染物的敏感性比較[J]. 實(shí)驗(yàn)動物與比較醫(yī)學(xué), 2013, 33(5): 354-357.
[11]王穎, 陳小曲, 林忠婷, 等. 鹵蟲無節(jié)幼體和配合餌料飼喂諸氏鯔蝦虎魚效果比較[J]. 河北漁業(yè), 2012, 217(1): 28-30.
[12]孫德明, 王天奇, 朱曉紅, 等. 實(shí)驗(yàn)用魚遺傳質(zhì)量控制及標(biāo)準(zhǔn)化[J]. 遺傳, 2012, 34(9): 1202-1207.
[13]麥康森, 趙錫光, 譚北平, 等. 我國水產(chǎn)動物營養(yǎng)研究與漁用飼料的發(fā)展戰(zhàn)略研究[J]. 浙江海洋學(xué)院學(xué)報(bào):自然科學(xué)版, 2001, 20: 1-5.
[14]祝梅香, 王天奇, 張長勇, 等. 實(shí)驗(yàn)用斑馬魚劍尾魚營養(yǎng)需求及飼料現(xiàn)狀分析[J]. 中國比較醫(yī)學(xué)雜志, 2009, 19(12): 61-65.
[15]Lawrence C. The husbandry of zebrafish (Daniorerio): A review[J]. Aquaculture, 2007, 269(1): 1-20.
[16]Tocher D R. Nutritional regulation of hepatocyte fatty acid desaturation and polyunsaturated fatty acid composition in zebrafish (Daniorerio) and tilapia (Oreochromisniloticus)[J]. Fish Physiology & Biochemistry. 2001, 24(4): 309-320.
[17]Rd S A, Garris H W, Jones W T,etal.. Growth and survival of zebrafish (Daniorerio) fed different commercial and laboratory diets[J]. Zebrafish. 2009, 6(3): 275-280.
[18]Markovich M L, Rizzuto N V, Brown P B. Diet affects spawning in zebrafish[J]. Zebrafish. 2007, 4(1): 69-74.
[19]Lawrence C, Ebersole J P, Kesseli R V. Rapid growth and out-crossing promote female development in zebrafish (Daniorerio)[J]. Environmental Biology of Fishes. 2008, 81(2): 239-246.
[20]Spence R, Fatema M K, Ellis S,etal.. Diet, growth and recruitment of wild zebrafish in Bangladesh[J]. Journal of Fish Biology. 2007, 71(1): 304-309.
[21]Smith D L Jr, Barry R J, Powell M L,etal.. Dietary protein source influence on body size and composition in growing zebrafish[J]. Zebrafish. 2013, 10(3): 439-446.
[22]吳淑勤, 黃志斌, 石存斌, 等. 魚類實(shí)驗(yàn)動物與劍尾魚水生實(shí)驗(yàn)動物化[C] 第六屆中國北京國際科技產(chǎn)業(yè)博覽會暨論壇報(bào)告會, 2003, 231-231.
[23]Chong A S C, Ishak S D, Osman Z,etal.. Effect of dietary protein level on the reproductive performance of female swordtailsXiphophorushelleri(Poeciliidae)[J]. Aquaculture, 2004, 234(1): 381-392.
[24]Shirley L, Roshada H, Sagiv K, et al.. Effect of varying dietary lipid and protein levels on growth and reproductive performance of female swordtailsXiphophorushelleri(Poeciliidae)[J]. Aquaculture Research, 2006, 37(13): 1267-1275.
[25]李芹, 刁曉明. 不同餌料對瓦氏黃顙魚稚魚生長和消化酶活性的影響[J]. 水生態(tài)學(xué)雜志, 2009, 2(1): 98-102.
[26]陳品健, 王重剛. 真鯛仔,稚,幼魚期消化酶活性的變化[J]. 應(yīng)用海洋學(xué)學(xué)報(bào), 1997, 16(3): 245-248.
[27]Nolting B M, Uebersch B, Rosenthal H. Trypsin activity and physiological aspects in larval rearing of European sea bass (Dicentrarchuslabrax) using live prey and compound diets[J]. Journal of Applied Ichthyology, 1999, 15(3): 138-142.
[28]Jeannine P R, Alexandre J C, Thébaud L,etal. Marine Fish Larvae Feeding: Formulated Diets or Live Prey?[J]. Journal of the World Aquaculture Society, 1993, 24(2): 211-224.
[29]Lochmann R T, Phillips H. Dietary protein requirement of juvenile golden shiners (Notemigonuscrysoleucas) and goldfish (Carassiusauratus) in aquaria[J]. Aquaculture, 1994, 128(1): 277-285.
[30]Luo Z, Liu Y J, Mai K S,etal. Optimal Dietary Protein Requirement of Grouper Epinephelus Coioides Juveniles Fed Isoenergetic Diets In Floating Net Cages[J]. Aquaculture Nutrition, 2004, 10(4): 247-252.
[31]徐捷. 尼羅羅非魚飼料中最適蛋白含量的研究[J]. 全國魚蝦飼料學(xué)術(shù)討論會論文集學(xué)術(shù)期刊出版社, 1988: 27-33.
[32]Lee J K, Cho S H, Park S U,etal. Dietary protein requirement for young turbot (ScophthalmusmaximusL.)[J]. Aquaculture Nutrition, 2003, 9(4): 283-286.
[33]Martínez-Palacios C A, Ríos-Durán M G, Ambriz-Cervantes L,etal. Dietary protein requirement of juvenile Mexican Silverside (MenidiaestorJordan 1879), a stomachless zooplanktophagous fish[J]. Aquaculture Nutrition. 2007, 13(4): 304-310.
[34]石存斌, 吳淑勤, 黃志斌, 等. 劍尾魚人工配合餌料中最適蛋白質(zhì)含量的初步探討[J]. 中國比較醫(yī)學(xué)雜志, 2000, 10(1): 11-14.
〔修回日期〕2015-12-25
[基金項(xiàng)目]實(shí)驗(yàn)動物質(zhì)量評價(jià)方法及其標(biāo)準(zhǔn)化研究與應(yīng)用(2013BAK11B02)。
[作者簡介]魏遠(yuǎn)征(1987-),男,碩士,研究方向:實(shí)驗(yàn)動物營養(yǎng)學(xué)。E-mail: yzwei87@163.com。 [通訊作者]李建軍(1975-),男,高級工程師。E-mail: lijianjun1125@126.com。
【中圖分類號】R-332
【文獻(xiàn)標(biāo)識碼】A
【文章編號】1671-7856(2016) 01-0029-08
doi:10.3969.j.issn.1671.7856. 2016.001.006
Effect of dietary nutrient level on the growth and feed utilization ofMugilogobiuschulae
WEI Yuan-zheng, LIN Zhong-ting, LI Jian-jun, YE Hui-xin
(Guangdong Laboratory Animals Monitoring Institute, Key Laboratory of Guangdong Laboratory Animals, Guangzhou 510663, China)
【Abstract】ObjectiveTo preliminary study nutrition requirement of Mugilogobius chulae in the transitional period and provide reference data for the research and development of compound feed and relevant standards. MethodsArtemia (Artemia nauplii, CK) and 7 commercial compound feeds (P30L8, P35L8, P50L8, P55L8; P50L12, P53L12, P55L12) were used to feed goby in transitional period. At the end of 8 weeks growing experiment, some data like survival rate (SR), weight gain (WG) and specific growth rate (SGR) and so on were measured. While, 8 groups’ body compositions were also measured. ResultsSR Treatment groups (51.78±8.98~68.22±4.95) and CK (58.22±6.51) have no significant different (P>0.05). WG Treatment groups except P30L8 (130.76±23.67) and P50L12 (220.86±16.9) were significant larger than CK (206±41.91, P<0.05). Using equal lipid (8% and 12%) dietary, WG increased with protein level rising.SGR Treatment groups’ SGR also increased with protein levels rised.FR, FCR P50L8, P55L8; P50L12, P53L12, P55L12’s FR and FCR were better than group CK (P<0.05). Using equal lipid (8%) dietary, FR and FCR were decreased with protein level rised. In addition, different feed feeding group’s body composition showed no significant difference (P<0.05). ConclusionsRear goby with compound feed replace the living food was viable and supported appreciable growth. Their crude protein and lipid have no effect to the goby’s body composition (P<0.05). Dietary with crude protein 50% and crude lipid 8% could obtain a better growth in transitional period.
【Key words】Mugilogobius chulae; Compound feed; Transitional period; Growth; Feed utilization; Body composition

