籽用西瓜種質資源SSR分析及初級核心種質庫構建
石 磊,王 萍,楊 靜,王豐豐,孫曉華
(內蒙古農業大學 農學院,內蒙古野生蔬菜種質資源與創新重點實驗室,呼和浩特010019)
?
籽用西瓜種質資源SSR分析及初級核心種質庫構建
石磊,王萍*,楊靜,王豐豐,孫曉華
(內蒙古農業大學 農學院,內蒙古野生蔬菜種質資源與創新重點實驗室,呼和浩特010019)
摘要:采用SSR分子標記技術對50份不同來源的籽用西瓜材料進行遺傳多樣性研究,并基于SSR分子標記聚類分析采用最小距離逐步抽樣法構建籽瓜初級核心種質庫。研究表明:(1)從106對SSR隨機引物中篩選出擴增條帶清晰、多態性高的31對引物,共得到138條清晰可辨條帶,其中多態性條帶115條,占83.33%,平均Shannon’s信息指數(I)為0.419 3,平均Nei’s多樣指數(h)為0.272 4,平均有效等位基因數(Ne)為1.458 0,平均等位基因數(Na)為1.981 4,說明50份籽瓜種質具有豐富的遺傳多樣性。(2)用NTsys2.10e軟件對種質資源聚類分析表明,種質間的遺傳相似系數介于0.57~0.91之間,其中來源地相同的個別種質間遺傳相似系數卻很小,而來源地不同的個別種質間的遺傳相似系數卻很高。(3)采用最小距離逐步抽樣法,按70%、60%、50%、40%、30%、20%、10%的比例抽樣后,各個核心子集遺傳多樣性指數總體上變化不明顯,但各抽樣比例相比,以抽樣比例20%獲得10份初選種質的 Ne、 h和 I達到最高值,說明抽樣20%構建的初級核心種質對原始種質具有很好的代表性。
關鍵詞:籽用西瓜;SSR分子標記;種質資源;遺傳多樣性;核心種質
籽用西瓜(Citrulluslanatusssp.vulgarisvar.megalaspermusLin et Chao)簡稱籽瓜,屬于葫蘆科普通西瓜亞種中的籽瓜變種,俗稱“打瓜”、“瓜籽瓜”,主要以種子為食用器官,常根據種子顏色分為黑籽瓜和紅籽瓜兩大品種[1]。籽瓜的瓜瓤和瓜皮具有多種微量礦質元素和果膠,長期食用能夠調節人體新陳代謝,祛除胃寒,溶蝕軟化血管,增強免疫力,排除體內沉積毒素,凈化小環境。近年來,隨著栽培面積的不斷擴大,復種指數增加,籽瓜的一些病害日趨嚴重,加之長期采用不規范的常規繁殖留種,造成各地栽培品種良莠不齊、混雜退化,致使品質下降、產量不穩,籽瓜產業的發展受到嚴重制約。因此,開展籽瓜種質資源遺傳多樣性研究,并建立核心種質庫,對于籽用西瓜育種及種質資源的保存利用具有重要意義。
植物遺傳多樣性資源是生物遺傳的基礎。近年來隨著遺傳資源的急劇減少,種質資源的保存利用成為急需解決的問題。Frankel[2-3]和Brown[4]研究提出核心種質的概念,即以最小的資源份數最大限度地代表該物種的遺傳多樣性,在一定程度上解決了這一問題。近年來國內外關于核心種質的研究較多,但多是基于農藝表型性狀,表型性狀易受環境因素的影響。因此,只按照表型性狀構建核心種質方法是片面的。分子標記輔助育種的研發表明,其能夠在短期內獲得大量的遺傳信息,且能穩定、高效地反映種質資源群體中個體間的親緣關系。近年來,溫景輝[5]、張維瑞等[6]、劉娟等[7]、白成科等[8]采用分子標記技術分別研究山葡萄、桂花、野杏、山茱萸等植物種質遺傳多樣性并構建核心種質都得到了準確的結果。
趙虎基等[9]用RAPD標記對籽用西瓜的8個品種(系)和西瓜種內其它變種的4個品種(系)進行了遺傳多樣性分析。張建農[10]用RAPD標記對4個籽用西瓜、2個野生西瓜和不同生態類型瓤用西瓜等34個品種(系)進行遺傳多樣性分析。柳唐鏡等[11]用RAPD標記對不同的紅籽瓜種質資源親緣關系進行分析。與前人相比,本研究運用SSR分子標記技術對19個不同來源地的50份籽(西)瓜種質材料進行遺傳多樣性分析,并基于聚類分析結果采用最小遺傳距離逐步抽樣法(LDSS)構建籽瓜的初級核心種質庫,能夠較為全面地為中國籽瓜種質資源的評價提供參考,為今后進一步構建籽瓜核心種質奠定基礎,也為籽瓜種質資源的保護利用及育種工作提供理論依據。
1材料和方法
1.1材料
本研究所收集的50份籽(西)瓜材料來自個19省區,甘肅13份,內蒙古5份,新疆、湖南、美國各4份,寧夏、廣東各3份,陜西、前蘇聯各2份,剩余的10份分別來自10個省區。其中含野生型種質2份,普通西瓜2份。所有材料已經過多代的自交純化。供試50份籽(西)瓜材料(表1)種植于內蒙古農業大學試驗田。參考錢韋等[12]的取樣方法,于2014年8月采集了生長旺盛期的籽瓜幼嫩葉片,將不同材料葉片放入有標記的塑封袋中,立即暫時存入冰盒,帶回實驗室置于-80 ℃冰箱中冷凍備用。
1.2PCR反應
采用DNA提取試劑盒(天根生化有限公司)提取50份材料的基因組DNA,用1%瓊脂糖凝膠電泳和紫外分光光度計檢測DNA純度和濃度,-20 ℃保存備用。選用106對隨機引物以提取的籽瓜基因組DNA為模板進行PCR反應,篩選出電泳條帶清晰、多態性高、重復性好的31對引物(表2),分別對50份樣品基因組DNA進行PCR擴增。PCR反應體系為20 μL[13],模板DNA 2 μL(約50 ng/μL),引物2 μL,25 mmol/L MgCl21.8 μL,2.5 mmol/L dNTPs 2 μL,10×TaqBuffer 2 μL,TaqDNA Polymerase 0.1 μL(5 U/μL),ddH2O 11.1 μL。PCR擴增程序反應在BYQ6031 E-505型PCR儀上進行,程序為:94 ℃預變性4 min,94 ℃變性30 s,52 ℃退火30 s,72 ℃延伸1 min,35個循環,最后72 ℃伸5 min,4 ℃保存以備電泳,擴增產物用6%變性聚丙烯酰胺凝膠于80 V電壓下預電泳30 min,后在70 W恒定電壓下電泳90 min左右,銀染后拍照記錄。

表1 供試籽瓜材料及來源
Table 1Continued
編號Code材料Accession類型Type來源Sourceofgermplasm引種地Introductionplace38大板2號瓜子DabanNo.2guazi黑籽瓜Blackseedwatermel-on甘肅GansuA39蘭州大板1號LanzhoudabanNo.1黑籽瓜Blackseedwatermel-on甘肅GansuB40紅籽瓜Hongzigua紅籽瓜Redseedwatermelon前蘇聯FormerSovietUnionB41道縣紅籽瓜(白肉)Daoxianhongzigua(bairou)紅籽瓜Redseedwatermelon湖南HunanB42江西信豐紅瓜子Jiangxixinfenghong-guazi紅籽瓜Redseedwatermelon江西Jiangxi江西Jiangxi43花皮籽瓜Huapizigua黑籽瓜Blackseedwatermel-on陜西ShaanxiB44寧夏紅籽瓜Ningxiahongzigua紅籽瓜Redseedwatermelon寧夏NingxiaB45道縣紅籽瓜(紅肉)Daoxianhongzigua(hongrou)紅籽瓜Redseedwatermelon湖南HunanB46靖遠大板1號JingyuandabanNo.1黑籽瓜Blackseedwatermel-on甘肅GansuB47蘭州大板Lanzhoudaban黑籽瓜Blackseedwatermel-on蘭州LanzhouA48道縣紅籽瓜(粉紅肉)Daoxianhongz-igua(fenghongrou)紅籽瓜Redseedwatermelon湖南HunanB49新籽瓜1號XinziguaNo.1黑籽瓜Blackseedwatermel-on新疆Xinjiang新疆Xinjiang50新疆紅籽瓜Xinjianghongzigua紅籽瓜Redseedwatermelon新疆Xinjiang新疆Xinjiang
注:A. 中國農業科學院蔬菜花卉研究所;B. 國家西甜瓜種質資源平臺(河南,鄭州)。
None: A. Vegetable and Flower Research Institute of Chinese Academy of Agricultural Sciences;B. The platform of watermelon and muskmelon germplasm resources (Henan, Zhengzhou)
1.3數據分析
利用0、1矩陣統計方式構建SSR數據庫。采用POPGENE32軟件分析擴增產物的多態位點數、多態位點比率、Shannon’s信息指數等遺傳多樣性指數。采用NTsys2.10e[14]聚類分析軟件UPGMA法進行聚類分析,構建聚類圖。
1.4初級核心種質庫構建及其評價
用NTsys2.10e軟件對種質資源聚類分析后,采用最小距離逐步抽樣法(LDSS)構建核心種質[15]。具體方法為:通過觀察50份種質的UPUMA聚類圖,將遺傳相似系數較大的種質組合隨機刪除1份,再將剩余的種質再次聚類分析;再次刪除遺傳相似系數較大的成對種質中的1份種質。以此類推,直到篩選出能夠達到要求的核心種質。第1次抽樣時,選出一定份數種質,運用NTsys2.10e軟件對其進行聚類分析;第2次抽樣在第1次抽樣聚類分析的基礎上進行,以此類推。每次抽樣后,均采用POPGENE32軟件分別對構建的核心種質的SSR-PCR擴增數據進行核心種質的遺傳多樣性分析,進而評價初級核心種質的代表性。
2結果與分析
2.1SSR標記的多態性分析
從106對SSR引物中共篩選出31對多態性好、條帶清晰的引物,分別對50份材料進行PCR擴增,圖1為引物P1、P43對50份籽瓜材料進行PCR擴增的電泳圖。由圖1可以看出每個樣品體系中均得到了清晰、豐富的條帶,可進行下一步的多樣性分析。31對引物(表2)對50份材料共擴增出138條條帶。有115條重復性好、清晰的多態性條帶,多態性條帶比率高達83.33%。表明本研究所收集的籽瓜種質資源在分子水平上具有豐富多態性,種質具有很好的代表性。
(1)首次揭示在郎酒高溫制曲進程中,細菌與真核微生物種類具多樣性,但細菌與真核微生物變化趨勢差異顯著。
2.2籽瓜種質資源遺傳多樣性分析
遺傳多樣性分析結果(表3)顯示,50個材料的擴增條帶平均Shannon’s信息指數為0.419 3,平均Nei’s多樣指數為0.272 4,平均有效等位基因數為1.458 0,這50份種質資源在分子水平上具有豐富的遺傳多樣性,具有很高的代表性。
2.3SSR聚類分析
31對隨機引物對50份籽(西)瓜種質進行SSR擴增,得到115條多態性條帶,通過NTsys軟件處理,在獲得的相似系數矩陣中,相似系數范圍為0.57~0.91,其中種質29和33之間的相似系數最小,表明兩者的親緣關系最遠,而親緣關系最近的1組種質是32和36,相似系數都為0.87。從基于SSR標記的聚類樹狀圖中可知(圖2),在相似系數為0.657處,50份籽(西)瓜種質可分為6組。第一組:2份野生種質,29(野籽瓜)和33(PI542120);第二組:30(磴口籽瓜)和34(GN-1);第三組:4(陜西紅籽)和6(黑大片-2);第四組:5(黑崩筋)和47(蘭州大板);第五組:40[紅籽瓜(蘇聯)]和44(寧夏紅籽瓜);第六組:剩余的40份種質資源,相似系數范圍為0.661~0.910。

1~50.編號同表1圖1 引物P1(A)和P43(B)對50份籽瓜材料的PCR擴增圖譜1~50.Same as Table 1Fig. 1 PCR products from primer P1(A)and P43(B) with 50 seed watermelon accessions
引物Primer序列Sequence總帶數No.ofbands多態性條帶Polymorphibands多態性比率Percentageofpolymorphicband/%P1FTCTGTGTGGATGCAAATGGT6583.33RGCTAATCGAGCCCAGTTACGP2FTCAAAAGGTTTGCCCTAAATGAAA5240.00RTGCTGATCTCCCATTCTTAACCTCP4FGCAAAGATTGTCTATGAAGCAGCA44100.00RGCTCATTGGCTTCTTGAATCTGTTP5FTGCTTCAAAATCTATTCACAATTTGC5360.00RTTCTTGGTTTCGGGTTTCTTTACAP6FAAACCATGATTTTACAGGGGATCA33100.00RTTTCTGTCTTCTTTTGACCAATGCP10FTGGTTGAAATCAATAAAAAGTGAA44100.00RTGGATGTTTTTGGCATTTGAP11FTTAGCCTAAGCAAGGGTTTTT3266.67RAAGTACACATTTTAAACAATCAATCCAP12FTCAAACCGACTGCCATATCA3266.67RAGCTTGTCTTCCTGGCCTTTP13FAAAATTACATCTTAAATGCGCC44100.00RGGAACATTGACTTCAATCAGCAP14FTTCTTGAAACTCAACCCTCAAA5360.00RAAAGCGTGTCGAGTGTGAGAP15FTGGATCATTTGACAGATTTAGCGA44100.00RCATCACAGTTAACGATCACAAGGCP19FTGTTGAGATTCTTTGATTTCAACTGT6583.33RTGGGTCAAAGTATTTTTGCTTTTTP20FATGGTTCATTTTCACGTTCG6583.33RAAAAATCAAGCAAAGAACAACATP21FTTCCACACCAAGGAGGTAGG44100.00RCATGTCATTCGATAAAGCAGAAA
Table 2Continued
引物Primer序列Sequence總帶數No.ofbands多態性條帶Polymorphibands多態性比率Percentageofpolymorphicband/%P24FATTTCTGGCCCCAGTGTAAG66100.00RGAACAACGCAACCACGTATGP25FCCCTATTGCCTATTTTTCTCAA6583.33RAAATTTGTGCTCTTCGTGGGP29FAGCAAATGCATGGGGAAAAC33100.00RTGTTGAATGGAGGCTTTGAGP30FATTTCTGGCCCCAGTGTAAG55100.00RGAACAACGCAACCACGTATGP32FTCAATTCCAATCATCCATCC33100.00RTAATGGCCGGACTTTATGCP34FGAGCAGGGGAGAAGGAAAAC66100.00RCCAGTAGCTTTTTCCGATGCP36FTGCTCAATCCACCCTTCTC6583.33RAAAAACAGCAACTCTCCCATCP43FCAGAGGAACGAGAGGGAGTG44100.00RGGGGAGCCCATATTTTAACCP47FGCTTTGAAGTTTGTTTAATTTTAGTCC3266.67RCGCCTCACGCTCTCTAACP52FAATCTTCCCCATGCCAAAAC4375.00RGACTTCCAAACCCTCCCTTCP54FAAAAATTTGAAAATTAGGTGAGGAG3266.67RTTTTGACTAGGTGTACACTACCTTTGP57FCAAACAAAAACTTAGGAACTAGATTG4375.00RTTAGCCATGAGGCGTGTACCP75FAGATGCCCCATTCAGTTTTG66100.00RTTGAAGGAGAGAGGGAATGGP81FAGACAGGGAAATCGCAGAGA22100.00RGGTTAAAGGACGTCGGGATTP83FTTGGGATGTAGATGTCCGGT55100.00RTCCCCAATCCAACTCCCTATP94FATATGTGTGTCGTGTTCCGC6583.33RCAGATTTCCGAGAGGGAAAA
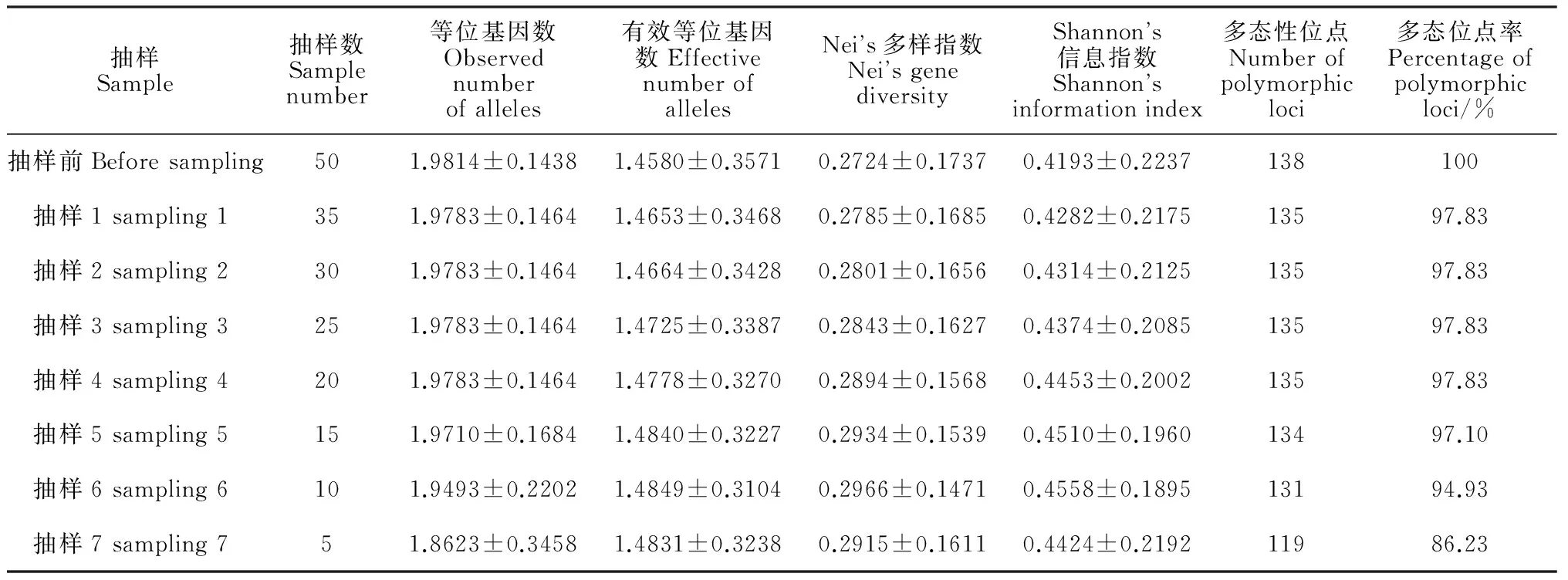
表3 最小距離逐步抽樣法構建籽瓜核心種質的遺傳多樣性

圖2 50份籽瓜種質資源的UPGMA聚類圖Fig. 2 UPGMA dendrogram of 50 edible seed watermelon germplasms
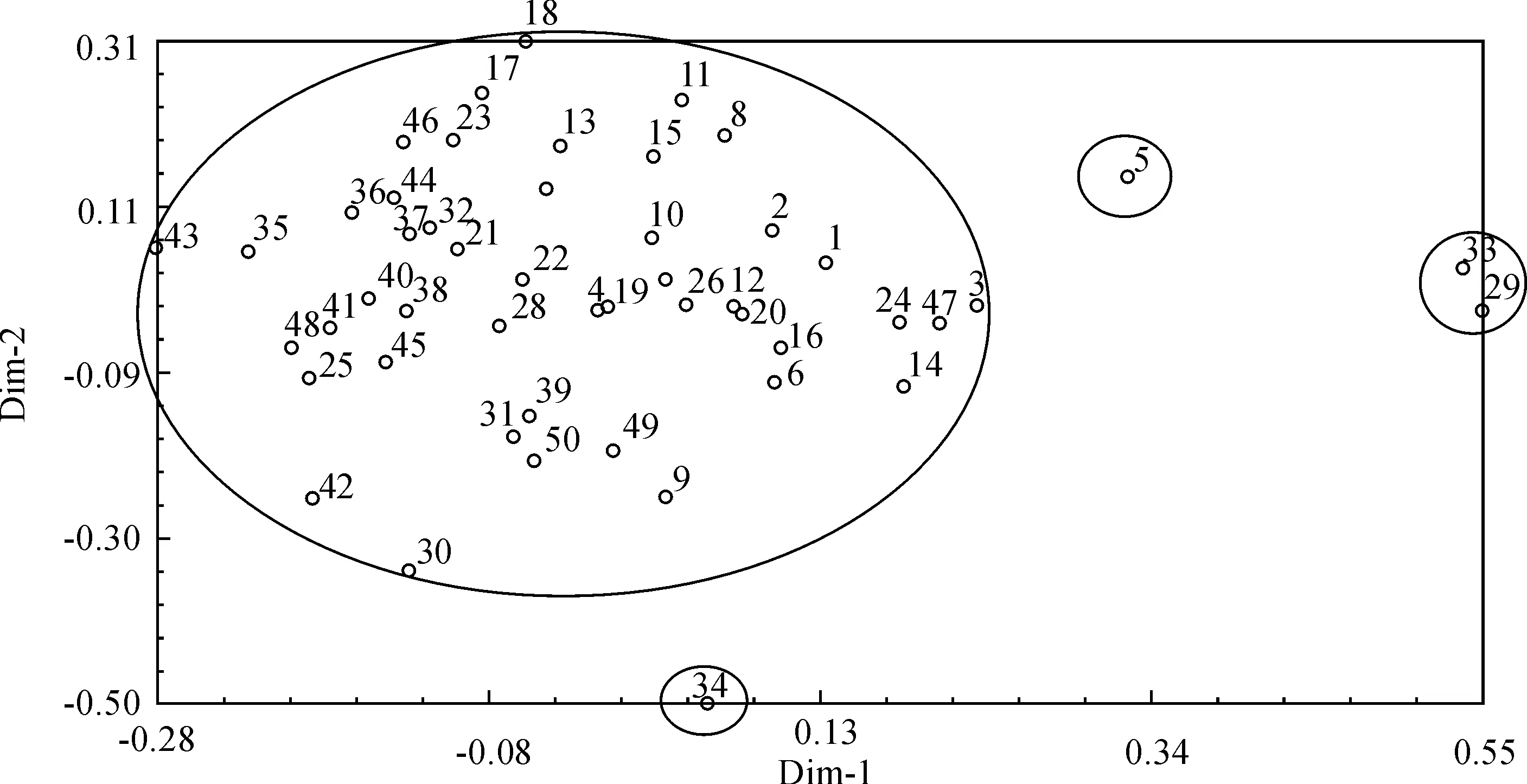
圖3 主成分散點圖Fig. 3 The principal component scatterplot
2.4基于SSR標記的主成分分析
對基于SSR標記的數據進行主成分分析,結果顯示:第一主成分的方差貢獻率為9.13%,第二主成分的方差貢獻率為7.42%,第三主成分的方差貢獻率為5.74%,累計方差貢獻率為22.84%。根據每份籽瓜種質的主成分之值,繪制第一、二主成分散點圖(圖3)。
從圖3可知,50份籽(西)瓜種質被分成4組,29(野籽瓜)和33(PI542120)單獨劃分出來分成一組,5(黑崩筋)獨自可分一組,表明這3份種質與其它份種質遺傳距離較遠。而其余份種質相對緊密的聚合在一起,表明它們之間的親緣關系非常近。雖然主成分分析和聚類分析對50份籽(西)瓜種質的分類結果基本一致,都能將野生西瓜種質、普通西瓜種質與籽瓜種質區分開來,但它們所反映的信息不同。聚類分析在揭示密切相關的個體間的關系時能夠提供更豐富的信息,而主成分分析偏重于在不同群體之間的聚類上提供更多的信息。
先對50份籽(西)瓜種質的聚類分析,其結果再用最小距離逐步抽樣法(LDSS)進行構建核心種質。共抽樣7次,每次抽樣構建籽瓜核心種質的遺傳多樣性如表3。由表3可以看出,隨著抽樣種質數目的減少,遺傳多樣性參數總體上變化較小;有效等位基因數目變化較小,且抽樣6的有效等位基因數目最高;Nei’s基因多樣性指數和Shannon’s信息指數均略有增加,而在抽樣6中達到最高值;多態性位點百分率呈現下降趨勢,在抽樣7下降較明顯。抽樣6所構建的種質庫的抽樣數是抽樣前的20%。
原始種質除去核心種質后保留下來的種質資源叫做保留種質[16]。從表3可看出核心種質保留了原種質20%的樣品,多態性位點數、等位基因數、有效等位基因數、Nei’s遺傳多樣性指數和Shannon信息指數的保留率分別為94.93%、97.47%、101.84%、108.88%和108.71%,可見核心種質能很好地代表原種質遺傳多樣性。綜合上述分析,取抽樣6為初級核心種質(圖4)。
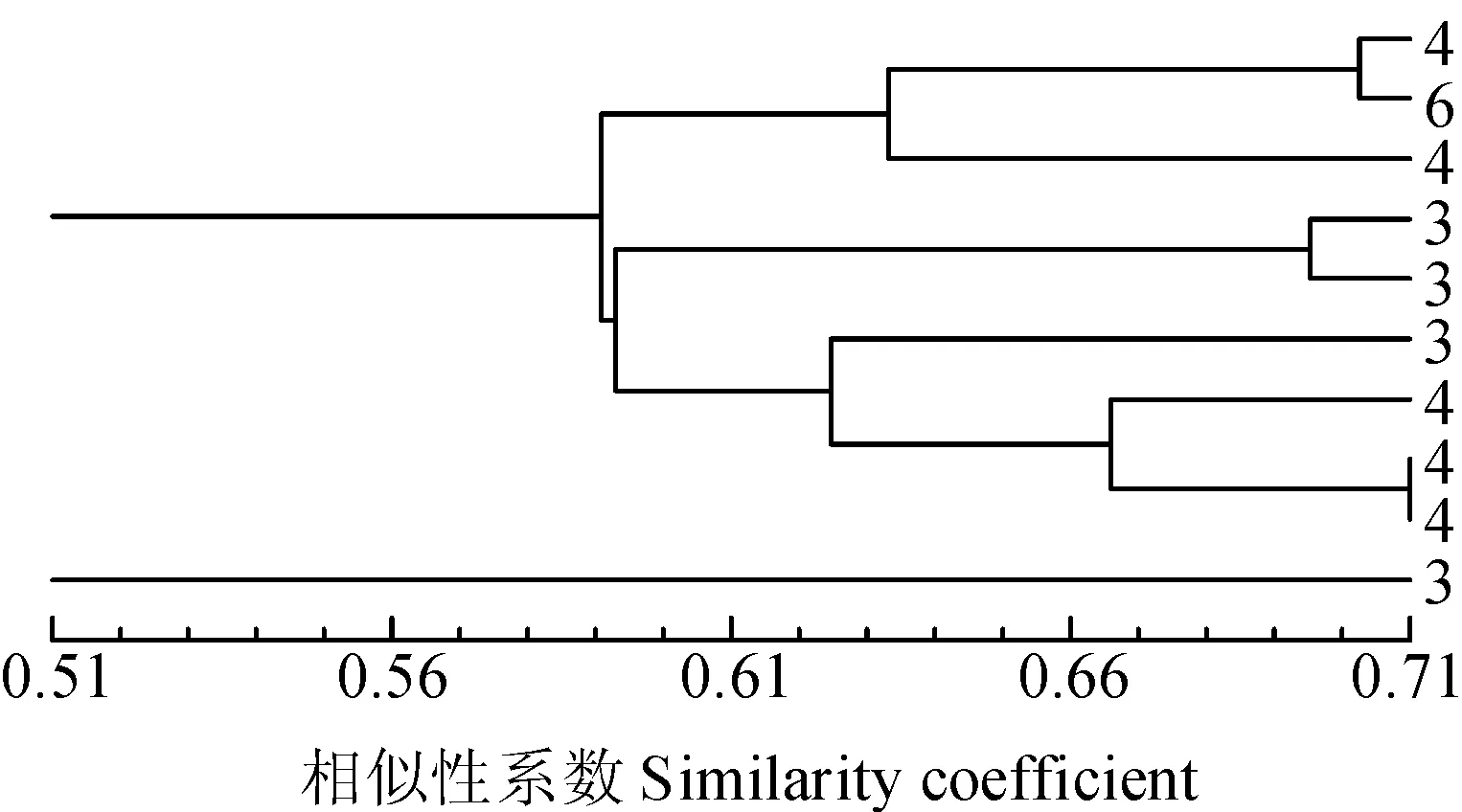
圖4 抽樣6構建的籽瓜核心種質庫聚類圖Fig. 4 Dendrogram of core collection of seed watermelon No.6 sampling
3討論
本研究SSR分子標記聚類結果顯示,篩選出的31對SSR引物,對50份來自個19省區種質資源PCR擴增出138條清晰的多態性條帶,多態性條帶比率高達83.33%,表明本研究收集到的籽瓜種質資源在分子水平上具有豐富的多態性。于海彬等[17]用篩選出的12條RAPD隨機引物在51份籽(西)瓜種質間共擴增出80條譜帶。其中74條為多態性條帶,多態性條帶的比率為92.50%,12條隨機引物的平均Shannon多樣性信息指數為0.7295;用不同分子標記方法對籽瓜種質研究結果證明了籽瓜DNA分子水平上的高度多態性和代表性。
本實驗聚類分析中,其遺傳相似系數介于0.57~0.91之間,除個別種質外,50個種質聚類結果與地區來源有較高的一致性,表明其親緣關系比較近,遺傳范圍狹窄。在相似系數為0.594時,將50份籽(西)瓜種質分為兩大類,2份野生種質廣東野生籽瓜(29)和美國野生籽瓜PI542120(33)單獨聚為一類,剩余48份種質聚為另一大類,說明這兩份野生種質的基因組和其所攜帶的遺傳信息與其它種質之間的差異較大,表明了野生型與栽培型籽瓜種質間親緣關系較遠,2份野生種質間遺傳關系較近,而栽培型的籽瓜間遺傳關系較近。這與趙虎基等前人研究結果相似[9,11,17]。
通過主成分分析和聚類分析也揭示出了地理上的來源對籽瓜種質資源親緣關系影響不大。例如,紅籽瓜(27)和大板2號瓜子(38)的遺傳相似系數為0.866,建陽月子籽瓜(32)和點心(83)(36)的遺傳相似系數為0.874。2種籽瓜所處地理位置和生態環境不同,卻在分子水平上聚為同一類,表明來自不同地區的種質資源之間在分子水平上親緣關系較近。另外,來自同一地區的種質親緣關系不一定近,例如來自甘肅省的8份種子類型為大板的籽瓜資源,其中大板紅籽瓜(放射網)(11)、大板紅籽瓜(綠網)(15)、甘肅大板1號(18)、大板瓜子(26)、大板2號瓜子(38)、靖遠大板1號(46)親緣關系比較近,而蘭州大板1號(39)、蘭州大板(47)與它們比較相對較遠。綜上所述,這可能是由于籽瓜在漫長的發展史中各地區相互引種交流,造成各地區籽瓜出現品種混雜、同名異物和同物異名等的現象。這種現象還需進一步的深入探討和研究。
核心種質構建是種質資源研究的熱點。形態標記作為研究核心種質的指標,有簡便和研究費用低等優點,但形態標記的數量少,易受環境條件的影響,對資源的鑒定和分類不夠精準,在反映品種間遺傳差異的問題上不夠真實[18];DNA分子標記是近年來發展起來的一種十分有效快速的手段,其中簡單重復序列(simple sequence repeat,SSR)標記技術具有共顯性、結果可靠、重復性好的特點[19],所以在對核心種質的評價上,利用SSR分子標記進行評價相比其它標記具有其獨特的優點。
李自超等[20]認為各物種適宜的核心種質規模不應簡單化而定,對應具體的物種,應按照該物種的遺傳多樣性來定。本實驗對50份籽(西)瓜種質資源進行最小距離逐步抽樣法構建核心種質,并對各抽樣進行遺傳多樣性分析,結果表明隨著抽取種質數目的減少,各種質庫遺傳多樣性參數變化較小,幾個參數出現了峰值變化,但多態性位點百分率呈現下降趨勢。綜合上述分析,確定20%的核心子集抽樣6為初級核心種質庫。抽樣6的Nei’s基因多樣性指數和Shannon’s信息指數分別為0.296 6和0.455 8,而且多態位點比率和等位基因數均達到抽樣前的94%以上,符合核心種質資源代表初始種質資源遺傳多樣性達到70%~80%的要求[21],表明抽樣比例為20%的抽樣6所構建的種質庫具有較高的代表性,更能代表原始群體的遺傳多樣性。種質資源合理的聚類分組、取樣方法、取樣比例是構建核心種質的關鍵之一,后期還需利用更多方法探討籽瓜種質的核心種質。
豐富的遺傳多樣性是物種具有更高的適應和存活能力的基礎,從而才能提高物種的進化、繁殖以及優化遺傳結構的能力[22]。所以,對現存籽瓜種質資源應該采取一些有效的保護措施。通過建立核心種質庫,收集、保存具有較高遺傳多樣性的種質資源,這些具有豐富的基因多樣性資源的地區是將來育種的優良種質庫的來源,在制定保護措施和對其利用時應多加注意。
參考文獻:
[1]柳唐鏡, 汪李平. 籽瓜(籽用西瓜)產業前景展望[J]. 北京農業, 2007, 11: 13-15.
LIU T J, WANG L P. Prospect of the industry of seed watermelon[J].BeijingAgriculture, 2007, 11: 13-15.
[2]FRANKEL O H. Genetic manipulation: impact on man and society[M]// ARBER W, II.I.MENSEE R, PEACOCK W J. Genetic Perspectives of Germplasm Onservation. London: Cambridge University Press, 1989: 161-170.
[3]FRANKEL O H.BROWN A H D. Crop genetic resources: conservation &. evolution[M]//HOLDEN J H W, WILLIAMSJ T,etal. Current Plant Genetic Resources Today-A Critical Appraisal. London: George Allen &. Urwin Ltd, 1984: 249-257.
[4]BROWN A H D. Core collections: a practical approach to genetic resources management[J].Genome, 1989, 31: 818-824 .
[5]溫景輝. 基于SSR分子標記的山葡萄種質遺傳多樣性研究與核心種質構建[D]. 吉林: 吉林農業大學, 2011.
[6]張維瑞, 袁王俊, 尚富德. 基于AFLP分子標記的桂花品種核心種質的構建[J]. 西北植物學報, 2012, 32(7): 1 349-1 354.
ZHANG W R, YUAN W J, SHANG F D. Construction of core collection of sweet osmanthus cultivars based on AFLP molecular markers[J].ActaBotanicaBoreali-OccidentaliaSinica, 2012, 32(7): 1 349-1 354.
[7]劉娟, 廖康, 趙世榮, 等. 利用ISSR分子標記構建新疆野杏核心種質資源[J]. 中國農業科學, 2015, 48(10), 2 017-2 028.
LIU J, LIAO K, ZHAO S R,etal. Using ISSR markers to construct Xinjiang wild apricot germplasm resources[J].ChineseAgriculturalScience, 2015, 48(10): 2 017-2 028.
[8]白成科, 俞君如, 于鳳, 等. 山茱英種質資源的ISSR遺傳多樣性分析與初級核心種質庫的構建[J]. 西北植物學報, 2009,29(12): 2 401-2 407.
BAI C K, YU J R, YU F,etal. Genetic diversity and construction of primary core germplasm inCornusofficinalisby ISSR marker[J].ActaBotanicaBoreali-OccidentaliaSinica, 2009, 29(12): 2 401-2 407.
[9]趙虎基,樂錦華,李紅霞,等. 籽用西瓜品種(系)間親緣關系的RAPD分析[J]. 果樹學報, 1999, 16(3): 235-238.
ZHAO H J, LE J H, LI H X,etal. Genetic relationships of seed watermelon varieties (lines) RAPD analysis[J].JournalofFruitScience, 1999, 16(3): 235-238.
[10]張建農. 籽用西瓜種質資源利用和耐貯性生理機理的研究[D]. 蘭州: 甘肅農業大學, 2005.
[11]柳唐鏡, 于海彬, 張棵, 等. 紅籽瓜種質資源親緣關系RAPD分析[J]. 中國農學通報, 2010, 26(22): 264-270.
LIU T J, YU H B, ZHANG K,etal. RAPD analysis of genetic relationship of Red Seed Watermelon germplasm resources[J].ChinaAgriculturalBulletin, 2010, 26(22): 264-270.
[12]錢韋, 葛頌, 洪德元. 采用RAPD和ISSR標記探討中國疣粒野生稻的遺傳多樣性[J]. 植物學報, 2000, 42(7): 741-750.
QIAN W, GE S, HONG D Y. Assessment of genetic variation ofOryzagrarzulatedetected by RAPDs and ISSRs[J].ActaBotanicaSinica, 2000, 42(7): 741-750.
[13]周鵬, 王萍, 石磊, 等. 籽用西瓜SSR體系的建立與優化[J]. 內蒙古農業大學學報, 2015, 29(12): 2 401-2 407.
ZHOU P, WANG P, SHI L,etal. Establishment and optimization of SSR system for seed used watermelon[J].JournalofInnerMongoliaAgriculturalUniversity, 2015, 29(12): 2 401-2 407.
[14]ROHI.F F J. NTSYSpc:Numerical taxonomy and multivariate analysis system, Version2.1[CP]. New York:Exeter Software, 2000.
[15]胡晉, 徐海明, 朱軍. 基因型值多次聚類法構建作物種質資源核心庫[J]. 生物數學學報, 2000, 15(1): 103-109.
HU J, XU H M, ZHU J. Constructing core collection of crop germplasm by multiple clusters based on geno typic values[J].JournalofBiomathematics, 2000, 15(1): 103-109.
[16]BROWN A H D. The core collection at the crossroad.//: Core Collection of Plant Genetic resources[PGR]. A Wiley-Sayce Publication, 1995, 3-19.
[17]于海彬. 籽用西瓜種子生長發育規律與種質資源遺傳多樣性研究[D]. 武漢: 華中農業大學, 2010.
[18]李慧峰, 盧森權, 李彥青, 等. 廣西甘薯核心種質構建初探[J]. 廣西農業科學, 2010, 41(7): 732-735.
LI H F, LU S Q, LI Y Q,etal. Preliminary study on constructing core collection of sweet potato germplasmin of Guangxi[J].GuangxiAgriculturulSciences, 2010, 41(7): 732-735.
[19]徐海明, 胡晉, 邱英雄. 利用分子標記和數量性狀基因型值構建作物核心種質庫的研究[J]. 生物數學學報,2005, 20(3): 351-355.
XU H M, H J, QIU Y X. Study on the construction of core collection of crops by using molecular markers and quantitative trait loci[J].JournalofBiomathematics, 2005, 20(3): 351-355.
[20]李自超, 張洪亮, 孫傳清, 等. 植物遺傳資源核心種質研究現狀與展望[J]. 中國農業大學學報, 1999, 4(5): 51-62.
LI Z C, ZHANG H L, SUN C Q,etal. Status and prospects of core collection in plant germplasm resource[J].JournalofChinaAgriculturalUniversity, 1999, 4(5): 51-62.
[21]GU X F, YANG A F, MENG H,etal. In vitro induction of tetraploid plants from diploidZizyphusjujubaMill, cv. Zhanhua[J].PlantCellReports, 2005, 24(11): 671-676.
[22]FRANKHAM R, BALLOU J D, BRISCOE D A. Introduction to Conversation Genetics[M]. Cambridge:Cambridge Univer City Press, 2002: 10-36.
(編輯:宋亞珍)
文章編號:1000-4025(2016)06-1125-10
doi:10.7606/j.issn.1000-4025.2016.06.1125
收稿日期:2016-03-16;修改稿收到日期:2016-05-09
基金項目:內蒙古自然科學基金(2016MS0356);內蒙古科技計劃(20090707,2010704,20110711,20120212);內蒙古高寒地區高產安全蔬菜生產的研究與創新(NDPYTD2013-3)
作者簡介:石磊(1989-),男,在讀碩士研究生,主要從事蔬菜種質資源與種質創新研究。E-mail:1010969973@qq.com *通信作者:王萍,副教授,碩士生導師,主要從事蔬菜種質資源與種質創新研究。E-mail:wangping@imau.edu.cn
中圖分類號:Q346+.5;Q789;S651
文獻標志碼:A
Genetic Diversity Analysis and Construction of Seed Watermelon Core Germplasm Resources by SSR
SHI Lei,WANG Ping*,YANG Jing,WANG Fengfeng,SUN Xiaohua
(College of Agronomy,Inner Mongolia Agricultural University,Key Laboratory of Wild Peculiar Vegetable Germplasm Resource and Enhancement,Hohhot 010019,China)
Abstract:The genetic diversity of 50 seed watermelon germplasm from different places were analyzed by SSR molecular marker and the primary core collection was constructed by Least Distance Step-wise Sampling(LDSS).The results showed that:(1) 31 pairs of primers which showed high polymorphism were selected from 106 SSR primers, showed 115 polymorphic bands in 138 bands owning 83.33% polymorphic loci, the average of Shannon information index(I), Nei’s genetic diversity(h),effective number of alleles(Ne) and number of alleles(Na) by POPGENE32 analysis was 0.419 3, 0.272 4, 1.458 0 and 1.981 4, respectively, which indicated high genetic diversity in 50 seed watermelon accessions. (2) The clustering result showed that genetic similarity coefficient ranged 0.57-0.91. Some germplasms distributed in different origins and far geographic distance showed high genetic similarity coefficient in 50 accessions. (3) The germplasm were sampled by the method of LDSS and ratio at 70%, 60%, 50%, 40%, 30%, 20% and 10%, and the genetic diversity parameters of each core subset was compared. The results showed that the change of genetic diversity parameters of each core subset was not clear with the samples reduced in six samplings. But the percentage of polymorphic loci, Ne, h and I of 10 primary accessions were obtained by sampling proportion 20%. It showed that the primary core collection from 20% sampling could well represent the genetic diversities of the whole collection.
Key words:seed watermelon; SSR molecular marker; germplasm resources; genetic diversity; core collection

