鈦膠RP-HPLC法同時測定5 種維生素
耿 瑛,李 榮*,姜子濤,張發博(天津商業大學生物技術與食品科學學院,天津市食品生物技術重點實驗室,天津 300134)
?
鈦膠RP-HPLC法同時測定5 種維生素
耿 瑛,李 榮*,姜子濤,張發博
(天津商業大學生物技術與食品科學學院,天津市食品生物技術重點實驗室,天津 300134)
采用鈦膠反相色譜柱,建立高效液相色譜法同時測定5 種維生素:煙酸、生物素、煙酰胺、葉酸和鈷胺素含量的檢測方法。研究5 種維生素的保留行為與磷酸緩沖鹽pH值、緩沖鹽類型及濃度、柱溫和流速的關系,得出了最優色譜條件:于波長210 nm處檢測生物素和鈷胺素,于波長270 nm處檢測煙酸、煙酰胺和葉酸,磷酸鹽pH 7.0,濃度5.0 mmol/L,柱溫50 ℃,流速0.8 mL/min。分析5 種維生素保留的熱力學參數焓、熵和吉布斯自由能。煙酸、生物素、煙酰胺、葉酸和鈷胺素標準曲線線性良好(R2>0.999 0);煙酸、生物素、煙酰胺、葉酸和鈷胺素的檢出限分別為6、10、20、22、8 ng/mL;5 種物質的相對標準偏差均低于1.36%;加標回收率范圍為92.30%~107.20%。方法的精密度和準確度均可滿足高效液相色譜法的測定要求。
鈦膠反相色譜柱;高效液相色譜法;維生素
隨著高效液相色譜在分析領域的應用越來越廣,色譜填料的發展也引起越來越多的關注。現在普遍使用的是硅膠色譜填料,但是它適用的pH值范圍窄(pH值通常為3~10),并存在對堿性化合物不可逆吸附的缺點。而能克服其弱點的鈦膠色譜填料,具有極其穩定的化學性質,在pH 1~14范圍都能夠穩定存在[1],對堿性化合物具有很好的分離效果[2],鈦膠基質可以與含有羥基、磷酸、羧酸等基團的化合物進行結合[3],且鈦膠色譜柱具有熱穩定性,升高溫度使色譜柱具有較低的柱壓,有利于分析物的分離分析,利用這一特性可測出分析物保留時的熱力學常數ΔH°、ΔS°和ΔG°。由于這些優于硅膠色譜柱的特點,近年來鈦膠作為色譜填料,吸引了眾多的國內外學者對其進行研究[4-8]。
Zhou Ting等[9]用鈦膠色譜柱分析了核苷酸以及它的中間體;Zhao Jing等[10]分析了大豆蛋白中的卵磷脂;Ozawa等[11]分析了嘌呤類化合物;?i?kovsky等[12]分析了昂丹司瓊及其相關的化合物;Liu Tenghao等[13]測定了飲料中的甜味劑;包榮等[14]分析了飲料中的咖啡因含量;杜麗霞等[15]分析了飲料中的檸檬黃含量;孫倩倩等[16]測定了飲料中的檸檬酸含量。這些研究表明,鈦膠是具有良好發展前景、性能優異的色譜填料。
維生素對于維護人體健康、預防及治療多種疾病都有著重要的作用,目前出現了越來越多補充維生素的食品及保健品,因此對于維生素含量的分析與測定具有重要意義。文獻中采用硅膠色譜柱測定維生素的方法,大多采用了離子對試劑:辛烷磺酸鈉[17]、庚烷磺酸鈉[18-19]、三氟乙酸[20-22]和醋酸銨[23]。離子對試劑和色譜柱固定相結合會產生不可逆吸附,進而影響固定相的活性位點,對色譜柱造成不可逆的傷害,縮短色譜柱的使用壽命。同時,由于VB12在維生素片中的含量少,文獻報道的方法對樣品中VB12含量的檢測低于檢出限[20],或將VB12單獨進行分析,不能與其他維生素同時分析[19],影響了分析效果。Tan等[24]采用鈦膠正相色譜柱分析了VB1,鈦膠反相色譜柱對其他維生素的分析鮮見報道。
實驗采用鈦膠反相色譜柱建立對5 種維生素分離分析新方法,結果表明此法對5 種維生素能較好地分離檢測,同時,鈦膠色譜柱有較高的靈敏度,能夠不用復雜的前處理過程,可直接檢測出樣品中的鈷胺素。
1 材料與方法
1.1 材料與試劑
2 種維生素片、4 種飲料樣品 市購;煙酸標準品(CAS:59-67-6;99.5%)、煙酰胺標準品(CAS:98-92-0;99.0%) 天津市光復精細化工研究所;生物素標準品(CAS:58-85-5;98.0%) 阿拉丁試劑(上海)有限公司;葉酸標準品(CAS:59-30-3;98.0%)、鈷胺素標準品(CAS:68-19-9;98.0%) 北京博奧拓達科技有限公司;甲醇、磷酸二氫鈉、磷酸氫二鈉(色譜級) 天津市科密歐化學試劑有限公司;Heal Force SMART-N純水機上海圣科儀器設備有限公司;0.45 μm濾膜 上海半島實業有限公司凈化器材廠。
1.2 儀器與設備
1100型高效液相色譜儀(可變波長檢測器)美國Agilent公司;FA1104N電子天平 上海精密科學儀器有限公司;Spectrometer Lambda 25 UV/VIS分光光度計美國Perkin-Elmer公司。
1.3 方法
1.3.1 溶液配制
1.3.1.1 標準溶液的配制
2.0 mg/mL煙酸、煙酰胺和鈷胺素:準確稱取20.0 mg標準品,用超純水溶解并定容至10 mL。2.0 mg/mL生物素和葉酸:準確稱取20.0 mg標準品,用0.1 mol/L NaOH溶液溶解并定容至10 mL。儲備液置于4 ℃冰箱儲存避光保存。標準混合溶液用儲備液按一定比例混合配制,用0.1 mol/L鹽酸調節pH值為7.0。
不同pH值和濃度的磷酸緩沖鹽溶液由50 mmol/L Na2HPO4和50 mmol/L NaH2PO4配制。
1.3.1.2 樣品處理
維生素片:取若干片維生素片,用研缽研細,準確稱取粉末0.200 0 g,用0.1 mol/L NaOH溶液溶解并定容到10 mL,超聲溶解20 min,3 000 r/min離心15 min,取上清液5 mL,用0.1 mol/L鹽酸調節pH值為7.0,定容到10 mL,過0.45 μm微孔濾膜后進樣分析。飲料:取5 mL飲料,超聲脫氣,過0.45 μm微孔濾膜后進樣分析。
1.3.2 色譜條件
Titania Sachtopore-RP色譜柱(250 mm×4.6 mm i.d.,5 μm,300 ?)。于波長210 nm處檢測生物素和鈷胺素,于波長270 nm處檢測煙酸、煙酰胺和葉酸。具體波長檢測為:0~3.15 min,270 nm;3.15~4.5 min,210 nm;4.5~10 min,270 nm;10~12 min,210 nm;12~20 min,270 nm。流動相流速0.8 mL/min。
流動相由水(溶液A)、甲醇(溶液B)和磷酸緩沖鹽(溶液C)組成,C在流動相中的比例始終保持為10%。流動相在0~2 min時,A為90%;2~12 min時,A 由90%降低到45%。以保留時間定性,峰面積定量。
1.3.3 標準曲線的繪制
配制一系列不同質量濃度的混合標準溶液,不同質量濃度的混合標準溶液分別取10 μL進樣。以質量濃度為橫坐標,峰面積為縱坐標繪制標準曲線,考察方法的線性范圍。
1.3.4 熱力學參數的測定
按照方法1.3.2節色譜條件,采用柱溫箱在5 個不同溫度條件下(30、40、50、60、70 ℃)對維生素進行分離。根據公式(1)van't Hoff方程[12,25],當lnk′和1/T呈線性關系時,由斜率和截距可以計算維生素保留時間的焓變(ΔH°)和熵變(ΔS°);不同溫度條件下的吉布斯自由能ΔG°由公式(2)計算:
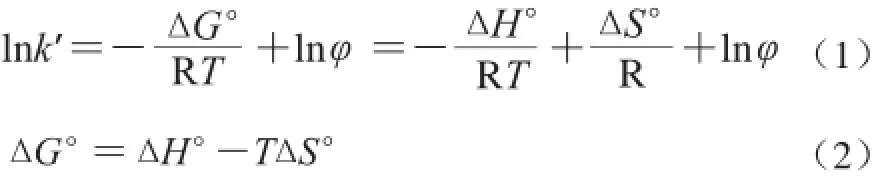
式(1)中:k′為容量因子;R為氣體常數;T為絕對溫度/K;φ為相比。
按公式(3)計算容量因子k′:

式中:t為分析物的保留時間/min;to為色譜柱的死時間/min;通過測定不同色譜柱作用的水的保留時間作為死時間。
按公式(4)計算相比φ:

式中:VS是色譜柱中固定相的體積/mL;Vo是色譜柱的死體積/mL。
按公式(5)、(6)計算VS、Vo:

式中:VCOL為色譜柱的幾何體積/mL;F為流動相的流速/(mL/min)。
2 結果與分析
2.1 檢測波長的選擇


圖1 5 種維生素在200 ~400 nm的紫外吸收光譜Fig.1 UV spectra of five vitamins within200-400 nm
用紫外分光光度計分別對5 種維生素標準溶液于波長200~400 nm處進行掃描,如圖1所示,根據吸收曲線選擇生物素和鈷胺素選擇于波長210 nm處進行檢測,煙酸、煙酰胺和葉酸于波長270 nm處進行檢測。
2.2 pH值及其緩沖鹽的選擇
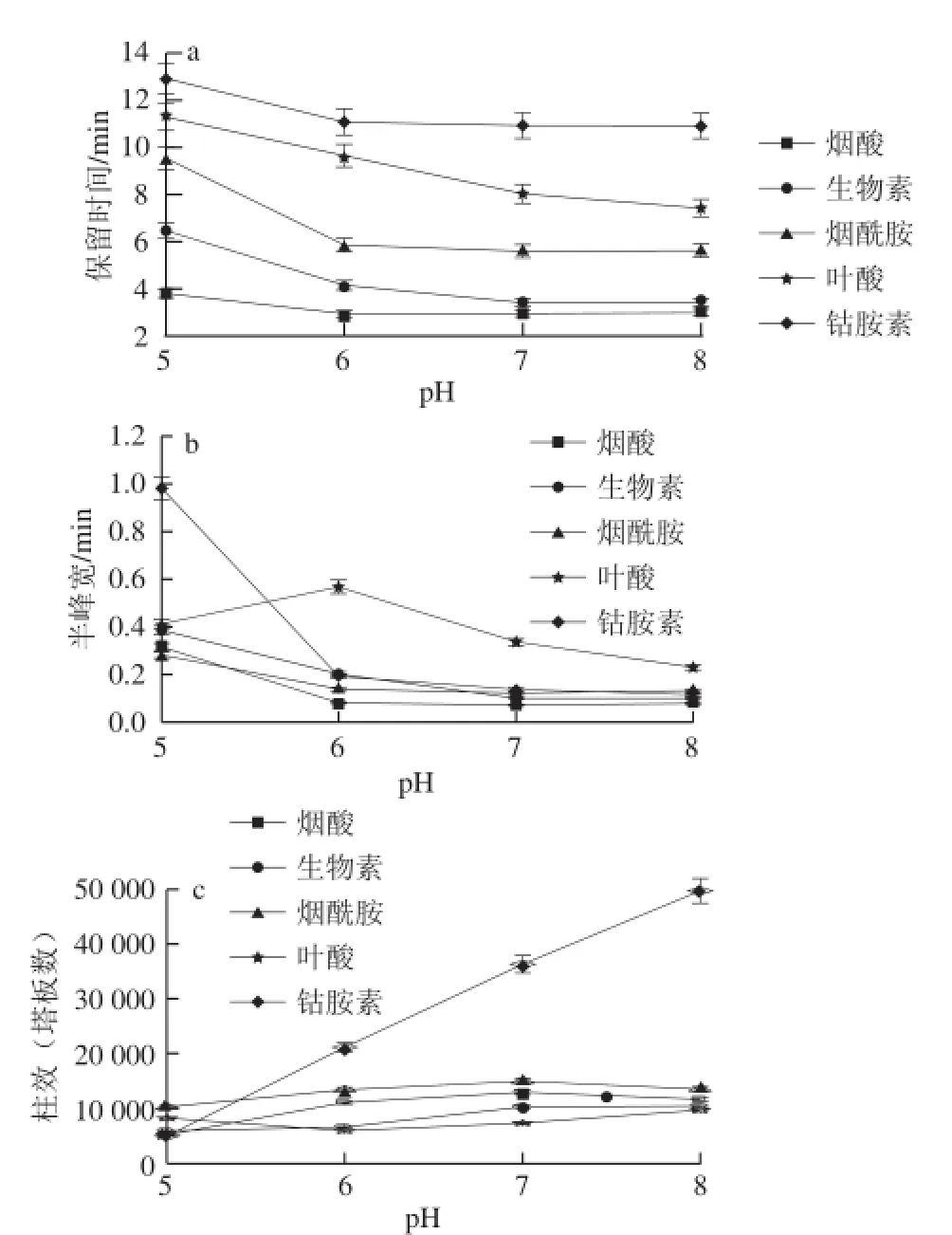
圖2 保留時間(a)、半峰寬(b)、柱效(c)與磷酸緩沖鹽pH值的關系Fig.2 Effects of phosphate buffer pH on retention time(a), peak width at half height(b)and the number of plates (c)
按照1.3.2節方法,在磷酸緩沖鹽濃度5.0 mmol/L、流速0.8 mL/min、柱溫25 ℃時,選擇磷酸緩沖鹽pH值范圍為5.0~8.0對5 種維生素進行分析,如圖2所示。
由圖2a可以看出,分析物在pH值為5.0時的保留時間都比較長,因為離子交換作用,PO43-離子與TiO2的表面結合,導致分析物的陽離子強的保留。當pH值大于5.0時,分析物分子脫質子化,離子交換作用減弱,因此,保留時間隨著pH值的增大而減小,與?i?kovsky等[12]分析的昂丹司瓊在鈦膠柱上的保留行為一致;隨著pH值增大,半峰寬呈現減小的趨勢,在pH值為7.0和8.0時最好(圖2b);理論塔板數呈現增加的趨勢,在pH值為7.0 和8.0時最好(圖2c);煙酰胺、葉酸和鈷胺素之間的分離效果很好,但是,在pH值為7.0時,生物素和煙酸的分離度為3.16,而pH值為8.0時,生物素和煙酸的分離度為2.74。綜合考慮,選擇pH值為7.0對5 種維生素進行分析。
2.3 磷酸緩沖鹽濃度的選擇
按照1.3.2節方法,在pH 7.0、流速0.8 mL/min、柱溫25 ℃時,分別選取流動相中磷酸緩沖鹽濃度為2.5、5.0、7.5 mmol/L和10.0 mmol/L進行分析,如圖3所示。

圖3 保留時間 ( a)、半峰寬 (b )、柱效 (c)與磷酸緩沖鹽濃度的關系Fig.3 Effect of phosphate buffer concentration on retention time (a),peak width at half height (b) and the number of plates (c)
由圖3a可以看出,隨著磷酸鹽濃度的增大,煙酸、生物素和煙酰胺的保留時間變化不大,而葉酸和鈷胺素的保留時間逐漸減小,因為磷酸根作為Lewis堿可以與鈦膠表面上的Lewis酸位點結合,這種競爭關系減弱了維生素在鈦膠上的保留;由圖3b、c可以看出,在2.5~7.5 mmol/L時,半峰寬呈減小趨勢,柱效呈增加趨勢,但當磷酸鹽增加到7.5 mmol/L,這種減小的趨勢會有所降低,當磷酸緩沖鹽濃度增加到10.0 mmol/L時,煙酸、生物素、煙酰胺的半峰寬會增加,煙酸、生物素、煙酰胺和鈷胺素的柱效降低。綜合考慮,選擇磷酸鹽濃度為5.0 mmol/L。
2.4 柱溫的影響
2.4.1 柱溫的選擇
按照1.3.2節方法,在pH 7.0、磷酸鹽濃度5.0 mmol/L、流速0.8 mL/min時,選擇柱溫30~70 ℃對5 種維生素進行分析,如圖4所示。

圖4 保留時間 (a)、半峰寬 (b )、柱效 (c)與柱溫的關系Fig.4 Effect of column temperature on retention time (a), peak width at half height (b) and the number of plates (c)
從圖4a可以看出,隨著色譜柱溫度的升高,維生素的保留時間減少,說明5 種維生素在鈦膠反相色譜柱上的保留過程是放熱的。隨著溫度的升高,保留時間會減小,煙酸和生物素保留時間減小非常少,煙酰胺和鈷胺素保留時間有所減少,葉酸保留時間明顯減少;由圖4b可以看出,生物素、煙酰胺和鈷胺素的半峰寬減小,煙酸的半峰寬變化很小,而葉酸的半峰寬在50 ℃時最小,超過50 ℃半峰寬很寬;同時,增加柱溫可以減小柱壓,峰形變好;但是當溫度超過50 ℃時,煙酸、煙酰胺和葉酸的柱效會降低(圖4c),同時,煙酸和生物素的分離效果會變差,綜合考慮,選擇柱溫為50 ℃。
2.4.2 熱力學研究
按照1.3.4節方法,在30~70 ℃對5 種維生素進行分析,如圖5,表1、2所示。
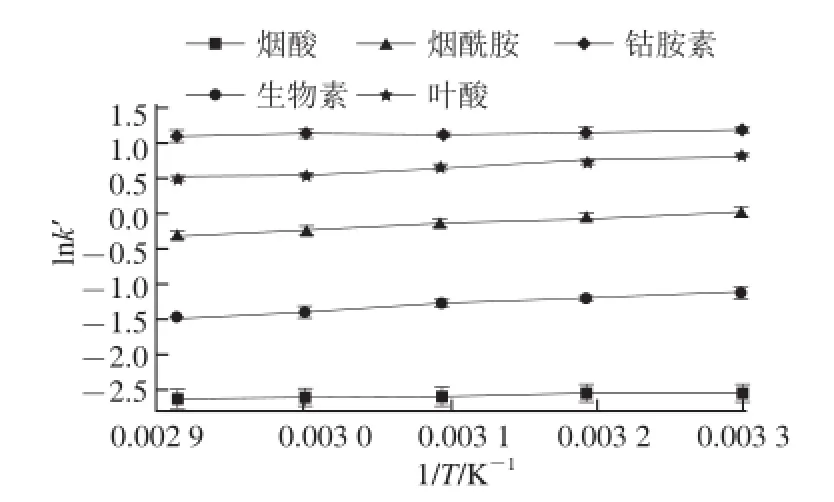
圖5 不同溫度條件下鈦膠色譜柱分離分析物的 v a n 't Ho f f曲線Fig.5 van't Hoff plots for five analytes on titania column at different temperatures
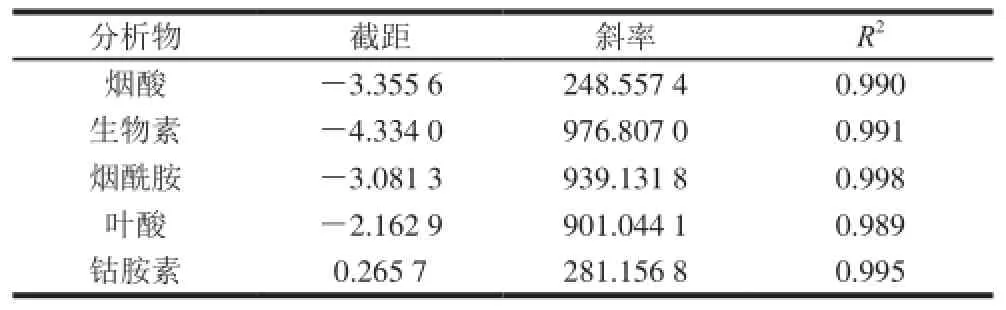
表1 分析 物的 回歸 參數Table 1 Regressi on parameters for theanalytes
由圖5和表1可以看出,鈦膠色譜柱在不同溫度時對5種維生素的分離呈現很好的線性,說明在30~70 ℃的溫度范圍內鈦膠柱對它們的分離機理是一致的。

表2 分析物在323.15K 的熵、焓和吉布斯自由能Table 2 St and ard enthalpy( ΔH °), entropy (Δ S°) and Gibbsfree en er gy (ΔG °) at3 23.15 K
由表2可以看出,鈦膠色譜柱對上述5 種維生素的分離是由不同的ΔH°和ΔS°決定的。煙酸、生物素和煙酰胺的ΔG°為正值,說明它們的保留行為是由ΔS°驅動的;葉酸和鈷胺素的ΔG°為負值,說明它們的保留行為是由ΔH°驅動的;ΔG°為負值表明分析物從流動相進入固定相是熱力學自發過程,ΔG°越小,表明分析物越容易從流動相轉移到固定相中,因而導致分析物在鈦膠固定相中的保留越強。葉酸和鈷胺素的ΔG°是負值,它們的保留也較強,可能是因為它們是具有疏水性苯環的大分子。煙酸、生物素、煙酰胺、葉酸和鈷胺素的ΔG°依次減小,這也從熱力學角度驗證了分析物的保留順序。
2.5 流速的選擇
按照1.3.2節方法,在pH 7.0、磷酸鹽濃度5.0 mmol/L、柱溫50 ℃時,選擇流速分別為0.6、0.8 mL/min和1.0 mL/min對5 種維生素進行分析,如圖6所示。

圖6 保留時間 (a)、半峰寬 (b )、柱效 (c)與流速的關系Fig.6 Effect of flow rates on retention time (a), peak width at half height (b) and the number of plates (c)
由圖6a、b可以看出,流速為0.6 mL/min時,5 種維生素的保留時間都長,半峰寬較寬;流速為1.0 mL/min時,雖然分析的時間縮短,半峰寬會減少,但是煙酸和煙酰胺的柱效降低(圖6c),同樣也會影響煙酸和生物素的分離效果。綜合考慮,選擇流速為0.8 mL/min。
綜合考慮以上因素,于波長210 nm處檢測生物素和鈷胺素,于波長270 nm處檢測煙酸、煙酰胺和葉酸,磷酸緩沖鹽pH 7.0,濃度5.0 mmol/L,柱溫50 ℃,流速0.8 mL/min對5 種維生素進行分析,如圖7所示。
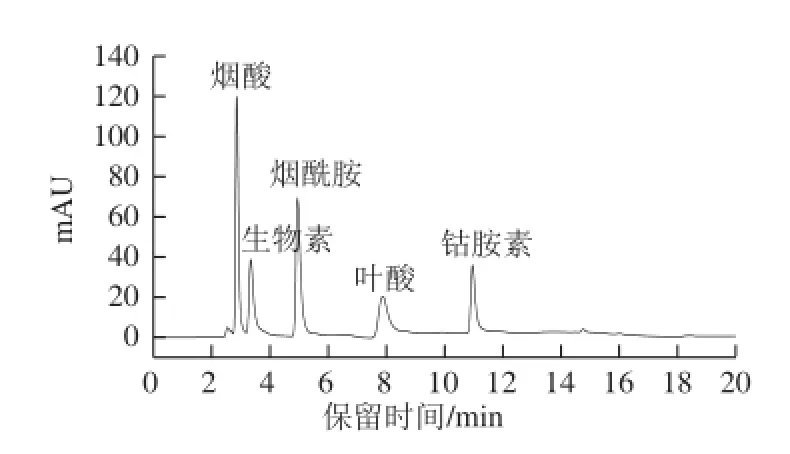
圖7 混合標準溶液的分離色譜圖Fig.7 Chromatogram of mixed vitamin standard solutions
2.6 方法驗證
按照方1.3.3節法,測定5 種維生素的線性范圍。結果顯示煙酸、生物素、煙酰胺、葉酸和鈷胺素的質量濃度分別在0.020~80.0、0.033~400.0、0.066~80.0、0.073~80.0 μg/mL和0.026~80.0 μg/mL范圍內時,標準曲線線性良好。分別對最小質量濃度的標準儲備液進行適當稀釋后測定,得到檢出限。對0.020 μg/mL的煙酸、0.033 μg/mL的生物素、0.066 μg/mL的煙酰胺、0.073 μg/mL的葉酸和0.026 μg/mL的鈷胺素重復測定8 次,得出方法的精密度,如表3所示。

表3 5 種維生素的線性回歸方程、相關系數、檢出限和精密 度(n=8)Table3 L in earregressi on equati on s,c orrelati on coefficients, LODs an d pr ec isi on (RS D) (n= 8)
2.7 樣品測定結果


圖8 樣品1~6的色譜圖Fig.8 Chromatograms of samples1-6
在最優色譜條件下,5 種維生素在維生素片和功能性飲料中測定結果如表4和圖8所示。每個樣品加入3 個不同質量濃度的標準混合溶液,測定加標回收率(n=3)。由表4可以看出,加標回收率范圍為92.30%~107.20%。由圖8可知,在本實驗提出的色譜條件下,同時實現對5 種維生素的色譜分離是切實可行的。
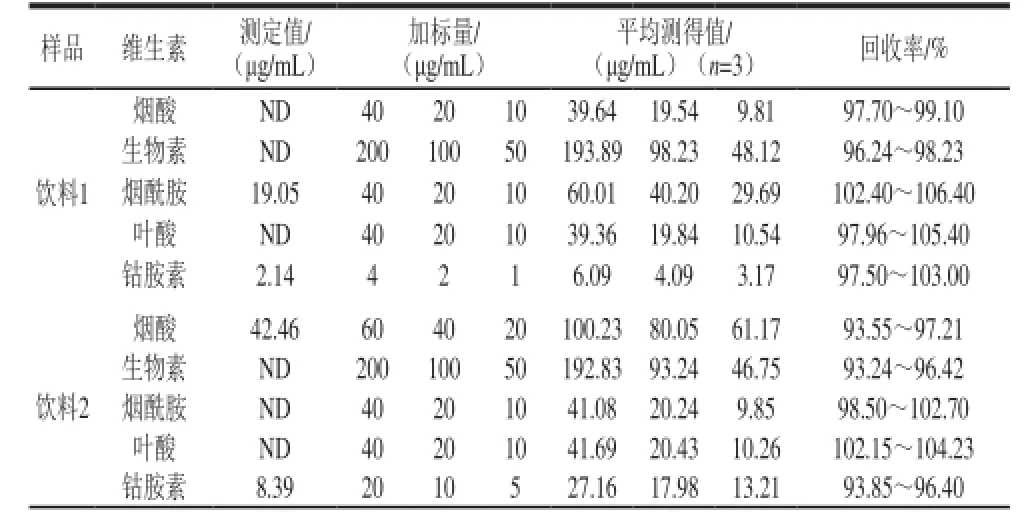
表4 樣品測定結果和加標回收率Table 4 Vitam in c on tents of realsamples and s piked recoveries

續表4
3 結 論
實驗建立了同時分離分析5 種維生素的方法,研究5 種維生素的保留行為與磷酸緩沖鹽pH值、緩沖鹽濃度、柱溫和流速的關系,得出了最優色譜條件:檢測波長210 nm和270 nm,磷酸鹽pH值7.0,濃度5.0 mmol/L,柱溫50 ℃,流速0.8 mL/min,同時由柱溫計算出維生素從流動相轉移到固定相的ΔH°、ΔS°和ΔG°,這從熱力學角度驗證了分析物的保留順序。5 種維生素的標準曲線線性良好(R2>0.999 0),煙酸、生物素、煙酰胺、葉酸和鈷胺素的檢出限分別為6、10、20、22、8 ng/mL,5 種物質的相對標準偏差都低于1.36%,加標回收率范圍在92.30%~107.20%之間。同時,本法樣品前處理過程簡單,操作方便,結果準確可靠。
[1] KAWAHARA M, NAKMURA H, NAKAJIMA T, et al.Preparation and evaluation of octadecyl titania as column-packing material for high-performance liquid chromatography[J].Microchemical Journal,1994, 49(2/3): 362-367.DOI:10.1006/mchj.1994.1047.
[2] KURGANOV A, TRUDINGER U, ISAEVA T, et al.Native and modified alumina, titania and zirconia in normal and reversed-phase high-performance liquid chromatography[J].Chromatographia, 1996,42(3/4): 217-222.DOI:10.1007/BF02269656.
[3] TAN J, LI R, JIANG Z T.Determination of melamine in liquid milk and milk powder by titania-based ligand-exchange hydrophilic interaction liquid chromatography[J].Food Analytical Methods, 2012,5: 1062-1069.DOI:10.1007/s12161-011-9350-x.
[4] TANI K, SUZUKI Y.Influence of titania matrix on retention behaviour in reversed-phase liquid chromatography[J].Journal of Chromatography A, 1996, 722(1/2): 129-134.DOI:10.1016/0021-9673(95)00456-4.
[5] ELLWANGER A, MATYSKA M T, ALBERT K, et al.Comparison of octadecyl bonded titania phases[J].Chromatographia, 1999, 49(7/8): 424-430.DOI:10.1007/BF02467618.
[6] PESEK J J, MATYSKA MT, RAMAKRISHNAN J.Synthesis and characterization of titania based stationary phases using the silanization/hydrosilation method[J].Chromatographia, 1997,44(9/10): 538-55.DOI:10.1007/BF02466748.
[7] MIR L, AMLOUKA A, ELALOUI E, et al.Preparation and optical characterization of transparent, microporous TiO2xerogel monoliths[J].Materials Science and Engineering B, 2008, 146(1/2/3): 69-73.DOI:10.1016/j.mseb.2007.07.055.
[8] WEI J, JIANG Z T, LI R, et al.Preparation of titania monolith column and application in determination of benzoic acid by HILIC[J].Chromatographia, 2012, 75(11/12): 563-569.DOI:10.1007/s10337-012-2230-8.
[9] ZHOU T, LUCY C A.Hydrophilic interaction chromatography of nucleotides and their pathway intermediates on titania[J].Journal of Chromatography A, 2008, 1187: 87-93.DOI:10.1016/ j.chroma.2008.02.027.
[10] ZHAO J, JIANG Z T, LU G R, et al.Determination of phosphatidylcholine in soybean lecithin samples by high performance liquid chromatography on titania[J].Analytical Methods, 2010, 2(11): 1779-1783.DOI:10.1039/C0AY00419G.
[11] OZAWA M, TANI K, TACHIBANA M, et al.Retention behavior of purine-like compounds on titania and the effect of organic modifiers content in the mobile phase[J].Chromatographia, 2010, 72(3/4): 313-316.DOI:10.1365/s10337-010-1658-y.
[12] ?I?KOVSKYY V, KUCERA R, KLIME? J, et al.Titania-based stationary phase in separation of ondansetron and its related compounds[J].Journal of Chromatography A, 2008, 1189: 83-91.DOI:10.1016/j.chroma.2007.12.017.
[13] LIU T H, JIANG Z T, LI R, et al.Simultaneous determination of cyclamate, acesulfame, and aspartame in beverages by titania-based RP-HPLC[J].Food Analytical Methods, 2014, 7(7): 1400-1406.DOI:10.1007/s12161-013-9762-x.
[14] 包榮, 李榮, 姜子濤.鈦膠反相高效液相色譜法測定飲料中的咖啡因[J].中國食品添加劑, 2012(5): 214-218.DOI:10.3969/ j.issn.1006-2513.2011.05.035.
[15] 杜麗霞, 姜子濤, 李榮.鈦膠反相高效液相色譜法測定飲料中的檸檬黃[J].食品研究與開發, 2013, 34(5): 69-73.DOI:10.3969/ j.issn.1005-6521.2013.05.019.
[16] 孫倩倩, 姜子濤, 李榮, 等.鈦膠反相高效液相色譜法測定飲料中的檸檬酸[J].中國釀造, 2012, 31(7): 151-155.DOI:10.3969/ j.issn.0254-5071.2012.07.042.
[17] ZAFRA-GóMEZ A, GARBALLO A, MORALES J A, et al.Simultaneous determination of eight water-soluble vitamins in supplemented foods by liquid chromatography[J].Journal of Agricultural and Food Chemistry, 2006, 54(13): 4531-4536.DOI:10.1021/jf060346e.
[18] RUDENKO A O, KARTSOVA L A.Determination of water-soluble vitamin B and vitamin C in combined feed, premixes, and biologically active supplements by reversed-phase HPLC[J].Journal of Analytical Chemistry, 2010, 65(1): 71-76.DOI:10.1134/S1061934810010132.
[19] RADA A, JASMINA B, OLIVERA C, et al.RP-HPLC determination of vitamins B1, B3, B6, folic acid and B12in multivitamin tablets[J].Journal of the Serbian Chemical Society, 2005, 70(10): 1229-1235.DOI:10.2298/JSC0510229A.
[20] HEUDI O, KILINC T, FONTANNAZ P.Separation of water-soluble vitamins by reversed-phase high performance liquid chromatography with ultra-violet detection: application to polyvitaminated premixes[J].Journal of Chromatography A, 2005, 1070(1/2): 49-56.DOI:10.1016/ j.chroma.2005.02.033.
[21] CIULU M, SOLINAS S, FLORIS I, et al.RP-HPLC determination of water-soluble vitamins in honey[J].Talanta, 2011, 83(3): 924-929.DOI:10.1016/j.talanta.2010.10.059.
[22] KLEJDUS B, PETRLOVá J, POTE?IL D, et al.Simultaneous determination of water- and fat-soluble vitamins in pharmaceutical preparations by high-performance liquid chromatography coupled with diode array detection[J].Analytica Chimica Acta, 2004, 520(1/2): 57-67.DOI:10.1016/j.aca.2004.02.027.
[23] MORENO P, SALVADó V.Determination of eight water- and fatsoluble vitamins in multi-vitamin pharmaceutical formulations by highperformance liquid chromatography[J].Journal of Chromatography A,2000, 870: 207-215.DOI:10.1016/S0021-9673(99)01021-3.
[24] TAN J, LI R, JIANG Z T.Determination of thiamine (vitamin B1)in pharmaceutical tablets and human urine by titania-based ligandexchange hydrophilic interaction chromatography[J].Analytical Methods, 2011, 3(7): 1568-1573.DOI:10.1039/C1AY05156C.
[25] KARATAPANIS A E, FIAMEGOS Y C, STALIKAS C D.Study of the behavior of water-soluble vitamins in HILIC on a diol column[J].Chromatographia, 2010, 71(9/10): 751-759.DOI:10.1365/s10337-010-1564-3.
Simultaneous Determination of Five Vitamins by Titania-Based RP-HPLC
GENG Ying, LI Rong*, JIANG Zitao, ZHANG Fabo
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science,Tianjin University of Commerce, Tianjin 300134, China)
A new method for simultaneous separation and determination of five vitamins including nicotinic acid (vitamin PP), biotin (VB7), nicotinamide (vitamin PP), folic acid (VB9), and cyanocobalamin (VB12) using high performance liquid chromatography (HPLC) on a titania-based column has been developed.The influence of buffer pH, buffer type, buffer concentration, column temperature and flow rate on separation efficiency was investigated.The optimized chromatographic conditions were obtained as follows: 5.0 mmol/L phosphate solution at pH 7.0 as buffer solution, column temperature of 50 ℃, and a flow rate of 0.8 mL/min.Biotin and cyanocobalamin were detected at 210 nm and three other vitamins at 270 nm.The thermodynamic parameters enthalpy, entropy and Gibbs free energy were calculated for the retention of the analytes.The proposed method presented good linearity (R2> 0.999 0) for the five vitamins.The limits of detection (LODs)for nicotinic acid, biotin, nicotinamide, folic acid and cyanocobalamin were 6, 10, 20, 22, and 8 ng/mL, respectively.The precisions (RSDs) for the five vitamins were less than 1.36%.The recoveries of spiked samples were between 92.30% and 107.20%.The precision and accuracy of this method can meet the requirements of HPLC analysis.
titania-based reverse phase; high performance liquid chromatography (HPLC); vitamins
10.7506/spkx1002-6630-201614020
TS218
A
1002-6630(2016)14-0116-07
耿瑛, 李榮, 姜子濤, 等.鈦膠RP-HPLC法同時測定5 種維生素[J].食品科學, 2016, 37(14): 116-122.DOI:10.7506/ spkx1002-6630-201614020. http://www.spkx.net.cn
GENG Ying, LI Rong, JIANG Zitao, et al.Simultaneous determination of five vitamins by titania-based RP-HPLC[J].Food Science,2016, 37(14): 116-122.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201614020. http://www.spkx.net.cn
2015-12-02
天津市自然科學基金項目(13JCYBJC18700;12JCZDJC34100)
耿瑛(1992—),女,碩士研究生,研究方向為食品質量與安全。E-mail:gengying92@126.com
*通信作者:李榮(1962—),女,教授,學士,研究方向為食品分析。E-mail:lirong@tjcu.edu.cn

