分泌表達(dá)蘋果酸乳酸酶的大腸桿菌系統(tǒng)的構(gòu)建
王寧寧,劉 瑞,陳福生,張秀艷*
(1.華中農(nóng)業(yè)大學(xué) 食品科技學(xué)院,湖北 武漢 430070;2.華中農(nóng)業(yè)大學(xué) 環(huán)境食品學(xué)教育部重點(diǎn)實(shí)驗(yàn)室,湖北 武漢430070)
分泌表達(dá)蘋果酸乳酸酶的大腸桿菌系統(tǒng)的構(gòu)建
王寧寧1,2,劉瑞1,2,陳福生1,2,張秀艷1,2*
(1.華中農(nóng)業(yè)大學(xué) 食品科技學(xué)院,湖北 武漢 430070;2.華中農(nóng)業(yè)大學(xué) 環(huán)境食品學(xué)教育部重點(diǎn)實(shí)驗(yàn)室,湖北 武漢430070)
蘋果酸乳酸酶(簡稱蘋乳酶)是果酒生產(chǎn)過程中蘋果酸乳酸發(fā)酵(簡稱蘋乳發(fā)酵)的關(guān)鍵酶。為了構(gòu)建分泌表達(dá)蘋乳酶的大腸桿菌表達(dá)系統(tǒng),作者通過融合PCR將信號肽基因(487 bp)和蘋乳酶基因 (1 623 bp)的編碼序列連接在一起,將融合片段 (2110 bp)克隆到表達(dá)質(zhì)粒pET28a(+)上并轉(zhuǎn)化大腸桿菌,得到陽性克隆子。IPTG誘導(dǎo)陽性克隆子后可得到相對分子質(zhì)量約為60 000左右的蛋白質(zhì),利用HPLC可在其發(fā)酵上清液中檢測到240.7 mg/L的L-乳酸。這說明成功構(gòu)建了分泌表達(dá)蘋乳酶的大腸桿菌系統(tǒng),該菌株的獲得將為蘋乳酶的研究和應(yīng)用提供了技術(shù)平臺。
蘋果酸乳酸酶;蘋乳發(fā)酵;分泌表達(dá)系統(tǒng)
蘋果酸-乳酸發(fā)酵(簡稱蘋乳發(fā)酵)是果酒生產(chǎn)過程中非常重要的發(fā)酵過程,它是在乳酸菌的作用下將酸澀的L-蘋果酸轉(zhuǎn)化成口感柔和的L-乳酸,并產(chǎn)生CO2[1],從而得到預(yù)期的酸度,除此之外還具有增加微生物學(xué)穩(wěn)定性、降低生澀味、增加香氣、使果酒的口感柔和等作用[2]。在蘋乳發(fā)酵過程中,由于果酒的低pH值,高SO2濃度,高酒精度等的影響而造成蘋乳發(fā)酵遲緩,導(dǎo)致生物胺或氨基甲酸乙酯的前體物質(zhì)等不良代謝產(chǎn)物,甚至導(dǎo)致蘋乳發(fā)酵終止不徹底而引發(fā)生物危害[3-4]。
針對這一問題,國內(nèi)外學(xué)者開展了系列研究,如向發(fā)酵液中加入蘋果酸乳酸酶(MLE)[5],或通過細(xì)胞融合構(gòu)建降酸釀酒酵母[6-8],或利用基因工程方法構(gòu)建降酸釀酒酵母等[9]。但對蘋果酸的轉(zhuǎn)化率都不高,這可能是因?yàn)镸LE不能很好地適應(yīng)果酒的環(huán)境。
因此,作者在擴(kuò)增MLE編碼序列的基礎(chǔ)上,構(gòu)建分泌型表達(dá)MLE的大腸桿菌表達(dá)系統(tǒng),為后續(xù)MLE的酶學(xué)性質(zhì)研究和酶學(xué)性質(zhì)改造奠定了基礎(chǔ)。
1材料與方法
1.1材料
1.1.1菌株和質(zhì)粒E.coli DH5α,E.coli BL21 (DE3),酒類酒球菌(Oenococcus oeni):作者所在實(shí)驗(yàn)室保存;枯草芽孢桿菌(Bacillus subtilis 168):農(nóng)科院惠贈;pET28a(+):作者所在實(shí)驗(yàn)室保存。
1.1.3培養(yǎng)基E.coli DH5α,E.coli BL21(DE3)和枯草芽孢桿菌的保存和培養(yǎng)用LB培養(yǎng)基;酒類酒球菌用ATB培養(yǎng)基;大腸桿菌陽性轉(zhuǎn)化子用LB培養(yǎng)基或含1%L-蘋果酸的M9培養(yǎng)基培養(yǎng)。
1.2方法
1.2.1酒類酒球菌基因組DNA的提取,大腸桿菌質(zhì)粒DNA的提取參照文獻(xiàn)[10]。
1.2.2PCR反應(yīng)條件
1)蘋乳酶基因的PCR擴(kuò)增:根據(jù)已報(bào)道的酒類酒球菌中蘋乳酶基因序列設(shè)計(jì)引物,引入EcoR I和Xho I酶切位點(diǎn),上游引物 F(mle):5'-CGGAATTCATGACAGATCCAGTAAGT-3',下游引物R(mle):5'-TCGCTCGAGTTAGTATTTCGG CT CCCAC-3'。PCR反應(yīng)程序:94℃預(yù)變性4 min,94 ℃30 s,58℃1.5 min,35個循環(huán)(兩步PCR反應(yīng));
2)信號肽基因的PCR擴(kuò)增:根據(jù)NCBI發(fā)布的Bacillus subtilis 168菌株β-葡聚糖酶基因序列設(shè)計(jì)引物,引入NcolⅠ酶切位點(diǎn)和與蘋乳酶基因反向互補(bǔ)的堿基,上游引物F(sig):5'-CATGCCATGGAA ACCTACATTGAGCGGGGAG-3',下游引物R(sig):5'-TACTTACTGGATCTGTCATTTGAGCTGAGGCAG TAGCAGTG-3'。PCR反應(yīng)程序:94℃預(yù)變性5 min、94℃30 s、55℃30 s、72℃40 s,30個循環(huán),72℃延伸10 min;
3)信號肽基因和蘋乳酶基因的融合PCR:重新設(shè)計(jì)蘋乳酶基因的上游引物F(mle2):5'-ATGACAGATCCAGTAAGT-3',下游引物仍為R(mle):5'-TCGCTCGAGTTAGTATTTCGGCTCCCAC-3',5'端帶有EcoR I酶切位點(diǎn)CTCGAG和保護(hù)堿基TCG。融合PCR體系中信號肽基因和蘋乳酶 (摩爾比)以1∶1加入25 μL反應(yīng)體系中,反應(yīng)體系其它成分組成同前。融合PCR反應(yīng)程序:94℃預(yù)變性5 min,94℃30 s,58℃5 min,72℃ 2 min 30 s,15個循環(huán),72℃延伸10 min。
1.2.3DNA的酶切、連接和測序酶切和連接按照產(chǎn)品說明書進(jìn)行,測序工作由南京金斯瑞公司完成。
《詩·小雅·常棣》:“死喪之威,兄弟孔懷。”《箋》:“死喪可畏怖之事,維兄弟之親甚相思念。”本為極其思念之意,后以孔懷指兄弟。《三國志·魏·管輅傳》“明年二月卒,年四十八”《注》引管輅弟辰作《輅別傳敘》:“辰不以闇淺,得因孔懷之親,數(shù)與輅有所諮論。”北齊顏之推《顏氏家訓(xùn)·文章》:“陸機(jī)《與長沙顧母書》,述從祖弟士璜死,乃言‘痛心拔腦,有如孔懷’。心既痛矣,即為甚思,何故言有如也?觀其此意,當(dāng)謂親兄弟為孔懷。 ”〔2〕8
1.2.4大腸桿菌的轉(zhuǎn)化和質(zhì)粒提取參照文獻(xiàn)[10]進(jìn)行。
1.2.5大腸桿菌陽性轉(zhuǎn)化子的誘導(dǎo)表達(dá)將活化好的陽性轉(zhuǎn)化子以體積分?jǐn)?shù)1%接種于5 mL LB液體培養(yǎng)基中(含50 mg/L卡那霉素),37℃、200 r/min下培養(yǎng) 2~3 h(OD600 nm=0.6~0.9),加入終濃度為0.8 mmol/L的IPTG誘導(dǎo)4 h。取1 mL培養(yǎng)液,12 000 r/min離心15 min后去上清液;加50 μL 1×SDS上樣緩沖液到沉淀中,沸水浴10 min,離心后的上清液可用于SDS-PAGE檢測。
1.2.6陽性轉(zhuǎn)化子產(chǎn)L-乳酸能力的分析陽性轉(zhuǎn)化子經(jīng)IPTG誘導(dǎo)后,在培養(yǎng)上清中加入終濃度為1 mmol/L NAD,0.5 mmol/L Mn2+,37℃反應(yīng) 1 h,取100 μL反應(yīng)液進(jìn)行HPLC分析。高效液相檢測條件:固定相為C18-EP柱;流動相為 20 mmol/L KH2PO4(pH 2.5);流速為0.8 mL/min;檢測波長為210 nm。為了測試酶法分析乳酸方法在檢測發(fā)酵液中蘋乳酶活性的可行性,我們同時用乳酸檢測試劑盒檢測了反應(yīng)液中乳酸的含量,檢測方法參見Labarre等(1996)的方法。
2結(jié)果與分析
2.1分泌型表達(dá)MLE的大腸桿菌表達(dá)系統(tǒng)構(gòu)建
通過融合PCR將蘋乳酶基因編碼序列 (1 623 bp)和信號肽序列(487 bp)連接,得到大小為2 110 bp的片段,見圖1。用EcoR I和Ncol I限制酶切合片段和載體pET28a(+),通過T4連接酶將酶切片段連接以構(gòu)建重組載體pET28a(+)-mle,具體過程見圖2。將重組載體轉(zhuǎn)入大腸桿菌感受態(tài)細(xì)胞,并涂在含50 mg/L的卡那霉素的LB平板上,篩選陽性轉(zhuǎn)化子。
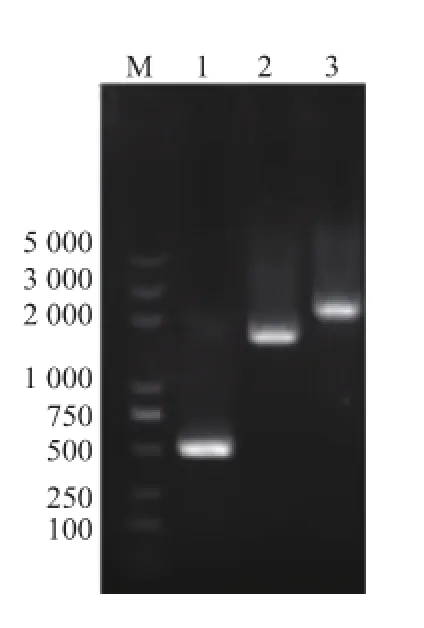
圖1 信號肽和mle編碼序列及其融合片段Fig.1 Signal peptide and mle encoding sequence and the fused fragment
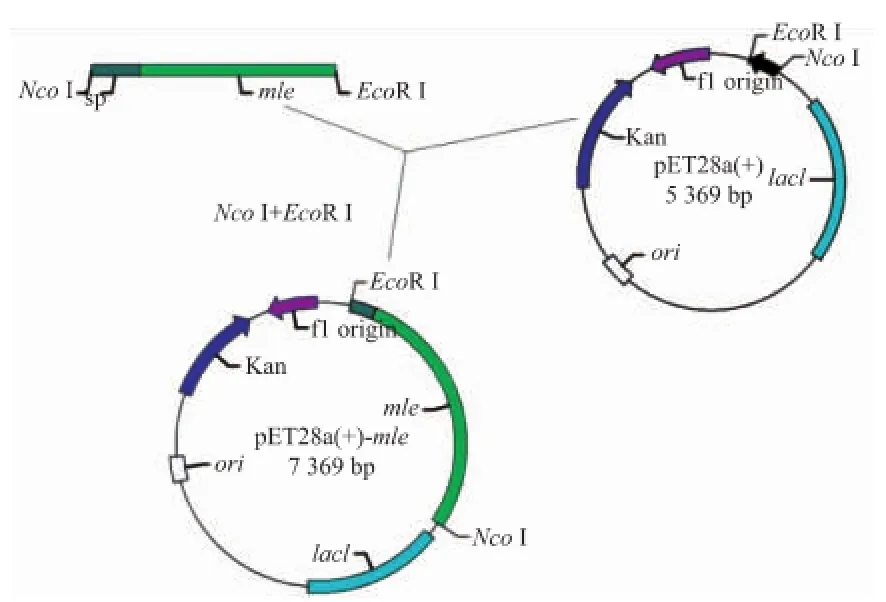
圖2 重組質(zhì)粒pET28a(+)-mle構(gòu)建流程圖Fig.2 Flowchart for pET28a(+)-mle construction
2.2陽性轉(zhuǎn)化子的PCR和雙酶切驗(yàn)證
對篩選到的陽性轉(zhuǎn)化子進(jìn)行PCR和雙酶切驗(yàn)證,以含有pET28a(+)的菌株作為對照菌株。以F (sig)和R(mle)為引物對轉(zhuǎn)化子進(jìn)行PCR驗(yàn)證。結(jié)果顯示,在含有重組載體菌株中擴(kuò)增出大小為2 110 bp的片段,而對照菌株則未擴(kuò)增出片段,見圖3。用EcoR I和Ncol I限制酶對重組載體進(jìn)行雙酶切驗(yàn)證,結(jié)果顯示:重組載體經(jīng)雙酶切后得到了大小為5 400 bp和2 110 bp的片段,而未經(jīng)切割的載體仍為7 369 bp,表明已經(jīng)得到了含有重組載體pET28a(+)-mle的陽性克隆子。

圖3 重組質(zhì)粒pET28a(+)-mle的PCR和雙酶切驗(yàn)證Fig.3 Verification of recombinant pET28a(+)-mle by PCR and enzyme digestion
2.3含重組載體pET28a(+)-mle的大腸桿菌的誘導(dǎo)表達(dá)
按照方法1.2.5對陽性克隆子進(jìn)行誘導(dǎo)表達(dá),并進(jìn)行SDS-PAGE。以含有pET28a(+)的菌株作為對照。結(jié)果見圖4。可以看出,含有pET28a(+)-mle 的E.coli BL21在經(jīng)過IPTG誘導(dǎo)后得到相對分子質(zhì)量大小約為60 000蛋白質(zhì),與預(yù)期大小相符合;而在未經(jīng)誘導(dǎo)的含有pET28a(+)-mle的E.coli BL21,在經(jīng)IPTG誘導(dǎo)的含有pET28a(+)的E.coli BL21和E.coli BL21中未發(fā)現(xiàn)該蛋白質(zhì)的表達(dá)。這說明分泌型表達(dá)蘋乳酶的重組表達(dá)系統(tǒng)已經(jīng)成功構(gòu)建。
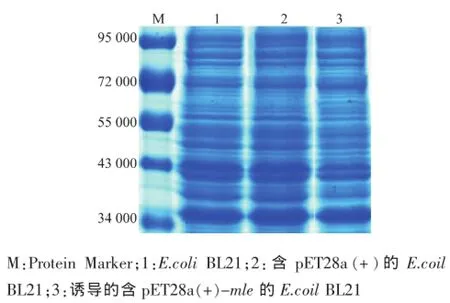
圖4 陽性轉(zhuǎn)化子全蛋白質(zhì)的SDS-PAGE圖Fig.4 SDS-PAGE photogram of whole protein from transformants
2.4陽性轉(zhuǎn)化子培養(yǎng)上清中產(chǎn)生L-乳酸的分析
根據(jù)方法1.2.6用HPLC對陽性轉(zhuǎn)化子發(fā)酵上清液中的乳酸進(jìn)行分析,以 E.coli BL21和含pET28a(+)的E.coli BL21作為對照,分析圖譜見圖5-8。
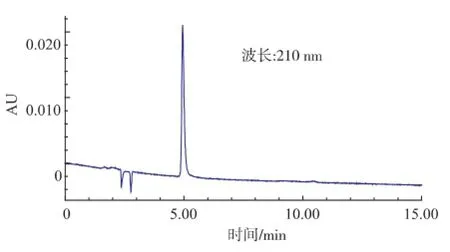
圖5 L-乳酸標(biāo)準(zhǔn)品(200 mg/L)的HPLC圖Fig.5 HPLC of L-lactic acid standard solution(200 mg/L)
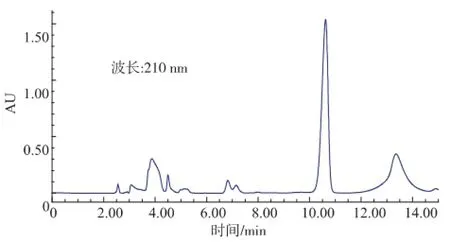
圖6 E.coli BL21培養(yǎng)上清液中L-乳酸HPLC圖Fig.6 HPLC of L-lactic acid in supernatant ofE.coli BL21
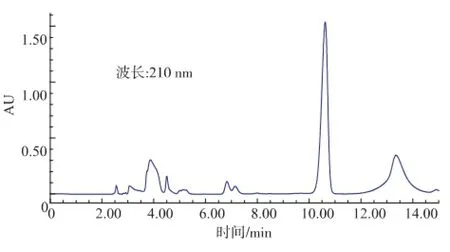
圖7 含pET28a(+)E.coli BL21培養(yǎng)上清液的 L-乳酸HPLC圖Fig.7 HPLC of L-lactic acid for supernatant of E.coli BL21 with pET28a(+)
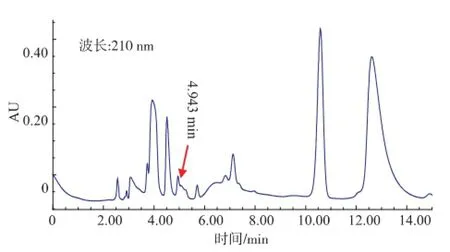
圖8 含pET28a(+)-mle E.coli BL21培養(yǎng)上清液的L-乳酸HPLC圖Fig.8 HPLC of L-lactic acid for supernatant of E.coli BL21 with pET28a(+)-mle
由圖5可以看出,L-乳酸的保留時間是4.941 min。由圖6-8可以看出,野生型和含pET28a(+)的E.coli BL21,在保留時間4.9 min附近無吸收,而含pET28a(+)-mle的E.coli BL21在4.943 min處有吸收,表明經(jīng)過誘導(dǎo)含有pET28a(+)-mle的E.coli BL21能夠表達(dá)蘋乳酶且能轉(zhuǎn)化蘋果酸為乳酸。通過外標(biāo)法計(jì)算出L-乳酸質(zhì)量濃度為240.7 mg/L。
同時用乳酸檢測試劑盒(酶法檢測原理)檢測各菌株發(fā)酵上清液中L-乳酸的質(zhì)量濃度,結(jié)果見表1。
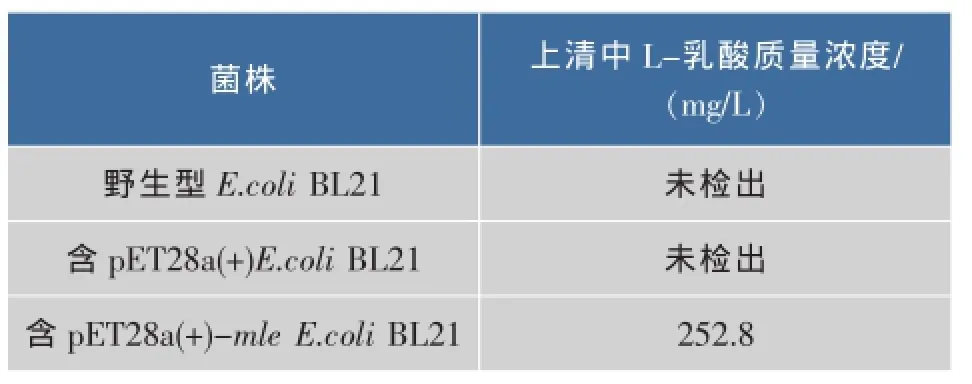
表1 乳酸試劑盒檢測培養(yǎng)上清中L-乳酸質(zhì)量濃度Table 1 L-lactic acid content detected with L-lactic acid assay kit
由表 1可以看出,野生和含 pET28a(+)的E.coli BL21的培養(yǎng)上清液中未檢出 L-乳酸,和HPLC檢測結(jié)果相一致。含pET28a(+)-mle的E.coli BL21上清液中檢出L-乳酸的質(zhì)量濃度為252.8 mg/L,比HPLC法檢出的結(jié)果稍大,這說明含pET28a(+)-mle的E.coli BL21外分泌的MLE有活性,具有將L-蘋果酸轉(zhuǎn)化為L-乳酸的能力。乳酸檢測試劑盒可用于蘋乳酶活性的檢測。
3結(jié)語
作者將來自枯草芽孢桿菌的β-葡聚糖酶的信號肽序列與蘋乳酶基因的編碼序列融合并克隆入載體pET28a(+)中,成功構(gòu)建了分泌型表達(dá)蘋乳酶的載體。含有該載體的E.coli BL21能夠成功地誘導(dǎo)表達(dá)蘋果酸乳酸酶,表達(dá)的蘋果酸乳酸酶能夠轉(zhuǎn)化蘋果酸產(chǎn)生乳酸,分別用HPLC和乳酸檢測試劑盒在發(fā)酵上清液中檢測到240 mg/L和252.8 mg/L的乳酸。
同時作者將含有信號肽編碼序列MLE插入表達(dá)載體pET22b(+)中,成功構(gòu)建了重組載體pET22b (+)-mle,見圖9。SDS-PAGE分析結(jié)果表明,在IPTG誘導(dǎo)的條件下,陽性克隆子能高效表達(dá)蘋乳酶,見圖10。但是其培養(yǎng)上清液中并沒有檢測到L-乳酸的存在,見圖11,這說明表達(dá)的MLE沒有活性,這可能是因?yàn)樵趐ET22b(+)表達(dá)系統(tǒng)中,表達(dá)量雖然較高,但信號肽不能有效地引導(dǎo)蛋白質(zhì)進(jìn)入周至空間和細(xì)胞外,而在胞內(nèi)的蛋白質(zhì)則可能因?yàn)闆]有來得及正確折疊而無法發(fā)揮其活性。
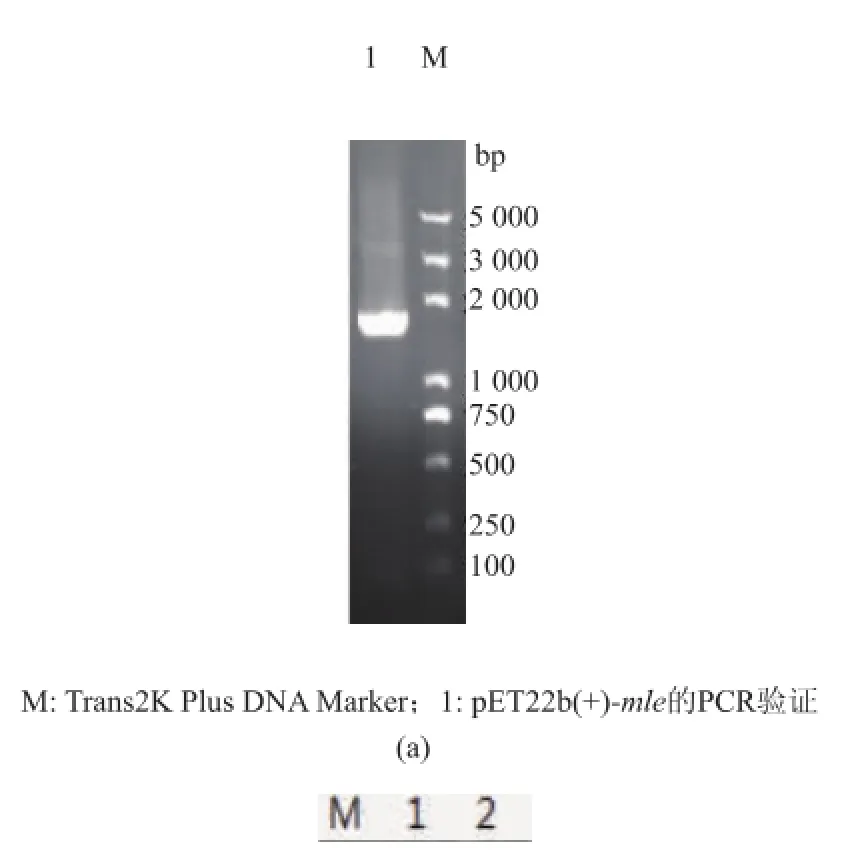
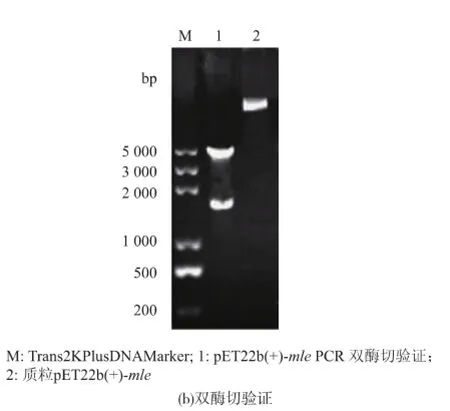
圖9pET22b(+)-mle的PCR和雙酶切驗(yàn)證Fig.9 Verification ofpET22b(+)-mle by PCR and double digestion
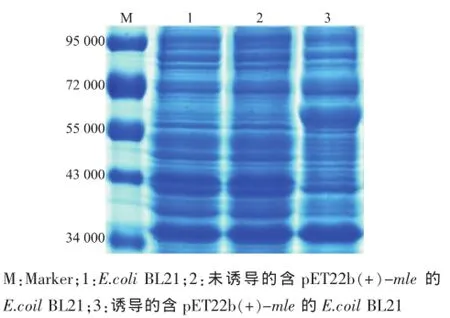
圖10 蘋果酸乳酸酶的SDS-PAGE圖Fig.10 SDS-PAGE analysis of MLE
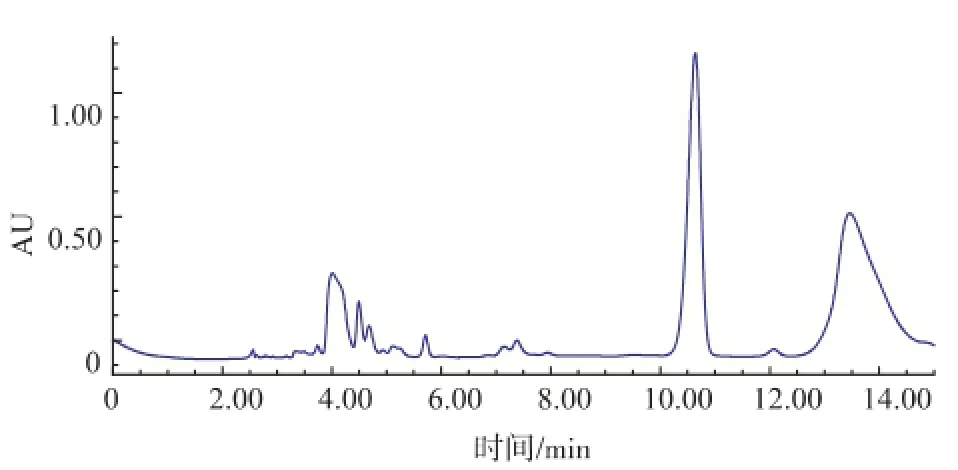
圖11 含pET22b(+)-mle E.coli BL21培養(yǎng)上清液的L-乳酸HPLC圖Fig.11 HPLC of L-lactic acid for supernatant of E.coli BL21 with pET22b(+)-mle
[1]張浩,莫海珍,李華.酒精、SO2和pH值對酒類酒球菌生長特性影響[J].中國釀造,2006(5):38-40. ZHANG Hao,MO Haizhen,LI Hua.Effect of ethanol,SO2and pH on the growth of Oneococcus oeni[J].China Brewing,2006,(5):38-40.(in Chinese)
[2]高年發(fā),孫騰飛,羅建華,等.葡萄酒生產(chǎn)技術(shù)[M].北京:化學(xué)工業(yè)出版社,2005:71-90.
[3]Labarre C,Guzzo J,Cavin J F.Cloning and characterization of the genes encoding malolactic enzyme and the malate permease of Leuconostocoenos[J].Applied and Environmental Microbiology,1996,62(4):1274-1282.
[4]Izquierdo Canas P M,Garcia Romero E,Gomez Alonso S.Amino acids and biogenic amines during spontaneous malolactic fermentation in Tempranillo red wines[J]. Journal of Food Composition and Analysis,2008,21:731-735.
[5]Liu Y L,Li H.Integrated expression of the oenococcus oeni mleA Gene in Saccharomyces cerevisiae[J].Agricultural Sciences in China,2009,8(7):821-827.
[6]高年發(fā),王淑豪,李曉剛.釀酒酵母與粟酒裂殖酵母屬間原生質(zhì)體融合選育降解蘋果酸的葡萄酒酵母[J].生物工程學(xué)報(bào),2000,16(6):718-722. GAO Nianfa,WANG Shuhao,LI Xiaogang,et al.Construction of yeast of reducing acid by intergeneric fusion between Saccharomycesbayanusand Schizosaccharomycespombe[J].ChineseJournalofBiotechnology,2000,16(6):718-722.(inChinese)
[7]高年發(fā),張穎.釀酒酵母和酒類酒球菌原生質(zhì)體制備與再生的條件優(yōu)化[J].中國釀造,2006(12):13-16. GAO Nianfa,ZHANG Ying.Method optimization on protoplast preparation and regeneration of Saccharomyces cerevisiae and Oenococcus oeni[J]. China Brewing,2006(12):13-16.(in Chinese)
[8]李華,游玲,劉曉晴,等.釀酒酵母與酒類酒球菌融合子特性及分子生物學(xué)研究[J].西北農(nóng)林科技大學(xué)學(xué)報(bào),2006,34(6):133-136. LI Hua,YOU Ling,LIU Xiaoqing,et al.Study of the fusant between Saccharomyces cerevisiae and Oenococcus oeni[J]. Journal of Northwest Sci-Tech University of Agriculture and Forestry,2006,34(6):133-136.(inChinese)
[9]李華,劉延琳,蔣思欣,等. Oenococcus oeni蘋果酸-乳酸發(fā)酵關(guān)鍵基因在釀酒酵母中的轉(zhuǎn)化與表達(dá)[J].農(nóng)業(yè)生物技術(shù)學(xué)報(bào),2006,14(4):606-611. LI Hua,LIU Yanlin,JIANG Sixin,et al.Cloning of two key enzyme genes from Oenococcus oeni for malolactic fermentation and their expressionsin Saccharomyces cerevisiae[J]. Journal of Agricultural Biotechnology,2006,14(4):606-611.(inChinese)
[10]薩姆布魯克J,拉塞爾著.分子克隆實(shí)驗(yàn)指南[M].D.W,黃培堂等,譯.(第三版).北京:科學(xué)出版社,2003:1217-1265.
Construction of Secretory Escherichia coli Expression System of Malolactic Enzyme
WANG Ningning1,2,LIU Rui1,2,CHEN Fusheng1,2,ZHANG Xiuyan1,2*
(1.College of Food Science and Technology,Huazhong Agricultural University,Wuhan 430070,China;2.Key Laboratory of Environment Correlative Dietology,Ministry of Education,Huazhong Agricultural University,Wuhan 430070,China)
Malolactic enzyme(MLE)is a key enzyme inmalactic fermentation(MLF)during fruit-wine producing.In order to construct the secretory Escherichia coli(E.coli)expression system of MLE.The signal peptide gene(487 bp)and the MLE gene(1 623 bp)were combined through fusion-PCR,then the fused fragment was inserted into pET28a(+)and transformed into E.coil. 60 000 protein was obtained when the positive strain was cultured and induced with IPTG.240.7 mg/L L-lactic acids could be detected in the fermentation supernatant with HPLC.All the results indicated the secretory E.coli expression system of MLE was successfully constructed.This will provide a technical platform for the research and application of MLE.
malolactic enzyme,malactic fermentation,secretory expression system
Q 78
A
1673—1689(2016)05—0498—06
2014-10-14
國家自然科學(xué)基金項(xiàng)目(31071588);中央高校基本科研業(yè)務(wù)費(fèi)專項(xiàng)資金項(xiàng)目(2662015PY068)。
*
張秀艷(1973—),女,河南南陽人,工學(xué)博士,副教授,碩士研究生導(dǎo)師,主要從事食品生物技術(shù)方面的研究。E-mail:xiuyanzhang73@mail.hzau.edu.cn

