一株高產2-苯乙醇酵母菌的篩選及鑒定
黃筱萍,劉 蘭,熊大維,黃國昌
(江西省科學院 微生物研究所,江西 南昌330029)
一株高產2-苯乙醇酵母菌的篩選及鑒定
黃筱萍,劉蘭,熊大維,黃國昌
(江西省科學院 微生物研究所,江西 南昌330029)
從24株不同來源的酵母菌中分離篩選出一株對2-苯乙醇耐受性強、生物轉化合成2-苯乙醇能力高的優良菌株SH003,該菌株能在含有4 g/L的2-苯乙醇培養基中生長,在優化的轉化條件下,轉化合成2-苯乙醇質量濃度達4.31 g/L,生成速率為0.18 g/(L·h),L-苯丙氨酸摩爾轉化率為72.4%,經菌落特征、菌體形態分析、生理生化試驗,結合18S rDNA序列分析,由系統發育樹表明它與釀酒酵母親緣關系最近,確定該菌株為Saccharomyces cerevisiae。
2-苯乙醇;釀酒酵母;菌株篩選和鑒定;18S rDNA
2-苯乙醇(2-phenylethanol,2-PE)是一種具有玫瑰花香的芳香醇,其作為主香和底香廣泛應用于食品香精、化妝品洗滌產品等日化產品中。此外,它還是重要的醫藥中間體,是合成苯乙醇苷、羥基苯乙醇的前體,作為精細化工中間體用于合成苯乙烯[1]。目前,全球2-苯乙醇年產量近萬噸,基本采用化學合成法生產。其產品大都含有難聞的有毒副產物,如聯二苯、二氯代乙苯、氯二醇等。隨著人們對天然香料的需求增多,從植物中主要是玫瑰精油中萃取獲得的天然2-苯乙醇已遠不能滿足市場的需求。2-苯乙醇是微生物代謝產物,它是一些發酵食品如面包、葡萄酒、干酪的自然產物,采用微生物生產2-苯乙醇生產周期短、原料便宜,具有大規模生產的潛在能力,通過微生物發酵法生產2-苯乙醇已獲得廣泛關注。
酵母細胞合成2-苯乙醇途徑主要有兩條:一是通過合成芳香族氨基酸的莽草酸途徑合成,二是通過艾氏途徑(Ehrlich pathway),即L-苯丙氨酸通過轉氨作用生成苯丙酮酸,再脫羧形成苯乙醛后,經氧化脫氫作用生成2-苯乙醇,通過添加前體物質L-苯丙氨酸使2-苯乙醇的產量大幅提高[2]。大多數酵母具有從頭合成或轉化L-苯丙氨酸為2-苯乙醇的能力,如馬克斯克魯維酵母[3]、發酵畢赤酵母[4]、乳酸克魯維酵母、釀酒酵母及異常漢遜酵母等[5],但通常產率較低,主要是嚴重的產物抑制成為酵母合成轉化2-苯乙醇的瓶頸。因此篩選對2-苯乙醇耐受性好、轉化率高的菌株成為國內外持續研究開發的關鍵。Etschmann M[6]等以工業廢糖蜜為碳源,L-苯丙氨酸為前體,從14株酵母菌中篩選出2株高產菌,采用原位分離技術,2-苯乙醇產量達到3 g/L。Eshkol等[7]通過對Ye9系類菌種的篩選,得到2株對于2-苯乙醇耐受性高的菌株,在補料分批發酵72 h后,2-苯乙醇質量濃度達4.5 g/L。唐育岐等[8]從9株酵母菌中篩選出一株2-苯乙醇產量達1.688 g/L的釀酒酵母,通過培養基優化,2-苯乙醇產量達4.402 5 g/L。崔志峰等[9]采用紫外誘變等方法篩選出一株對2-苯乙醇耐受性和產量較高的釀酒酵母突變株,2-苯乙醇的耐受性和產率分別提高了50%和9.1%。王航等[10]從8株酵母菌株中2-苯乙醇產量達1.48 g/L的釀酒酵母,通過紫外誘變和原生質融合,獲得一株2-苯乙醇產量達2.51 g/L的突變株。榮紹峰[11]篩選出一株釀酒酵母菌種,在優化的條件下2-苯乙醇產量達3.2 g/L,梅建風等[12]通過紫外誘變選育出一株釀酒酵母突變株,轉化合成2-苯乙醇產量達5.4 g/L。通過從自然界中分離篩選酵母菌,以及從不同來源的酵母菌株中進行2-苯乙醇的耐受性的篩選和對L-苯丙氨酸轉化合成2-苯乙醇能力的研究,篩選到一株對2-苯乙醇耐受性高、產率高的酵母菌株,并對它進行了鑒定。
1材料與方法
1.1實驗材料
1.1.1樣品采集和菌種來源市售不同產地葡萄,酒廠泥窖,土壤,市售酵母干粉,外購菌種。
1.1.2培養基
1)斜面及保藏培養基(g/L):麥芽汁瓊脂培養基。
2)篩選培養基 (g/L):葡萄糖30,酵母粉1,KH2PO45,MgSO40.2,2-苯乙醇2,瓊脂粉 18;pH 6.5~6.7。2-苯乙醇于培養基滅菌后加入。
3)種子培養基(g/L):葡萄糖30,蛋白胨5,酵母粉3,麥芽汁3;pH自然。
4)初篩轉化培養基(g/L):葡萄糖60,酵母粉3,L-苯丙氨酸6,KH2PO45,MgSO40.2;L-苯丙氨酸于培養基滅菌后加入。
5)轉化培養基(g/L):葡萄糖100,酵母粉5,L-苯丙氨酸8;復合無機鹽營養液2 mL。L-苯丙氨酸于培養基滅菌后加入。
1.1.3主要試劑L-苯丙氨酸:河北冀海生物科技有限公司,純度99.5%;2-苯乙醇標準品:Sigma公司,純度99.0%;甲醇:色譜純;超純水自制,其他試劑均為國產分析純。
1.2主要儀器
Shimadzu LC-20A高效液相色譜儀,SPD-20A紫外檢測器,Agilent HC-C18反相色譜柱(250 mm× 4.6 mm,5 μm),Olympus BX53顯微鏡,呈像系統DP80,Sartorius prachfum 224-1CN分析天平。
1.3實驗方法
1.3.1酵母菌的篩選和分離純化取不同來源的樣品,分別接入含有2-苯乙醇的篩選培養基中,于28℃、180 r/min搖瓶培養24 h,取0.1 mL富集后的菌液進行梯度稀釋度,涂布于篩選培養基平板中,于28℃培養24~48 h,挑選不同的單菌落劃線純化并鏡檢,將純化的酵母菌接種麥芽汁斜面中,28℃培養48 h,4℃冰箱保存。
1.3.2種子液培養和生物轉化從斜面菌種中挑取少量菌苔接種于30 mL種子培養液中,28℃、180 r/min培養24 h,再按10%的接種體積分數接種于含有L-苯丙氨酸轉化培養液中,于28℃、200 r/min培養24 h,轉化液于10 000 r/min離心10 min,上清液采用高效液相色譜法檢測L-苯丙氨酸和2-苯乙醇質量濃度。
1.3.3酵母菌對2-苯乙醇耐受性試驗斜面培養基滅菌后,加入2-苯乙醇使其在培養基中的質量濃度分別為0、1、2、3、3.5、4、5 g/L,用無菌量杯準確量取20 mL培養基,倒入直徑10 cm的平皿中,制成厚度均一的篩選培養基平板。從待測菌株的斜面上取一環菌苔至含有玻璃珠的50 mL無菌水中,振蕩均勻,制成菌懸液,稀釋涂平板,于28℃培養3 d后進行菌落計數。
1.3.4反相高效液相色譜法測定L-苯丙氨酸和2-苯乙醇含量發酵液經10 000 r/min離心10 min,取上清液1 mL,加純水稀釋1倍,用0.22 μm濾膜過濾。樣品于HPLC分析,流動相為V甲醇∶V水=50%∶50%,流速為1.0 mL/min,檢測波長260 nm,柱溫30℃,進樣量10 μL。
1.3.5酵母菌形態特征及生理生化鑒定利用顯微鏡及觀察固體平板上的菌落形態,并根據《酵母菌的特征與鑒定手冊》[13]所列的酵母菌鑒定方法進行生理生化鑒定。生理生化鑒定主要為碳源同化、氮源同化和其它特定的生理生化試驗等。
1.3.618S rDNA的擴增、測序和系統樹的構建提取SH003菌株的基因組DNA,以引物NS1(5'-GTAGTCATATGCTTGTCTC-3')和NS8(5'-TCCGC AGGTTCACCTACGGA-3')擴增18S rDNA。PCR反應條件:94℃5 min預變性;94℃30 s變性,54℃30 s退火,72℃2 min延伸,35個循環;72℃10 min延伸,PCR產物經瓊脂糖凝膠電泳,在北京諾禾致源生物信息科技公司完成測序。
將測序獲得18S rDNA序列在NCBI核酸數據庫中進行BLAST搜索,從數據庫中獲得高相似性的18S rDNA序列,下載相關菌種的18S rDNA序列,與供試菌株的序列一同用Clustal1.83軟件進行多序列完全比對,結果采用MEGA5.2中的鄰接法(Neihbor-Joining tree)進行系統樹的構建,并用Bootstrap對進化樹進行1 000次可信度分析。
2結果與討論
2.1生物轉化合成2-PE菌株的初篩
從篩選平皿中挑選出24株菌株,經菌落形態和菌體形態觀察,初步確定這些菌株均為酵母菌,分離純化后,將這些酵母菌分別接種于初篩轉化培養液中,于28℃、200 r/min培養24 h,以篩選合成轉化2-苯乙醇能力較高的菌株,轉化結束后,檢測轉化液中的2-苯乙醇質量濃度,結果見表1。
初篩結果表明,所分離的酵母菌合成轉化2-PE的能力差異較大,有3株2-苯乙醇產量達2.5~3.2 g/L,13株2-苯乙醇產量為1.0~2.8 g/L,8株2-苯乙醇產量低于1 g/L。其中菌株SH003顯示出最高的2-苯乙醇合成能力,其產量達3.15 g/L,轉化率為70.74%。圖1為菌株SH003的發酵上清液的HPLC圖譜。
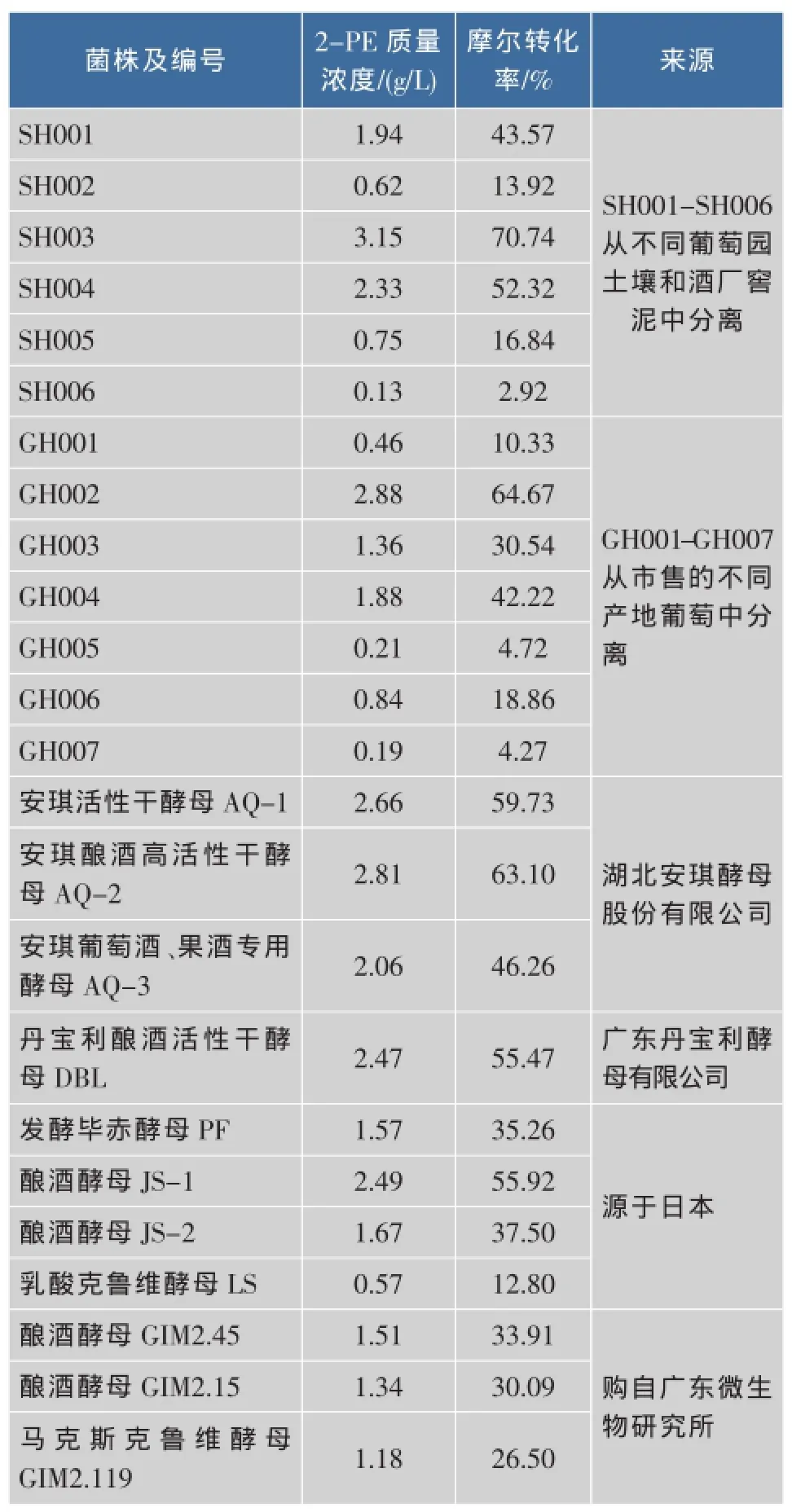
表1 不同酵母菌株轉化合成2-苯乙醇質量濃度和摩爾轉化率Table 1 2-PE concentration and molar yield in screening process by different yeast
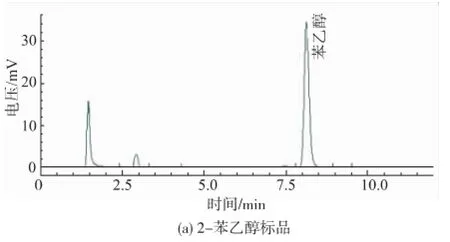
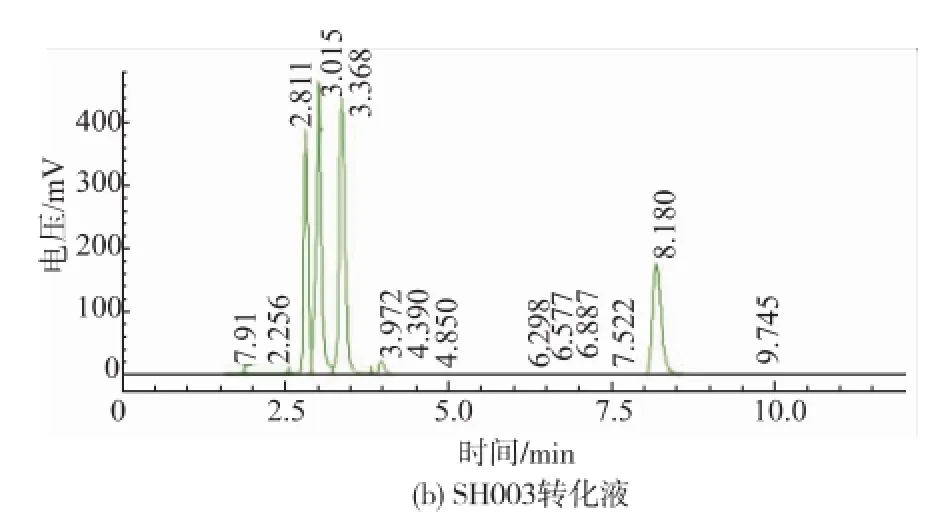
圖1 菌株SH003轉化液HPLC圖譜Fig.1 HPLC of 2-phenylethanol from the transformed reaction solution of strain SH003
2.2菌株對2-苯乙醇耐受性試驗
對產2-苯乙醇高于1 g/L的19株菌進行2-苯乙醇耐受性平板試驗,在篩選培養基中加入1~5 g/L 的2-苯乙醇,分別用菌懸液涂布接種后,于30℃培養3 d。19株菌均能在含2 g/L的平皿中生長,在高于2 g/L的平板中其生長明顯受到抑制,菌落變小,培養72 h有3株能在含3 g/L的2-苯乙醇平皿上生長,當質量濃度達到4 g/L以上時,基本上無菌落形成。菌株SH003在3.5 g/L的平板中生長良好,在4.0 g/L的平板上亦有少量菌生長,對2-苯乙醇的耐受性明顯高于其它2株酵母菌。表2為對2-苯乙醇耐受性最強的3株菌株的結果。
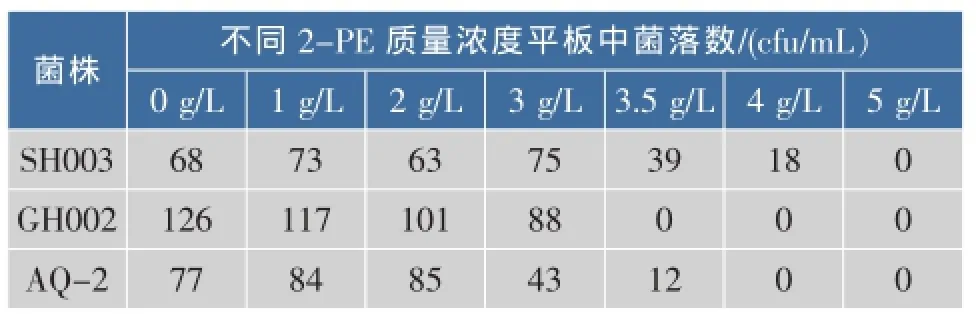
表2 不同2-苯乙醇質量濃度平板中酵母菌落數Table 2 Colony forming units ofyeastin dishes containing different concentration of 2-PE
2.3酵母菌株轉化合成2-苯乙醇能力試驗
將初篩中對2-苯乙醇耐受性較高,轉化能力較高的3株酵母菌株,接種于轉化培養基,于28℃、200 r/min培養24 h,2-苯乙醇產率見表3。
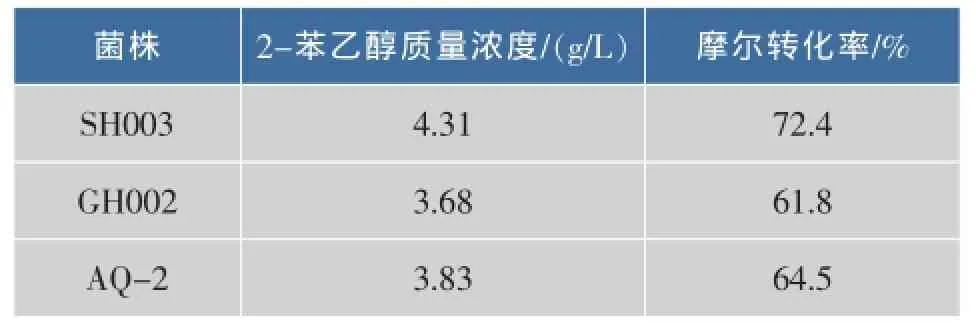
表3 不同酵母菌株轉化合成2-苯乙醇質量濃度和摩爾產率Table 3 2-phenylenthanol concentration and molar yield by different yeast
在提高轉化培養基中L-苯丙氨酸底物質量濃度和葡萄糖質量濃度后,各菌株轉化合成2-苯乙醇質量濃度均有很大提高,其中對2-苯乙醇耐受性最高的菌株SH003產率最高,產2-苯乙醇質量濃度達4.3 g/L,摩爾轉化率達72.4%。這表明菌株對產物的耐受性越高,其生物轉化合成2-苯乙醇的能力越強。
2.4菌株形態特征觀察
菌株SH003在麥芽汁瓊脂平板中于28℃培養48 h,其菌落形態和菌體形態特征見圖2及表4。
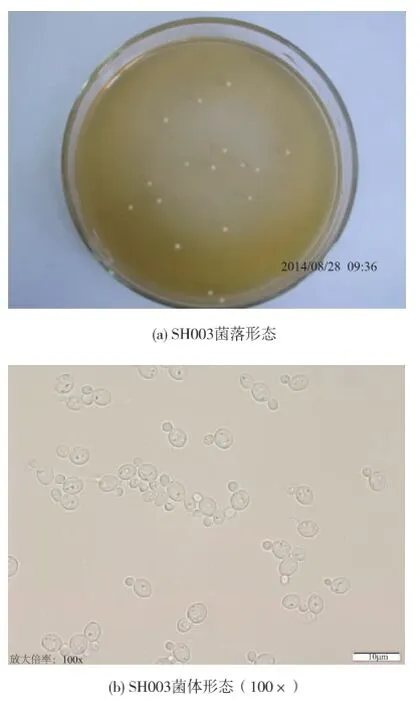
圖2 酵母SH003形態特征Fig.2 Morphologic characteristic of yeast SH003

表4 酵母SH003的形態特征Table 4 Morphology characteristics of yeast SH003
2.5生理生化鑒定
根據《酵母菌的特征與鑒定手冊》和《食品微生物實驗技術》等相關方法,生理生化鑒定主要進行了碳源同化、氮源同化和其它生理生化實驗,采用廣東省微生物研究所購買的釀酒酵母Saccharomyces cerevisiae GIM2.45(ATCC AS2.119)作為模式種,每個菌株分別作3個重復,結果見表5。
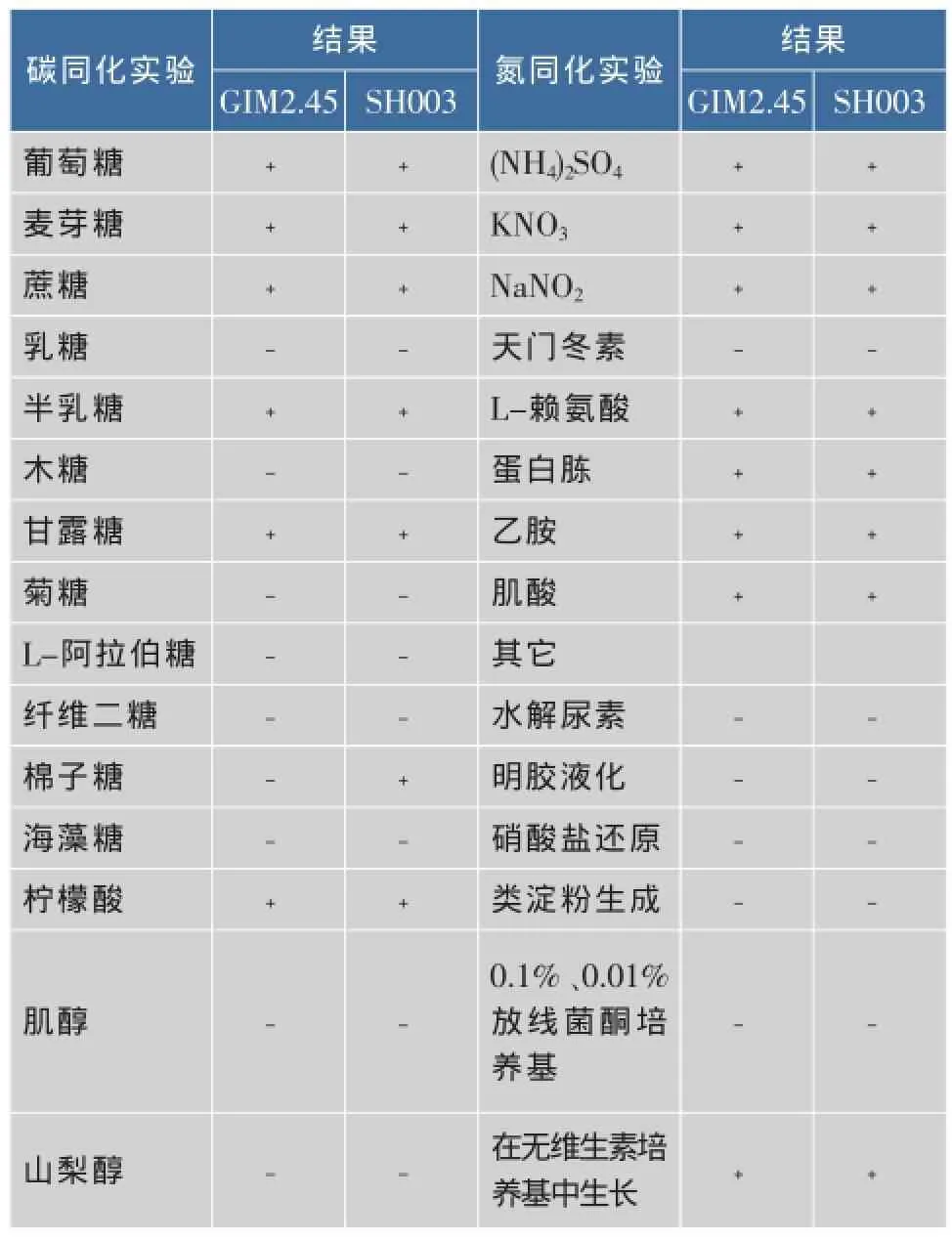
表5 S.cerevisiae GIM2.45與菌株SH003部分生理生化特征Table 5 Some physiological and biochemical characteristics of S.cerevisiae GIM2.45 and strain SH003
菌株SH003碳源同化實驗中棉子糖同化為陽性,而菌株Saccharomyces cerevisiae GIM2.45棉子糖同化為陰性,其它生理生化特性均相同,從鑒定手冊中亦列舉了部分釀酒酵母可利用棉子糖。
2.618S rDNA序列分析
測序結果表明,該菌株18S rDNA序列共1 039 bp。在NCBI中進行BLAST,結果表明,它與釀酒酵母(Saccharomyces cerevisiae)的18S rDNA序列同源性最高,達99.0%。菌株SH003的18S rDNA序列與S.cerevisiae MA09AN菌株的序列只有3個堿基的差別。用ClustalX+MEGA5.2建立SH003的系統發育樹,結果見圖3。可以看出,菌株SH003與S.cerevisiae KMS0510和 S.cerevisiae MA09-AN同源性最高,可以確定酵母菌SH003歸屬于S.cerevisiae。
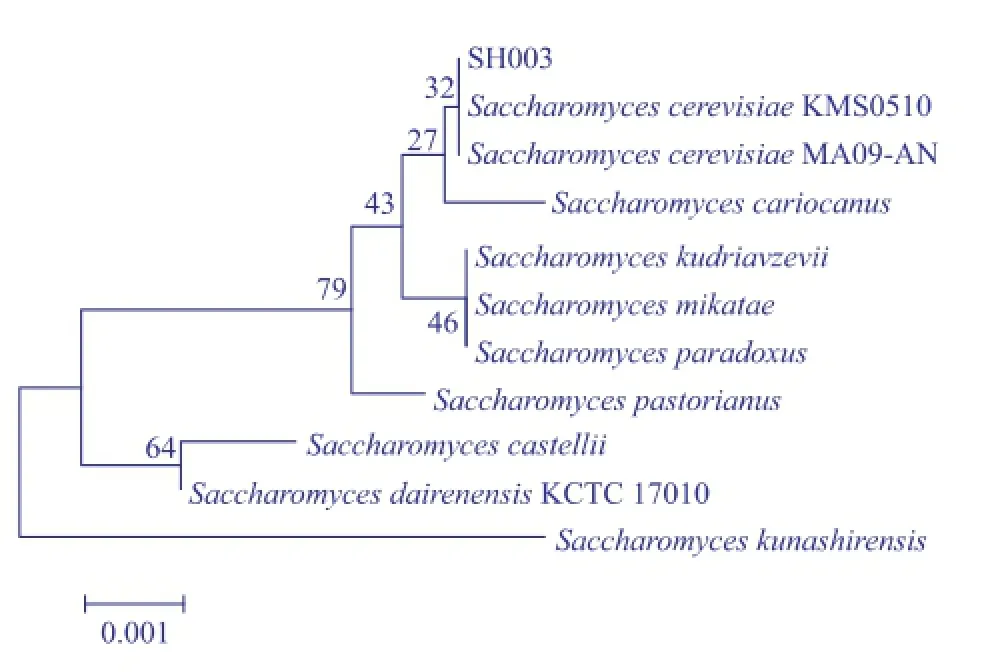
圖3 基于菌株SH00318S rDNA基因構建的系統進化樹Fig.3 Phylogenetic tree of stain SH003 on its 18S rDNA
3結語
酵母菌在自然界分布廣泛,很多酵母菌都有轉化生成2-苯乙醇的能力,但不同酵母菌株中轉化合成2-苯乙醇的能力差別很大。從不同產地的市售葡萄、酒廠窖泥、市售干酵母中分離出的17株酵母菌和不同來源的7株酵母菌中篩選到3株轉化合成2-苯乙醇能力較高的菌株,通過對2-苯乙醇耐受性和對2-苯乙醇合成能力測試,發現酵母菌對2-苯乙醇的耐受性越強,其轉化合成2-苯乙醇的能力越高,為從自然界中快速分離獲得2-苯乙醇高產菌株提供一種高效便捷的方法。從葡萄果皮中分離的菌株SH003對2-苯乙醇的耐受性最強,在含有4 g/L 的2-苯乙醇培養基中亦能生長,在L-苯丙氨酸底物質量濃度為8 g/L時,轉化合成2-苯乙醇質量濃度為4.31 g/L,生成速率為0.18 g/(L·h),摩爾轉化率為72.4%,該菌株的成功選育為后續生物轉化合成2-苯乙醇的研究和生產提供了很好的菌種來源。
通過形態學、生理生化鑒定,菌株SH003的形態學特征和生理生化特性均與釀酒酵母相符,通過18S rDNA序列分析,菌株SH003與釀酒酵母同源性最高,可確定其為釀酒酵母。
[1]盧健,盧少明,馬集鋒.β-苯乙醇的現狀與發展前景[J].廣東化工,2012,39(11):123-124. LU Jian,LU Shaoming,MA Jifeng.Situation and development prospects of the β-phenylethanol[J]. Guangdong Chemical Industry,2012,39(11):123-124.(in Chinese)
[2]榮紹豐,付艷麗.微生物轉化法生產β-苯乙醇的研究進展[J].上海應用技術學院學報,2009,9(4):266-269. RONG Shaofeng,FU Yanli.Progress in β-phenylethanol production by biotransformation method[J].Journal of Shanghai Institute of Technology:Natural Science,2009,9(4):266-269.(in Chinese)
[3]Fabre C E,Duviau V J,Blane P J,et al.Identification of volatile flavor compounds obtained in culture of Kluyveromyces marxianus[J].Biotechnol Lett,1995,17:1207-1212.
[4]Huang C J,Lee S L,Chou C C.Production of 2-phenylethanol,a flavor ingredient by Pichia fermentans L-5 under various culture conditions[J].Food Res Int,2001,34:277-282.
[5]Etschmann M,Sell D,Schrader J.Screening of yeasts for the production of the aroma compound 2-phenylethanol in a molasses-based medium[J]. Biotechnol Lett,2003,25:531-536.
[6]Etschmann M,Bluemkee W,Sell D.et al.Biotechnological production of 2-phenylethanol[J].Appl Microbiol Biotechnol,2002,59:1-8.
[7]Eshiol N,Sendovski M,Bahalul M.et al.Production of 2-phenylethanol from L-phenylalanine by a stress tolerant Ssccharomyces cerevisiae strain[J].Journal of Applied Microbiology,2009,106(2):534-542.
[8]唐育岐,劉天明,趙修報,等.高產2-苯乙醇酵母菌株的篩選及培養基優化[J].中國食品添加劑,2012,3:137-142. TANG Yuqi,LIU Tianming,ZHAO Xiubao,et al.Screening of high-yield yeast strains for 2-phenylethanol medium optimization [J].China Food Additives,2012,3:137-142.(in Chinese)
[9]崔志峰,車智博,楊霄,等.2-苯乙醇耐受性高產酵母菌株的選育[J].浙江工業大學學報,2008,36(4):427-430. CHUI Zhifeng,CHE Zhibo,YANG Xiao,et al.Screening of the Saccharomyces cerevisiae strain for resistance and higher production of 2-phenylethanol[J].Journal of Zhejiang University of Techonlogy,2008,36(4):427-430.(in Chinese)
[10]王航,董清風,孟春,等.高產2-苯乙醇釀酒酵母的選育[J].福州大學學報,2010,38(1):153-156. WANG Hang,DONG Qingfeng,MENG Chun,et al.Breeding for high-yield 2-phenylethanol strains of Saccharomyces cerevisiae [J].Journal of Fuzhou University:Nature Science Edition,2010,38(1):153-156.(in Chinese)
[11]榮紹豐,付艷麗,王濤,等.釀酒酵母AS2.1182發酵生產β-苯乙醇的研究[J].食品與發酵工業,2009,35(8):69-77. RONG Shaofeng,FU Yanli,WANG Tao,et al.The study on β-phenylethanol fermented by Saccharomyces cerevisiae AS2.1182 [J].Food and Fermentation Industries,2009,35(8):69-77.(in Chinese)
[12]梅建風,閔航.生物轉化合成2-苯乙醇菌種的誘變選育[J].食品與發酵工業,2007,33(5):22-24. MEI Jiangfeng,MIN Hang.Breeding of yeast strain for production of 2-phenylethanol by biotransformation[J].Food and Fermentation Industries,2007,33(5):22-24.(in Chinese)
[13]巴尼特J A,佩恩R W,亞羅D著.胡瑞卿譯.酵母菌的特征與鑒定手冊[M].青島:青島海洋大學出版社,1991.
[14]李成,戚南昌,彭果,等.S-苯乙醇高產菌株的篩選及鑒定[J].微生物學雜志,2013,33(2):43-47. LI Cheng,QI Nanchang,PENG Guo,et al.Screening and identification of S-phenylethanol-producing strain[J].Journal of Microbiology,2013,33(2):43-47.(in Chinese)
[15]蘇艷秋,朱衛,吳鵬,等.耐高溫、耐酸產酒精酵母的篩選與鑒定[J].微生物學雜志,2009,29(2):243-247. SU Yanqiu,ZHU Weihua,WU Peng,et al.Screening and identification of heat-resistant and acid-proof alcohol-producing yeast [J]. Journal of Microbiology,2009,29(2):243-247.(in Chinese)
Screening and Identification of High-Yield Strain for 2-Phenylethanol
HUANG Xiaoping,LIU Lan,XIONG Dawei,HUANG Guochang
(Institution of Microbiology,Jiangxi Academy of Sciences,Nanchang 330029,China)
A strain designated as SH003 with high 2-phenylethanol tolerance and bioconversion properties was selected from 24 yeast strains with different sources.It could grow in the medium containing 4 g/L 2-phenylethanol.Under the optimized conditions,the production and productivity of 2-phenylethanol respectively reached to 4.31 g/L and 0.18 g/(L·h).The molar conversion rate of L-phenylalanine to 2-phecylethanol was 72.4%.Identified by the morphological and physiological characteristics and its 18S rDNA sequence,strain SH003 was closely related with Saccharomyces cerevisiae on phylogenesis.
2-phenylethanol,Saccharomyces cerevisiae,screening and identification,18S rDNA
TQ 92
A
1673—1689(2016)05—0531—06
2014-11-14
江西省重點科技支撐計劃項目(20133BBE50018);江西省科研院所基礎設施配套項目(20151BBA13031)。
*
黃筱萍(1965—),女,江西南昌人,理學碩士,研究員,主要從事生物發酵、活性物質提取精制方面的研究。Email:plahxp@163.com

