二甲雙胍對高糖培養(yǎng)H9c2細(xì)胞Connexin43表達(dá)的影響
王光宇,畢亞光,劉向東,魏 盟,張慶勇
(上海交通大學(xué)附屬第六人民醫(yī)院心血管內(nèi)科,上海 200233)
?
二甲雙胍對高糖培養(yǎng)H9c2細(xì)胞Connexin43表達(dá)的影響
王光宇,畢亞光,劉向東,魏盟,張慶勇
(上海交通大學(xué)附屬第六人民醫(yī)院心血管內(nèi)科,上海200233)
目的研究二甲雙胍(metformin, Met)對高糖培養(yǎng)下的H9c2細(xì)胞縫隙連接蛋白43(connexin43,Cx43)表達(dá)的影響及其機(jī)制。方法高糖培養(yǎng)的大鼠H9c2心肌細(xì)胞分別加入3和5 μmol·L-1的兩種不同濃度的二甲雙胍繼續(xù)培養(yǎng)24 h。MTT實(shí)驗(yàn)檢測H9c2細(xì)胞活力;LDH釋放實(shí)驗(yàn)檢測細(xì)胞毒力;細(xì)胞免疫熒光實(shí)驗(yàn)檢測Cx43的表達(dá)和分布;熒光法檢測細(xì)胞內(nèi)活性氧(ROS)水平;Western blot檢測Cx43、p-AMPK、AMPK和GAPDH的表達(dá)。結(jié)果Met能增加H9c2細(xì)胞活力,降低細(xì)胞內(nèi)ROS水平,對LDH釋放差異無顯著性;Met使AMPK磷酸化水平明顯升高,增加心肌Cx43表達(dá),改善Cx43的分布。結(jié)論Met可能通過激活A(yù)MPK途徑,增加心肌細(xì)胞Cx43的表達(dá)和減少細(xì)胞內(nèi)ROS的產(chǎn)生,進(jìn)而發(fā)揮心血管的保護(hù)效應(yīng)。
二甲雙胍;高血糖;connexin43;氧化應(yīng)激;AMP依賴的蛋白激酶;H9c2
超過50%的糖尿病患者死亡原因歸于心血管疾病[1]。糖尿病可以引起多種并發(fā)癥,如心肌梗死、糖尿病心肌病,糖尿病腎病等。因此嚴(yán)格的血糖控制對糖尿病患者來說顯得尤為重要。
在心肌細(xì)胞閏盤處存在一種縫隙連接(gap junction, GJ)通道,由縫隙連接蛋白(connexin, Cx)組成。它是心肌細(xì)胞間電、化學(xué)信號偶聯(lián)通道,不僅可以進(jìn)行細(xì)胞間物質(zhì)交換,如離子、ATP等,還可以傳導(dǎo)電信號,實(shí)現(xiàn)心肌細(xì)胞同步性舒縮,完成泵血過程。心室肌細(xì)胞閏盤處主要存在縫隙連接蛋白43(connexin43,Cx43)[2]。研究表明,Cx43的表達(dá)或分布異常與許多疾病相關(guān),如心律失常[3]、高血壓、動(dòng)脈粥樣硬化[4]等。研究發(fā)現(xiàn)高血糖情況下Cx43的表達(dá)降低、分布異常、心律失常發(fā)生率增加[5]。這些證據(jù)提示Cx43在維持心臟正常功能中起著至關(guān)重要的作用。
二甲雙胍是最常用的口服降糖藥,廣泛用于治療2型糖尿病患者。研究表明,二甲雙胍能改善骨骼肌胰島素抵抗[6],減少糖尿病患者全因死亡率和心血管事件發(fā)生率[7]。此外,二甲雙胍還能改善心肌梗死后重構(gòu)效應(yīng)及炎癥反應(yīng)[8],降低糖尿病患者房顫發(fā)生率[9]。但二甲雙胍發(fā)揮心血管保護(hù)作用是否與心肌Cx43變化有關(guān),目前尚無定論。本研究擬在H9c2大鼠心肌細(xì)胞系中,觀察二甲雙胍對高糖培養(yǎng)的H9c2細(xì)胞Cx43表達(dá)的影響及其潛在機(jī)制。
1 材料與方法
1.1材料與試劑大鼠心肌細(xì)胞株H9c2(2-1)購自中國科學(xué)院上海細(xì)胞庫;Cx43、AMP依賴的蛋白激酶(AMPK)、磷酸化的AMP依賴的蛋白激酶(P-AMPK)、GAPDH抗體購自Cell Signal Technology公司;羊抗兔二抗購自武漢谷歌生物有限公司;二甲雙胍(metformin, Met)、二甲基亞砜(DMSO)、噻唑藍(lán)(methylthiazolyl tetrazolium, MTT)購自Sigma公司;DMEM、胎牛血清(FBS)購自美國Gibco公司;ROS檢測試劑盒、LDH檢測試劑盒、BCA蛋白定量試劑盒購自碧云天生物技術(shù)公司;增強(qiáng)型化學(xué)發(fā)光(ECL)顯影液購自Thermo公司;EPOCH型多功能酶標(biāo)儀購自Bio-Tek公司;PowerPac Universal電泳裝置購自Bio-rad公司。
1.2細(xì)胞培養(yǎng)及分組用含10% FBS的DMEM培養(yǎng)液培養(yǎng)H9c2細(xì)胞,放在含5% CO2,95% O237℃培養(yǎng)箱中。當(dāng)細(xì)胞長滿培養(yǎng)皿80%~90%時(shí),用PBS緩沖液沖洗3遍,加1 mL 0.25%的胰酶使其與細(xì)胞充分接觸,消化1 min,再加3 mL的DMEM培養(yǎng)基終止消化。將細(xì)胞懸液加入離心管中,以900×g離心3 min,去除上清,將細(xì)胞稀釋后轉(zhuǎn)移至6孔板繼續(xù)培養(yǎng)。待細(xì)胞長滿80%左右,在高糖(25.0 mmol·L-1)培養(yǎng)的H9c2細(xì)胞中分別加3 μmol·L-1Met(Met3)和5 μmol·L-1Met(Met5)繼續(xù)培養(yǎng)24 h,另設(shè)對照組(不含Met,Con)。
1.3細(xì)胞活力檢測稱取適量的MTT,溶解于去離子水中,使其終濃度為0.5 g·L-1,繼續(xù)培養(yǎng)4 h,去除上清,每孔加DMSO 150 μL,快速震蕩10 min,使結(jié)晶充分溶解。然后在酶標(biāo)儀測吸光度在490 nm處的吸光度值[D(490 nm)]。
1.4細(xì)胞毒性檢測按照試劑盒說明書方法進(jìn)行操作。簡言之,待細(xì)胞長滿80%左右,設(shè)置以下幾組:背景空白對照孔、樣品對照孔、樣品最大酶活性對照孔、不同藥物濃度處理樣品孔。到達(dá)預(yù)計(jì)檢測時(shí)間點(diǎn)前1h,在樣品最大酶活性對照孔加入原有體積10%的LDH釋放液并混勻。到達(dá)預(yù)定時(shí)間后,每組取120 μL的上清加入96孔板中,同時(shí)加入60 μL LDH檢測工作液,室溫避光30 min,在490 nm處測吸光度。細(xì)胞毒性/%=(處理樣品吸光度-樣品對照孔吸光度)/(細(xì)胞最大酶活性的吸光度-樣品對照孔吸光度)×100。
1.5細(xì)胞免疫熒光檢測細(xì)胞爬片之后,進(jìn)行預(yù)定時(shí)間藥物處理,然后用PBS清洗3次,每次3 min;用4%的多聚甲醛室溫固定30 min,PBS清洗3次,每次3 min。在玻片上滴加山羊血清,室溫封閉30 min,吸水紙吸掉封閉液加入Cx43的一抗,4℃孵育過夜。清洗玻片上多余的一抗,加熒光二抗室溫避光孵育1 h,滴加DAPI避光孵育5 min,清洗封片,用熒光顯微鏡觀察采集圖像。
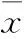
2 結(jié)果
2.1Met對H9c2細(xì)胞活力的影響MTT實(shí)驗(yàn)結(jié)果顯示:與Con組相比,3 μmol·L-1和5 μmol·L-1的Met處理能明顯增加細(xì)胞活力(P<0.05);與Met3組相比,雖然Met5組細(xì)胞活力有升高趨勢,但是兩者間差異無統(tǒng)計(jì)學(xué)意義(P>0.05),見Fig 1。
2.2Met對H9c2細(xì)胞毒力的影響LDH實(shí)驗(yàn)結(jié)果顯示:與Con組相比,Met3和Met5組細(xì)胞釋放的LDH都有升高趨勢,但是差異無統(tǒng)計(jì)學(xué)意義(P>0.05),見Fig 2。

Fig 1 Effects of different concentrations of Met on viability of H9c2 cells measured by ±s,n=3)
*P<0.05vscontrol group

Fig 2 Effects of different concentrations of Met on toxicity
2.3細(xì)胞免疫熒光細(xì)胞免疫熒光結(jié)果顯示:與Con組相比,Met3和Met5組細(xì)胞Cx43的表達(dá)量明顯升高,而且在細(xì)胞表明分布更加規(guī)則(Fig 3白色箭頭)。Met3和Met5組組間比較發(fā)現(xiàn)Cx43的表達(dá)和分布無差異。
2.4Met對細(xì)胞內(nèi)ROS產(chǎn)生的影響用熒光顯微鏡觀察細(xì)胞內(nèi)ROS的變化,結(jié)果顯示:與Con組相比,Met3和Met5組細(xì)胞內(nèi)的ROS明顯減少(Fig 4);與Met3組相比,Met5組細(xì)胞內(nèi)的ROS含量進(jìn)一步降低。
2.5Met對細(xì)胞Cx43,AMPK及p-AMPK表達(dá)的影響Western blot結(jié)果顯示:與Con組相比,Met3和Met5組內(nèi)Cx43和p-AMPK表達(dá)明顯升高(Fig 5,P<0.05)。與Met3組相比,Met5組內(nèi)P-AMPK表達(dá)量升高更加明顯(P<0.05),但Cx43的含量差異無顯著性。
3 討論
本研究觀察到,二甲雙胍不僅能增加H9c2細(xì)胞活力,還能降低高血糖條件下ROS的產(chǎn)生。在分子生物學(xué)水平我們還發(fā)現(xiàn)二甲雙胍能增加高糖條件下H9c2細(xì)胞Cx43和P-AMPK的表達(dá),其中降低ROS產(chǎn)生和增加P-AMPK的表達(dá)效應(yīng)呈現(xiàn)劑量依賴形式。
心肌Cx43在維持心臟正常功能過程中具有重要作用。研究發(fā)現(xiàn),心肌在發(fā)育過程中Cx43缺陷可以引起流出道梗阻[10],而且Cx43還參與細(xì)胞周期和轉(zhuǎn)錄調(diào)控[11]。大量研究已經(jīng)證實(shí),心室肌Cx43的表達(dá)和分布與室性心律失常的發(fā)生密切相關(guān)。

Fig 3 The immunofluorescence of Cx43 in H9c2 cells(n=3)

Fig 4 Effects of different concentrations of Met on the ROS generated of H9c2 cells culture with high glucose(magnification 200×,n=3)

Fig 5 Effects of different concentrations of Met levels of

The protein levels of Cx43, P-AMPK and AMPK were examined by Western blot. One of three representative experiments is shown. Data are the mean ± SD of band intensities volume/GAPDH intensities volume from three different experiments.*P<0.05vscon group;#P<0.05vsMet3 group.
Rutledge等[3]研究發(fā)現(xiàn),心肌梗死后瘢痕邊界的Cx43含量明顯降低,Cx43也從心肌閏盤處轉(zhuǎn)向細(xì)胞側(cè)面,導(dǎo)致側(cè)面連接增多。Rutledge等用c-Src抑制劑提高了梗死邊界Cx43的含量,降低室性心動(dòng)過速易感性。Greener等[12]研究也發(fā)現(xiàn)通過基因轉(zhuǎn)染等手段上調(diào)豬心肌梗死邊界局部心肌Cx43的表達(dá),可以有效的抑制心肌梗死后室性心律失常的發(fā)生。不論是動(dòng)物實(shí)驗(yàn)還是細(xì)胞實(shí)驗(yàn)均表明高血糖能降低心肌Cx43的表達(dá),此外動(dòng)物實(shí)驗(yàn)還證實(shí)Cx43表達(dá)量的降低及分布異常與糖尿病易于發(fā)生心律失常存在密切聯(lián)系[5]。在本次實(shí)驗(yàn)中,我們觀察到二甲雙胍能增加高血糖情況下細(xì)胞Cx43的表達(dá)量和改善Cx43的分布,據(jù)此推測二甲雙胍降低糖尿病患者心血管事件的發(fā)生率及死亡率與增加心肌Cx43表達(dá)及改善分布有關(guān)。
氧化應(yīng)激在長期高血糖導(dǎo)致心功能不良過程中起重要作用[13]。ROS產(chǎn)生過多可以引起線粒體滲透性轉(zhuǎn)運(yùn)通道的開放,導(dǎo)致線粒體損傷。研究發(fā)現(xiàn)活性氧(ROS)在引起心室重構(gòu)和心衰過程中扮演重要角色[14]。減少ROS的產(chǎn)生能保護(hù)細(xì)胞免受氧化應(yīng)激損傷。我們研究發(fā)現(xiàn)高糖培養(yǎng)H9c2細(xì)胞能增加ROS的產(chǎn)生,但是加入二甲雙胍能抑制細(xì)胞ROS的生成,并且呈劑量依賴形式。因此我們有理由相信二甲雙胍降低細(xì)胞ROS的產(chǎn)生也參與保護(hù)心血管這一過程。
研究發(fā)現(xiàn),二甲雙胍發(fā)揮心血管保護(hù)作用的機(jī)制主要通過激活A(yù)MPK。AMPK的激活不僅可以增加血糖攝取,脂肪酸氧化,提高細(xì)胞活力[15],還能減輕心肌梗死帶來的炎癥反應(yīng)[8]。本實(shí)驗(yàn)也發(fā)現(xiàn),二甲雙胍通過增加p-AMPK的表達(dá)激活A(yù)MPK。Guo等[16]研究發(fā)現(xiàn)激活A(yù)MPK能上調(diào)腎內(nèi)皮細(xì)胞Cx43的表達(dá),延緩腎內(nèi)皮細(xì)胞的衰老。因此,我們推測二甲雙胍上調(diào)心肌細(xì)胞Cx43的表達(dá)和降低細(xì)胞內(nèi)ROS的產(chǎn)生與AMPK激活相關(guān)。
綜上所述,本實(shí)驗(yàn)證實(shí),在高糖條件下,二甲雙胍能增加H9c2細(xì)胞Cx43的表達(dá)及改善其分布,此外二甲雙胍還能降低細(xì)胞內(nèi)ROS的產(chǎn)生,增加細(xì)胞活力。這為二甲雙胍治療糖尿病患者帶來的心血管益處提供了重要的實(shí)驗(yàn)依據(jù)。至于二甲雙胍增加Cx43的表達(dá)和降低ROS的產(chǎn)生可能與AMPK的激活有關(guān),需要以后的研究進(jìn)行驗(yàn)證。
(致謝:本研究在上海交通大學(xué)附屬第六人民醫(yī)院心血管內(nèi)科實(shí)驗(yàn)室完成,在此致以由衷的感謝!)
[1]Asrih M, Steffens S. Emerging role of epigenetics and miRNA in diabetic cardiomyopathy[J].CardiovascPathol, 2013,22(2):117-25.
[2]Vozzi C, Dupont E, Coppen S R,et al. Chamber-related differences in connexin expression in the human heart[J].JMolCellCardiol, 1999, 31(5): 991-3.
[3]Rutledge C A, Ng F S, Sulkin M S, et al. c-Src kinase inhibition reduces arrhythmia inducibility and connexin43 dysregulation after myocardial infarction[J].JAmCollCardiol, 2014, 63(9): 928-34.
[4]Brisset A C, Isakson B E, Kwak B R. Connexins in vascular physiology and pathology[J].AntioxidRedoxSignal, 2009, 11(2): 267-82.
[5]Okruhlicova L, Tribulova N, Misejkova M, et al. Gap junction remodelling is involved in the susceptibility of diabetic rats to hypokalemia-induced ventricular fibrillation[J].ActaHistochem, 2002, 104(4): 387-91.
[6]吳文君,湯孫寅炎,時(shí)俊鋒,等. 二甲雙胍抑制SREBP-1c改善高脂誘導(dǎo)的骨骼肌胰島素抵抗[J]. 中國藥理學(xué)通報(bào),2016,32(1):55-9.
[6]Wu W J,Tang S Y Y,Shi J F,et al. Metformin ameliorates PA-induced skeletal muscle insulin resistance by suppressing SREBP-1c[J].ChinPharmacolBull,2016,32(1):55-9.
[7]Fung C S, Wan E Y, Wong C K, et al. Effect of metformin monotherapy on cardiovascular diseases and mortality: a retrospective cohort study on Chinese type 2 diabetes mellitus patients[J].CardiovascDiabetol, 2015, 14:137.
[8]Soraya H, Rameshrad M, Mokarizadeh A. Metformin attenuates myocardial remodeling and neutrophil recruitment after myocardial infarction in rat[J].Bioimpacts, 2015, 5(1): 3-8.
[9]Chang S H, Wu L S, Chiou M J, et al. Association of metformin with lower atrial fibrillation risk among patients with type 2 diabetes mellitus: a population-based dynamic cohort andinvitrostudies[J].CardiovascDiabetol, 2014, 13(123):1-8.
[10]Walker D L, Vacha S J, Kirby M L. Connexin43 deficiency causes dysregulation of coronary vasculogenesis[J].DevBiol, 2005, 284(2): 479-98.
[11]Giepmans B N. Gap junctions and connexin-interacting proteins[J].CardiovascRes, 2004, 62(2): 233-45.
[12]Greener I D, Sasano T, Wan X, et al. Connexin43 gene transfer reduces ventricular tachycardia susceptibility after myocardial infarction[J].JAmCollCardiol, 2012, 60(12): 1103-10.
[13]Ansley D M, Wang B. Oxidative stress and myocardial injury in the diabetic heart[J].JPathol, 2013, 229(2): 232-41.
[14]Sun X, Chen R C, Yang Z H, et al. Taxifolin prevents diabetic cardiomyopathyinvivoandinvitroby inhibition of oxidative stress and cell apoptosis[J].FoodChemToxicol, 2014, 63:221-32.
[15]Johnson R, Dludla P, Joubert E, et al. Aspalathin, a dihydrochalcone C-glucoside, protects H9c2 cardiomyocytes against high glucose-induced shifts in substrate preference and apoptosis[J].MolNutrFoodRes, 2016,60(4):922-34.
[16]Guo Y N, Wang J C, Cai G Y, et al. AMPK-mediated downregulation of connexin43 and premature senescence of mesangial cells under high-glucose conditions[J].ExpGerontol, 2014, 51:71-81.
Effect of metformin on connexin43 expression in H9c2 cells cultured with high glucose
WANG Guang-yu, BI Ya-guang, LIU Xiang-dong, WEI Meng, ZHANG Qing-yong
(DeptofCardioloy,ShanghaiJiaoTongUniversityAffiliatedSixthPeople′sHospital,Shanghai200233,China)
AimTo investigate the effect of metformin(Met) on connexin43(Cx43) expression in H9c2 cells cultured with high glucose and the relevant mechanisms.MethodsRat myocardial cells H9c2 were cultured with high glucose, then combined with 3 μmol·L-1and 5 μmol·L-1of Met for 24 h respectively. The viability and toxicity of H9c2 cells were detected by MTT and LDH, respectively. The expression and distribution of Cx43 were detected by immunofluorescence staining. The intracellular oxygen species reactive(ROS) level was detected by fluorescencemicroscopy. And the expression of Cx43, P-AMPK, AMPK and GAPDH was determined by Western blot. ResultsThe viability of H9c2 cells was increased and the level of intracellular ROS was decreased in Met group, while there existed no significant difference in LDH release among groups. Met significantly increased the phosphorylation of AMPK and the expression of Cx43, and improved the distribution of Cx43 also.ConclusionThe beneficial effect of Met on cardiovascular system in diabetic patients may via up-regulating the expression of Cx43 and down-regulating of intracellular ROS through activation of AMPK.
metformin; high glucose; connexin43; oxidative stress; AMPK; H9c2
2016-01-20,
2016-04-15
上海自然科學(xué)基金資助項(xiàng)目(No 13ZR1431500)
王光宇(1989-),男,碩士,研究方向:心律失常發(fā)病機(jī)制,E-mail:wanggysjtj@163.com;張慶勇(1972-),男,博士,副教授,碩士生導(dǎo)師,研究方向:糖尿病心律失常發(fā)病機(jī)制,通訊作者,E-mail:zhangqingyong6th@126.com
10.3969/j.issn.1001-1978.2016.07.008
A
1001-1978(2016)07-0920-05
R-332;R322.11;R329.24;R341;R587.1;R977.15
網(wǎng)絡(luò)出版時(shí)間:2016-6-20 11:49網(wǎng)絡(luò)出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160620.1149.016.html