概念辨析及趣味焰色反應實驗的設計
束婷婷 丁偉
摘要:針對學生通常易將焰色反應與燃燒分屬物理變化和化學變化的概念混淆,從化學反應原理、反應現象等方面闡述了二者的本質區別。同時,設計了焰色反應的“魔燈”實驗,探討了焰色反應實驗的相關特點。
關鍵詞:焰色反應;燃燒;概念辨析;趣味實驗設計
文章編號:1005–6629(2016)6–0057–03 中圖分類號:G633.8 文獻標識碼:B
人們利用焰色反應有意識地在煙花、禮花中加入特定的金屬元素使焰火更加絢麗多彩,也讓我們的生活更加豐富多彩。西方化學史記載了德國化學家馬格拉夫在一次實驗中將碳酸鈉和碳酸鉀粉末分別撒在酒精燈火焰上,火焰迅速染成了黃色和紫色。而我國藥學家陶弘景早在1400多年前就明確指出:“以火燒之紫青煙起,云是真消石也。”其中消石的主要成分是硝酸鉀。后來人們逐漸將某金屬或其化合物在無色火焰中燃燒時呈現特征焰色的反應稱為“焰色反應”、“焰色測試”或“焰色試驗”。
焰色反應是中學化學中的一個重要實驗,其原理是某些金屬在火焰中灼燒時能使火焰呈現特征顏色。在教學中,教師常通過演示焰色反應實驗幫助學生理解檢驗金屬元素的特殊方法,同時實驗中新奇的現象也激發了學生對化學學習的興趣。值得思考的是:焰色反應為什么會帶來如此美妙的焰火?其生色原理是什么?與一般的燃燒有怎樣的不同?是否有簡便而有趣的實驗來展示焰色反應?本文將帶著這些問題進行細致的探討。
1 焰色反應與燃燒的概念辨析
由于焰色反應和燃燒均與火有關,因此學生極易將這兩個概念混淆,其原因在于不能從本質上認識到焰色反應屬于物理變化。因此,有必要對焰色反應和燃燒作一個較為詳細的區分,具體如表1所示[1]。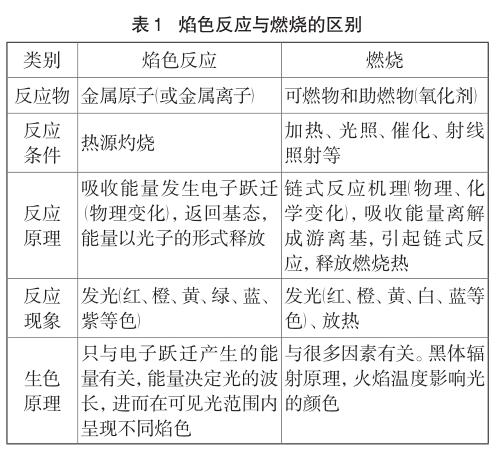
從上表可以看出,無論是反應物、反應條件,反應原理和反應現象等,焰色反應均與一般燃燒都有著顯著的區別。因此在課堂教學中,教師可以基于學生不同的認知水平從不同的角度引導學生將二者予以區分,以避免對其錯誤的認識。
2 焰色反應的原理闡釋
樣品物質在火焰中加熱形成氣態金屬原子,各種原子間運動速度加快,發生非彈性碰撞,外層電子獲得能量從基態躍遷至激發態,也有可能獲得能量先失去最外層電子變成離子,離子再從基態躍遷至激發態。激發態不穩定,電子又躍遷回基態或低能態,多余的能量以光的形式釋放出來。焰色反應中發生電子躍遷的主要是金屬原子還是金屬離子呢?
由于氣態金屬原子從基態躍遷至第一激發態所需的能量(可近似用軌道能級差估算)要比金屬原子失去一個電子成+1價陽離子所需的能量(第一電離能)要低,火焰加熱又為熱激發,能量不是很高,因而處于激發態的原子數目要比處于激發態的離子多。這一點可從熱力學角度進行分析證明。
以堿金屬鹵化物為例,從基態氣態原子到基態氣態離子過程的吉布斯自由能變ΔG可以通過如下公式得到:
ΔG=ΔH-TΔS=[I1+(-EA)]-T[S(M+,g,基態)+ S(X-,g,基態)-S(M,g,基態)-S(X,g,基態)]
式中I1為堿金屬第一電離能,EA為鹵素電子親和能;S(M,g,基態)、S(M+,g,基態)、S(X,g,基態)和S(X-,g,基態)分別為基態氣態金屬原子和金屬離子以及基態氣態鹵素原子和鹵素離子的熵。由于氣態金屬原子失去一個電子成為氣態金屬離子是混亂度增加過程,而氣態鹵素原子得到一個電子變為氣態鹵素離子是混亂度減小過程,兩個過程熵變可以大致相互抵消。因此,總熵變ΔS很小,在吉布斯自由能變ΔG中起主要作用的應該是焓變ΔH。理論計算得,ΔH>0,則ΔG>0,說明氣態原子較氣態離子穩定,堿金屬鹵化物主要分解為氣態原子。
由于金屬的原子結構不同,電子躍遷時能量的變化就不相同,從而發出不同波長的光。事實上,肉眼所觀察到的焰色是可見光范圍內不同波長的光的綜合結果。在光譜學上,不同波長的光表現出一系列的譜線,每種元素都有其特殊的譜線,而與原子的化合狀態及物質的聚集狀態無關。像鎂、鋁和銀等元素因在可見光區沒有譜線而展現出無特征的焰色[2]。不同焰色對應波長可根據λ=hc/ΔE(其中h為普朗克常數,c為光速,λ為光的波長)計算而得。我們可以據此計算出常見金屬原子對應的可見光區譜線波長及所呈焰色,如表2所示。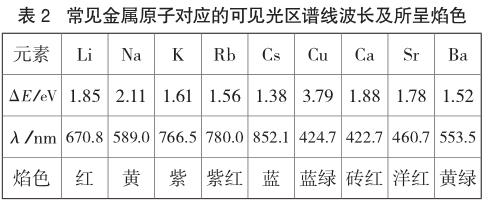
對于一些非金屬元素如F、Cl、Br、I、C、N、O等,由于核外電子躍遷需要吸收較高的能量,在火焰中不易被激發,且非金屬元素激發態原子的電子躍遷所產生的波長大多在200nm以下,位于遠紫外區。因此,進行焰色反應實驗時,F、Cl、Br、I、C、N、O等非金屬元素不會對金屬元素的鑒別產生干擾[3]。
3 趣味性焰色反應實驗的設計
焰色反應中產生的多種焰色給化學實驗帶來了一抹清新的色彩。多年來,教師按照教科書中“鉑絲蘸液酒精燈法”進行演示實驗操作,但實驗現象并不明顯,效果不甚理想。對此,不少研究者從反應儀器、加熱裝置或實驗操作上作相應改進,提出氫火焰噴壺法[4]、金屬離子酒精燈法[5]等十幾種方法,起到了一定的效果,但這些方法不是操作繁瑣就是設備要求高。本研究采用常見的低成本的生活用品代替鉑絲和酒精燈,制作燃燒裝置來進行焰色反應,稱之為“魔燈”實驗。通過簡單的實驗裝置進行焰色反應不僅現象明顯、操作簡便,而且安全高效,還能將各類金屬燃燒時的焰色形成鮮明對比。
3.1 實驗藥品和儀器
藥品:無水乙醇、蒸餾水、五水合硫酸銅晶體、氯化鈉固體、氯化鍶固體、硝酸鈣粉末、八水合氫氧化鋇晶體、硝酸鉀固體、六水合氯化鈷晶體
儀器:易拉罐(鋁制的汽水瓶)、棉簽(或化妝棉棒)
3.2 實驗內容
(1)制作燃燒器。準備兩個空的易拉罐,分別用剪刀沿橫截面剪開,棄去上半部分,將易拉罐下半部分修剪成高約2.5cm的圓盤。將其中一個圓盤底部挖一個直徑約4厘米的圓孔,且沿外邊緣用剪刀刺穿一排孔洞(大約11個,如圖1所示),然后將兩圓盤對合扣壓在一起,組裝成簡易的燃燒器。
圖2為制作燃燒器過程的簡筆圖。
(2)配制乙醇溶液。用量筒量取化學純的95%乙醇75mL,倒入潔凈的250mL燒杯中,加水稀釋至100mL(體積分數約為70%)備用。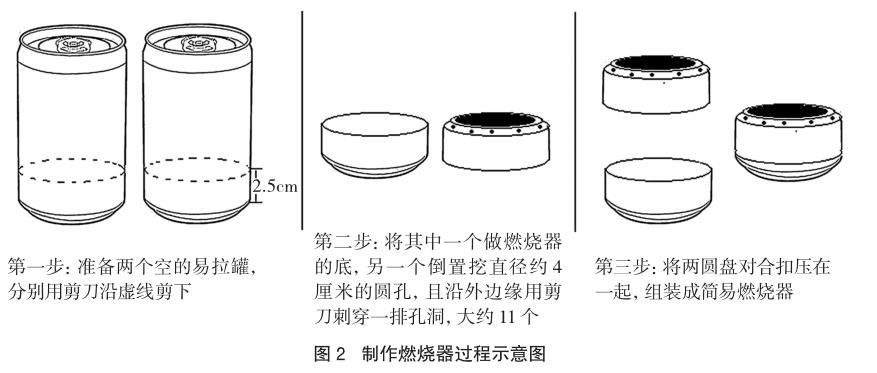
(3)配制鹽溶液。取上述新配制的體積分數為70%乙醇溶液10mL倒入50mL燒杯中,在玻璃棒攪拌下不斷加入五水合硫酸銅晶體,直至晶體不再溶解,配制成飽和溶液(其他金屬離子鹽溶液配制方法同上)。
(4)實驗環節。向圖1所示的燃燒器中加入30mL 70%乙醇溶液,火柴伸入圓孔點燃。用干凈棉簽蘸取飽和CuSO4乙醇溶液后,放置火焰中部灼燒,觀察現象。
點燃裝置后,燃燒器中乙醇溶液的火焰近乎無色透明,當用蘸有飽和CuSO4乙醇溶液的棉簽放入火焰中部時,火焰立刻呈現出一片藍綠色火焰,持續時間約30秒。同法,收集的所有金屬離子的焰色如圖3所示。
3.3 實驗分析討論
(1)從焰色反應的原理看,熱源的溫度無需太高,本實驗使用70%乙醇溶液作燃料燃燒時提供的能量完全能滿足灼燒供給的需要。
(2)本裝置中乙醇溶液燃燒火焰顏色極淺,可以排除酒精燈中鈉等元素和雜質焰色的干擾。實驗過程中火焰持續時間長(30秒以上),可見度大,并且可以進行對比及反復實驗。
(3)鋁制易拉罐燃燒器耐高溫,火焰覆蓋面大,確保金屬原子被充分灼燒。棉簽蘸取鹽溶液時,吸附量比玻璃棒大得多,實驗現象非常明顯。
(4)實驗燃燒裝置是生活中廢棄的易拉罐,成本低,清洗時能直接用水沖洗,操作簡便安全,綠色環保,且可進行家庭實驗。
參考文獻:
[1]趙志國.燃燒本質、燃燒條件與火災危險隱患的辨識[J].教育技術,2011,(5):12~13.
[2]陳曉峰.淺析焰色反應[J].大學化學,2013,(10):77~79.
[3]陸燕海,林肅浩.對焰色反應認識的補正[J].中學化學教學參考,2013,(5):46~48.
[4]王美志.焰色反應的趣味性實驗設計[J].化學教育,2013,(7):80~83.
[5]李明立,曹廣雪.利用固體酒精進行的焰色反應[J].教學儀器與實驗,2013,(12):28~29.
[6]王儀輝.焰色反應演示實驗的改進[J].化學教與學,2014,(6):96.
[7]李嘉.利用無紡布巧做焰色反應實驗[J].化學教學,2013,(11):71~72.
[8]陳軍.焰色反應實驗的改進[J].實驗教學與儀器,2013,(6):26.
[9]羅鵬,謝巧兵,顧緒平.針尖上的焰色反應[J].化學教育,2015,(9):61~62.

