誘導痰細胞分類在重疊綜合征患者中的表達
周鋒 劉錦銘 杜春玲 段艷紅 周紅 孫穎新 蔡曉婷 谷亮
?
誘導痰細胞分類在重疊綜合征患者中的表達
周鋒劉錦銘杜春玲段艷紅周紅孫穎新蔡曉婷谷亮
目的探討阻塞性睡眠呼吸暫停低通氣綜合征(OSAHS)合并慢性阻塞性肺疾病(COPD)的重疊綜合征(OS)患者氣道炎癥反應情況。方法入選49例受試者分成3組,OS組18例、COPD組15例、OSAHS組16例,另設20例正常對照組,分別完成體質量指數(BMI)測定、肺功能檢查、多導睡眠圖(PSG)監測、誘導痰細胞分類檢測等,并比較4組水平的差異。結果OS組與OSAHS組的BMI高于正常對照組和COPD組,差異有統計學意義(P<0.05);OS組與OSAHS組的呼吸暫停低通氣指數(AHI)明顯高于正常對照組和COPD組,差異有統計學意義(P<0.05);OS組和COPD組的FEV1%pred明顯低于正常對照組和OSAHS組,差異有統計學意義(P<0.05);OS組的動脈血氧分壓(PaO2)明顯低于其他3組水平,差異有統計學意義(P<0.05)。OS組的嗜中性粒細胞百分比明顯高于其他3組,差異均有統計學意義(P<0.05);OSAHS組與COPD組的嗜中性粒細胞百分比都明顯高于正常對照組,差異均有統計學意義(P<0.05)。49例受試者嗜中性粒細胞相對計數水平與PaO2呈低度負相關(r=-0.22,P<0.05),與FEV1%pred呈中度負相關(r=-0.48,P<0.05)。結論OS患者氣道炎癥反應更加強烈,易引起更為嚴重的通氣功能障礙,間歇性低氧血癥更為明顯。誘導痰細胞分類計數檢測有助于反映OS患者氣道炎癥病變情況。
阻塞性睡眠呼吸暫停低通氣綜合征; 慢性阻塞性肺疾病; 重疊綜合征; 氣道炎癥; 間歇性低氧血癥
慢性阻塞性肺疾病(COPD)是由阻塞性肺通氣功能障礙所引起的疾病,它與肺部或氣道內的異常炎癥反應有關,其中嗜中性粒細胞、巨噬細胞、T淋巴細胞等慢性炎癥細胞因子均參與了COPD的炎癥反應過程[1]。阻塞性睡眠呼吸暫停低通氣綜合征(OSAHS)的直接發病機制為上氣道的狹窄和阻塞[2]。近來的一些研究表明,OSAHS患者也存在局部和全身性的炎癥反應。Rubinstein等[3]發現在OSAHS患者的鼻黏膜中嗜中性粒細胞的比例明顯增加。COPD存在有合并OSAHS的情況發生,我們稱之為重疊綜合征(overlap syndrome, OS)[4]。OS在≥40歲的成年人群中的發病率約為0.5%~1%,較單獨的COPD患者或OSAHS患者更易出現低氧血癥和高碳酸血癥,也更容易誘發心力衰竭等一系列全身癥狀[5]。本研究通過誘導痰細胞分類檢測,調查OS患者的氣道炎癥反應情況,并與單純COPD患者及OSAHS患者的氣道炎癥反應情況作比較,為進一步相關研究提供理論依據。
1 對象與方法
1.1對象OSAHS組:選擇2014年2月至2015年1月上海市青浦區中心醫院呼吸內科門診就診的OSAHS患者,進行多導睡眠圖(polysomnography, PSG)[6]監測,入選16例患者,男12例,女4例,年齡57~75歲,平均(58.5±7.2)歲。OSAHS診斷根據2011 年中華醫學會呼吸病學分會睡眠呼吸病學組制定的OSAHS 診治指南[7]。排除有酗酒、慢性鎮靜藥物使用史、患有可能影響睡眠行為的急性疾病(如呼吸、腎臟、肝臟、腦卒中、心臟等系統疾病)或危重疾病,并且除外合并COPD的情況。COPD組和OS組:選擇2014年2月至2015年1月上海市青浦區中心醫院呼吸內科門診和院外隨訪的COPD穩定期患者33例,男23例,女10例,年齡58~78歲,平均(65.8±11.2)歲,診斷符合中華醫學會呼吸病學分會制定的“慢性阻塞性肺疾病診治指南(2007年修訂版)”[8]。排除急性疾病(如呼吸、腎臟、肝臟、腦卒中、心臟等系統疾病)或危重疾病,并且除外COPD急性加重的情況。同時應用PSG監測,從33例穩定期COPD患者中篩查出合并有OSAHS的患者18例,作為OS組,年齡58~76歲,平均(64.9±10.2)歲。15例單純的穩定期COPD患者作為COPD組,年齡62~78歲,平均(66.1±11.9)歲。對照組為上海市青浦區中心醫院健康體檢者20例,男12例,女8例,年齡55~70歲,平均(57.4±4.8)歲。4組間年齡、性別以及患有糖尿病、高血壓等慢性疾病情況比較,差異無統計學意義(P>0.05),具有可比性。所有受試者及志愿者均簽署知情同意書,并經上海市青浦區中心醫院倫理委員會審查通過。
1.2檢測方法
1.2.1體質量指數(BMI):測量患者身高與體質量,按照公式:BMI=體質量/身高2(kg/m2) 計算BMI。
1.2.2肺功能檢查(pulmonary function test, PFT):采用德國Jaeger Pet肺功能檢測儀給所有入選對象進行常規肺功能檢測,測試前輸入受試者的身高、體質量、年齡等參數,常規吸入沙丁胺醇氣霧劑后進行操作,測定用力肺活量(FVC)、第1秒用力呼氣容積(FEV1)、FEV1/FVC%,上述指標分別以占預計值百分比(%pred)表示,為FVC%pred、FEV1%pred、FEV1/FVC%pred。并于肺功能檢查前予動脈血氣分析(arterial blood gas, ABG)檢查。
1.2.3PSG監測:所有入選患者至我院行整夜PSG監測(監測儀器Alice4,美國Respironics公司生產)。監測參數包括腦電圖、眼電圖、下頜和腿部肌電圖、鼻腔口鼻氣流、胸腹部和腿部運動、心電圖、指脈儀測血氧飽和度及體位。麥克風置于頸部記錄鼾音[6]。OSAHS 病情嚴重程度分級:呼吸暫停低通氣指數(AHI) 5~15次/h為輕度,AHI 15~30次/h為中度,AHI>30次/h為重度[7]。
1.2.4誘導痰細胞分類檢測:誘導痰細胞檢測方法采用ERS推薦的方案[9]。(1)痰液的誘導:誘導前10 min讓患者吸入沙丁胺醇氣霧劑, 以防止高滲鹽水霧化吸入引起的氣道痙攣。常用的鹽水霧化程序采用單一濃度法,用4%或4.5%濃度的高滲鹽水進行誘導。(2)痰液的處理:采用選取法,即挑選痰栓或痰的黏稠部分進行處理;通常加入和痰液等體積的0.1%二硫蘇糖醇(DTT)將痰的黏液裂解,使細胞均勻分布。均勻化的痰液經48 μm尼龍網過濾后,牛鮑氏計算板計數每毫升痰的總細胞數,臺盼藍染色法測定細胞存活率, 濾液離心300~1500 g,5~10 min,留取上清液,-80 ℃凍存待測,細胞沉淀涂片后行染色, 光鏡下對400個以上的非上皮細胞進行分類計數。
2 結果
2.14組對象睡眠監測、肺功能、動脈血氣指標及BMI比較OS組與OSAHS組的BMI高于正常對照組和COPD組,差異有統計學意義(P<0.05)。OS組與OSAHS組的AHI明顯高于正常對照組和COPD組,差異有統計學意義(P<0.05)。OS組和COPD組的FEV1%pred明顯低于正常對照組和OSAHS組,差異均有統計學意義(P<0.05)。OS組的動脈血氧分壓(PaO2)明顯低于其他3組,差異有統計學意義(P<0.05),見表1。
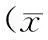
表1 4組資料睡眠監測、肺功能、動脈血氣指標及BMI比較±s)
注:與OS組比較,*P<0.05;與COPD組比較,△P<0.05;與OSAHS組比較,#P<0.05
2.24組誘導痰細胞分類相對計數水平比較誘導痰細胞分類相對計數中,OS組的嗜中性粒細胞百分比明顯高于其他3組,差異均有統計學意義(P<0.05);OSAHS組與COPD組比較,差異無統計學意義(P>0.05);但OSAHS組與COPD組的嗜中性粒細胞百分比都明顯高于正常對照組,差異均有統計學意義(P<0.05)。另外,OS組、COPD組、OSAHS組3組的巨噬細胞百分比均明顯低于正常對照組,差異有統計學意義(P<0.05);而3組間互相比較,巨噬細胞百分比差異無統計學意義(P>0.05)。見表2。
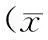
表2 4組誘導痰細胞分類相對計數水平比較±s,%)
注:與OS組比較,*P<0.05;與正常對照組比較,△P<0.05
2.349例受試者嗜中性粒細胞相對計數水平與睡眠監測、肺功能、動脈血氣指標及BMI的相關性分析49例受試者嗜中性粒細胞相對計數水平與PaO2呈低度負相關(r=-0.22,P<0.05),與FEV1%pred呈中度負相關(r=-0.48,P<0.05)。而與BMI和AHI無明顯相關性(P>0.05)。
3 討論
誘導痰細胞分類計數是指通過高滲鹽水或其他誘導物霧化吸入誘導獲得痰液并對其中的非上皮細胞進行分類計數的方法。該方法具有經濟、無創、快速、可靠等優勢。通常誘導痰中細胞的分類主要以巨噬細胞和嗜中性粒細胞為主,淋巴細胞次之,偶見嗜酸性粒細胞和異染細胞(嗜堿性粒細胞、肥大細胞)[10]。目前研究表明,誘導痰中細胞分類與肺部疾病中炎性病變的發生演變有著極其重要的關系。利用誘導痰細胞分類計數可以客觀、快速地反映肺部炎癥情況[11-12]。
本研究結果表明,在COPD患者中,與嗜中性粒細胞相關的炎癥介質引起了氣道平滑肌的結構和功能改變,從而導致了COPD患者外周氣道的阻塞,致阻塞性通氣功能障礙,導致呼吸道氣流受限。相關研究結果也佐證了上述發現,無論是在穩定期COPD患者還是在急性發作期COPD患者中,其誘導痰細胞分類抑或是氣道肺泡灌洗液中嗜中性粒細胞的分類計數均明顯升高[13-14]。另外,在目前的研究中,氣道和全身炎癥細胞產生的嗜中性粒細胞趨化因子正作為COPD的研究熱點及新的治療靶位而備受關注。這其中,IL-8和白三烯B4(LTB4)是嗜中性粒細胞趨化因子家族中的主要組成成分,目前認為,IL-8、LTB4參與了嗜中性粒細胞在呼吸道的募集和活化,導致細胞變形反應、脫顆粒反應、呼吸爆發反應、釋放溶酶體、形成超氧化物[15-16]。
研究結果還表明,OS組患者嗜中性粒細胞分類計數的百分比,明顯高于COPD組和OSAHS組。這說明,由于OS是OSAHS合并COPD所產生,OS同時存在上氣道和外周氣道的阻塞,其氣道炎癥反應更加強烈。在同類研究中,Owens等[17]研究發現無論COPD還是OSAHS患者,炎性因子水平均明顯升高,表明COPD和OSAHS炎性分子通路有相似性,而OS可能存在炎性分子的倍增效應。
另外,本研究還發現,嗜中性粒細胞相對計數水平與PaO2呈低度負相關(r=-0.22,P<0.05),表明嗜中性粒細胞介導的炎癥因子在參與氣道炎癥反應的過程中,造成了相關疾病的間歇性低氧血癥的發生,特別是在OS患者中同時存在上氣道和外周氣道的阻塞,其氣道炎癥反應更加強烈,易引起更為嚴重的通氣功能障礙,間歇性低氧血癥更為明顯,其所造成的不良后果亦更為嚴重。Dewan等[18]的研究佐證了上述發現。
綜上所述,誘導痰細胞分類計數在COPD、OSAHS及OS等疾病的診斷、鑒別診斷以及治療中有著重要的指導意義。本研究的創新性在于:通過誘導痰細胞分類計數了解OS患者氣道炎癥反應情況,探討了誘導痰細胞分類計數的應用價值。但本研究由于樣本量較少,且存在一定的年齡混雜因素,故有一定的局限性,尚需更大樣本的臨床研究來進一步闡釋OS患者的氣道炎癥反應情況。
[1]Rabe KF, Hurd S, Anzueto A, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary [J]. Am J Respir Crit Care Med, 2007, 176(6):532-555.
[2]Ryan S, Taylor CT, McNicholas WT. Predictors of elevated nuclear factor-kappaB-dependent genes in obstructive sleep apnea syndrome [J]. Am J Respir Crit Care Med, 2006,174(7):824-830.
[3]Rubinstein I. Nasal inflammation is present in patients with obstructive sleep apnea [J]. Laryngoscope,1995,105(2):175-177.
[4]Weitzenblum E, Chaouat A, Kessler R, et al. Overlap Syndrome: obstructive sleep apnea in patients with chronic obstructive pulmonary disease [J]. Proc Am Thorac Soc,2008,5(2):237-241.
[5]Chaouat A, Weitzenblum E, Krieger J, et al. Association of chronic obstructive pulmonary disease and sleep apnea syndrome [J]. Am J Respir Crit Care Med,1995,151(1):82-86.
[6]Sleep-related breathing disorders in adults: recommendations for syndrome definition and measurement techniques in clinical research. The report of an American Academy of Sleep Medicine Task Force[J]. Sleep, 1999,22(5):667-689.
[7]中華醫學會呼吸病學分會睡眠呼吸障礙學組.阻塞性睡眠呼吸暫停低通氣綜合征診治指南(2011 年修訂版)[J].中華結核和呼吸雜志, 2012, 35(1): 9-12.
[8]中華醫學會呼吸病學分會,慢性阻塞性肺疾病學組.慢性阻塞性肺疾病診治指南(2007年修訂版)[J].中華結核和呼吸雜志,2007,30(1):8-17.
[9]Paggiaro PL, Chanez P, Holz O, et al. Sputum induction [J]. Eur Respir J Suppl, 2002,37:3s-8s.
[10]Spanevello A, Confalonieri M, Sulotto F, et al. Induced sputum cellularity: reference values and distribution in normal volunteers [J]. Am J Respir Crit Care Med, 2000,162(3 Pt 1):1172-1174.
[11]Liu QQ, Chen SH, Liang MB, et al. Induced sputum eosinophil count for the diagnosis of bronchial asthma [J]. Saudi Med J, 2010,31(6):710-712.
[12]Holownia A, Mroz RM, Kolodziejczyk A, et al. Increased FKBP51 in induced sputum cells of chronic obstructive pulmonary disease patients after therapy [J]. Eur J Med Res, 2009,14 (Suppl 4):108-111.
[13]Peleman RA, Rytil? PH, Kips JC, et al. The cellular composition of induced sputum in chronic obstructive pulmonary disease [J]. Eur Respir J, 1999,13(4):839-843.
[14]Lacoste JY, Bousquet J, Chanez P, et al. Eosinophilic and neutrophilic inflammation in asthma, chronic bronchitis, and chronic obstructive pulmonary disease [J]. J Allergy Clin Immunol, 1993,92(4):537-548.
[15]Woolhouse IS, Bayley DL, Stockley RA. Sputum chemotactic activity in chronic obstructive pulmonary disease: effect of alpha(1)-antitrypsin deficiency and the role of leukotriene B(4) and interleukin 8 [J]. Thorax, 2002,57(8):709-714.
[16]Biernacki WA, Kharitonov SA, Barnes PJ. Increased leukotriene B4 and 8-isoprostane in exhaled breath condensate of patients with exacerbations of COPD [J]. Thorax, 2003,58(4):294-298.
[17]Owens RL, Malhotra A. Sleep-disordered breathing and COPD: the overlap syndrome[J]. Respir Care, 2010,55(10):1333-1344.
[18]Dewan NA, Nieto FJ, Somers VK. Intermittent hypoxemia and OSA: implications for comorbidities [J]. Chest, 2015,147(1):266-274.
Expression of induced sputum cell in patients with overlap syndrome
ZHOUFeng,DUChun-ling,DUANYan-hong,ZHOUHong,SUNYing-xin,CAIXiao-ting,GULiang.
DepartmentofRespiratoryDiseases,QingpuCentralHospital,Shanghai201700,China;LIUJin-ming.DepartmentofPulmonaryCirculation,ShanghaiPulmonaryHospitalAffiliatedtoTongjiUniversity,Shanghai200433,China
ObjectiveTo explore the airway inflammation situation in patients with overlap syndrome(OS) through detecting induced sputum cell.MethodsForty-nine patients were recruited and divided into three groups, including OS group (n=18), COPD group (n=15) and OSAS group (n=16), and 20 normal subjects were selected as control group. Body mass index(BMI), pulmonary function test(PFT), arterial blood gas(ABG),sputum induction and polysomnography were detected and compared.ResultsBMI was higher in OS group and OSAHS group, compared with COPD group and control group (P<0.05). AHI was much higher in OS group and OSAHS group than that in COPD group and control group (P<0.05). However, FEV1%pred was much lower in OS group and COPD group than that in OSAHS group and control group (P<0.05). PaO2in OS group was the lowest (P<0.05). The percentage of neutrophils in induced sputum was higher in OS group(74.33±14.80,P<0.05), COPD group(63.33±13.22,P<0.05) and OSAS group(60.69±17.06,P<0.05) compared with control group. A weak negative correlation was found between PaO2and percentage of airway neutrophils (r=-0.22,P<0.05). A moderate negative correlation was found between FEV1%pred and percentage of airway neutrophils (r=-0.48,P<0.05).ConclusionsPatients suffering from OS present a higher percentage of neutrophils in induced sputum than those suffering from COPD or OSASHS alone. It means that OS induces more adverse airway inflammation because of coexistence of upper and peripheral airway obstruction. It would result in more significant intermittent hypoxemia.
obstructive sleep apnea-hypopnea syndrome; chronic obstructive pulmonary disease; overlap syndrome; airway inflammation; intermittent hypoxemia
201700上海市,上海市青浦區中心醫院呼吸內科(周鋒,杜春玲,段艷紅,周紅,孫穎新,蔡曉婷,谷亮);200433上海市,同濟大學附屬上海市肺科醫院肺循環科(劉錦銘)
劉錦銘,Email: jinmingliu2007@163.com
R 563
Adoi:10.3969/j.issn.1003-9198.2016.06.009
2015-10-20)

