血清淀粉樣蛋白A與大動脈粥樣硬化型腦梗死病人頸動脈斑塊穩定性的相關性研究
賈文輝,胡風云,陳文軍,楊曉文,來春林
?
血清淀粉樣蛋白A與大動脈粥樣硬化型腦梗死病人頸動脈斑塊穩定性的相關性研究
賈文輝,胡風云,陳文軍,楊曉文,來春林
目的通過檢測大動脈粥樣硬化型腦梗死(LAA)病人與健康對照者的血清淀粉樣蛋白A(SAA)水平,探討SAA與頸動脈斑塊穩定性的關系。方法分別檢測病例組(30例)、對照組(54例)病人SAA水平,病例組行頸動脈彩色多普勒超聲檢查,評估頸動脈斑塊穩定性。結果病例組血清SAA水平高于對照組(P<0.05);不穩定斑塊組血清SAA水平明顯高于穩定斑塊組(P<0.05)。結論SAA參與動脈粥樣硬化過程,可反映大動脈粥樣硬化型腦梗死病人的頸動脈斑塊穩定性。
大動脈粥樣硬化型腦梗死;血清淀粉樣蛋白A;頸動脈斑塊;動脈粥樣硬化;相關性
血清淀粉樣蛋白A(SAA)于2008年由Bozinovski等[1]報道,是一種重要的急性時相蛋白,炎癥反應時由肝臟細胞大量合成分泌,5 h~6 h內可升高1 000倍,是反映炎癥的一個敏感性指標之一。SAA作為一種敏感的炎性標志物,參與動脈粥樣硬化的形成,發展和產生不穩定性,最終破裂的各個階段。目前在亞洲地區腦梗死病人頸動脈斑塊檢出率明顯高于世界其他各大洲地區,大量研究證實頸動脈斑塊不穩定可引起斑塊脫落,造成腦梗死,因此研究頸動脈斑塊及其穩定性對于防止斑塊破裂,預防腦梗死有重要意義。本研究直接選取明確病因的腦梗死病人,通過血清SAA水平的測定,探究SAA是否可作為腦梗死病人頸動脈斑塊穩定性的標志物。
1 資料與方法
1.1一般資料2012年1月—2014年12月連續入住山西省人民醫院神經內科的100例急性腦梗死病人,經TOAST病因分型為大動脈粥樣硬化型腦梗死(LAA)病人30例,其中男20例,女10例,年齡(62.37±14.11)歲,選取年齡、性別相匹配的健康體檢者54名為對照組。
1.2診斷標準所有腦梗死病例均符合中國急性缺血性腦卒中診治指南2010所制定的腦梗死診斷標準[2],經頭顱磁共振成像(MRI)證實;腦梗死首次發病;發病72 h內入院;參考TOAST病因分型[3]為大動脈粥樣硬化型腦梗死。
1.3排除標準急慢性炎癥性病變,痛風,自身免疫性疾病,肝腎疾病,甲狀腺疾病,糖尿病,近期手術或創傷,心臟瓣膜病,心功能不全,腫瘤病史,出血性腦梗死,凝血功能障礙及大動脈炎所致腦梗死。
1.4方法
1.4.1標本檢測方法所有研究對象均于入院后次日清晨空腹抽取靜脈血,離心分離血清,酶聯免疫吸附測定法(ELISA )檢測血清SAA濃度,二等分置于EP管中在-80 ℃冰箱中保存,標本采集完成后一次性批量檢測,測定時保證試劑批號一致,按照試劑盒說明書進行操作。
1.4.2頸動脈彩色多普勒超聲檢查病例組病人均進行頸動脈彩色多普勒超聲檢查,受檢者采取仰臥位,充分暴露頸前部,頸后墊枕,頭后仰,并偏向檢查對側,先進行橫切探測:將探頭置于頸根部,依次檢查頸總動脈、頸內動脈及頸外動脈,盡可能探查至頸部最高點,觀察動脈走行,頸動脈內中膜厚度(IMT)、斑塊及血管狹窄等。縱切探測:當頸前部探測頸動脈顯示欠佳時,將探頭置于胸鎖乳突肌后緣,采用后側位來觀察。斑塊形成定義:當IMT≥1.5 mm,凸出于血管腔內,或局限性內膜增厚高于周邊IMT的50%。斑塊分型方法:通過對斑塊的形態學、內部回聲、表面纖維帽的完整性、是否潰瘍形成等綜合分析評價。穩定斑塊:形態規則,高回聲或等回聲,無潰瘍;不穩定斑塊:形態不規則,低回聲、混合回聲,潰瘍斑塊[4]。
2 結 果
2.1兩組一般資料比較(見表1)病例組與對照組的性別、年齡、吸煙、飲酒史及體重指數(BMI)差異均無統計學意義(P>0.05)。

表1 兩組一般資料比較
2.2兩組血脂、空腹血糖、尿酸、白細胞計數比較病例組與對照組的總膽固醇(TC)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、血尿酸(UA)、白細胞計數(WBC)水平差異無統計學意義(P>0.05),三酰甘油(TG)、空腹血糖(FPG)水平差異有統計學意義(P<0.05)。詳見表2。
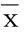
表2 兩組的血脂、空腹血糖、尿酸、白細胞計數比較(±s)
2.3兩組的血清SAA水平比較(見表3)病例組血清SAA水平明顯高于對照組,差異有統計學意義(P<0.05)。
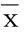
表3 兩組血清SAA水平比較(±s) ng/L
2.4穩定斑塊組與不穩定斑塊組的血清SAA水平比較不穩定斑塊組血清SAA水平明顯高于穩定斑塊組,差異有統計學意義(P<0.05)。詳見表4。
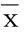
表4 各組血清SAA水平比較(±s) ng/L
3 討 論
動脈粥樣硬化(AS)目前是腦梗死主要病因。大量研究已證實:AS形成與發展的全過程均與炎癥反應有關。SAA作為一種新型敏感的炎性標志物,在炎癥反應時,SAA與LDL-C形成SAA/LDL復合體,誘導內皮細胞黏附因子產生,使巨噬細胞與血管內膜結合,形成早期動脈粥樣硬化斑塊[5];還通過替換HDL-C上的載脂蛋白A-I(ApoA-I),與HDL-C形成SAA/HDL-C復合體,減少膽固醇的逆轉運及清除,轉運膽固醇到巨噬細胞內,增高了斑塊脂質池中膽固醇和游離膽固醇的濃度,導致脂質硬度下降,從而使斑塊不穩定性增加,因此SAA參與了AS的形成和發展,促進動脈粥樣斑塊形成。與國外多項研究[6-7]一致,本研究結果同樣顯示病例組血清SAA水平明顯高于對照組,從而證實SAA參與AS產生、發展至血栓形成。
SAA還通過誘導基質金屬蛋白酶的表達,使纖維帽中細胞外基質的降解加快,導致纖維帽破裂,從而破壞粥樣硬化斑塊的穩定性[5],可用來識別AS不穩定斑塊。ICARAS研究[8]通過對1 268例病人頸動脈超聲連續觀察隨訪,結果顯示:SAA與AS進展呈顯著相關,頸動脈硬化斑塊的進展與SAA存在密切的相關性,SAA可以作為AS進展及不穩定斑塊的標志物。國外研究[6-7]證實:SAA與動脈硬化斑塊破裂及血栓形成有關,為反映動脈粥樣硬化斑塊穩定性的重要標志物。本研究結果顯示:不穩定斑塊組的血清SAA水平明顯高于穩定斑塊組,差異有統計學意義(P<0.05)。這表明血清SAA與頸動脈斑塊穩定性密切相關,在臨床上可用來早期識別不穩定斑塊,幫助病人早期采取有效措施,減少腦梗死事件的發生。
[1]Bozinovski S,Hutchinson A,Thompson M,et al.Serum amyloida is a biomarker of acute exacerbations of chronic obstructive pulmonary disease [J].Am J Respir Crit Care Med,2008,177 (3):269-278.
[2]中華醫學會神經病學分會腦血管病學組急性缺血腦卒中診治指南撰寫組.中國急性缺血性腦卒中診治指南2010[J].中華神經科雜志,2010,43:147-148.
[3] Adams HP,Bendixen BH,Kappelle LJ,et al.Classification of subtype of acute ischemic stroke.Definition for use in a multiceuter clinical trial.TOAST.Trial of org 10172 in Acute Stroke Treat
ment[J].Stroke,1993,24(1):35-41.
[4]華揚.腦卒中高危人群的血管超聲篩查與治療評估[J].中國腦卒中防治,2011,1(3):56-57.
[5]Carty CL,Heagerty P,Heckbert SR,et al.Association of genetic variation in serum amyloid-A with cardiovascular disease and interactions with the IL6,IL1RN,IL1β and TNF genes in the Cardiovascular Health Study [J].J Atheroscler Thromb,2009,16(4):419-430.
[6]King VL,Thompson J,Tannock LR.Serum amyloid A in atherosclerosis[J].Curr Opin Lipidol,2011,22(4):302-307.
[7]Werba JP,Veglia F,Amato M,et al.Patients with a historty of stable or unstable coronary heart disease have different acute phase responses to an inflammatory stimulus [J].Atherosclerosis,2008,196(2):835-840.
[8]Sehillinger M,Exner M,Lekusch W,et al.Inflammalion and carotid artery risk for atherosclerosis study(ICARAS)[J].Cirenlation,2005,111(17):2203-2209.
(本文編輯郭懷印)
山西省科技廳科技攻關項目(No.20120313018-8);山西省衛計委科技攻關項目(No.201201060)
山西省人民醫院(太原 030012)
胡風云,E-mail:fengyun71@163.com
R741R255.2
Bdoi:10.3969/j.issn.1672-1349.2016.14.033
1672-1349(2016)14-1664-03
2016-03-25)

