我國生化藥品的質量現狀與展望
任麗萍,范慧紅
(中國食品藥品檢定研究院,北京 100050)
我國生化藥品的質量現狀與展望
任麗萍,范慧紅Δ
(中國食品藥品檢定研究院,北京 100050)
結合2008~2015年國家藥品質量分析報告,就我國生化藥品的質量現狀和存在的一些共性質量問題進行了概述,并結合工作實踐對今后我國生化藥品的質控方向及展望提出了自己的看法。
藥品質量;生化藥品;質量控制;質量評價
作為我國醫藥產品的一個大類,生化藥品具有針對性強、毒性低、不良反應小、易為人體吸收等特點,在臨床上應用廣泛,對防治疾病發揮著重要的作用。尤其對于嚴重危害人類健康和生命的疾病,如心腦血管病、癌癥、糖尿病和病毒疾患等有其獨特的治療效果。按臨床需求,生化藥品正在醫藥領域逐漸形成規模化、系列化及醫療上的專門化。隨著藥品監管的日益嚴格,當前個別生化藥品企業的原輔料的供應鏈問題、起始原料的質量控制問題等頻頻曝光,引發了公眾對生化藥品的關注和重新認識。了解并認清我國生化藥品的質量現狀及存在的問題,對生化制藥行業的發展具有重要的意義。
1 生化藥物的定義及范圍
生化藥物是指從生物體分離、純化所得,用于預防、治療和診斷疾病的生化基本物質,以及用化學合成或現代生物技術制得的一類藥物[1]。生化藥物來源于生物體,即來源于動物、植物、微生物,但生化藥物不包括抗生素和疫苗、菌苗、類毒素、抗毒素等生物制品。也不包括從植物中提取純化所得的生物堿、有機酸等[2]。
傳統的生化藥物主要包括氨基酸及衍生物、多糖、酶及輔酶、脂類、多肽與蛋白、核苷酸及衍生物、多組分提取物共七大類。多組分提取物特指來源復雜、物質基礎尚不明確,但又具有一定生物活性的生化藥物。隨著對藥品生產要求的日趨嚴格和藥品質控水平的不斷提高,多組分提取物的有效性和安全性有待進一步深入研究確證。
2 生化制藥工業的發展
我國生化制藥工業的發展歷經了從畜禽資源綜合利用階段、臟器生化制藥階段到形成完善的生化制藥工業體系[3]。60多年來,生化制藥工業逐漸成為醫藥行業的一個重要組成部分。2014~2015年,我國生化藥的出口貿易均保持了穩定的增長[4-5]。肝素、玻璃酸、硫酸軟骨素、尿激酶、輔酶A等品種一直居于出口的生化藥前列,在國際上占有重要地位[6]。隨著生物技術的不斷發展以及產業不斷升級,我國生化制藥工業的產品結構日趨合理,技術水平不斷提高、生產結構規模逐漸擴大,個別品種在國際同行業中處于不可取代的位置,實現了規模經濟效益。
3 生化藥品的質控特點
生化藥品來源的特殊性和具有一定的生物活性,使其質量控制不同于一般的化學藥品,有以下特點:由于生化藥品來源的多樣性,導致雜質譜具有一定的特殊性和復雜性,使標準研究、制訂的難度加大,多學科知識、技術得以在生化藥品標準中得到應用和體現;由于生化藥品結構的復雜性,有效成分的結構或相對分子量不確定,其結構的確證很難沿用元素分析、紫外、紅外、核磁、質譜等方法加以證實,往往還要用生物化學特殊方法加以證實;很多生化藥品具有生物活性,在制備多肽、蛋白質類藥物時,工藝條件的稍許變化,可能導致其生物活性的改變甚至失活,除用通常的理化方法檢驗外,還需測定其生物活性;由于生化藥品性質的特殊性、工藝復雜、易引入特殊雜質,為保證臨床用藥的安全,需進行熱原、降壓物質、異常毒性、過敏反應等安全性檢查。
4 我國生化藥品質量現狀
4.1 國家基本藥物目錄收載情況 國家基本藥物目錄2012年版收載的317個化學藥品和生物制品中,共有28種生化藥品,涉及18個臨床藥理學分類,占所有25個分類的72%,國家基本藥物目錄中生化藥品的收載情況表明生化藥品是我國臨床用藥不可或缺的一部分[7]。具體收載情況見表1。

表1 國家基本藥物目錄(2012年版)收載的生化藥品統計Tab.1 Biochemical drugs in national essential medicine list (2012 edition)
4.2 我國生化藥品質控概況 我國生化藥品的法定標準分為以下幾類:即藥典標準、國家藥品標準(第九冊、十六冊)、《衛生部藥品標準》二部第六冊-生化藥品第一分冊、新藥轉正標準、企業注冊標準。對自2005年版以來中國藥典收載的生化藥品按照不同分類進行統計[8-10],所收載的品種數和標準數逐步增加,與2010年版相比,2015年版收載的生化藥品總數增加近20%,收載了共84個品種222個標準。具體收載情況見表2(括號內為品種數)。
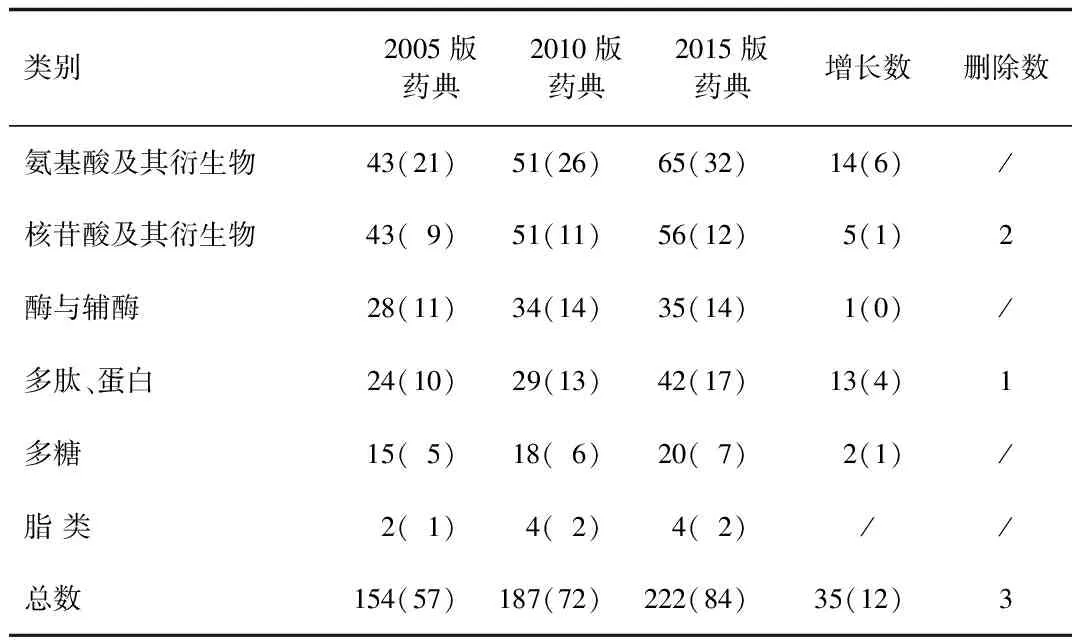
表2 中國藥典收載的生化藥品統計
盡管歷版中國藥典所收載的生化藥品的品種數和標準數穩中有升,但生化藥品標準的整體水平參差不齊,特別是部分地方標準標升入國家標準的品種,如部分多組分提取物注射劑,限于當時的審批要求,該類品種質控水平較低,其質量標準的合理性以及可行性還有待進一步商榷,為保證藥品的安全性和有效性,這類品種的生產企業需進一步優化處方工藝并提高完善標準。
4.3 我國生化藥品質量分析主要手段及國抽品種遴選原則 國家評價性抽驗(以下簡稱“國抽”)是近年來我國生化藥品質量分析的主要途徑,是在常規法定檢驗的基礎上,增加與藥品上市后安全、有效性相關的研究性檢驗,開辟了我國上市后藥品質量與安全相關性研究的新領域。通過評價性抽驗為藥品的市場監管提供技術支撐,為生產企業改進工藝、提高藥品質量、降低使用風險提供技術指導。藥品的質量評價分析主要涉及處方工藝、藥品的功能特性、穩定性、質量標準、標準物質、檢驗方法及臨床的不良反應等[11-12]。
生化藥品國抽品種遴選的原則主要有2個,一是臨床應用范圍廣的品種,這類品種多是基本藥物目錄或藥典收載的品種;二是一些高風險的品種,如多組分提取物類、大容量注射劑、穩定性差的品種,藥品質量標準較低、或是臨床不良反應風險較高的品種。自2008年國家開始實施評價性抽驗工作以來,基本實現了基本藥物目錄中收載的生化藥品種全覆蓋。
4.4 國抽生化藥品抽驗樣品概況 根據歷年國抽生化藥品質量分析報告統計,2008~2015年國家評價性抽驗共涉及67個、83次生化藥品品種,完成了總計10 018批次的檢驗。67個品種包括片劑、注射劑、膠囊劑、眼用制劑、口服溶液劑、顆粒劑等多種劑型。對歷年品種數和批次的統計結果及趨勢見圖1、圖2,歷年國抽抽取的生化藥品的品種數和批次數基本呈穩步遞增。所抽樣的品種按照類別和劑型劃分,具體統計結果見圖3、圖4,歷年國抽中,注射劑為主要劑型,核苷類占較大比重。
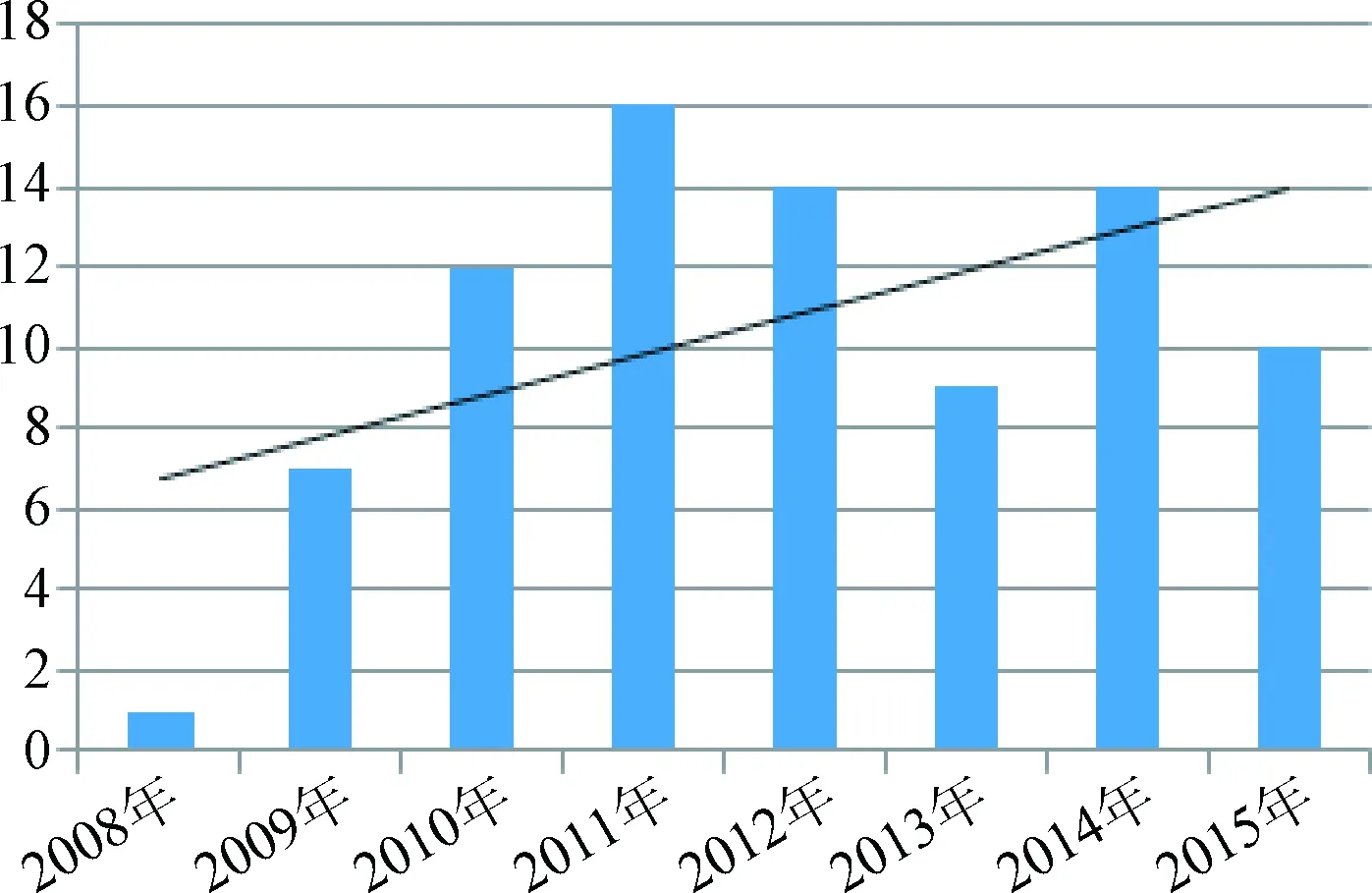
圖1 2008~2015年國抽生化藥品品種數統計Fig.1 Biochemical drugs in national assessment of programs from 2008 to 2015
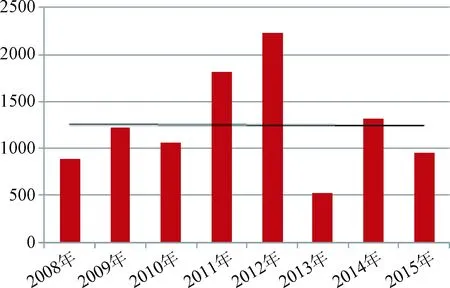
圖2 2008~2015年國抽生化藥品批數統計Fig.2 The number of batch of biochemical drugs in national assessment of programs from 2008 to 2015
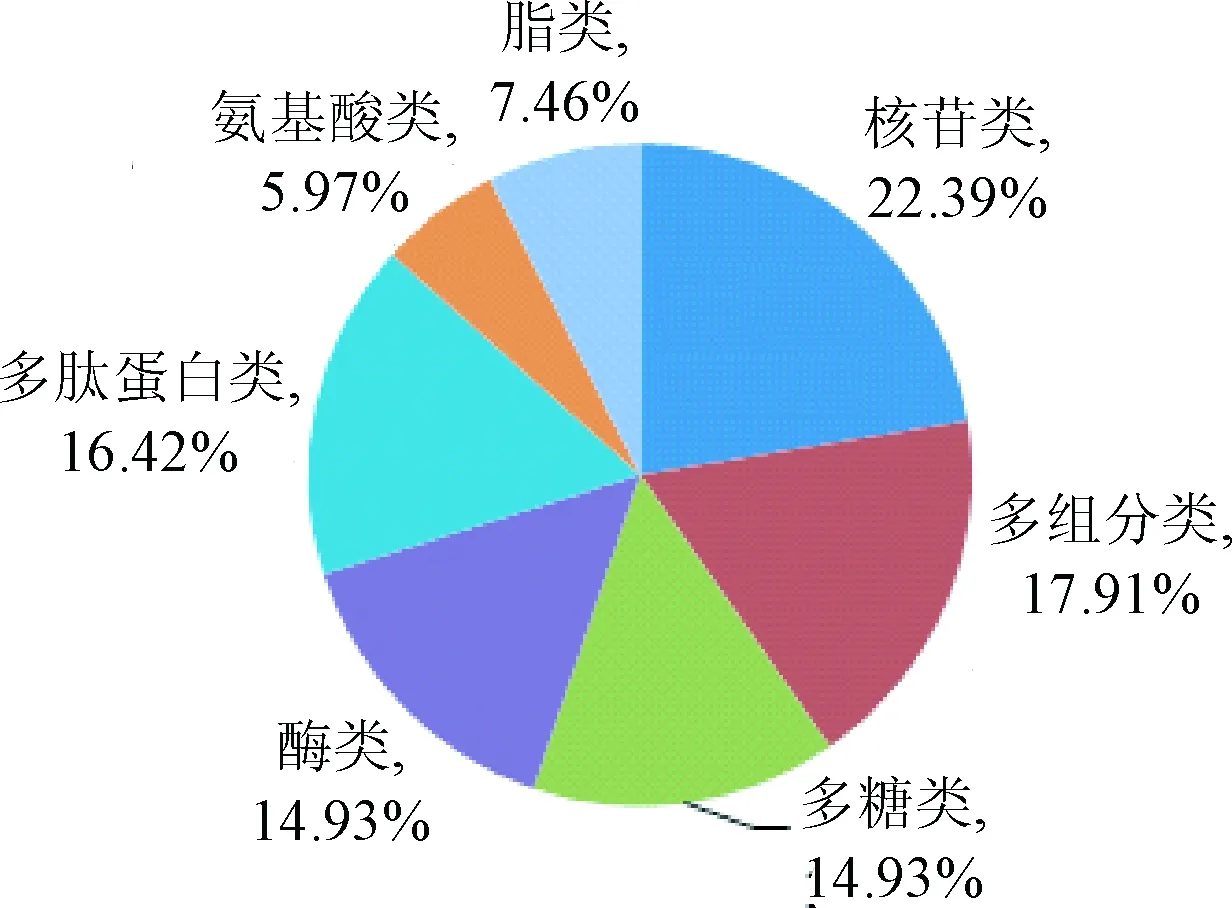
圖3 2008~2015年國抽生化藥品類別分布Fig.3 Type distribution of biochemical drugs in national assessment of programs from 2008 to 2015
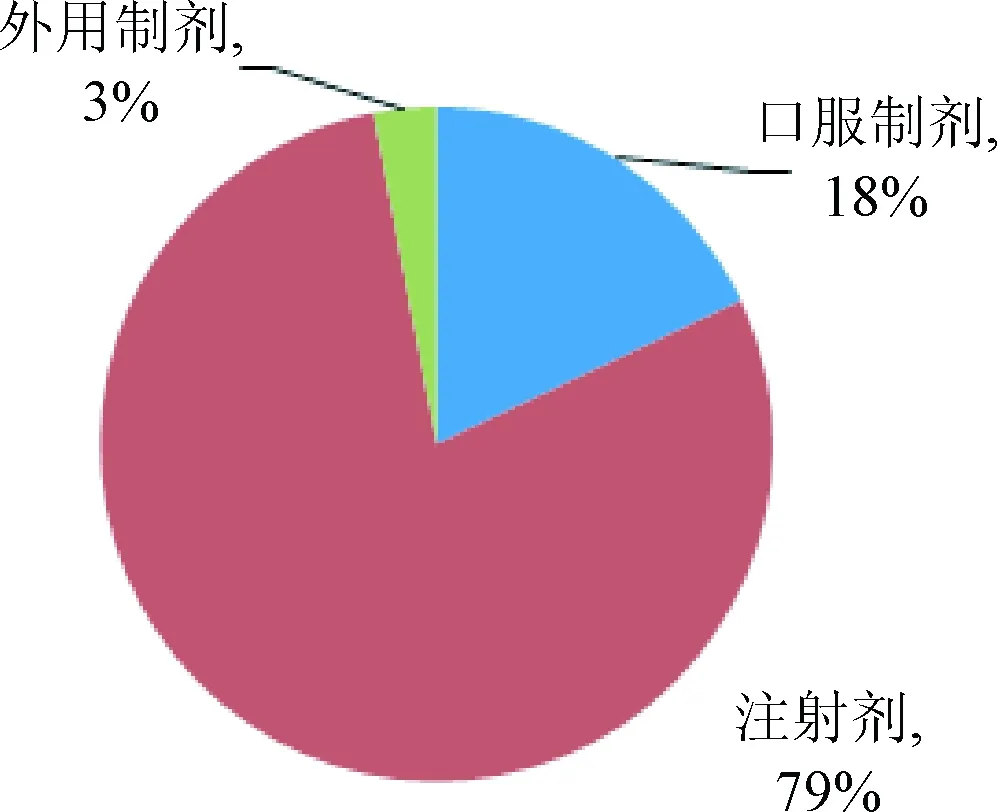
圖4 2008~2015年國抽生化藥品劑型分布Fig.4 Dosage distribution of biochemical drugs in national assessment of programs from 2008 to 2015
4.5 國抽生化藥品質量總體狀況 對歷年國抽藥品的質量狀況進行總體評價,主要體現以下3個特點:①從法定檢驗的不合格率進行統計,從法定檢驗結果看,不合格率逐年降低,我國生化藥品總體質量較好,并向好的方向進一步發展。具體統計結果見圖5。②國家基本藥物品種質量一般好于其他藥品。國家基本藥物品種法定檢驗的平均不合格率為2.90%,而非國家基本藥物品種法定檢驗的不合格率為4.91%。大部分基本藥物的質量評價為較好。③不同類別的生化藥品質量存在較大差別:氨基酸及核苷酸類藥品為小分子藥物,相對來說質量標準上存在的問題比較少;產品質量較好。多糖類中的肝素,由于近兩年連續對其質量進行監控,質量提高較快;低分子肝素問題較多,質量一般。提取的多肽蛋白類、多組分類質量標準存在的問題較多,多組分生化藥品質量控制是難點,質量狀況一般。
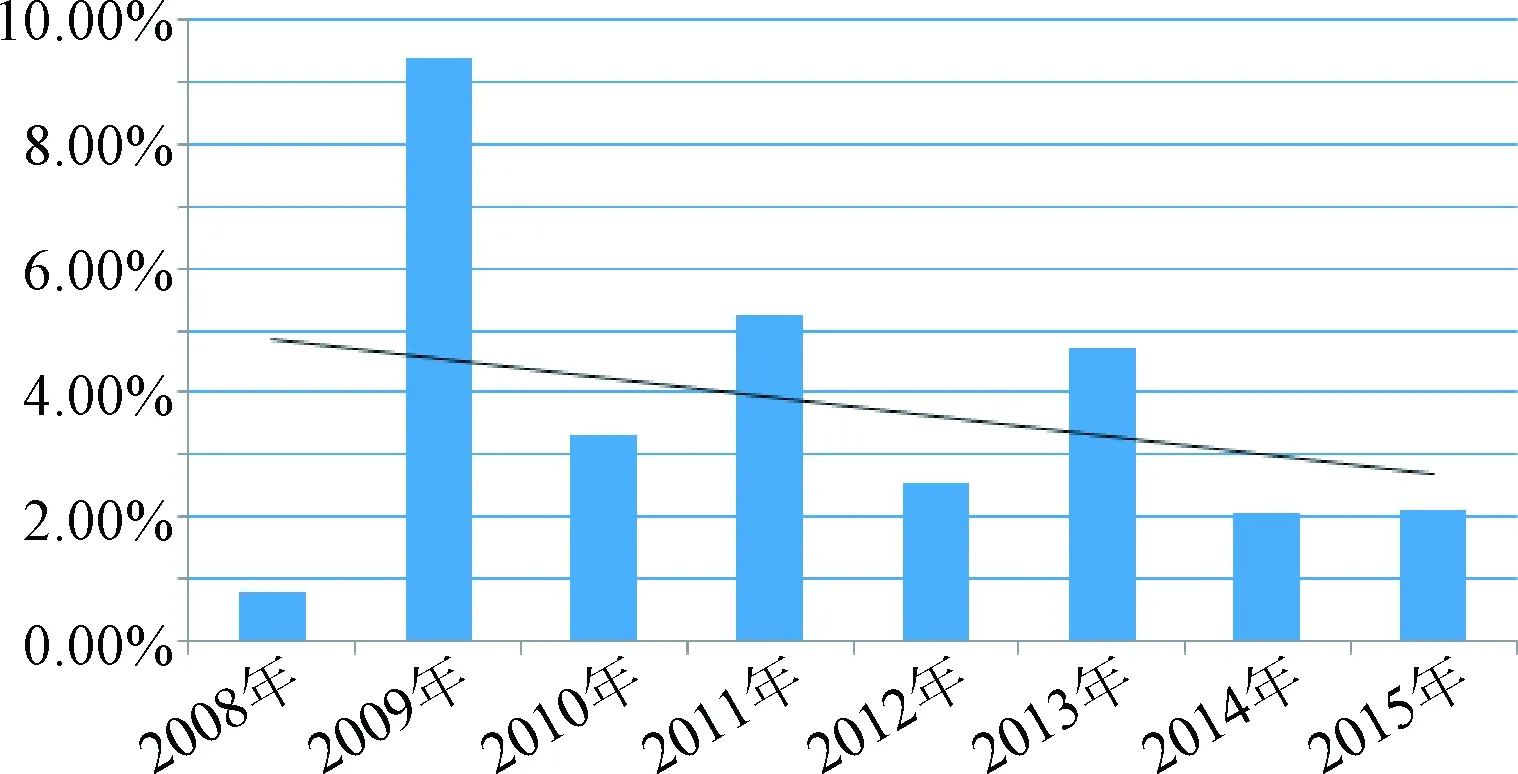
圖5 2008~2015年國抽生化藥品種法定檢驗不合格率趨勢圖Fig.5 The unqualified rate trend map of biochemical drugs in national assessment of programs from 2008 to 2015
4.6 國抽生化藥品存在的共性質量問題 對生化藥品的國抽報告進行分析我們發現,目前生化藥品存在著如下共性質量問題。
4.6.1 與標準相關的問題:① 部分品種多個標準共存,不同標準尺度有所不同,2015年國家評價性抽驗涉及10個品種,但檢驗涉及47個標準,其中藥典標準2個,占4.2%,國家局頒標準42個,占89.3%,其他標準(衛生部標準)3個,占6.4%。標準不完善也是質量標準存在的又一共性問題。②個別品種存在著安全性或有效性檢驗項目不全、檢驗方法不專屬、檢查限度不合理的問題。檢驗方法不專屬比較突出的問題是多肽含量測定中處方中輔料(還原類物質、酚類、甘氨酸、糖類)對原方法測定結果有干擾。③部分品種的批準文號閑置率較高。如2014年抽取的一個品種,目前全國共有226家生產企業擁有334個批準文號,但實際生產的企業僅有4家,涉及的文號僅占所有批準文號的1.2%。
4.6.2 產品設計合理性問題:主要列舉了制劑處方和生產工藝合理性存在一些問題。關于制劑處方,部分品種的乳化劑或抗氧劑的使用存在一些問題[13-14];關于生產工藝,有些品種的部分企業其滅菌條件為“105 ℃,時間30 min”,F0小于8,存在較大的風險。還有注射劑品種的部分企業采用過濾除菌工藝同時用流通蒸汽輔助滅菌,而考察產品在100 ℃不同時間加熱產生的雜質數量和含量,均有所增加,因此工藝合理性應進一步考察。
4.6.3 生產工藝和過程控制問題:部分品種存在著生產工藝和過程控制的問題,如關鍵生產工藝參數不明確、生產工藝不穩定從而導致樣品質量差異較大以及未控制起始原料、中間體、原液質量,僅控制終產品質量等問題。
5 結語與展望
5.1 生化藥品探索性研究的關注點 為保證藥品的有效性和安全性,不同類別的生化藥品的探索性研究的關注點應有所不同。氨基酸和核苷酸類小分子藥物,主要是按照化學藥的要求,關注有關物質、溶出度、有機殘留等;多肽、蛋白類藥物主要關注純度、比活、有關物質等;多糖類藥物主要關注分子量與分子量分布、工藝雜質;而脂類藥物品種較少,主要關注有關物質及與產品穩定性相關的項目;多組分提取物類生化藥主要關注過程控制,制定原材料標準,嘗試建立種屬鑒定方法,關注安全性項目如高分子物質、過敏、降壓物質等,探索建立專屬性指標如嘗試建立特征圖譜;酶類藥物主要關注純度、比活、效價測定方法等。
5.2 展望 綜上所述,不同于一般的化學藥品,生化藥品有其自身的特殊性和復雜性。我國生化藥品的生產企業在把握生化藥品的特殊性的同時,更應嚴格遵守GMP要求。適逢國家即將發布針對生化藥品的GMP附錄,生產企業更應關注產品在藥品整個生命周期的質量:包括從起始原料的控制,生產工藝的規范,GMP生產的合規性,產品放行到上市后藥品不良反應的跟蹤及再評價等。國家監管部門也要鼓勵企業優化處方和生產工藝,完善藥品說明書,加快生化藥品質量標準的提高進度等。總之,通過各方的共同努力來保證我國生化制藥產業健康良性發展。
志謝本文的撰寫得到中檢院食品藥品技術監督所的大力協助,文中統計結果的源數據均來自技術監督所2008~2015年生化藥品國家藥品質量分析報告,在此表示感謝。
[1] 王鳳山,凌沛學,張天民,等.生化藥物研究[M].北京:人民衛生出版社,1997:1,434-442.
[2] 張天民,姚世文,唐永業.中國生化制藥工業協會關于生化藥物的定義和范圍的建議[J].中國生化藥物雜志,1995,16(5):240-241.
[3] 姚世文,王友同,張天民.中國生化制藥工業發展輝煌五十年[J].中國生化藥物雜志,2000,21(4):214-217.
[4] 榮嫡.2014年我國西藥類產品外貿形勢分析[J].精細與專用化學品,2015,23(6):14-17.
[5] 朱仁宗.2015年我國原料藥產品進出口情況分析[J].精細與專用化學品,2016,24(4):5-9.
[6] 凌沛學,郭學平,榮曉花,等.中國生化原料藥的現狀和展望[J].中國生化藥物雜志,2001,22(5):268-269.
[7] 中華人民共和國衛生部.國家基本藥物目錄2012年版[M].北京.
[8] 國家藥典委員會.中華人民共和國藥典2005年版二部[S].北京:化學工業出版社.
[9] 國家藥典委員會.中華人民共和國藥典2010年版二部[S].北京:化學工業出版社.
[10] 國家藥典委員會.中華人民共和國藥典2015年版二部[S].北京:化學工業出版社.
[11] 國家食品藥品監督管理局.藥品評價抽驗質量分析指導原則[Z].國食藥監辦稽[2009]30號,2009.
[12] 國家食品藥品監督管理局.2008年國家藥品抽驗工作計劃[Z].國食藥監市[2008]21號,2008.
[13] 陳華,鄧鋒,梁蔚陽.脂肪乳注射液乳粒質量研究的探討[J].中國生化藥物雜志,2016,36(3):172-175.
[14] 任麗萍,藺娟,閔祺,等.多烯酸乙酯軟膠囊的抗氧化劑研究[J].中國生化藥物雜志,2015,35(5):174-176.
(編校:吳茜)
Qualitystatusandfutureperspectivesofnationalbiochemicaldrugs
REN Li-ping, FAN Hui-hongΔ
(National Institutes for Food and Drug Control, Beijing 100050, China)
To summarize the quality situation and some generic quality problems based on the national drug quality study reports about biochemical drug of 2008-2015. The prospects of national biochemical drugs and quality control were outlooked in this paper.
quality; biochemical drugs; quality control; quality evaluation
10.3969/j.issn.1005-1678.2016.10.001
任麗萍,女,碩士,副主任藥師,研究方向:生化藥品的質量研究與控制,E-mail:pplucky@126.com;范慧紅,通信作者,女,博士,研究員,研究方向:生化藥品的質量研究與控制,E-mail:shenghuayaoshi@126.com。
R914
A

