一種重力電池的實驗設計
葉佩佩 丁偉
摘要:重力電池是一種形式介于單液電池和雙液電池之間的電池。它利用不同溶液密度的不同使溶液分層,電池兩極分別位于上下兩層液體中,具有內阻小、電流大并且穩定的特點。設計并制作了重力電池,結合實驗介紹了重力電池的原理及發展簡況。
關鍵詞:重力電池;實驗設計;濃差電池;鋅電極;銅電極
文章編號:1005–6629(2016)7–0057–03 中圖分類號:G633.8 文獻標識碼:B
1 背景介紹
銅鋅原電池是高中電化學中的重要實驗。必修《化學2》教材中介紹了單液銅鋅原電池,旨在幫助學生了解原電池的工作原理和構成條件,初步形成原電池的概念。選修4《化學反應原理》教材中介紹了電池效率更高、更加穩定的帶鹽橋的雙液原電池。由此可見,課程在原電池原理及實用性方面,對學生的要求逐漸提高。
追溯原電池的發展過程,重力電池是形式介于傳統的單液原電池和帶鹽橋的雙液原電池之間的一種電池。它最早源于19世紀60年代法國的Cal laud對簡單的丹尼爾電池的改進[1],直到20世紀50年代都被用作電源為美國和英國的電報網絡供電。傳統的重力電池如圖1所示,由一個底部放有一個銅電極(+),邊緣懸掛一個鋅電極(-)的容器組成。硫酸銅晶體分散在正極的周圍,容器裝滿了蒸餾水。當在負極表面形成一層硫酸鋅的時候,就開始有電流產生了。重力電池的首要條件是保持液體呈現靜止狀態,因此它不是一個便攜式的電源,晃動或攪拌都可能使兩種溶液混合。隨著電池放電時間的延長,上層的鋅電極和下層的硫酸銅會不斷消耗,因此電池使用了一段時間之后需要通過更換鋅電極或向溶液中直接添加硫酸銅晶體的方法,使該重力電池重新開始工作。重力電池據此可以不斷被充電,在沒有電網的情況下,可重復使用,這也是當時重力電池能被廣泛應用的原因之一。
重力電池中銅電極位于硫酸銅溶液中,鋅電極位于硫酸鋅溶液中,構成銅鋅原電池。銅電極為正極,發生還原反應,Cu2++2e-=Cu;鋅電極為負極,發生氧化反應,Zn-2e-=Zn2+,電池的總反應為:Zn+Cu2+=Zn2++Cu。
重力電池將電池反應分為在上下兩層溶液中進行的兩個半反應,是利用了溶液分層的原理。一般認為,溶液是均一、穩定的混合物。但是因為不同溶液中溶質的種類不同或含溶質的多少不同,所以不同的溶液的密度一般是不同的。如果在沒有攪拌或振蕩的情況下混合兩種溶液,將密度大的溶液緩慢從密度小的溶液下部加入,靜置時由于重力的作用,兩種溶液不能均勻混合,密度大的溶液在下層,密度小的溶液在上層。若兩種溶液的顏色不同,在宏觀上能明顯觀察到顏色分層的現象。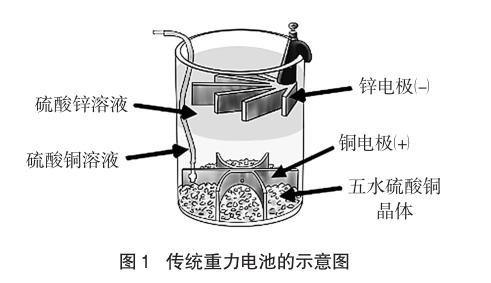
高中化學教材曾呈現過不同溶液因為其密度不同而分層的現象。人教版高中必修《化學1》[2]第三章第一節“金屬的化學性質”中展示了一幅鋁絲和硫酸銅溶液反應的圖片,如圖2所示,其發生了如下反應:2Al+3CuSO4=Al2(SO4)3+3Cu。可以觀察到伸入液面以下的鋁絲被置換出的銅單質包裹,隨著反應的進行,藍色的硫酸銅溶液逐漸變為無色的硫酸鋁溶液。若按方程式計量系數反應,3mol CuSO4反應生成1mol Al2(SO4)3,反應前溶液溶質為3mol CuSO4,其質量為480g,反應后溶質為1mol Al2(SO4)3,其質量為342g。3mol CuSO4的質量大于1mol Al2(SO4)3的質量,反應前后溶液體積不變,所以反應后的Al2(SO4)3溶液的密度小于反應前CuSO4溶液的密度,靜置時溶液分層,上層為無色Al2(SO4)3溶液,下層為藍色CuSO4溶液。由此可得,溶液能因密度不同而分層。
一般溶液分層并不是一種穩定的狀態。在熱力學中,體系有自發傾向于熵增的趨勢,溶質會自發地從高濃度向低濃度擴散,所以溶液并不能長時間維持分層的狀態,一段時間之后分層的現象消失,形成均一、穩定的溶液。但是重力電池在工作中,溶液能始終維持分層,其原因可從離子遷移方向的影響因素上考慮。一方面受電勢高低的影響,電解質溶液中的陰離子向原電池的負極移動,陽離子向原電池的正極移動。另一方面受溶液濃度的影響,離子傾向于向濃度低的方向擴散。重力電池能在宏觀上觀察到溶液分層的界面,是因為Cu2+在水溶液中呈藍色。由于電勢的影響,Cu2+離子向電勢高的銅電極(+)方向移動,由于受離子濃度的影響,Cu2+應該向銅離子濃度低的鋅電極(-)方向移動,兩種因素促使Cu2+向相反的方向移動。受這兩種方向相反作用的影響,綜合表現為在宏觀上能夠觀察到無色液體和藍色液體的界面始終存在。因此,使用重力電池作為電源時,電流必須保持流動來抵消兩層溶液相互擴散的效應。
重力電池在19世紀的西方已經被廣泛應用,而國內這種形式的電池卻還鮮為人知。重力電池的形式介于單液和雙液原電池之間,和單液原電池相比重力電池將電池反應分成兩個半反應,分別在不同的溶液中進行。和雙液電池相比,重力電池沒有使用鹽橋,電池反應在同一液體體系中進行。本文設計并制作了一種重力電池,測量了其電動勢及電流隨時間的變化并進行了分析。此外,還依據重力電池的形式進行了拓展和創新。
2 實驗內容
2.1 重力電池的制作
2.1.1 實驗試劑與器材
CuSO4·5H2O(AR)、ZnSO4·7H2O(AR)、蒸餾水
燒杯(150mL)、容量瓶(100mL)、量筒(100mL)、三角漏斗、滴管、玻璃棒、銅片、鋅片、鐵夾、帶夾導線、數字萬用表(VC890D)
2.1.2 實驗步驟
(1)制作電極。將6.0cm×2.3cm鋅片和10.0cm×2.3cm銅片卷成螺旋狀并連接導線。
(2)配制溶液。配制1 mol/L CuSO4溶液和0.5 mol/L ZnSO4溶液。
(3)混合溶液。向燒杯中加入約70mL ZnSO4溶液,插入漏斗使漏斗下口緊貼燒杯底部,沿漏斗緩慢倒入約70mL CuSO4溶液,靜置。最終溶液分層,上層無色,下層藍色。
(4)安裝電池。將銅片緩緩放入下層溶液中,鋅片浸沒于上層無色的液體中并用鐵夾固定在燒杯壁上,切勿讓銅片或鋅片接觸另一層液體,裝置如圖3所示。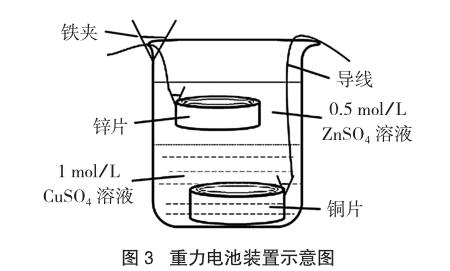
(5)電池電動勢的測量。將鋅片和銅片分別連接數字萬用表的負極和正極接線柱,測量電動勢和電流隨時間的變化并觀察實驗現象。實驗發現,鋅片逐漸溶解,表面變黑,銅片上有亮紅色物質生成。實驗過程中重力電池的電流和電動勢隨時間變化較穩定,因此此處僅選取其中幾個時間點的電流和電動勢的數據列于表1。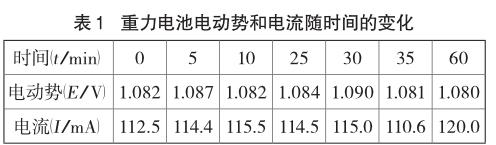
2.1.3 結果分析
實驗發現,隨著時間的變化重力電池的電動勢和外電路的電流變化不大,呈現出相對穩定的狀態。有研究表明,單液電池的電池電動勢和電流在10分鐘內均呈現出快速降低的趨勢,而帶鹽橋的雙液原電池則相對比較穩定[3]。與單液原電池中鋅電極和CuSO4溶液直接接觸不同,重力電池的形式讓兩個半反應分別在上下兩層液體中發生,與雙液原電池將兩個半反應分別置于兩個容器中類似,都避免了因為鋅電極和CuSO4溶液直接接觸而導致的電極的極化,使電池效率增大,所以在測量時重力電池的電流和電動勢能在較長時間內保持相對穩定。
此外,與雙液原電池中鹽橋和電解質溶液共同導電的情況不同,重力電池的電池反應在同一液體體系中進行,與單液原電池相同,通過電解質溶液導電,所以其內電阻較小,如在本研究中所測得的重力電池的內電阻約為9Ω。上述實驗表明,重力電池具有內阻小,電流大且能提供穩定的電流和電壓的特點,電池的轉化效率高,作為電源有一定的優勢,多個重力電池串聯后可用作實用的電源。
2.2 重力電池的拓展應用
依據重力電池的原理,仿照其形式,改變電極和電解質溶液,可以設計成其他的重力電池。例如用銅片代替上層的鋅片,用蒸餾水代替上層ZnSO4溶液,可制得銅電極和不同濃度的CuSO4溶液組成的濃差電池。該濃差電池的上層為蒸餾水,下層為1 mol/L CuSO4溶液,上下兩個電極均為銅電極。用萬用表測得該電池的電動勢為0.036V,電流為0.62mA。
此濃差電池的下層CuSO4溶液中的銅電極作正極,發生還原反應:Cu2+(c1)+2e-=Cu,反應的過程中有亮紅色物質在銅表面析出;上層水中的銅電極作負極,發生氧化反應:Cu-2e-=Cu2+(c2),因為反應過程中有Cu2+生成,故銅電極周圍的無色溶液一段時間后略帶淺藍色;電池的總反應為:Cu2+(c1)=Cu2+(c2)。查電動勢表得:Cu2++2e-=Cu,Eθ=+0.342V,標準狀況下c(Cu2+)=1 mol/L。實際測得該濃差電池的E=0.036V,則負極的電勢為E(Cu2+/ Cu)=0.306V,由此可根據E(Cu2+/Cu)=Eθ(Cu2+/Cu)+(0.0592/2)lg(Cu2+)可進一步計算出測量時上層溶液中的銅離子濃度為c(Cu2+)=0.06 mol/L。上述計算是一種理論判斷,要準確測量該電池的電動勢,需要使用鹽橋,以降低液接電勢[4]。重力電池的形式為濃差電池的制作提供了新的思路,也為學生學習濃差電池相關原理提供了幫助。
另外,也可以制作以鐵和碳棒為電極的重力電池,下層Fe2(SO4)3溶液中,碳棒作正極,發生還原反應,Fe3++e-=Fe2+;上層FeSO4溶液中,鐵是負極,發生氧化反應,Fe-2e-=Fe2+。據此還可以設計更多種類的其他重力電池。但需要注意的是,制作重力電池時可先將水和另一種鹽溶液進行分層,再向上層液體中添加電解質,也可以直接通過傾倒的方法將兩種不同的電解質溶液分層。若采用將兩種溶液分層的方法,實驗前應先計算溶液的密度,盡可能保證兩種溶液的密度差足夠大,在添加液體時使用三角漏斗從下部添加密度較大的液體,避免兩種液體混合。
3 結語
重力電池是一種形式介于單液與雙液原電池之間的原電池,重力電池具有電阻小、電流大并且穩定的特點,但是因為工作時必須保持靜置的狀態且只能連續供電而不被廣泛應用。研究原電池最終是為了創造出更加穩定、持久的化學電源,學習的過程中通過重力電池與單液、雙液電池的比較能使我們對單液與雙液原電池原理及鹽橋的作用理解更加深刻。
引入重力電池到教學中不僅能幫助學生認識溶液因為密度不同而分層的原理及濃差電池的相關知識,還可以進行實驗探究,設計不同類型的重力電池。制作重力電池的材料方便易得,形式新穎且顏色漂亮,有利于開展學生興趣實驗,增強其對化學的興趣。
參考文獻:
[1] James B. Calvert. The Electromagnetic Telegraph[EB/OL]. http://mysite.du.edu/~jcalvert/tel/morse/morse. htm.Retrieved, 2010-07-30.
[2]宋心琦主編.普通高中化學課程標準實驗教科書·化學1(必修)(第3版)[M].北京:人民教育出版社,2007:46.
[3]韋存容,許麗哲,馬宏佳.利用數字化實驗探究鹽橋對原電池工作效率的影響[J].教學儀器與實驗,2015,(5):55~57.
[4]葉禮華.銅和硫酸銅溶液可以構成原電池——兼介濃差電池[J].實驗教學與儀器,2013,(2):33~34,51.

