奶牛圓形、長形、成熟精子細胞微量RNA制備和含量分析
任小霞,陳曉麗,李秀嶺,王 艷,秦 彤,王 棟*
(1.中國農業科學院北京畜牧獸醫研究所,農業部畜禽遺傳資源與種質創新重點實驗室,北京 100193;2.北京市大興區動物疾病控制中心,北京 102600)
?
奶牛圓形、長形、成熟精子細胞微量RNA制備和含量分析
任小霞1,陳曉麗1,李秀嶺2,王艷2,秦彤1,王棟1*
(1.中國農業科學院北京畜牧獸醫研究所,農業部畜禽遺傳資源與種質創新重點實驗室,北京 100193;2.北京市大興區動物疾病控制中心,北京 102600)
本研究旨在探究奶牛變形精子細胞獲取方法、建立穩定奶牛精子RNA提取體系及分析單個生精細胞RNA含量變化。采用激光顯微捕獲技術結合冰凍切片,采集奶牛圓形、長形精子細胞樣品,利用附睪尾精子浮游法獲得成熟精子,通過對已報道的小鼠、奶牛及人類精子RNA制備方法的嘗試和比較,獲得RNeasy Kit最佳奶牛精子RNA制備方法,并用PicoPure RNA Isolation Kit對圓形和長形精子細胞進行RNA制備,篩選去除白細胞、上皮細胞等體細胞污染及基因組DNA污染的反轉錄聚合酶鏈式反應(RT-PCR)檢測方法,并對生精細胞RNA含量進行單因素方差分析。結果表明,激光顯微切割技術可有效捕獲圓形、長形精子細胞;通過RNeasy Kit獲得的牛精子RNA純度高、質量好,單個精子RNA含量為0.023~0.025 pg;同時,隨精子細胞變形,其RNA含量顯著降低,其中圓形精子到成熟精子RNA含量降低75倍。本研究從復雜樣品取樣、微量RNA細胞轉錄本制備與檢測等方面,為精子發生與變形機理研究提供重要參考。
生精細胞;轉錄本;激光顯微切割;附睪;表達
研究發現,精子中含有種類繁多的RNA[1-3],迄今只有少量研究對于這些RNA在受精[4-5]、獲能[6]、胚胎發育[7]等過程中的重要作用進行探索,絕大部分RNA的作用尚不清晰。主要是因為精子為單倍體生殖細胞,且在發育成熟過程中伴隨大量細胞質和細胞器的丟失,而細胞核的高度濃縮,使轉錄表達受到抑制,導致精子RNA含量更少[8]。研究表明,人單個體細胞約含RNA 1~3 pg,而單個精子的RNA含量卻低至0.015 pg[9],而且,不同研究RNA檢測結果差別很大,小鼠每個精子含RNA (0.16±0.13)pg,牛冷凍精子RNA含量則為0.000 18~0.14 pg[10-13]。RNA含量差異,一方面可能是物種本身或生理狀況不同導致的,另一方面可能是精子RNA制備效率原因。精子細胞極難裂解,制備難度較大,不同實驗室、不同制備方法RNA制備效率差異很大[10-11,14],由于精子不含有核糖體RNA[1,15],較難進行RNA制備效果檢測。另外,精子樣品采集時,精漿中白細胞與上皮細胞污染不可避免[1],高純度精子的獲取也是困擾精子RNA研究的重要因素。建立穩定高效的精子RNA制備方法,并進行精子RNA含量的精確分析至關重要。很多研究采用trizol法[16-17]、trizol和試劑盒結合法[18]及試劑盒法[19]分別對豬、奶牛和人類精子進行RNA制備分析。與體細胞比,精子RNA含量極低,且trizol法提取的RNA純度低,影響后續的RNA測序分析;trizol和試劑盒結合法,操作復雜,步驟繁瑣,增加試驗操作時間,易導致RNA降解;而試劑盒法,操作簡便,通過吸附柱富集得到的RNA純度較高,同時吸附柱對RNA較敏感,通過吸附柱可實現少量RNA的富集。本研究前期經過對比多種試劑盒的RNA制備效果,發現RNeasy Kit (Qiagen,德國)效果最佳,且操作簡便,耗時也短。利用該方法結合浮游法獲取精子、蔗糖溶液洗滌及體細胞裂解等處理,有效富集高質量精子RNA,為后續試驗提供基礎。
關于精子RNA來源尚存爭議。有研究認為,精子本身不發生轉錄,其含有的RNA是精子發生過程的遺留產物[20-21];而對人[22]、大鼠[23]、果蠅[24]研究發現,精子變形前后有轉錄差異,目前尚無關于精子變形期間轉錄本變化趨勢的定量研究。本研究以奶牛作為試驗動物,借助于在腫瘤研究領域廣泛應用的單細胞激光顯微切割(LCM)技術[25-26],突破精子變形期間細胞樣品采集難題,針對各階段生精細胞建立穩定的RNA制備方法,定量分析精子RNA含量,并對精子變形期間轉錄本的含量變化進行有意義的探索,為精子變形及受精機理研究奠定基礎。
1 材料與方法
1.1試驗動物及樣品采集
以健康、有正常性行為的荷斯坦公牛為試驗動物。采用散欄式飼養、全自動TMR日糧飼喂,每天上午06:00和下午15:00分兩次投放飼料、保證自由采食和清潔飲水。睪丸及附睪采集后,立即用冰袋低溫保存,3 h內運回實驗室。凍精購于北京奶牛中心。
1.2試劑
HistoGene LCM Frozen Section Staining Kit,PicoPure RNA Isolation Kit,Reverse transcription Kit均購于life公司;蔗糖、無水乙醇、β-巰基乙醇、TritonX-100均購于鼎國生物公司。
1.3附睪尾精子和冷凍精子的獲取及RNA制備
取附睪尾放到裝有PBS的50 mL RNase-free離心管中,用剪刀剪碎,在4 ℃冰箱靜置30 min,取上清于1.5 mL離心管中,然后從中取10 μL用PBS稀釋100倍后,用顯微鏡檢測精子形態、活力。正常形態精子數量大于75%,向前運動的精子達到50%則為達標樣本,冷凍精子活力不低于30%即為達標[27]。將達標精子樣本用25×16格的血球計數板進行細胞計數,17 800 g 4 ℃離心10 min,棄上清,得到附睪尾精子沉淀,用于制備精子RNA。將凍精37 ℃解凍,鏡檢合格后,同樣進行細胞計數,在17 800 g 4 ℃離心10 min,獲得凍精沉淀。將附睪尾精子及凍精沉淀用1 mL蔗糖溶液重懸,17 800 g 4 ℃離心10 min,棄上清,重復上述操作兩遍后,向精子沉淀中加入1 mL體細胞裂解液,冰浴15 min后,17 800 g 4 ℃離心10 min,獲得高純度精子沉淀。
采用RNeasy Kit(Qiagen,德國)進行精子RNA制備。每5×107個精子加600 μL提取緩沖液RLT,用吸管反復吹打30 s。反復通過20 G 一次性注射器針頭10次以剪切DNA;加入等體積70%乙醇,吹打混勻后加至吸附柱,8 000 g室溫離心15 s,棄去收集到的液體,再向吸附柱加350 μL漂洗緩沖液RW1,重復漂洗1次后,再向吸附柱加80 μL DNaseI工作液,常溫放置15 min,加350 μL漂洗緩沖液RW1至吸附柱,8 000 g室溫離心15 s,加 500 μL漂洗液RPE至吸附柱,8 000 g室溫離心15 s,加500 μL漂洗液RPE至吸附柱,12 000 g 室溫離心2 min,加20 μL RNase-free水至吸附柱膜上,12 000 g室溫離心1 min,收集管中液體即為細胞總RNA。用核酸測定儀(Biometra,德國)測定其RNA含量和純度,并進行瓊脂糖凝膠電泳檢測。
1.4圓形、長形精子細胞的獲取及RNA制備
用滅菌剪刀將睪丸剪成1.5 cm×1.5 cm×0.3 cm大小的組織塊,放入1.5 mL的RNase-free離心管中,用包埋劑(OCT)包埋,液氮速凍,制作冰凍切片。將冰凍切片機機箱溫度調至-20 ℃,樣品溫度調至-18 ℃,預冷15 min。將速凍好的組織塊放到切片機機箱內平衡30 min,然后用OCT將其固定在樣品托上至包埋劑完全凝固,將樣品托固定到樣品頭上,將切片厚度調為20 μm左右開始修塊,至組織塊露出最大橫截面積,將厚度調至5 μm開始正式切片,用RNase-free的激光顯微切割儀專用膜玻片貼片,并用life染色試劑盒染色。首先,將膜玻片放入75%酒精中固定1 min,RNase-free H2O清洗30 s,洗去浮層酒精,用50 μL染色劑(HistoGene LCM Frozen Section Staining Kit)染色1 min,RNase-free H2O洗去浮層染色劑,再使用75%、95%、100%梯度酒精依次脫水30 s;然后,在激光顯微切割儀下,根據細胞形態進行圓形、長形精子細胞確認。用鼠標選定所需切割線,沿細胞邊緣畫線,然后進行自動切割。切割細胞因自身重力落到含細胞裂解液的收集管蓋子中,取下收集管,蓋緊蓋子,反復顛倒2 min。離心收集細胞消化液,并把圓形與長形精子樣品分別標記為R1、R2、R3與L1、L2、L3,-80 ℃保存備用。取樣時,每張切片更換一次收集管,每張切片切割時間40 min左右。
采用AB kit制備圓形和長形精子RNA。向切割獲取的細胞樣品中加Extration buffer至總體積100 μL,混勻后42 ℃孵育30 min,然后3 000 g離心2 min;吸取上清于另一離心管中,加入100 μL 70%的酒精,用移液槍混勻得到混合液體備用。
根據說明書要求,將吸附柱放入收集管,向吸附柱內加入250 μL condition buffer,16 000 g離心1 min;將上述混合液體加入吸附柱,100 g離心2 min,然后16 000 g離心30 s,去廢液;加100 μL W1至吸附柱,8 000 g離心1 min;加40 μL DNaseI工作液,室溫孵育15 min;加40 μL W1至吸附柱,8 000 g離心15 s;加100 μL W2至吸附柱,8 000 g離心1 min;加100 μL W2至吸附柱,16 000 g離心2 min;將吸附柱放入新的離心管,加入16 μL elution buffer,室溫放置1 min,1 000 g 離心1 min,16 000 g離心1 min,得到RNA溶液。用核酸測定儀(Biometra,德國)測定其RNA含量和純度,并進行瓊脂糖凝膠電泳檢測。
1.5反轉錄
取2 μL總RNA,加入Olig(dT) 1 μL,25 mmol·L-1MgCl24 μL,RNA酶抑制劑0.5 μL,10×反轉錄緩沖液2 μL,10 mmol·L-1dNTPs 2 μL,反轉錄酶0.6 μL,10× reverse buffer 2 μL用RNAse-free水補夠20 μL體系,42 ℃ 1 h,95 ℃ 5 min,冰上急冷5 min。以所得cDNA 為模板進行后續聚合酶鏈反應(PCR)。
1.6RNA的完整性及基因組DNA和體細胞去除效果檢測
針對白細胞特異表達基因CD45(NCBI登錄號NM_001206523.1)的第4和第7外顯子設計一對特異引物,擴增產物為320 bp;針對上皮細胞特異表達基因CDH1(CDH1,NCBI登錄號NM_001002763.1)的第5、第6外顯子設計上游引物,第8外顯子設計下游引物,擴增產物為491 bp。針對GAPDH基因(NCBI登錄號NM_001034034.2)的第4外顯子和第6外顯子設計一對特異性引物,其產物涵蓋了第4、5內含子完整序列,當RNA不含有DNA污染時,其RT-PCR產物僅含249 bp條帶,而含有基因組DNA污染時,則還顯示470 bp條帶。各引物信息見表1。
20 μL PCR 體系:TaqTMDNA 聚合酶mix 10 μL,引物1 μL,cDNA 3 μL,RNase-free H2O 6 μL。PCR 程序:94 ℃ 5 min預變性后,進入循環程序:94 ℃變性30 s;退火30 s(退火溫度見表1),72 ℃延伸30 s,循環34次;最后72 ℃ 延伸10 min。RT-PCR產物經1.5%瓊脂糖凝膠電泳鑒定。
表1PCR引物序列
Table 1RCR primer sequences
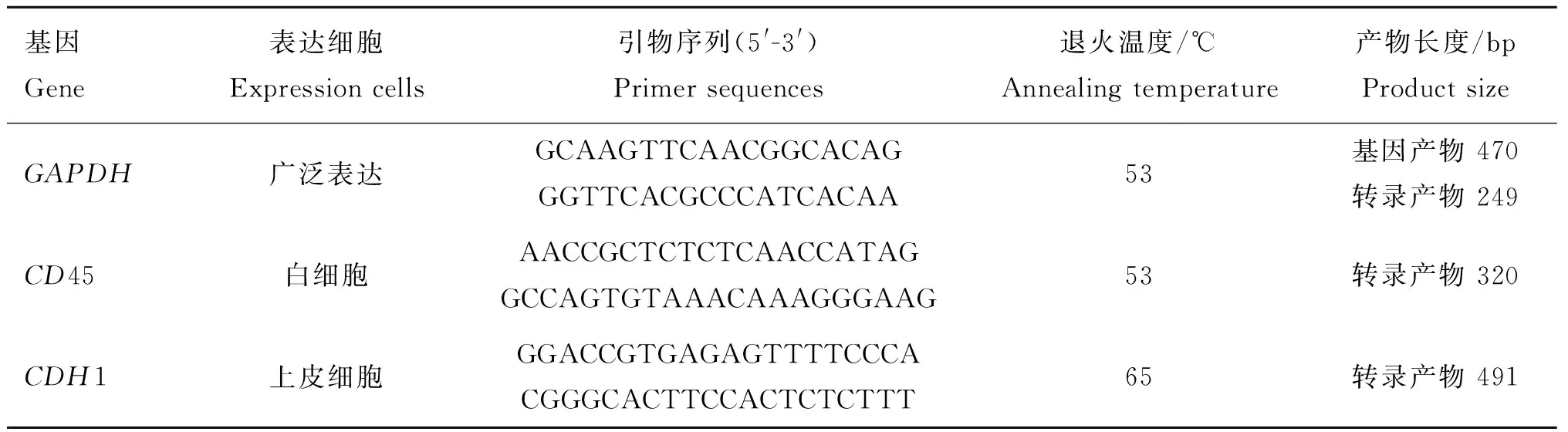
基因Gene表達細胞Expressioncells引物序列(5'-3')Primersequences退火溫度/℃Annealingtemperature產物長度/bpProductsizeGAPDH廣泛表達GCAAGTTCAACGGCACAGGGTTCACGCCCATCACAA53基因產物470轉錄產物249CD45白細胞AACCGCTCTCTCAACCATAGGCCAGTGTAAACAAAGGGAAG53轉錄產物320CDH1上皮細胞GGACCGTGAGAGTTTTCCCACGGGCACTTCCACTCTCTTT65轉錄產物491
1.7統計分析
使用SAS 9.2對附睪尾精子和凍精RNA量進行t檢驗分析,對圓形、長形精子細胞,附睪尾成熟精子細胞的RNA量進行單因子方差分析,P<0.05為差異顯著。
2 結 果
2.1附睪尾精子與冷凍精子數量及活力
鏡檢結果(表2)顯示,3個附睪尾樣本的精子數量為2.750×107~5.275×107個,3個冷凍精子樣本數量為1.500×107。采用目測評定法對精子活率進行測定(根據10級制精子活率評定法,新鮮精液活率不低于50%,凍精解凍不低于30%),附睪尾精子活率為0.72~0.85,冷凍精子樣本活力為0.49~0.52,可以用于后續研究。
2.2切片染色及激光顯微切割結果
奶牛睪丸組織冰凍切片染色后,顯微鏡下觀察生精細胞在曲細精管上的位置及形狀、大小,通過激光顯微切割儀進行目標細胞切割、收集并統計。圓形、長形精子細胞切割前后及收集管收集的情況如圖1(A~D)所示。A、B為63×物鏡條件下激光顯微切割儀切割前后圓形精子細胞;C、D為63×物鏡條件下激光顯微切割儀切割前后長形精子細胞;E為150×物鏡條件下激光顯微切割儀切割后收集管蓋子里收集到的細胞。共收集到的圓形和長形精子細胞個數分別為30 254(Y1)、30 559(Y2)、29 763(Y3)、40 168(C1)、39 862(C2)、42 621(C3)。
表2樣本精子數量及活力
Table 2The quantity and activity of sperm
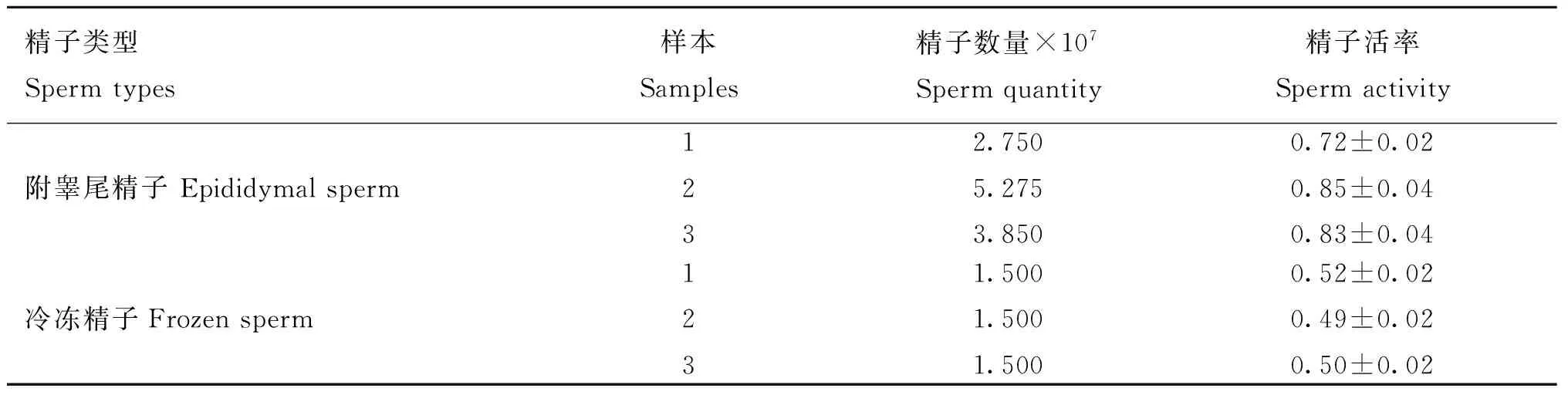
精子類型Spermtypes樣本Samples精子數量×107Spermquantity精子活率Spermactivity附睪尾精子Epididymalsperm1232.7505.2753.8500.72±0.020.85±0.040.83±0.04冷凍精子Frozensperm1231.5001.5001.5000.52±0.020.49±0.020.50±0.02
2.3RNA純度檢測及定量分析
表3顯示,附睪尾精子(F1~ F3)和冷凍精子(D1~D3)RNA的OD260 nm/OD280 nm比值均為1.8~2.1,證明RNA純度較高;但圓形精子細胞(Y1~Y3)和長形精子細胞(C1~C3)RNA的OD260 nm/OD280 nm比值均小于1.8,可能混有酚類等雜質,或由顯微切割獲取細胞樣品較少導致RNA含量較低所致。3×104~4×104個圓形精子細胞總RNA量為516~524 ng,平均每個圓形精子細胞RNA含量約為17.06~21.73 pg;等量的長形精子細胞獲得的RNA總量為401.4~446.0 ng,平均每個長形精子細胞RNA含量約為9.81~11.19 pg;2.750×107~5.275×107個附睪尾精子的RNA總提取量為734.4~950.4 ng,平均每個精子RNA約含0.014~0.035 pg;1.500×107個冷凍精子RNA總提取量為283.2~435.2 ng,平均每個精子RNA含量約為0.019~ 0.029 pg。表明單倍體精子細胞RNA含量極低,且隨精子發育過程中細胞質和細胞器的丟失而逐漸減少。
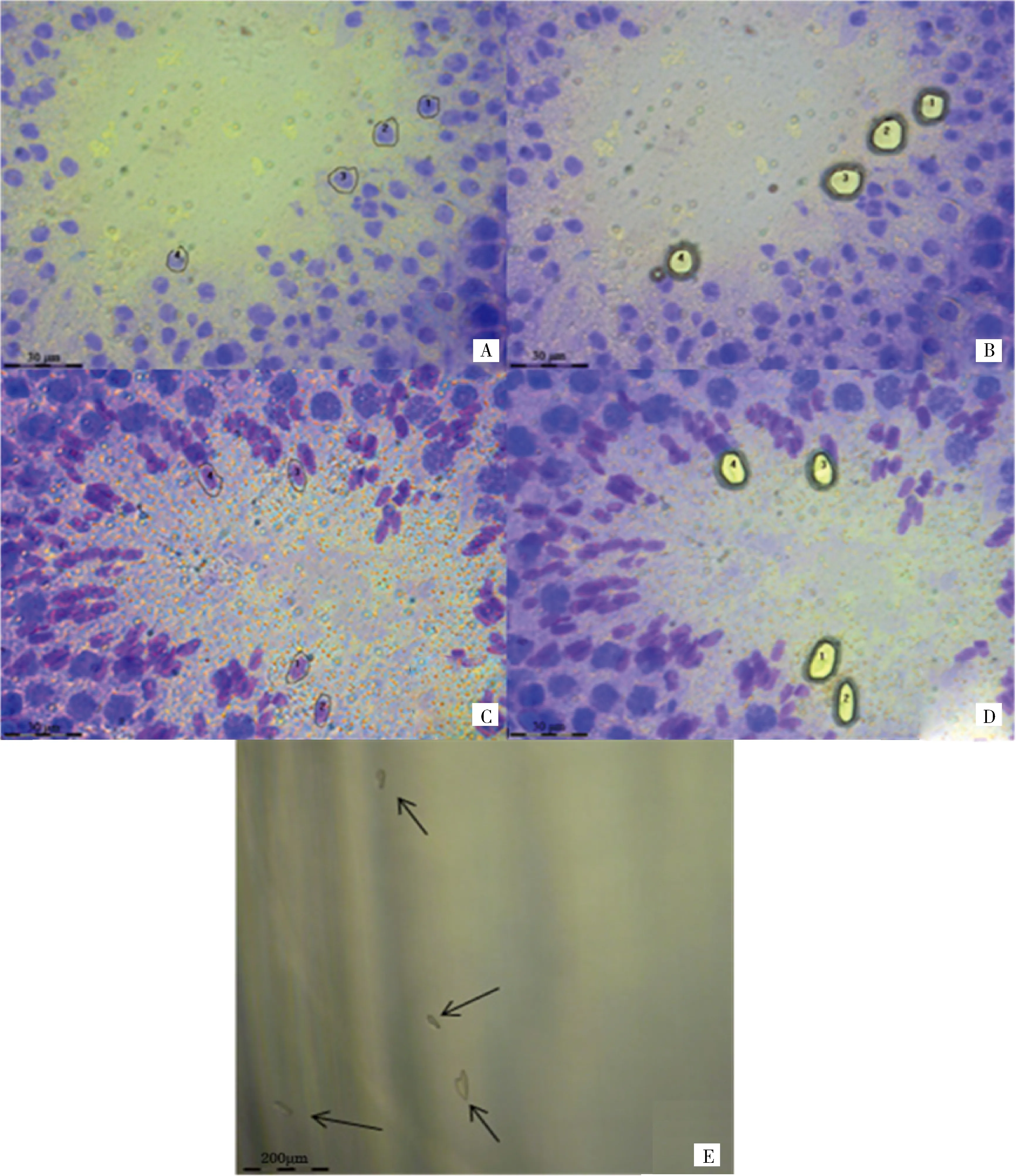
A、B.激光顯微切割儀切割前后圓形精子細胞(630×);C、D.激光顯微切割儀切割前后長形精子細胞(630×);E.激光顯微切割儀切割后收集到的細胞(1 500×)A,B.The round spermatids under the microscope of LCM(630×);C,D.The elongated spermatids under the microscope of LCM(630×);E.The collected spermatids under the microscope of LCM after dissecting(1 500×)圖1 生精細胞的獲取Fig.1 The capture of spermatogenic cells
表3總RNA濃度檢測
Table 3The concentration of total RNA
Y1~Y3.圓形精子細胞;C1~C3.長形精子細胞;F1~F3.附睪尾精子;D1~D3.冷凍精子。下同
Y1-Y3.Round spermatids;C1-C3.Elongated spermatids;F1-F3.Epididymal sperm;D1-D3.Frozen sperm.The same as below
2.4RNA的完整性及基因組和體細胞的去除效果檢測
2.4.1RNA的完整性檢測對附睪尾精子和冷凍精子總RNA的瓊脂糖凝膠電泳檢測結果顯示(圖2),牛睪丸組織總RNA樣品泳道出現了明亮的28S和18S rRNA條帶,且寬度和亮度比接近2∶1,但精子RNA樣品未檢測到任何條帶,其中圓形和長形精子細胞未出現條帶,說明RNA含量極低,與檢測結果一致;附睪尾精子和冷凍精液總RNA樣品中未出現條帶,與精子中不含有核糖體RNA或含量極低檢測不到結果一致。
圖2 RNA質量檢測Fig.2 RNA quality test
2.4.2基因組DNA去除效果檢測總RNA的RT-PCR檢測結果見圖3,各個RNA樣品均在249 bp處出現明亮條帶,與GAPDH基因的cDNA理論長度一致,沒有出現470 bp基因組DNA條帶,說明制備的精子總RNA完整性較好,且無基因組DNA污染。
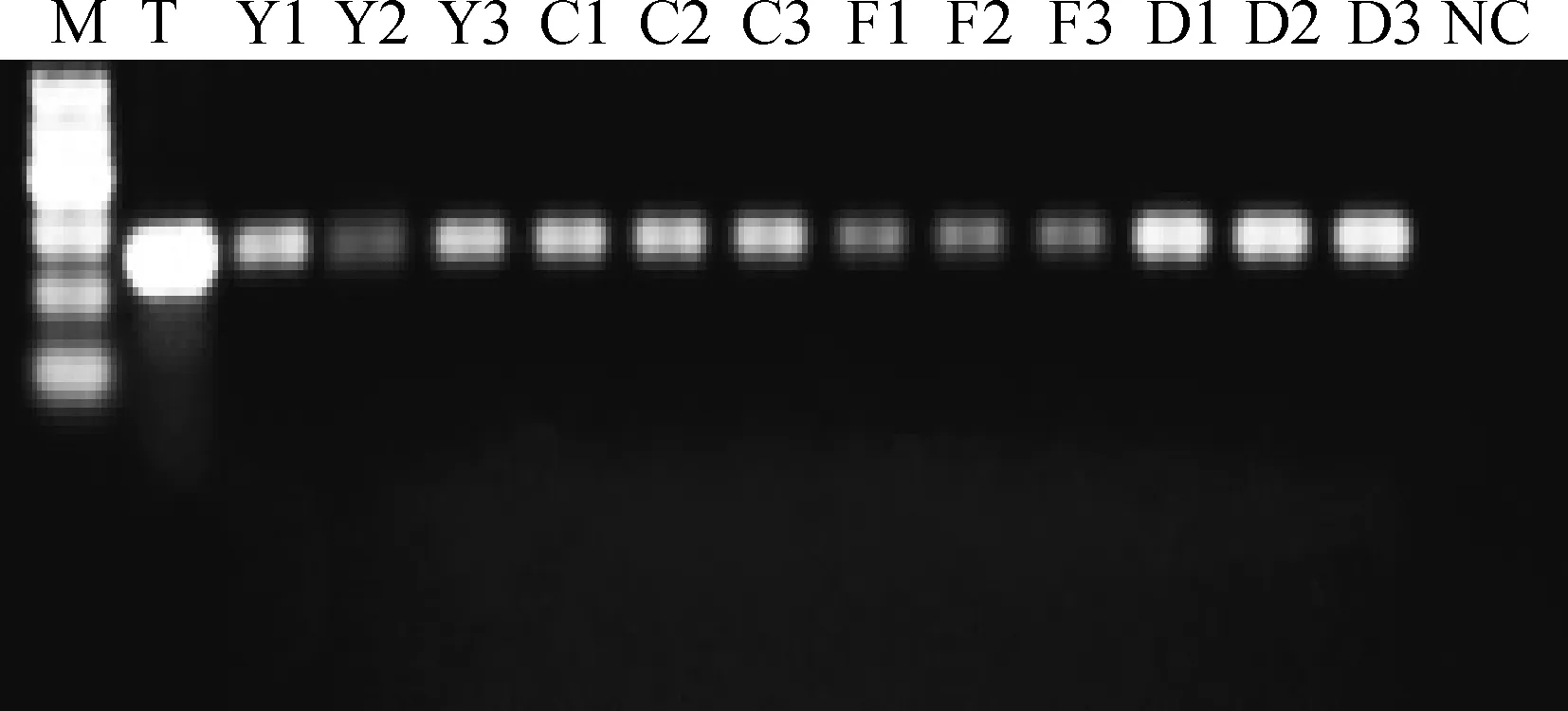
M.Marker I。下同M.Marker I.The same as below圖3 GAPDH基因RT-PCR檢測Fig.3 RT-PCR test of GAPDH
2.4.3體細胞去除效果檢測各RNA樣品針對基因CD45和CDH1的RT-PCR檢測結果(圖4、圖5)顯示,只有睪丸組織樣品檢測到了320 bp的CD45基因產物和491 bp的CDH1基因產物,各種精子RNA樣品均未檢測到上述條帶,表明精子RNA樣品中無白細胞和上皮細胞污染。

圖4 CD45基因RT-PCR檢測Fig.4 RT-PCR test of CD45

圖5 CDH1基因RT-PCR檢測Fig.5 RT-PCR test of CDH1
2.5精子細胞中的RNA含量方差分析
根據各類精子細胞RNA制備結果,計算各階段精子細胞中單個細胞的RNA含量,并進行單因素方差分析,結果顯示(表4),圓形、長形和附睪尾精子RNA含量有顯著差異,且隨變形與成熟而逐漸減少,但附睪尾精子與冷凍精子RNA含量卻差異不顯著。
表4單個生精細胞RNA含量
Table 4RNA quantity of spermatogenic cell
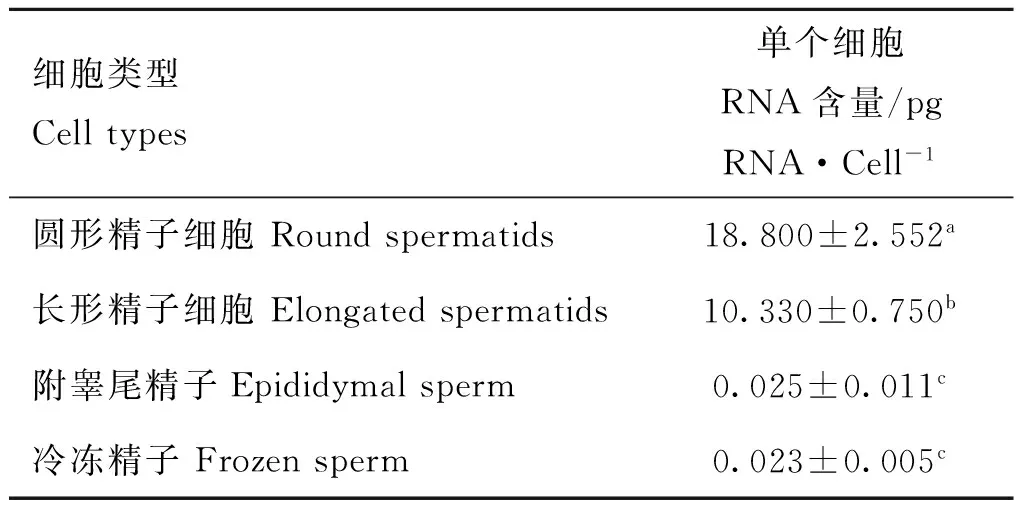
細胞類型Celltypes單個細胞RNA含量/pgRNA·Cell-1圓形精子細胞Roundspermatids18.800±2.552a長形精子細胞Elongatedspermatids10.330±0.750b附睪尾精子Epididymalsperm0.025±0.011c冷凍精子Frozensperm0.023±0.005c
結果用“平均值±標準差”表示(n=3);同行數據后所標字母相異表示差異顯著(P<0.05),所標字母相同表示差異不顯著(P>0.05)
The results are given as “means±SD”;Different letters in the same row means significant difference between the treatments(P<0.05),same letter in the same row means not significant difference between treatments(P>0.05)
3 討 論
本研究前期通過對前人精子RNA制備方法[28-30]的重復和比較,發現trizol法獲得的RNA樣品純度不高;而trizol和試劑盒結合的方法操作復雜,且時間過長,易導致樣品降解;對Qiagen公司和Life公司的多種試劑盒進行比較分析發現,使用RNeasy Kit(Qiagen,德國)制備的RNA量最高,另外,對人類精子含量的研究發現,不同裂解液對精子細胞核裂解程度不同,核裂解程度影響RNA獲得率[19],且發現該試劑盒對精子核裂解效果較好,試劑盒提取法獲得的精子RNA純度較高,質量較好,通過使用RNeasy Kit,并對精子樣本進行蔗糖溶液洗滌及體細胞裂解液處理,篩選較為靈敏的體細胞及基因組去除效果檢測方法,建立高效、高純度奶牛精子RNA制備方法。本研究通過對大量樣本的多次重復和冷凍精子對照分析,檢測出奶牛單個精子的RNA含量為(0.023±0.005)pg,并且RNA提取量穩定。同時,附睪尾精子與冷凍精子RNA含量差異不顯著,表明精子RNA在凍融前后[31]、獲能前后[32]都存在差異,但是精子RNA含量還是相對穩定的,這為今后精子RNA制備及轉錄表達定量研究提供科學的指導。人類體細胞的RNA含量是成熟精子的600倍[9,33],本研究檢測到奶牛每個精原干細胞約含25.133~30.696 pg RNA(未發表),與精子細胞存在顯著差異,同時,變形期間精子細胞RNA含量也存在顯著差異,其中,長形與圓形精子細胞的RNA含量分別是附睪尾精子的413倍和752倍,從圓形、長形到附睪精子的精子細胞變形成熟過程中,細胞RNA含量逐漸降低,從圓形到長形精子細胞RNA含量下降45.1%,從長形到附睪尾精子RNA含量下降99.8%,精子細胞RNA的這種變化趨勢與精子變形過程中染色體逐漸致密緊湊的發展趨勢相一致[34],說明染色體結構的改變導致了精子細胞中轉錄表達水平的逐漸降低,但是,究竟發育成熟的精子中是否繼續進行基因的轉錄表達還需要進一步的證明。另外,本研究通過RNA凝膠電泳檢測證明了前人的研究結論,即精子中可能不含有rRNA,或其含量極少以至于檢測不到[1,15,35]。這將為精子RNA的提取提供一定的理論依據,更為大動物精子發生過程的轉錄組研究奠定基礎。
本研究同時采集了牛的睪丸和附睪,其中睪丸用于采集圓形和長形精子細胞,用附睪精子浮游獲得成熟精子樣品,并且在檢測分析時,力爭使各級生精細胞及精子都來自同一個體,通過以個體為單位的系列研究,探索精子發育過程中真實的轉錄變化,保證了研究的延續性和可靠性。同時,圓形和長形精子細胞都與支持細胞相嵌合散在分布于曲細精管生精上皮上,難以進行細胞樣品采集,本研究通過冷凍切片制作結合激光顯微切割技術,突破了復雜細胞樣品的取樣技術瓶頸,解決了圓形、長形精子細胞取樣難題。激光顯微切割技術(Laser capture microdissection,LCM)是一項在顯微鏡下從組織切片中分離、純化單一類型細胞群或單個細胞的技術,成功解決了組織中的細胞異質性問題[36]。精子細胞獲取,使精子成熟過程中精子轉錄活性變化成為可能。激光顯微切割技術為獲取睪丸組織中圓形和長形精子細胞提供便利條件。但是激光對細胞的損傷仍不可忽略,因此設置合適的激光參數對于獲取高質量細胞樣品至關重要。本研究主要在63×物鏡下進行激光切割獲取細胞,經過多次試驗摸索,最終確定的參數:Power設為10,Aperture設為1,Specimen Balance設為8,Head Current設為66%,Pulse Frequency設為 201時為最佳切割參數,可在最短時間內,順利切下目的細胞,平均切割數量為長形精子細胞1 000個·片-1,圓形精子細胞700個·片-1,由于精原干細胞體積較大,數量較小,每張玻片只能收集500個左右。在選取目的細胞時盡量選取目的細胞群,這樣可使所選區域的中間位置細胞免受激光損傷,保證細胞RNA完整性。另外,在收集細胞時,收集管的蓋子里應放上細胞裂解液,裂解液里按100∶1加入RNase抑制劑。圓形、長形精子細胞的獲取及RNA制備為后續高通量測序研究奠定技術基礎,同時為深入進行精子發生與成熟機制研究提供重要參考。
[1]CARD C J,ANDERSON E J,ZAMBERLAN S,et al.Cryopreserved bovine spermatozoal transcript profile as revealed by high-throughput ribonucleic acid sequencing[J].BiolReprod,2013,88(2):49.
[2]HOSKEN D J,HODGSON D J.Why do sperm carry RNA? Relatedness,conflict,and control[J].TrendsEcolEvol,2014,29(8):451-455.
[3]MARTINS R P,KRAWETZ S A.RNA in human sperm[J].AsianJAndrol,2005,7 (2):115-120.
[4]FAGERLIND M,ST?LHAMMAR H,OLSSON B,et al.Expression of miRNAs in bull spermatozoa correlates with fertility rates[J].ReprodDomestAnim,2015,50(4):587-594.
[5]OSTERMEIER C G,GOODRICH R J,DIAMOND M P,et al.Toward using stable spermatozoal RNAs for prognostic assessment of male factor fertility[J].FertilSteril,2005,83(6):1687-1694.
[6]LAMBARD S,GALERAUD-DENIS I,MARTIN G,et al.Analysis and significance of mRNA in human ejaculated sperm from normozoospermic donors:relationship to sperm motility and capacitation[J].MolHumReprod,2004,10(7):535-541.
[7]FENG R Z,SANG Q,ZHU Y,et al.miRNA-320 in the human follicular fluid is associated with embryo qualityinvivoand affects mouse embryonic developmentinvitro[J].SciRep,2015,5:8689.
[8]STEGER K.Transcriptional and translational regulation of gene expression in haploid spermatids[J].AnatEmbryol(Berl),1999,199 (6):471-487.
[9]MILLER D,OSTERMEIER G C,KRAWETZ S A,et al.The controversy,potential and roles of spermatozoal RNA[J].TrendsMolMed,2005,11(4):156-163.
[10]GILBERT I,BISSONNETTE N,BOISSONNEAULT G,et al.A molecular analysis of the population of mRNA in bovine spermatozoa[J].Reproduction,2007,133(6):1073-1086.
[11]LALANCETTE C,MILLER D,LI Y,et al.Paternal contributions:new functional insights for spermatozoal RNA[J].JCellBiochem,2008,104(5):1570-1579.
[12]CONCHA I I,URZUA U,YAEZ A,et al.U1 and U2 snRNA are localized in the sperm nucleus[J].ExpCellRes,1993,204(2):378-381.
[13]PESSOT C A,BRITO M,FIGUEROA J,et al.Presence of RNA in the sperm nucleus[J].BiochemBiophysResCommun,1989,158 (1):272-278.
[14]OLIVA R,DIXON G H.Vertebrate protamine genes and the histone-to-protamine replacement reaction[J].ProgNucleicAcidResMolBiol,1991,40:25-94.
[15]YU Y,VANHORNE J,OKO R,et al.The origin and assembly of a zona pellucida binding protein,IAM38,during spermiogenesis[J].MicroscResTech,2009,72 (8):558-565.
[16]曾有權,仇恒濱,徐凱,等.豬精子RNA提取的初步研究[J].中國畜牧雜志,2008,44(17):18-22.
ZENG Y Q,QIU H B,XU K,et al.The preliminary study on extraction of RNA in swine spermatozoa[J].ChineseJournalofAnimalScience,2008,44(17):18-22.(in Chinese)
[17]GILBERT I,BISSONNETTE N,BOISSONNEAULT G,et al.A molecular analysis of the population of mRNA in bovine spermatozoa[J].Reproduction,2007,133(6):1073-1086.
[18]王惠娥,孫獻瑩,高慶華,等.奶牛精子RNA提取[J].中國畜牧獸醫,2011,38(3):80-84.
WANG H E,SUN X Y,GAO Q H,et al.Sperm RNA extraction from dairy cattle[J].ChinaAnimalHusbandryandVeterinaryMedicine,2011,38(3):80-84.(in Chinese)
[19]李紅鋼,周慧,官黃濤,等.人精子RNA的提取及含量分析[J].生殖醫學雜志2008,17(2):104-108.
LI H G,ZHOU H,GUAN H T,et al.The preparation and quantity of human sperm RNA[J].JournalofReproductiveMedicine,2008,17(2):104-108.(in Chinese)
[20]EDDY E M.Male germ cell gene expression[J].RecentProgHormRes,2002,57:103-128.
[21]GRUNEWALD S,PAASCH U,GLANDER H J,et al.Mature human spermatozoa do not transcribe novel RNA[J].Andrologia,2005,37(2-3):69-71.
[22]DADOUNE J P,PAWLAK A,ALFONSI M F,et al.Identification of transcripts by macroarrays,RT-PCR and in situ hybridization in human ejaculate spermatozoa[J].MolHumReprod,2005,11(2):133-140.
[23]WELCH J E,BARBEE R R,MAGYAR P L,et al.Expression of the spermatogenic cell-specific glyceraldehyde 3-phosphate dehydrogenase (GAPDS) in rat testis[J].MolReprodDev,2006,73(8):1052-1060.
[24]BARREAU C,BENSON E,GUDMANNSDOTTIR E,et al.Post-meiotic transcription in Drosophila testes[J].Development,2008,135(11):1897-1902.
[25]ANORUO B,VAN OORSCHOT R,MITCHELL J,et al.Isolating cells from non-sperm cellular mixtures using the PALM microlaser micro dissection system[J].ForensicSciInt,2007,173(2-3):93-96.
[26]VANDEWOESTYNE M,VAN HOOFSTAT D,VAN NIEUWERBURGH F,et al.Automatic detection of spermatozoa for laser capture microdissection[J].IntJLegalMed,2009,123(2):169-175.
[27]熊承良,吳明章,劉繼紅,等.人類精子學[M].武漢:湖北科技出版社,2002.
XIONG C L,WU M Z,LIU J H,et al.Human sperm[M].Wuhan:Hubei Science and Technology Press,2002.(in Chinese)
[28]OSTERMEIER G C,DIX D J,MILLER D,et al.Spermatozoal RNA profiles of normal fertile men[J].Lancet,2002,360(9335):772-777.
[29]LI H G,DING X F,LIAO A H,et al.Expression of CatSper family transcripts in the mouse testis during post-natal development and human ejaculated spermatozoa:relationship to sperm motility[J].MolHumReprod,2007,13(5):299-306.
[30]DAS P J,PARIA N,GUSTAFSON-SEABURY A,et al.Total RNA isolation from stallion sperm and testis biopsies[J].Theriogenology,2010,74(6):1099-1106.
[31]CHEN X,WANG Y,ZHU H,et al.Comparative transcript profiling of gene expression of fresh and frozen-thawed bull sperm[J].Theriogenology,2015,83(4):504-511.
[32]HWANG J Y,MULLIGAN B P,KIM H M,et al.Quantitative analysis of sperm mRNA in the pig:relationship with early embryo development and capacitation[J].ReprodFertilDev,2013,25(5):807-817.
[33]ZHAO Y,LI Q,YAO C,et al.Characterization and quantification of mRNA transcripts in ejaculated spermatozoa of fertile men by serial analysis of gene expression[J].HumReprod,2006,21(6):1583-1590.
[34]張俊芳,朱化彬,張留光,等.精子形成期基因轉錄表達的研究進展[J].遺傳,2013,35(5):587-594.
ZHANG J F,ZHU H B,ZHANG L G,et al.Advance on research of gene expression during spermiogenesis at transcription level[J].Hereditas(Beijing),2013,35(5):587-594.(in Chinese)
[35]CAPPALLO-OBERMANN H,SCHULZE W,JASTROW H,et al.Highly purified spermatozoal RNA obtained by a novel method indicates an unusual 28S/18S rRNA ratio and suggests impaired ribosome assembly[J].MolHumReprod,2011,17(11):669-678.
[36]衛晉雄,趙怡芳.激光顯微切割技術的發展和應用[J].國外醫學口腔醫學分冊,2003,30(4):295-296,299.
WEI J X,ZHAO Y F.Development and application of laser microdissection[J].InternationalJournalofStomatology,2003,30(4):295-296,299.(in Chinese)
(編輯程金華)
The Preparation and Quantity Analysis of Trace RNA from Round Spermatids,Elongated Spermatids and Mature Sperm of Dairy Cattle
REN Xiao-xia1,CHEN Xiao-li1,LI Xiu-ling2,WANG Yan2,QIN Tong1,WANG Dong1*
(1.TheKeyLarboratoryforFarmAnimalGeneticandUtilizationofMinistryofAgricultureofChina,InstituteofAnimalScience,ChineseAcademyofAgriculturalSciences,Beijing100193,China;2.AnimalDiseaseControlCenterofDaxingDestrictinBeijing,Beijing102600,China)
To explore the method to capture dairy cattles round and elongated spermatids and build the stable system extracting sperm RNA and analyzing the RNA quantity of spermatogenic cells,the round and elongated spermatids were captured by laser capture microdissection (LCM) combined with the technology of frozen section,and sperm samples were obtained using the method of sperm floating from epididymids.Compared the reported sperm RNA preparation methods,a better RNA preparation result was obtained from dairy cattle sperm using RNeasy Kit,and the better RNA preparation results were also obtained from round and elongated spermatids using PicoPure RNA Isolation Kit.Besides,the removal results of contaminated somatic cells and genomic DNA were tested by reverse transcription polymerase chain reaction(RT-PCR).The one-way analysis of variance showed that the round and elongated spermatids were successfully captured by LCM,the high quality RNA was extracted from sperm using RNeasy Kit,and the RNA quantity of each sperm was 0.023-0.025 pg.The RNA quantity decreased by 750-fold from round to elongated spermatids.The exploration that capture spermatogenic cells from complex tissues and extract RNA from less RNA containing cells will provide an important reference for the study on mechanism of spermatogenesis and spermiogenesis.
spermatogenic cells;transcripts;laser capture microdissection;epididymis;expression
10.11843/j.issn.0366-6964.2016.08.004
2016-02-02
國家自然科學基金(31372296)
任小霞(1988-),女,河南新鄉人,碩士生,主要從事動物遺傳育種與繁殖研究,E-mail:13552641190@163.com
王棟,博士,研究員,主要從事動物遺傳育種與繁殖研究,E-mail:dwangcn2002@vip.sina.com
S814
A
0366-6964(2016)08-1546-09

