高原地區小尾寒羊附睪細胞外基質相關蛋白分布特征研究
李 聰,袁莉剛,張 勇
(甘肅農業大學動物醫學院,蘭州 730070 )
?
高原地區小尾寒羊附睪細胞外基質相關蛋白分布特征研究
李聰,袁莉剛*,張勇
(甘肅農業大學動物醫學院,蘭州 730070 )
旨在研究高原地區小尾寒羊附睪細胞外基質相關蛋白的分布特征。應用Masson’s、Gomori’s、PAS和 AB-PAS(pH=2.5)組織化學染色方法觀察5只健康成年高原地區小尾寒羊附睪的組織結構特點,進而用免疫組織化學SP法觀察層粘連蛋白(LN)、Ⅳ型膠原蛋白(Col Ⅳ)和硫酸乙酰肝素蛋白多糖(HSPG)的分布特征。高原地區小尾寒羊附睪各部分管腔為柱狀纖毛上皮,附睪尾間質膠原纖維和網狀纖維較附睪頭及附睪體明顯增多。PAS反應顯示附睪頭和附睪尾陽性強于附睪體,AB-PAS反應顯示附睪頭、體、尾陽性差異較小。免疫組織化學顯示,Col Ⅳ在附睪頭和附睪體組織中表達最強,HSPG次之,LN表達較弱,HSPG和LN的陽性表達差異不顯著(P>0.05);而HSPG在附睪尾組織中表達最強,LN次之,Col Ⅳ表達較弱,HSPG和LN的陽性表達差異不顯著(P>0.05)。高原地區小尾寒羊附睪尾間質膠原纖維和網狀纖維的分布較附睪頭和附睪體多,附睪各部分中PAS的反應強弱與附睪上皮分泌功能的變化密切相關,附睪頭和附睪尾輸精管的分泌功能增強。附睪頭上皮基細胞Col Ⅳ、HSPG和LN分泌增加,且Col Ⅳ、HSPG和LN與血管的調節作用密切相關。
高原地區小尾寒羊;附睪;Ⅳ型膠原蛋白;層粘連蛋白;硫酸乙酰肝素蛋白多糖;組織化學
小尾寒羊四季發情,全年可配種,具有極高的繁殖力,是中國獨特的遺傳資源[1]。哺乳動物附睪具有儲存、轉運和成熟精子的作用[2],分布于附睪管固有層、上皮和間質區的細胞外基質(Extracellular matrix,ECM)主要包括膠原蛋白I、III、Ⅳ (Type Ⅳ Collage,Col Ⅳ)、層粘連蛋白(Laminin,LN)、硫酸乙酰肝素蛋白多糖(Heparan sulfate proteoglycan,HSPG)等,能夠維持組織和細胞的形態和功能,并在生長、分化過程中起重要作用[3]。
哺乳動物睪丸生精小管基膜富含Col Ⅳ、LN、HSPG、制動素以及纖維粘蛋白等[4]。Col Ⅳ是由α肽鏈組成的異源三聚體螺旋結構的非原纖維膠原蛋白,形成器官基膜的力學結構[5];HSPG則是由5個復雜結構域組成的蛋白多糖,維持基膜的穩定性并與基膜的濾過作用有關[6];而由α、β、γ 3種肽鏈組成的異源三聚體糖蛋白LN是基膜中最豐富的一種ECM[7]。成年小鼠附睪各部分管壁基膜有Ⅳ型膠原和LN的分布[8]。附睪ECM成份在其生長繁殖過程中有重要調控的作用。筆者的前期研究表明,高原型成年藏綿羊附睪各部分中PAS(Periodic acid-schiff stain,PAS)的反應強弱與附睪上皮分泌功能的變化密切相關,Col Ⅳ參與基膜的物質轉運;HSPG與血-附睪屏障構成相關;LN與基膜的形成及其他ECM的合成和分泌有關[9]。高原地區小尾寒羊對青藏高原的環境有很強的適應性,能在氣候寒冷、牧草生長期短、空氣稀薄的惡劣環境下生活并繁育后代,附睪細胞外基質在高原地區小尾寒羊的生殖繁育過程中起到重要的調控作用。在此基礎上,本研究采用組織化學方法對高原地區小尾寒羊附睪組織中ECM相關纖維(膠原纖維、網狀纖維)、糖(糖原、酸性粘多糖及中性粘多糖)以及蛋白(LN、Col Ⅳ和HSPG)等成份的分布特征進行比較觀察,分析高原低氧環境對小尾寒羊的精子成熟環境的影響,為進一步研究高寒地區小尾寒羊生殖發育特點提供參考資料。
1 材料與方法
1.1試驗動物
健康2歲成年小尾寒羊附睪樣品采自青海牧民養殖場,共5對,通過睪丸摘除手術采集。以4%中性福爾馬林溶液固定3 d后備用。
1.2主要試劑
Ⅳ型膠原兔抗鼠多克隆抗體(bs-4595R)、LN兔抗鼠多克隆抗體(bs-8561R)和HSPG兔抗鼠多克隆抗體(bs-5072R)購自北京博奧森生物技術有限公司;免疫組化染色試劑盒(sp-0023)購自北京博奧森生物技術有限公司;DAB顯色試劑盒(ZLI-9018)和(ZLI-9502)購自北京中杉金橋生物技術有限公司。
1.3普通切片制備
新鮮組織樣品稱重測量,記錄解剖數據,4%中性福爾馬林溶液固定,常規石蠟包埋,連續切片(片厚 5 μm),相鄰切片分為8套,其中3套分別用于Ⅳ型膠原(Col Ⅳ)、LN和HSPG免疫組織化學SP法染色,剩5套用于組織化學Masson’s、Gomori’s、PAS、AB-PAS (Alcian blue-periodic acid schiff,pH=2.5)染色及陰性對照。
1.4組織化學染色法
切片脫水、脫蠟后分別進行Masson’s、Gomori’s、PAS和AB-PAS染色,之后繼續進行脫水、透明,然后封片、觀察、拍照。Masson’s三色(亮綠)染色,膠原纖維呈現藍綠色,細胞核呈現灰黑或灰藍色,紅細胞呈紅色;Gomori’s銀染顯示網狀纖維為灰色,蘇木素-伊紅復染后呈棕紅色;PAS染色顯示糖原及其他PAS反應陽性物質均呈陽性,細胞核呈藍色;AB-PAS(pH=2.5)染色顯示酸性黏液物質呈藍色,中性黏液物質呈紅色,混合呈紫紅色,細胞核呈淺藍色。
1.5免疫組織化學SP法檢測Col Ⅳ、LN和HSPG的分布
免疫組織化學SP法進行染色;切片脫水、脫蠟后,進行高溫高壓抗原修復,后加一抗,一抗用Col Ⅳ、LN和HSPG多克隆抗體,Col Ⅳ按1∶400比例稀釋,LN和HSPG均按1∶600比例稀釋,陰性對照組用0.01 mol·L-1的PBS代替一抗(Col Ⅳ、LN和HSPG),4 ℃過夜,孵育、清洗、顯色、脫水、透明、封片。然后顯微鏡進行觀察、照相。
1.6圖像分析
光鏡下觀察免疫組織化學切片隨機選取5張,每組切片中在400倍顯微鏡(Olympus)下進行拍照,每張切片照片采集5個視野,用Image-Pro Plus6.0軟件進行圖像分析,測定陽性反應物的平均光密度,并用SPSS 21.0統計軟件對數據進行單因素方差分析,結果用“平均值±標準差”表示,P<0.05為差異顯著,P<0.01為差異極顯著。
2 結 果
2.1高原地區小尾寒羊附睪纖維及糖成份的組織化學特征
光鏡下,高原地區小尾寒羊附睪各管腔上皮可見4~5層上皮細胞,管周肌樣細胞胞核呈長梭形圍繞各附睪管固有膜外周,大量成熟精子分布于腔面(圖1F);間質結締組織較發達,富含膠原纖維(圖1A~C)、網狀纖維和血管(圖1D~F),且附睪頭和附睪體間質膠原纖維(圖1A,B)和網狀纖維(圖1D,E)較少,附睪尾間質膠原纖維(圖1C)和網狀纖維(圖1F)明顯增多;附睪頭和附睪體管腔內纖毛較長(圖1D,B),而附睪尾管腔內纖毛較短,變為刷狀緣結構清晰(圖1F)。PAS染色顯示各附睪管上皮固有膜、間質毛細血管壁、基細胞、管周肌樣細胞及腔面精子紫紅色糖原陽性條帶明顯(圖1G~I),附睪頭上皮游離緣和附睪尾刷狀緣呈強陽性(圖1G,I),且附睪頭和附睪尾PAS陽性反應強于附睪體(圖1G~I)。AB-PAS染色顯示各部分細胞核為藍色,附睪各部分毛細血管內皮細胞、柱狀上皮下固有膜、基細胞及管周肌樣細胞呈深紫紅色(圖1J~L),附睪頭和附睪尾上皮游離緣和腔面精子呈深紫紅色(圖1J,L),但附睪頭、體、尾AB-PAS陽性強弱差異較小(圖1J~L)。
2.2高原地區小尾寒羊附睪組織中Col Ⅳ、LN和HSPG的分布
高原地區小尾寒羊附睪細胞外基質相關蛋白免疫組織化學染色顯示,Col Ⅳ在附睪頭上皮基細胞、血管內皮細胞和腔面精子呈強陽性表達,其他上皮細胞和纖毛呈中等陽性表達,管周肌樣細胞呈弱陽性表達(圖2A);在附睪體和附睪尾管腔上皮細胞、纖毛和腔面精子呈強陽性表達,血管內皮細胞和管周肌樣細胞呈弱陽性表達(圖2B,C),但附睪頭陽性表達率高于附睪體,附睪體陽性表達率高于附睪尾(表1)。HSPG在附睪頭上皮基細胞和血管內皮細胞呈強陽性表達,其他上皮細胞和纖毛呈中等陽性表達,管周肌樣細胞呈弱陽性表達(圖2D);在附睪體和附睪尾管腔上皮細胞和纖毛呈強陽性表達,血管內皮細胞、管周肌樣細胞和腔面精子呈弱陽性表達(圖2E,F),但附睪頭的陽性表達率高于附睪體和附睪尾,附睪體和附睪尾的陽性表達率差異較小(表1)。LN在附睪頭上皮基細胞、血管內皮細胞和腔面精子呈強陽性表達,其他上皮細胞、纖毛和管周肌樣細胞成中等陽性表達(圖2G);在附睪體和附睪尾管腔上皮細胞、纖毛和血管內皮細胞呈強陽性表達,腔面精子和管周肌樣細胞呈弱陽性表達(圖2H,I),但附睪頭的陽性表達率高于附睪體和附睪尾,附睪體和附睪尾的陽性表達率差異較小(表1)。各蛋白陰性對照無表達(圖2J~L)。
表1高原地區小尾寒羊附睪Col Ⅳ、LN和HSPG的平均光密度
Table 1The average optical density of Col Ⅳ、LN and HSPG in epididymitis of Small-tail Han sheep in plateau
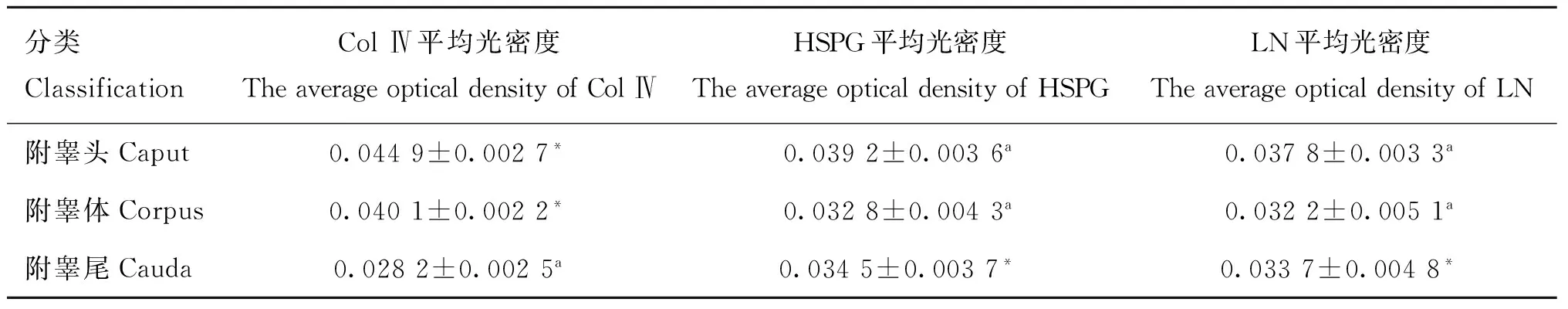
分類ClassificationColⅣ平均光密度TheaverageopticaldensityofColⅣHSPG平均光密度TheaverageopticaldensityofHSPGLN平均光密度TheaverageopticaldensityofLN附睪頭Caput0.0449±0.0027*0.0392±0.0036a0.0378±0.0033a附睪體Corpus0.0401±0.0022*0.0328±0.0043a0.0322±0.0051a附睪尾Cauda0.0282±0.0025a0.0345±0.0037*0.0337±0.0048*
同行標有*表示差異顯著(P<0.05);標有相同字母的無明顯差異(P>0.05)
In the column, *means significant difference between groups(P<0.05),same letters means no significant difference between groups(P>0.05)
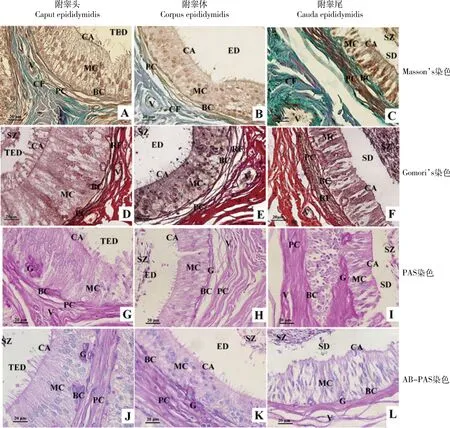
BC.基細胞;CA.纖毛;CF.膠原纖維;ED.附睪管;G.糖原;MC.主細胞;PC.管周肌樣細胞;RF.網狀纖維;SD.輸精管;SZ.精子;TED.睪丸輸出管;V.血管。A、D、G、J.成年高原地區小尾寒羊睪丸輸出管;B、E、H、K.成年高原地區小尾寒羊附睪管;C、F、I、L.成年高原地區小尾寒羊輸精管BC.Basal cells; CA.Cilia; CF. Collagen fiber; ED.Epididymal duct; G.Glycogen; MC.Main cells; PC.Peritubular myoid cells; RF.Reticular fiber; SD.Seminiferous duct; SZ.Spermatozoon; TED.Testicular efferent duct; V.Vessel.A,D,G,J.The structure of testicular efferent duct in Small-tail Han sheep in plateau. Masson’s staining. B,E,H,K.The structure of epididymal duct in Small-tail Han sheep in plateau. Masson’s staining. C,F,I,L.The structure of seminiferous duct in Small-tail Han sheep in plateau. Masson’s staining. 圖1 高原地區小尾寒羊附睪Masson’s、Gomori’s、PAS和AB-PAS組織化學染色(bar=20 μm)Fig.1 The histochemistry of Masson’s,Gomori’s,PAS and AB-PAS staining in epididymis of Small-tail Han sheep in plateau (bar=20 μm)
統計結果表明,LN、HSPG和Col Ⅳ在附睪體和附睪尾的表達規律相一致。Col Ⅳ在附睪頭和附睪體組織中表達最強,HSPG次之,LN表達較弱,HSPG和LN的陽性表達差異不顯著(表1,P>0.05);而HSPG在附睪尾組織中表達最強,LN次之,Col Ⅳ表達較弱,HSPG和LN的陽性表達差異不顯著(表1,P>0.05)。
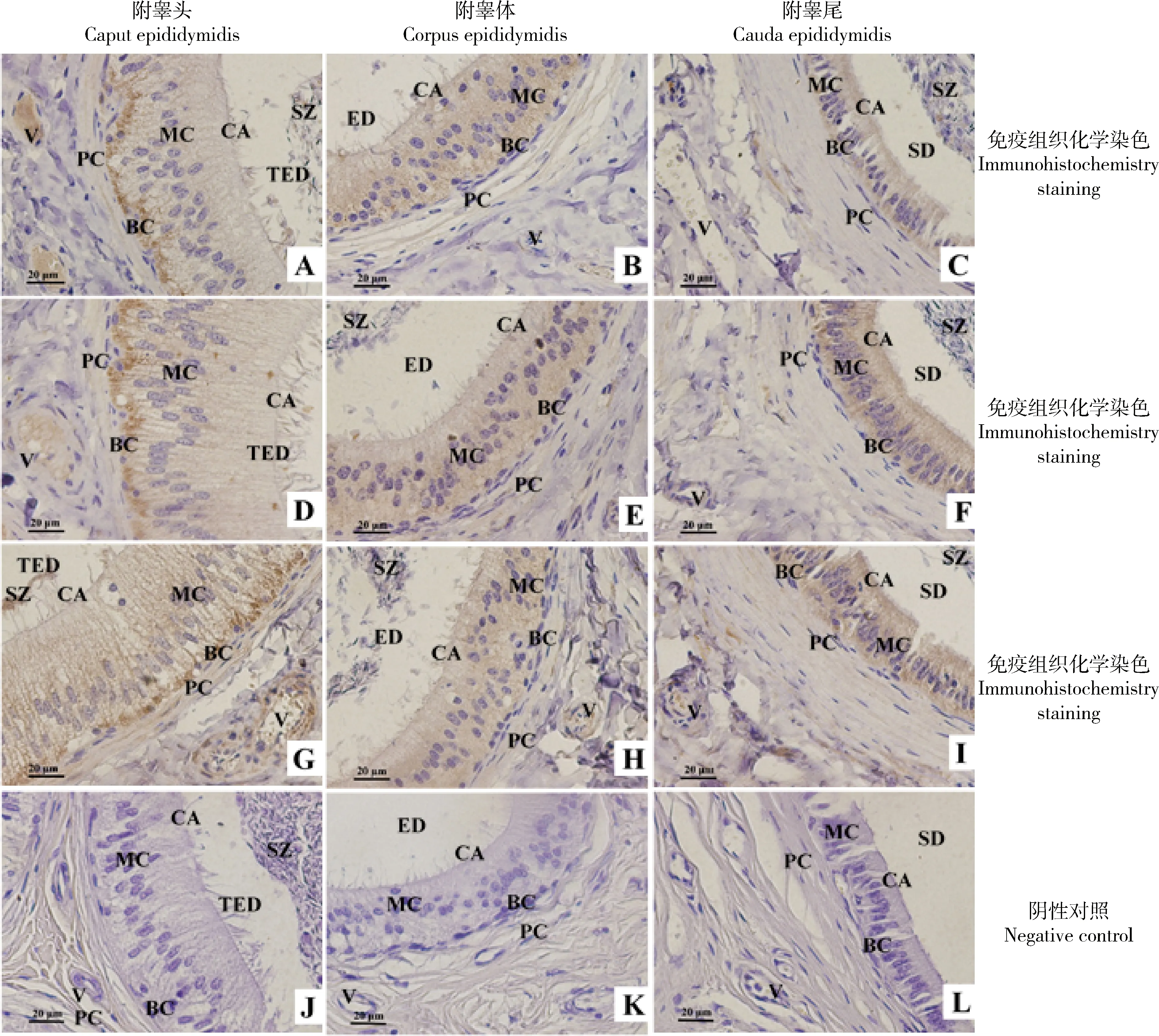
BC.基細胞;CA.纖毛;ED.附睪管;MC.主細胞;PC.管周肌樣細胞;SD.輸精管;SZ.精子;TED.睪丸輸出管;V.血管。A、D、G.Col IV、HSPG和LN在成年高原地區小尾寒羊睪丸輸出管中的表達;B、E、H.Col IV、HSPG和LN在成年高原地區小尾寒羊附睪管中的表達;C、F、I.Col IV在成年高原地區小尾寒羊輸精管中的表達;J、K、L.陰性對照BC.Basal cells; CA.Cilia; ED.Epididymal duct; MC.Main cells; PC.Peritubular myoid cells; SD.Seminiferous duct; SZ.Spermatozoon; TED.Testicular efferent duct; V.Vessel.A,D,G.The expresstion of Col IV,HSPG and LN in testicular efferent duct of Small-tail Han sheep in plateau;B,E,H.The expresstion of Col IV,HSPG and LN in epididymal duct of Small-tail Han sheep in plateau; C,F,I.The expresstion of Col IV,HSPG and LN in seminiferous duct of Small-tail Han sheep in plateau. J,K,L.Negative control圖2 高原地區小尾寒羊附睪的免疫組織化學染色 (bar=20 μm)Fig.2 The immunohistochemical staining in epididymidis of Small-tail Han sheep in plateau (bar=20 μm)
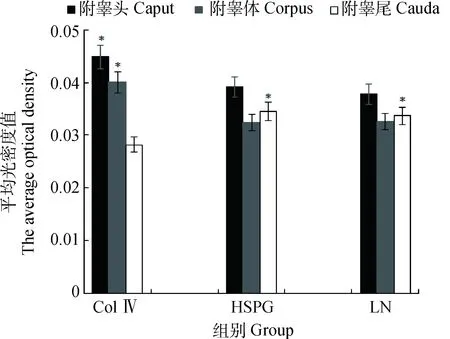
Col Ⅳ表達的平均光密度值在高原地區成年小尾寒羊附睪頭和附睪體具有統計學顯著差異(與HSPG和LN組相比,P<0.05);HSPG和LN表達的平均光密度值在高原地區成年小尾寒羊附睪尾具有統計學顯著差異(與Col Ⅳ組相比,P<0.05)The average optical density of Col Ⅳ expression was significantly higher in caput and corpus of Small-tail Han sheep in plateau(compared with counterparts of HSPG and LN);The average optical density of LN and HSPG expression was significantly higher in cauda of Small-tail Han sheep in plateau(compared with counterparts of Col Ⅳ)圖3 Col Ⅳ、LN和HSPG在高原地區成年小尾寒羊附睪表達平均光密度檢測柱形圖Fig.3 Column graph of average optical density of Col Ⅳ,LN and HSPG in epididymitis of Small-tail Han sheep in plateau
3 討 論
附睪ECM各成份以纖維、蛋白多糖及基質等各種形式參與附睪管的構建。多數器官中Ⅰ型膠原纖維和Ⅲ型膠原纖維并存,以Ⅰ型膠原纖維為主[10]。小鼠附睪管外圍為Ⅰ型膠原纖維,其含量從附睪頭至附睪尾逐漸增加[11]。D.R.Keene等[12]發現Ⅰ型膠原纖維有較強的伸展性。本研究中小尾寒羊附睪各管腔外圍膠原纖維豐富,但附睪尾膠原纖維的分布較附睪頭和附睪體明顯增多,可能與Ⅰ型膠原纖維良好的伸展性促進附睪尾的收縮功能運送精子到輸精管有關。網狀纖維位于疏松結締組織,由Ⅲ型膠原蛋白形成,并常伴其他類型的膠原、蛋白多糖和糖蛋白[13]。隨著年齡的增長,網狀纖維可以轉化為膠原纖維[14],F.A.Fakoya等[15]發現大鼠睪丸間質中的網狀纖維可以為精子形成過程中精子從生精小管上皮到腔面的遷移提供結構支持。本研究中小尾寒羊附睪各管腔外圍網狀纖維較豐富,但附睪尾網狀纖維的分布較附睪頭和附睪體明顯增多,提示網狀纖維的分布規律與膠原纖維一致,附睪間質網狀纖維可能也為精子的成熟提供結構支持,附睪尾間質網狀纖維較多可能與其較強的收縮能力促進精子運輸有關。
附睪為精子的貯存和成熟提供了適宜的微環境,具有分泌、吸收、收縮和濃縮等功能。P.M.Wassarman等[16]認為精子與卵子的特異性識別是依賴于精子表面的糖蛋白和透明帶糖蛋白互補而實現的,精子表面的中性和酸性粘多糖參與細胞之間的識別及信息交流。本研究中小尾寒羊各附睪管PAS和AB-PAS染色腔面精子可見較強陽性反應帶,提示精子表面的中性和酸性粘多糖在附睪管中已經具備,為進一步精子與卵子的特異性識別奠定物質基礎。B.C.Moore等[17]發現美國短吻鱷睪丸組織PAS和AB-PAS反應顯示基膜和管周肌樣細胞呈陽性。本研究中小尾寒羊各附睪管PAS和AB-PAS反應顯示基膜和管周肌樣細胞均有紫紅色陽性反應條帶,提示基膜和管周肌樣細胞與中性和酸性粘多糖的合成有關。R.E.Glegg等[18]發現網狀纖維較豐富的區域,其PAS反應也較強;與本研究結果一致,小尾寒羊附睪尾間質網狀纖維分布較多,PAS反應也較強。亮細胞主要存在于大鼠附睪的尾部,是PAS陽性細胞分泌周期中的一種狀態[19];大白鼠附睪頭、體、尾PAS反應陽性逐漸增強是因為亮細胞的數量逐漸增多導致[20]。本研究中PAS染色顯示各附睪管上皮固有膜、間質毛細血管壁、基細胞、管周肌樣細胞及腔面精子紫紅色糖原陽性條帶明顯,附睪頭上皮游離緣和附睪尾刷狀緣呈強陽性,且附睪頭和附睪尾PAS陽性反應強于附睪體,提示PAS反應的強弱和亮細胞的數量有直接關系,附睪尾PAS反應較強與亮細胞數量較多及網狀纖維含量較多有關。附睪上皮PAS的反應強弱與附睪上皮分泌功能的變化密切相關,附睪尾分泌功能較強,而附睪頭PAS反應較強,提示附睪頭亮細胞數目較多,分泌功能增強。AB-PAS陽性反應的糖原、糖蛋白和蛋白多糖典型存在于結締組織黏液以及基膜中[17]。本研究中AB-PAS染色顯示各部分細胞核為藍色,附睪各部分毛細血管內皮細胞、柱狀上皮下固有膜、基細胞及管周肌樣細胞呈深紫紅色,附睪頭和附睪尾上皮游離緣和腔面精子呈深紫紅色,但附睪頭、體、尾陽性反應強弱差異較小,提示各附睪管上皮下固有膜和間質區域富含酸性粘多糖。本研究中小尾寒羊附睪頭、體、尾AB-PAS陽性反應強弱差異較小,而附睪頭和附睪尾PAS陽性反應強于附睪體,提示附睪頭、體、尾各管腔酸性粘多糖的含量差異較小,附睪頭和附睪尾管腔中性粘多糖含量較附睪體多,而附睪頭和附睪尾的分泌能力強于附睪體,附睪上皮的分泌能力對中性及酸性粘多糖含量的影響有待于進一步的探究。
Col Ⅳ是基膜的主要膠原成分,形成結構網架,廣泛存在于各種基膜中,使其具有韌性和通透性,對基質和細胞間物質交換具有篩板作用[21]。Col Ⅳ主要在上皮或內皮細胞合成,是上皮細胞或內皮細胞等生長的依附和支架,不僅有促進血管生成的作用,還可以抑制血管生成[22]。本研究中Col Ⅳ在小尾寒羊附睪頭上皮基細胞和血管內皮細胞呈強陽性表達;在附睪體和附睪尾管腔基膜呈強陽性表達,血管內皮細胞呈弱陽性表達,提示Col Ⅳ對基膜及基膜上基細胞有一定的調節作用,與血管的生成也有密切的關系。在哺乳動物的附睪中,各附睪管基膜是ECM的特殊型,可以作為細胞遷移的附著物和選擇性濾過屏障[23],而膠原是良好的細胞粘附基質,在組織中含量豐富[24]。本研究中Col Ⅳ在小尾寒羊各附睪管基膜均為強陽性表達,提示Col Ⅳ參與基膜和細胞間的物質轉運。研究表明牦牛犢牛睪丸管周肌樣細胞與Ⅳ型膠原的合成和分泌有關[25]。本研究中小尾寒羊各附睪管管周肌樣細胞均為弱陽性表達,提示附睪各段管周肌樣細胞分泌Col Ⅳ的能力較弱。
HSPG是基膜中普遍存在的重要成分,具有細胞黏附、聚集及構建組織的作用,能結合基膜的LN和Col Ⅳ等多種成分,并與ECM的多樣性密切相關[26]。免疫組化研究證實,HSPG在成熟且高度分化的上皮細胞不表達[27]。本研究中HSPG在小尾寒羊附睪頭上皮基細胞呈強陽性表達,其他上皮細胞呈中等陽性表達;而在附睪體和附睪尾管腔上皮細胞呈強陽性表達,表明HSPG在附睪頭除基細胞外的其他上皮細胞表達較弱可能與附睪頭除基細胞外其他上皮細胞的分化程度有關。HSPG可作為血管生長因子的儲存庫[28]。HSPG大量表達于血管內皮細胞表面,在血管形成過程中,內皮細胞表面HSPG可作為某些血管生長因子和抑制因子的輔助受體發揮調節作用[29]。本研究中HSPG在小尾寒羊附睪頭間質血管呈強陽性表達,而在附睪體和附睪尾間質血管呈弱陽性表達,提示HSPG在血管發育過程中有重要的調節作用。本研究中小尾寒羊各附睪管管周肌樣細胞均為弱陽性表達,提示小尾寒羊附睪各段管周肌樣細胞分泌HSPG的能力較弱。
LN屬于糖蛋白,為基膜的主要成分之一,具有促進細胞黏附、調節細胞形態、分化及細胞移動等作用[24]。研究表明LN由位于基膜上的上皮細胞合成[30],本研究中LN在小尾寒羊各附睪管基膜均為強陽性表達,提示LN和基膜的形成密切相關。睪丸生精小管基膜的基本成分如LN是PAS特殊反應陽性糖蛋白[17],因此,本研究中各附睪管基膜基本成分LN可能與PAS合成及分泌相關。LN由血管內皮細胞分泌[31]。本研究中小尾寒羊各附睪間質血管內皮細胞均為強陽性表達,LN對血管生長有重要作用。牦牛犢牛睪丸管周肌樣細胞可能與LN的合成和分泌有關[25]。本研究中小尾寒羊附睪頭管周肌樣細胞呈中等陽性表達,而附睪體和附睪尾各管周肌樣細胞呈弱陽性表達,提示附睪頭管周肌樣細胞分泌LN的能力強于附睪體和附睪尾。HSPG可以和Ⅳ型膠原和LN構成基膜[32],LN通過巢蛋白與Ⅳ型膠原形成穩定的基膜[33]。本研究中小尾寒羊各附睪管管腔LN與HSPG和Col Ⅳ的表達規律基本一致,提示LN的形成與HSPG和Col Ⅳ有關。
4 結 論
高原地區小尾寒羊附睪尾間質膠原纖維和網狀纖維的分布較附睪頭和附睪體多,附睪各部分中PAS的反應強弱與附睪上皮分泌功能的變化密切相關,附睪頭和附睪尾輸精管的分泌功能增強。附睪頭上皮基細胞Col Ⅳ、HSPG和LN分泌增加,且Col Ⅳ、HSPG和LN與血管的調節作用密切相關。
[1]張英杰,劉月琴,儲明星.小尾寒羊高繁殖力和常年發情內分泌機理的研究[J].畜牧獸醫學報,2001,32(6):510-516.
ZHANG Y J,LIU Y Q,CHU M X.Study on endocrine basis of prolificacy and non-seasonal estrus in small tail han sheep[J].ActaVeterinariaetZootechnicaSinica,2001,32(6):510-516.(in Chinese)
[2]成令忠.組織學[M].第二版.北京:人民衛生出版社,1994.
CHENG L Z.Histology[M].2nded.Beijing:People’s Medical Press,1994.(in Chinese)
[3]SWINEHART I T,BADYLAK S F.Extracellular matrix bioscaffolds in tissue remodeling and morphogenesis[J].DevDyn,2016,245(3):351-360.
[4]宋陽,許增祿.睪丸細胞外間質作用的研究[J].解剖學報,1997,28(2):221-223.
SONG Y,XU Z L.Study on role of the testis extracellular matrix[J].ActaAnatomicaSinica,1997,28(2):221-223.(in Chinese)
[5]HUDSON B G,REEDERS S T,TRYGGVASON K.Type Ⅳ collagen:structure,gene organization,and role in human diseases.Molecular basis of Goodpasture and Alport syndromes and diffuse leiomyomatosis[J].JBiolChem,1993,268(35):26033-26036.
[6]FARACH-CARSON M C,WARREN C R,HARRINGTON D A,et al.Border patrol:insights into the unique role of perlecan/heparan sulfate proteoglycan 2 at cell and tissue borders[J].MatrixBiol,2014,34:64-79.
[7]KRUEGEL J,MIOSGE N.Basement membrane components are key players in specialized extracellular matrices[J].CellMolLifeSci,2010,67(17):2879-2895.
[8]崔麗,許增祿,劉霄,等.小鼠附睪Ⅳ型膠原和層粘連蛋白的分布[J].解剖學報,1999,30(3):273-275.
CUI L,XU Z L,LIU X,et al.Distribution of type Ⅳ collagen and laminin in the mice epididymis[J].ActaAnatomicaSinica,1999,30(3):273-275.(in Chinese)
[9]李聰,袁莉剛,曲亞玲,等.高原型藏綿羊附睪細胞外基質的組織化學研究[J].畜牧獸醫學報,2016,47(4):820-827.
LI C,YUAN L G,QU Y L,et al.The histochemical study of extracellular matrix in plateau tibetan sheep epididymis[J].ActaVeterinariaetZootechnicaSinica,2016,47(4):820-827.(in Chinese)
[10]陶凱忠,陳爾瑜,丁光宏.膠原纖維的結構和生物力學[J].解剖科學進展,1998,4(4):289-293.
TAO K Z,CHEN E Y,DING G H.The structure and biomechanics of collagen fibers[J].ProgressofAnatomicalSciences,1998,4(4):289-293.(in Chinese)
[11]崔麗,劉霄,許增祿,等.小鼠附睪細胞外間質發育的研究[J].中國醫學科學院學報,1996,18(4):318.
CUI L,LIU X,XU Z L,et al.Study of extracellular matrix in the mice epididymis (briefing)[J].ActaAcademiaeMedicinaeSinicae, 1996,18(4):318.(in Chinese)
[12]KEENE D R,SAKAI L Y,BCHINGER H P,et al.Type III collagen can be present on banded collagen fibrils regardless of fibril diameter[J].JCellBiol,1987,105(5):2393-2402.
[13]蔡新華,郭志坤,毛會麗,等.大鼠心肌組織中網狀纖維組織學構筑及增齡變化[J].解剖學報,2009,40(1):127-129.
CAI X H,GUO Z K,MAO H L,et al.Histological architecture of reticular fibers and age-related changes of myocardial tissue in rats[J].ActaAnatomicaSinica, 2009,40(1):127-129.(in Chinese)
[14]上海第一醫學院.組織學[M].北京:人民衛生出版社,1981.
The First Medical College in Shanghai.Histology[M].Beijing:People’s Medical Press,1981.(in Chinese)
[15]FAKOYA F A.Reticulin fibres in the tunica albuginea and peritubular tissue of seminiferous tubules of adult male Wistar rats[J].ActaHistochem,2002,104(3):279-283.
[16]WASSARMAN P M,LITSCHER E S.A bespoke coat for eggs:getting ready for fertilization[J].CurrTopDevBiol,2016,117:539-552.
[17]MOORE B C,HAMLIN H J,BOTTERI N L,et al.Posthatching development of Alligator mississippiensis ovary and testis[J].JMorphol,2010,271(5):580-595.
[18]GLEGG R E,EIDINGER D,LEBLOND C P.Some carbohydrate components of reticular fibers[J].Science,1953,118(3073):614-616.
[19]薛同一,謝蔚英,朱繼業.大鼠、牛、豬和羊附睪上皮內富有PAS陽性顆粒細胞的組織學觀察[J].解剖學報,1984,15(3):318-320.
XUE T Y,XIE W Y,ZHU J Y.Histological observation on PAS-positive granular cells in epididymal epithelium from rat,bull,swine and ram[J].ActaAnatomicaSinica,1984,15(3):318-320.(in Chinese)
[20]湯美蓉,齊易詳.大白鼠附睪的結構和功能Ⅰ.組織學和PAS反應[J].皖南醫學院學報,1987,6(2):108-111.
TANG M R,QI Y X.Structure and function of the rat epididymis.I.Histology and PAS reaction[J].MctaAcademiaeMedicinaeWannan,1987,6(2):108-111.(in Chinese)
[21]HARVEY S J,PERRY J,ZHENG K,et al.Sequential expression of type Ⅳ collagen networks:testis as a model and relevance to spermatogenesis[J].AmJPathol,2006,168(5):1587-1597.
[22]李戈,楊程顯,李煜生.膠原蛋白Ⅳ的生物學特性研究進展[J].生命科學,2014,26(9):931-935.
LI G,YANG C X,LI Y S.Research progress of molecular and biological characteristics of type Ⅳ collagen[J].ChineseBulletinofLifeSciences, 2014,26(9):931-935.(in Chinese)
[23]OGUZKURT P,KAYASEL?UK F,TUNCER I,et al.Evaluation of extracelluar matrix protein composition in sacs associated with undescended testis,hydrocele,inguinal hernia,and peritoneum[J].Urology,2007,70(2):346-350.
[24]許志強,劉平.細胞外基質的結構與功能[J].肝臟,1999,4(2):92-93.
XU Z Q,LIU P.The structure and function of extracellular matrix[J].ChineseHepatology,1999,4(2):92-93.(in Chinese)
[25]袁莉剛,曲亞玲,朱俊峰,等.牦牛犢牛睪丸結構特征及細胞外基質相關蛋白的分布[J].解剖學報,2015,46(1):106-112.
YUAN L G,QU Y L,ZHU J F,et al.Structure and distribution of extracellular matrix proteins in yak calves testis[J].ActaAnatomicaSinica, 2015,46(1):106-112.(in Chinese)
[26]姜篤銀,付小兵,盛志勇.硫酸乙酰肝素糖蛋白的結構-功能多樣性與相關修飾酶群作用[J].中國病理生理雜志,2005,21(5):1020-1025.
JIANG D Y,FU X B,SHENG Z Y.The diversity of structure and function of heparin sulfate proteoglycans via modification of some relative enzymes[J].ChineseJournalofPathophysiology,2005,21(5):1020-1025.(in Chinese)
[27]HAYASHI K,HAYASHI M,JALKANEN M,et al.Immunocytochemistry of cell surface heparan sulfate proteoglycan in mouse tissues.A light and electron microscopic study[J].JHistochemCytochem,1987,35(10):1079-1088.
[28]李媛,崔慧斐.硫酸乙酰肝素蛋白聚糖與血管形成[J].食品與藥品,2005,7(8):19-23.
LI Y,CUI H F.Heparan sulfate proteoglycan and angiogenesis[J].FoodandDrug, 2005,7(8):19-23.(in Chinese)
[29]PRESTA M,LEALI D,STABILE H,et al.Heparin derivatives as angiogenesis inhibitors[J].CurrPharmDes,2003,9(7):553-566.
[30]譚獸魯,周柔麗.醫學細胞生物學[M].北京:北京醫科大學、中國協和醫科大學聯合出版社,1992.
TAN S L,ZHOU R L.Medical cell biology[M].Beijing:Beijing Medical University and Chinese Peking Union Medical College Unit Press,1992.(in Chinese)
[31]陳光,賀占國,王永海,等.層粘蛋白在頜面部毛細血管瘤組織中的表達[J].實用口腔醫學雜志,1998,14(1):9-10.
CHEN G,HE Z G,WANG Y H,et al.The expression of laminin in maxillofacial capillary hemangioma[J].JournalofPracticalStomatology,1998,14(1):9-10.(in Chinese)
[32]BEHRENS T,VILLONE D,KOCH M,et al.The epidermal basement membrane is a composite of separate laminin-or collagen Ⅳ-containing networks connected by aggregated perlecan,but not by nidogens[J].JBiolChem,2012,287(22):18700-18709.
[33]RAGHAVAN S,GILMONT R R,BITAR K N.Neuroglial differentiation of adult enteric neuronal progenitor cells as a function of extracellular matrix composition[J].Biomaterials,2013,34(28):6649-6658.
(編輯程金華)
The Distribution of Extracellular Matrix Proteins in Small-tail Han Sheep Epididymis in Plateau
LI Cong,YUAN Li-gang*,ZHANG Yong
(CollegeofVeterinaryMedicine,GansuAgriculturalUniversity,Lanzhou730070,China)
To explore the distribution of extracellular matrix proteins in epididymis of Small-tail Han sheep in plateau.The histochemistry of Masson’s,Gomori’s,PAS and AB-PAS(pH=2.5)staining were used to study the microstructure of epididymis in 5 pairs of Small-tail Han sheep in plateau,and the distribution of the laminin (LN),type Ⅳ collagen (Col Ⅳ) and heparan sulfate glycoprotein (HSPG) were identified by SP immunohistochemical method.The observations made with the light microscope showed that the epithelium of epididymal ducts were columnar ciliated and the distribution of the collagen and reticular fibers in the cauda were more abundant than the caput and the corpus,although the PAS positive reaction in the caput and the cauda were stronger than the corpus,but the AB-PAS positive reaction without significant differences in the caput,the corpus and the cauda.Immunohistochemical analysis appeared that Col Ⅳ was strongly presented in the caput and the corpus,the relative expression of HSPG was lower than Col Ⅳ,and LN was expressed weakly,the distribution of LN and HSPG without statistical differences in epididymis (P>0.05),but in the cauda,it was showed that HSPG was strongly presented,the Col Ⅳ was lower than LN and HSPG,and the distribution of LN and HSPG without statistical differences in epididymis (P>0.05).Taken together,the collagen and reticular fibers of the epididymis cauda were more abundant than the caput and corpus in Small-tail Han sheep from plateau,and the positive of the PAS reaction was companied with the changes of the secretion function of epithelium.The secretion of Col Ⅳ,HSPG and LN in the basal cells of caput epithelium were increased than the other parts,and the Col Ⅳ,HSPG and LN might work together closely for the regulation of the vessel.
Small-tail Han sheep in plateau;epididymis;type Ⅳ collagen;laminin;heparan sulfate proteoglycan;histochemistry
10.11843/j.issn.0366-6964.2016.08.006
2016-03-02
甘肅省財政廳基本科研業務項目(2012);國家自然科學基金項目(31160488);甘肅省自然科學研究基金(145RJZA223)
李聰(1991-),女,青海大通人,碩士,主要從事動物發育生物學研究,E-mail:393803599@qq.com
袁莉剛, 教授,E-mail:yuanyuanxi2011@hotmail.com
S852.16+2
A
0366-6964(2016)08-1565-09

