丁苯酞腹腔注射對大鼠局灶性腦缺血再灌注損傷的預防作用及其機制探討
王鵬,劉華坤,張磊,李玉芝,王凱麗
(濟寧市第一人民醫院,山東濟寧 272000)
?
丁苯酞腹腔注射對大鼠局灶性腦缺血再灌注損傷的預防作用及其機制探討
王鵬,劉華坤,張磊,李玉芝,王凱麗
(濟寧市第一人民醫院,山東濟寧 272000)
目的觀察丁苯酞腹腔注射對大鼠局灶性腦缺血再灌注損傷的預防作用,并探討其可能機制。方法60只成年健康SD大鼠隨機分為A、B、C組各20只,A組大鼠腹腔注射400 mg/(kg·d)丁苯酞,B、C組予相同體積生理鹽水,共1周。A、B組均制備局灶性腦缺血再灌注損傷模型,C組僅暴露頸總動脈及分叉處。比較各組大鼠神經行為學評分、腦梗死體積及腦組織凋亡細胞數、核轉錄因子κB(NF-κB)蛋白、NF-κB mRNA。結果與C組比較,A組和B組神經行為評分、腦梗死體積、腦組織凋亡細胞數及NF-κB蛋白、mRNA陽性細胞數增加;與B組比較,A組神經行為評分、腦梗死體積、腦組織凋亡細胞數及NF-κB蛋白、mRNA陽性細胞數減少;P均<0.01。結論丁苯酞對大鼠腦缺血再灌注損傷有預防作用,其機制可能與抑制NF-κB表達、減少腦組織凋亡細胞有關。
丁苯酞;腦缺血再灌注損傷;核轉錄因子κB
使缺血腦組織盡快恢復再灌注是治療腦梗死最有效的方法,然而再灌注往往導致原有缺血腦組織的損害進一步加重,即缺血再灌注損傷。既往研究[1]發現,炎癥因子參與到腦缺血再灌注損傷,其中核轉錄因子κB(NF-κB)信號通路介導的炎癥反應在缺血再灌注損傷中起重要作用。丁苯酞具有抗血小板、促進血管生成、改善循環、減少氧自由基生成、抗凋亡等作用,現已廣泛應用于腦梗死急性期的治療中。研究[2]證實,丁苯酞在腦缺血再灌注中產生腦組織保護作用,其機制可能涉及到抑制炎癥反應,但確切的分子機制尚不明確。本研究觀察了丁苯酞腹腔注射對大鼠局灶性腦缺血再灌注損傷的預防作用,并探討其可能機制。
1 材料與方法
1.1實驗動物及藥品SPF級SD大鼠60只,體質量220~240 g,清潔級,由濟南市藥物檢驗所實驗動物中心提供。丁苯酞購自石藥集團恩必普藥業有限公司。
1.2丁苯酞用法及局灶性腦缺血再灌注損傷模型制備60只SD大鼠隨機分為A、B、C組各20只,A組大鼠腹腔注射400 mg/(kg·d)丁苯酞,B、C組予相同體積生理鹽水,共1周。A、B組用線栓法制備局灶性腦缺血再灌注損傷模型,缺血2 h,將線栓退至頸外動脈殘端恢復再灌注24 h后做相應處理。不符合模型要求的剔除,并及時補遺。C組僅暴露頸總動脈及分叉處。術中均用白熾燈使其肛溫維持在體溫水平,術后單籠飼養。
1.3大鼠神經功能評價于再灌注24 h時按文獻[3]等級評分法對神經功能進行評分,無明顯神經缺損癥狀計0分,不能伸展對側前肢計1分,行走時向對側旋轉計2分,行走時向對側傾倒計3分,不能自行行走伴意識喪失計4分。
1.4大鼠腦梗死體積測算每組隨機選取6只大鼠,于再灌注24 h后麻醉并斷頭取腦,自額極2 mm向后連續等距切取5個冠狀腦片,間距2 mm,2%TTC 37 ℃避光染色10 min。正常腦組織染為紅色,梗死組織為白色。梗死體積=各層梗死面積之和×層間隔(2 mm)。
1.5大鼠腦組織凋亡細胞數觀察采用TUNEL法。高倍鏡下(400×)在梗死灶周圍隨機取4個視野,計數凋亡細胞核數(胞質);正常神經細胞核呈藍色,細胞核中有棕黃色或黃褐色顆粒定義為陽性表達,即凋亡細胞。
1.6大鼠腦組織NF-κB蛋白、mRNA檢測取各組剩余14只大鼠,麻醉后取仰臥固定,依次用生理鹽水、4%甲醛溶液各250 mL經心臟灌注固定,斷頭,完整取腦,置于4%甲醛溶液后固定2 h,蒸餾水浸泡6 h。常規梯度乙醇脫水、二甲苯透明、石蠟包埋。冠狀位切片后4 ℃保存,免疫組化和原位雜交備用。①NF-κB蛋白檢測:采用免疫組化法。石蠟切片脫蠟至水,按SABC免疫組化試劑盒說明染色,DAB顯色。光鏡下觀察胞質或胞核有棕黃色顆粒者為陽性細胞。所有切片均在同一光強度、放大倍數下進行觀察,每張切片先在低倍鏡下隨機選擇額頂葉梗死灶周圍區4個象限視野,然后在高倍鏡下(400×)選擇缺血灶周圍5個不連續的視野計數陽性細胞,取其平均值為該張切片的陽性細胞數。②NF-κB mRNA檢測:采用原位雜交法。石蠟切片常規脫蠟至水,滅活內源性酶;滴加3%檸檬酸新鮮稀釋的胃蛋白酶暴露mRNA核酸片段;室溫后固定10 min,嚴格按照原位雜交檢測試劑盒操作程序進行。陽性細胞胞質呈棕黃色。所有切片均在同一光強度下,同一放大倍數下進行,每張切片先在低倍鏡下隨機選擇額頂葉梗死灶周圍區4個象限視野,然后在高倍鏡下(400×)選擇缺血灶周圍5個不連續的視野計數陽性細胞,取其平均值為該張切片的陽性細胞數。
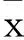
2 結果
2.1兩組神經行為評分、腦梗死體積、腦組織凋亡細胞數比較神經行為評分、腦梗死體積、腦組織凋亡細胞數比較見表1。
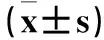
表1 兩組神經行為評分、腦梗死體積、腦組織凋亡細胞數比較
注:與C組比較,aP<0.01;與B組比較,bP<0.01。
2.2兩組腦組織NF-κB蛋白、mRNA表達比較腦組織NF-κB蛋白、mRNA表達比較見表2。
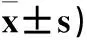
表2 兩組腦組織NF-κB蛋白、mRNA陽性表達細胞數比較(個,
注:與C組比較,aP<0.01;與B組比較,bP<0.01。
3 討論
目前,隨著溶栓治療的普及和神經介入工作的開展,其成為腦梗死血管再通的有效治療方法,然而再灌注早期可能導致致死性腦水腫,出血轉化,神經血管損傷,甚至腦組織死亡。因此,研究潛在內源性神經保護機制在治療缺血再灌注損傷時所起的作用尤為重要。炎癥因子的表達、炎癥反應的異常亢進、神經細胞的凋亡在腦缺血再灌注損傷過程中起重要作用[4]。
NF-κB作為機體廣泛存在的轉錄因子,在調控細胞增殖、凋亡及炎癥反應等靶基因的表達中起重要作用。在腦缺血、腦外傷、蛛網膜下腔出血等均有NF-κB參與[5~7]。大量證據表明,腦缺血再灌注損傷時,NF-κB信號通路激活,導致腦組織損傷加重[1,5,8]。在MCAO的動物模型中,發現恢復再灌注30 min時腦組織NF-κB DNA表達明顯增加[9]。在缺血再灌注時,NF-κB激活導致TNF-α、IL-1β、IL-6等炎癥因子的表達變化,加重腦組織損害,抑制NF-κB激活時改善實驗大鼠神經缺損評分、減少腦梗死體積、減輕腦水腫、降低凋亡細胞數,相應TNF-α、IL-1β、IL-6等炎癥因子的表達減少[10]。另外,NF-κB P50亞基缺陷大鼠在缺血再灌注時腦組織損傷明顯降低[11];而缺血后以藥物處理,發現異氟烷、芍藥苷等通過抑制NF-κB的激活,減少腦組織的損害,產生神經保護作用[12~14]。
目前,丁苯酞已廣泛用于腦梗死的治療中。研究[15~17]發現,丁苯酞通過改善線粒體功能,抑制自由基,維持血腦屏障的完整性,減少腦梗死面積,產生神經保護作用。文獻[2]報道,丁苯酞能抑制炎癥因子NF-κB、TNF-α、IL-6炎癥因子表達產生神經保護作用。丁苯酞腹腔注射可抑制大腦皮層炎癥細胞浸潤,使神經細胞及細胞結構損傷減輕[18]。任建宏等[19]發現,丁苯酞腹腔注射能夠抑制TLR4及內源性配體的表達,進而抑制炎癥反應的發生,發揮腦保護作用。另外,丁苯酞在大鼠缺血再灌注的模型中能夠通過抑制細的凋亡,從而對缺血再灌注所導致損傷起到神經保作用,并且改善效果與缺血再灌注的時間及給予丁苯酞的時間有密切關系[20]。
總之,丁苯酞對大鼠缺血再灌注損傷有預防作用,其機制可能與抑制NF-κB表達、減少腦組織凋亡細胞有關。
[1] Berti R, Williams AJ, Moffett JR, et al. Quantitative real-time RT-PCR analysis of inflammatory gene expression associated with ischemia-reperfusion brain injury [J]. J Cereb Blood Flow Metab, 2002,22(9):1068-1079.
[2] Wang HM, Zhang T, Huang JK, et al. 3-N-butylphthalide (NBP) attenuates the amyloid-β-induced inflammatory responses in cultured astrocytes via the nuclear factor-κB signaling pathway[J]. Cell Physiol Biochem, 2013,32(1):235-242.
[3] Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebralartery occlusion without craniectomy in rats[J]. Stroke, 1989,20(1):84-91.
[4] Kim J, Kim HY, Lee SM, et al. Protective effects of geniposide and genipin against hepatic ischemia/reperfusion injury in mice[J]. Biomol Ther (Seoul), 2013,21(2):132-137.
[5] Zhang W, Potrovita I, Tarabin V, et al. Neuronal activation of NF-kappaB contributes to cell death in cerebral ischemia [J]. J Cereb Blood Flow Metab, 2005,25(1):30-40.
[6] Chu W, Li M, Li F, et al. Immediate splenectomy down-regulates the MAPK-NF-κB signaling pathway in rat brain after severe traumatic brain injury[J]. J Trauma Acute Care Surg, 2013,74(6):1446-1453.
[7] You WC, Wang CX, Pan YX, et al. Activation of nuclear factor-κB in the brain after experimental subarachnoid hemorrhage and its potential role in delayed brain injury [J]. PLoS One, 2013,8(3):e60290.
[8] Mohamed HE, El-Swefy SE, Hasan RA, et al. Neuroprotective effect of resveratrol in diabetic cerebral ischemic-reperfused rats through regulation of inflammatory and apoptotic events[J]. Diabetol Metab Syndr, 2014,6(1):88.
[9] Schneider A, Martin-Villalba A, Weih F, et al. NF-κB is activated and promotes cell death in focal cerebral ischemia[J]. Nat Med, 1999,5(5):554-559.
[10] Jin XQ, Ye F, Zhang JJ, et al. Triptolide attenuates cerebral ischemia and reperfusion injury in rats through the inhibition the nuclear factor kappa B signaling pathway[J]. Neuropsychiatr Dis Treat, 2015,3(11):1395-1403.
[11] Nurmi A, Lindsberg PJ, Koistinaho M, et al. Nuclear factor-kappaB contributes to infarction after permanent focal ischemia[J]. Stroke, 2004,35(4):987-991.
[12] Liang J, Luan Y, Lu B, et al. Protection of ischemic postconditioning against neuronal apoptosis induced by transient focal ischemia is associated with attenuation of NF-κB/p65 activation[J]. PLoS One, 2014,9(5):e96734.
[13] Li H, Yin J, Li L, et al. Isoflurane postconditioning reduces ischemia-induced nuclear factor-κB activation and interleukin 1β production to provide neuroprotection in rats and mice[J]. Neurobiol Dis, 2013,6(54):216-224.
[14] Guo RB, Wang GF, Zhao AP, et al. Paeoniflorin protects against ischemia-induced brain damages in rats via inhibiting MAPKs/NF-κB-mediated inflammatory responses [J]. PLoS One, 2012,7(11):e49701.
[15] Li J, Li Y, Ogle M, et al. DL-3-n-butylphthalide prevents neuronal cell death after focal cerebral ischemia in mice via the JNK pathway[J]. Brain Res, 2010,1359:216-226.
[16] 紀海茹,孔令偉,孔維,等.丁苯酞對腦缺血再灌注損傷大鼠血腦屏障的影響[J].中華老年心腦血管病雜志,2015,3(17):307-309.
[17] Li L, Zhang B, Tao Y, et al. Dl-3-n-butylphthalide protects endothelial cells against oxidative/nitrosative stress, mitochondrial damage and subsequent cell death after oxygen glucose deprivation in vitro[J]. Brain Res, 2009,22(1290):91-101.
[18] 張曉璇,朱江,趙淑敏,等.丁苯酞對腦缺血再灌注大鼠炎癥介質和神經細胞超微結構的影響[J].中國醫院藥學雜志,2015,4(35):307-310.
[19] 任建宏,劉瑞珍.丁苯酞預處理對大鼠腦缺血再灌注損傷后HSP70與TLR4表達的影響[J].中西醫結合心腦血管病雜志,2011,9(5):572-573.
[20] 張曉璇,李佳佳.丁苯酞對腦缺血再灌注大鼠凋亡情況的影響[J].中國實用神經疾病雜志,2014,14(17):44-46.
王凱麗(E-mail: wangkaili20033@163.com)
10.3969/j.issn.1002-266X.2016.15.012
R743.3
A
1002-266X(2016)15-0038-03
2015-12-17)

