血根堿與c-myc G4-DNA相互作用的光譜法研究
胡穎智,沈海輝,鄔期望,沈宏,孫悅(1.廣東藥科大學中藥學院,廣東 廣州510006;2.國家中醫藥管理局中藥數字化質量評價技術重點研究室,廣東廣州510006;3.廣東高校中藥質量工程技術研究中心,廣東廣州510006;.浙江大學微分析系統研究所,浙江杭州310058)
血根堿與c-myc G4-DNA相互作用的光譜法研究
胡穎智1,2,3,沈海輝1,2,3,鄔期望4,沈宏4,孫悅1,2,3
(1.廣東藥科大學中藥學院,廣東 廣州510006;2.國家中醫藥管理局中藥數字化質量評價技術重點研究室,廣東廣州510006;3.廣東高校中藥質量工程技術研究中心,廣東廣州510006;4.浙江大學微分析系統研究所,浙江杭州310058)
目的研究血根堿與c-myc G4-DNA的相互作用。方法采用紫外可見吸收光譜、圓二色譜、變溫試驗等方法,對血根堿與c-myc G4-DNA的結合常數、結合比例、結合模式及穩定性進行研究。結果在紫外可見吸收光譜中,血根堿在300~350 nm之間的特征吸收峰隨c-myc G4-DNA濃度的增加出現明顯的減色效應和紅移,減色率ΔH=35.4%(Δλ=7 nm),與c-myc G4-DNA結合常數為3.1×104mol/L;G-四鏈體/血紅素過氧化物酶競爭試驗中,血根堿競爭血紅素引起吸光度下降;變溫試驗中c-myc G4-DNA的熔點在血根堿作用下升高4.7℃。結論血根堿以結合比例為1∶1外部堆積于c-myc G4-DNA,并促使其結構穩定,這可能是血根堿抗腫瘤的分子機制之一。
血根堿;c-myc G4-DNA;相互作用
四鏈螺旋結構的核酸稱為 G-四鏈體(G-quadruplex),4個鳥嘌呤堿基通過Hoogsteen氫鍵配對形成G平面(G-tetrad),適當體積的陽離子或配體可以促使多個G平面堆疊形成G-四鏈體結構,能夠與G-四鏈體特異性結合并使之穩定的化合物可通過降低原癌基因的轉錄表達而達到抗腫瘤的效果[1]。c-myc是體內重要的原癌基因之一,研究表明c-myc啟動區DNA形成的G-四鏈體已經成為抗腫瘤藥物研究的靶點[2-4]。
血根堿(sanguinarine,San)是一種在白屈菜含量較高的生物堿,課題組前期試驗[5]和許多體外試驗證明,血根堿能通過誘導細胞凋亡而抑制不同來源的癌細胞生長,包括肝癌、人鱗狀細胞癌、肺癌、乳腺癌和前列腺癌等癌細胞[6]。血根堿還是一種細胞周期的阻斷劑,是一種潛在的抗癌藥物[6]。JI Xiaohui等[7]研究表明血根堿可與C-myc22形成的G-四鏈體結合,誘導G-四鏈體的形成并提高其穩定性,但缺乏深入研究。本文用G-四鏈體/血紅素過氧化物酶競爭試驗結合光譜法進一步探討了血根堿與c-myc G4-DNA的結合模式,并測得血根堿與c-myc G4-DNA的結合常數和結合比例,為以G-四鏈體為靶點的新型抗腫瘤藥物的設計提供依據。
1 材料與方法
1.1儀器與試劑
K640型熱循環儀(杭州晶格科學儀器);UV-2200PC型紫外-可見分光光度儀(上海舜宇恒平科學儀器公司);SC-15型數控恒溫槽(寧波新芝生物科技公司);MOS-450圓二色譜儀器型號(法國BioLogic Science Instrument)。
c-myc G4-DNA為 C-myc22(5′-TGAGGGTGG GGAGGGTGGGGAA-3′)、HT4(5′-TTAGGGTTAGGG TTAGGGTTAGGG-3′)、Pu27(5′-TGGGGAGGGTGG GGAGGGTGGGGAAGG-3′)均購于英濰捷基上海貿易有限公司;血根堿(San,質量分數>98%,阿拉丁試劑公司);三羥甲基氨基甲烷(Tris)、2,2-聯氮-二(3-乙基-苯并噻唑-6-磺酸)(ABTS)、30%過氧化氫(H2O2)、血紅素(hemin)、二甲基亞砜(DMSO)、KCl(均為分析純,上海國藥集團有限公司)。DNA用緩沖液(pH7.4,10 mmol/L Tris-Hcl)配制成100 μmol/L的儲備液,分裝后于-20℃儲存;hemin溶于DMSO,配制成500 μmol/L儲備液,儲存于-20℃;KCl溶液用緩沖液配置成500 μmol/L。DNA退火:DNA儲備液分別使用無K+和有K+緩沖液稀釋,置于熱循環儀95℃加熱10 min,緩慢冷卻至室溫形成DNA溶液。
1.2ABTS-H2O2顯色體系試驗[8]
顯色試驗樣品總體積為2.5 mL,向比色皿加入50 μmol/L DNA溶液100 μL,加入20 μmol/L hemin 250 μL,加入緩沖液2 100 μL,混合均勻后在恒溫槽37℃孵育1 h,向樣品中分別加入25 μL 40 mmol/L ABTS和H2O2。未加DNA為空白組,10 min時測定415 nm的吸光度。
1.3血根堿與C-myc22結合常數試驗[9-10]
參比池加入緩沖液,樣品池中加入10 μmol/L血根堿溶液3 mL。每隔5 min用微量移液器分別往參比池和樣品池比色皿中加入2 μmol/L C-myc22溶液,使C-myc22與San濃度比值按一定比例遞增,在300~500 nm掃描吸收譜圖。
1.4血根堿與C-myc22結合比例試驗[11]
保持San與C-myc22溶液總濃度10 μmol/L不變,改變體系中 San與 C-myc22的比例。測定327 nm的吸光度值,以相應濃度的血根堿溶液作為空白對照,扣除空白后,以血根堿的含量作Job plot圖。數據用Origin 8軟件處理。
1.5血根堿與C-myc22結合模式試驗[8]
G-四鏈體/Hemin過氧化物酶表征試驗由紫外測定,向C-myc22溶液中加入hemin,37℃孵育1 h,即得具有過氧化物酶活性的DNA酶。再向溶液中加入San,使得溶液中hemin、C-myc22、K+和San成特定濃度比,37℃反應1 h。在360~460 nm掃描紫外吸收光譜圖。
G-四鏈體/Hemin過氧化物酶競爭試驗中樣品總體積2.5 mL,向比色皿加50 μmol/L C-myc22 G-四鏈體溶液50 μL,加入10 μmol/L hemin 250 μL,加入緩沖液1 900 μL,混合均勻后37℃孵育1 h,接著分別加入20 μmol/L和100 μmol/L San各250 μL,混合均勻后37℃孵育1 h,向樣品中分別加入40 mmol/L ABTS和40 mmol/L H2O2各25 μL。測定樣品在10 min內415 nm處的吸光度變化。
1.6變溫試驗
配制一定濃度的C-myc22溶液、含有血根堿的C-myc22溶液以及空白溶液,加入到帶有控溫裝置的石英比色池中(光程10 mm),經過脫氣,塞上四氟乙烯以防止溶液在高溫蒸發。待吸光度穩定后,以緩沖液或相同濃度的血根堿作參比,以0.25℃/min速度增溫,測定295 nm處、不同溫度下的吸光度。
1.7圓二色譜試驗
C-myc22分別與一定比例的K+、hemin和 San混合均勻,37℃孵育1 h后,將樣品溶液加入到光徑1 cm的石英比色皿,從220 nm掃描至320 nm,掃描速率100 nm/min,帶寬10 nm,讀數3次,響應時間1 s,測定光譜均扣除空白組。
2 結果與分析
2.1DNA鏈的選擇
血根堿與不同DNA鏈形成的G-四鏈體均有結合,如端粒鏈HT4[12]、啟動區Pu27[13]和C-myc22[7],為找到對光譜法分析靈敏的鏈,采用ABTS-H2O2顯色體系對這3條DNA鏈與血紅素形成的G-四鏈體-hemin DNA酶催化活性進行了比較,如圖1。可見,無K+情況下,這3條DNA與血紅素結合后都表現出微弱的催化活性,而有K+組中,DNA酶催化活性明顯提高,說明K+對G-四鏈體的形成至關重要。其中 C-myc22形成的 DNA酶催化活性最高,且C-myc22形成的G-四鏈體結構單一,核磁譜圖清晰,結構解析完全,因此在文獻[14]中以C-myc22為靶點,進行藥物設計與篩選。梅文杰課題組[10,15-16]也以C-myc22為抗腫瘤藥物靶點進行研究。綜上所述,C-myc22形成的DNA酶催化活性高利于光譜法分析,且研究它與血根堿的相互作用可探討血根堿的抗腫瘤機制,所以選擇C-myc22鏈作為研究對象。
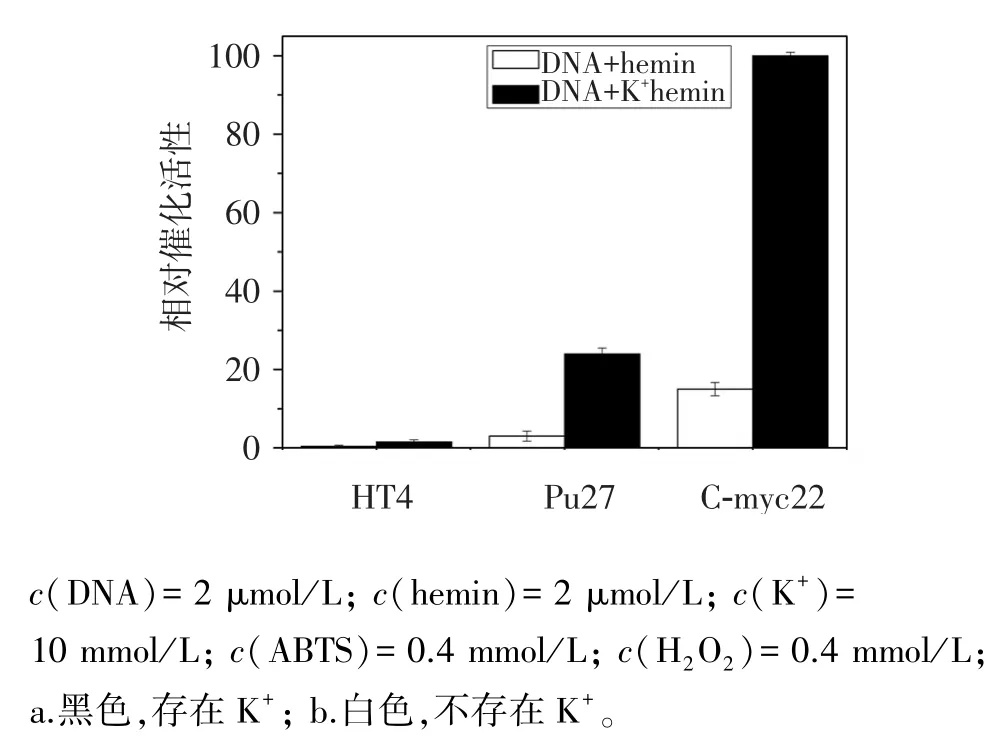
圖1 3種DNA酶催化活性的比較Figure 1 Comparison of three DNAzyme catalytic activity
2.2血根堿與C-myc22的結合常數
紫外-可見光譜法是研究G-四鏈體和化合物相互作用最常用的方法,通常化合物與DNA結合后最大吸收峰會有譜帶變化,以此來判斷化合物與DNA是否結合,從圖2可知血根堿加入C-myc22后發生了7 nm紅移(從327 nm至334 nm),并伴隨著35.4%的減色現象,通過下列方程計算出血根堿與C-myc22相互作用的結合常數Kb:


式中:DNA代表DNA的濃度;εa、εf、εb分別代表在不同 C-myc22濃度溶液中,游離的和與C-myc22鍵合飽和的血根堿的摩爾吸光系數;Kb可由擬合直線與y軸相交的截距求得,在試驗條件下,計算得到結合常數Kb為3.1×104mol/L,說明血根堿與C-myc22有較強的結合作用[8-9]。
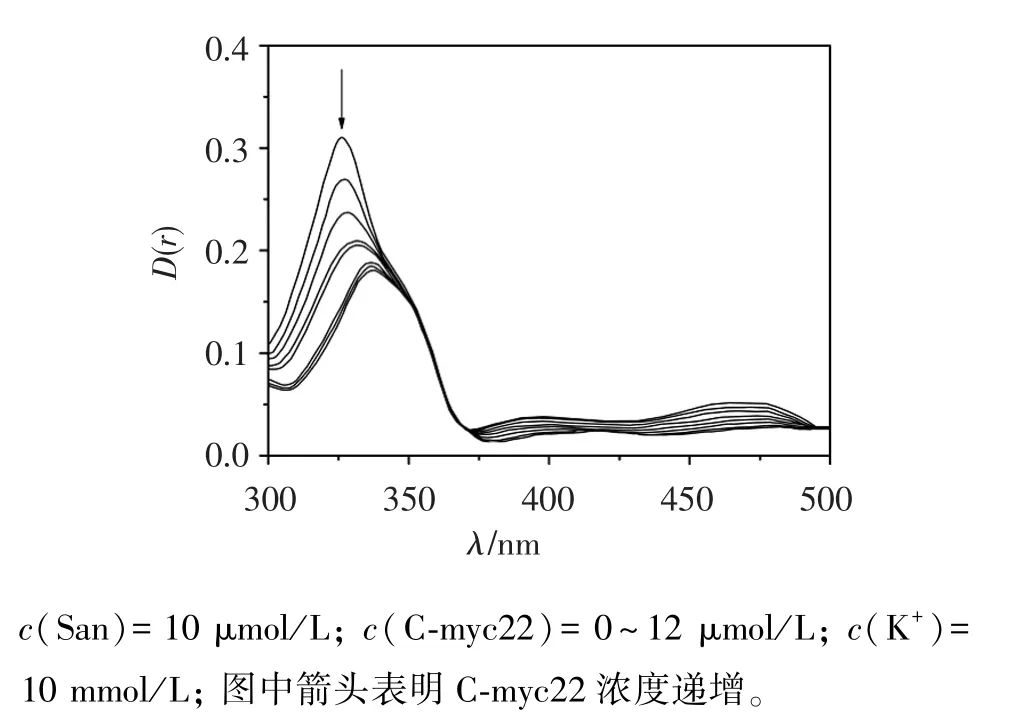
圖2 血根堿與不同濃度C-myc22相互作用后的紫外吸收光譜圖Figure 2 Absorption spectra of San in the presence of increasing amounts of C-myc22
2.3血根堿與C-myc22的結合比例
Job plot分析試驗即保持血根堿與G-四鏈體的總濃度不變,連續改變血根堿與G-四鏈體的濃度比,在不同的濃度比下的測定體系吸收信號,以此來確定 G-四鏈體與血根堿結合的化學計量比[8,11]。從圖3可見,隨著體系中血根堿比例的增加,吸光度減少程度先變大后變小,交叉點是0.5,表明血根堿與C-myc22的結合比為1∶1。
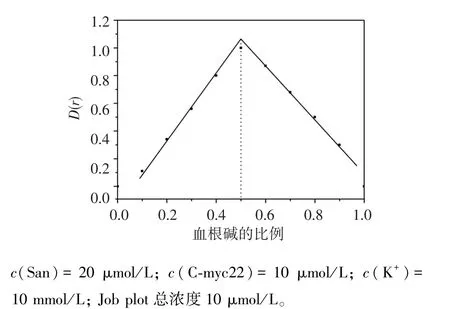
圖3 血根堿與C-myc22相互作用的Job plotFigure 3 The Job plot of San with C-myc22
2.4 血根堿與C-myc22的結合模式
血紅素卟啉環在400 nm波長附近有紫外吸收,即Soret帶,當血紅素與G-四鏈體結合形成DNA酶后,Soret帶會產生增色紅移現象,可表征G-四鏈體/ Hemin過氧化物酶。如圖4所示,血紅素的特征吸收波長為397 nm(曲線a),當血紅素與C-myc22作用后,Soret帶有紅移(7 nm)及增色現象(曲線b),這與文獻[17]報道的血紅素與G-四鏈體親合作用結果一致,說明C-myc22在無K+的情況下也能形成G-四鏈體;在有K+組中,血紅素與C-myc22反應的紅移及增色比無K+組明顯增強(曲線c),說明K+能大量促進C-myc22形成G-四鏈體,加入血根堿后紅移增色現象減弱(曲線d),表明血根堿競爭血紅素與G-四鏈體的結合。
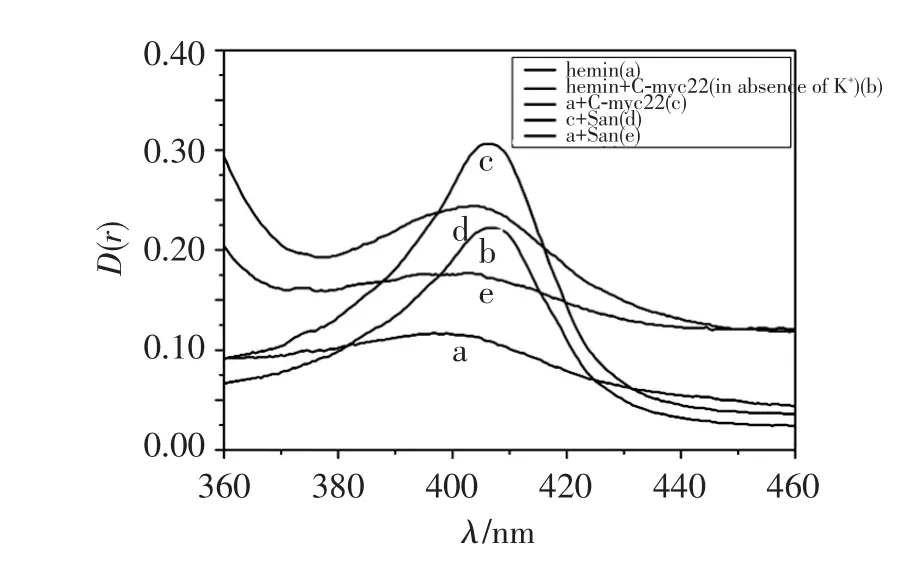
圖4 血紅素、C-myc22和San紫外可見吸收光譜Figure 4 UV-visible absorption spectra of San/C-myc22/ hemin complex
Hemin通過外部堆積的方式與G-四鏈體結合,G-四鏈體/hemin復合物可催化H2O2氧化ABTS2-。其他分子如能與 G-四鏈體結合,且結合位點與hemin相同,則能與 hemin競爭,使得 G-四鏈體/ hemin復合物減少,導致體系的顏色變淺,吸光度下降[8],因此可用G-四鏈體/hemin過氧化物酶競爭試驗判斷結合模式。由圖4可見,血根堿能與hemin發生競爭關系。C-myc22和血紅素體系中加入不同濃度血根堿,血根堿濃度越高,體系催化活性也越低(見圖5),說明San與hemin有競爭作用,降低了G-四鏈體/hemin過氧化物的酶活性。
從上述紫外光譜試驗和DNA酶催化H2O2氧化ABTS2-試驗結果均可推斷:在與G-四鏈體的結合中,San與hemin是競爭關系,hemin是通過外部堆積的方式與G-四鏈體結合,因此推斷血根堿與G-四鏈體的結合模式也為外部堆積。
2.5變溫試驗
變溫試驗檢測G-四鏈體通常是測定295 nm吸收,可以得到G-四鏈體結構存在與否以及化合物能否穩定G-四鏈體結構[11]。從圖6中可見,隨著溫度的升高,295 nm熔融曲線都形成倒“S”曲線,說明均有G-四鏈體存在;無 K+組,C-myc22的 Tm值為31.5℃;有K+組,熔點Tm為74.8℃,明顯增大,是K+進入G-四鏈體平面中間,促進了G-四鏈體的穩定性[18];有K+組加入San后,Tm為79.5℃,額外增加了4.7℃,說明San與C-myc22結合并增加其結構的穩定性。
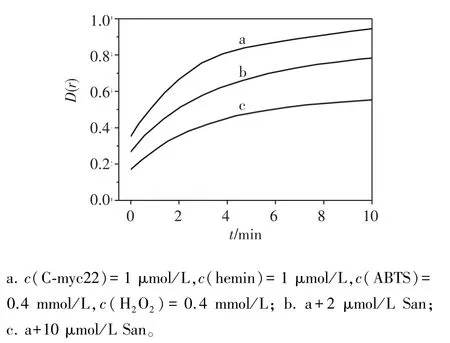
圖5 血根堿抑制G-四鏈體-hemin DNA酶催化活性Figure 5 Inhibition effect of San on activity of G-quadruplexhemin DNAzyme
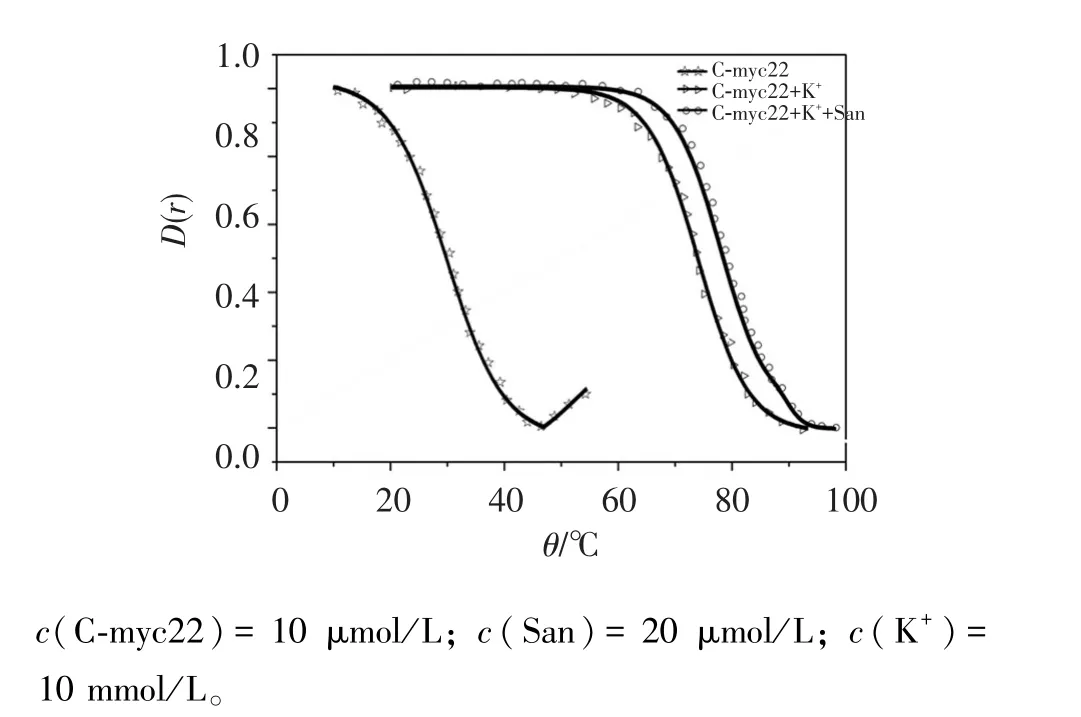
圖6 C-myc22與K+、San的變溫試驗圖譜Figure 6 The melting temperature experiment of C-myc22 with K+and San
2.6圓二色譜表征G-四鏈體
CD是研究G-四鏈體構型和G-四鏈體與化合物相互作用的重要方法之一,平行型和反平行型G-四鏈體各自具備不同的CD特征譜圖,平行G-四鏈體結構出現265 nm正峰和240 nm負峰[10]。從圖7可知,C-myc22無K+能自身形成平行G-四鏈體(曲線a);當加入10 mmol/L K+時,240 nm負峰明顯降低,265 nm正峰增高(曲線b),說明K+促進C-myc22形成平行G-四鏈體結構;hemin和San加入后,CD譜圖均沒有變化(曲線c和d基本相同),而有K+組,San能促進C-myc22形成G-四鏈體[7]。以上說明San對G-四鏈體結構沒有破壞或誘導構型轉變作用,并且與K+進入G-四鏈體平面之間不同,有可能與hemin一致,以外部堆積形式與G-四鏈體結合。
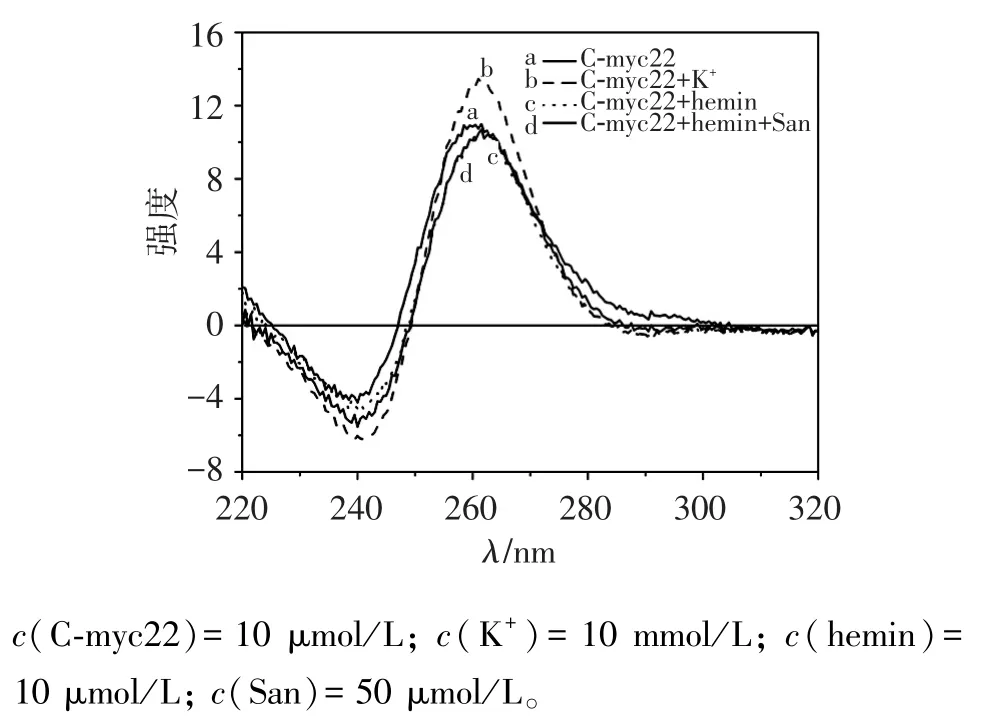
圖7 C-myc22與K+、hemin、San相互作用CD譜圖Figure 7 CD spectra of interaction between K+,hemin,San and C-myc22
3 結論
本文研究了血根堿與C-myc22的相互作用,K+進入相鄰的G-四鏈體平面中間,促進C-myc22形成G-四鏈體,紫外分光光度法測得血根堿與C-myc22結合常數為3.1×104mol/L,結合比例為1∶1。采用G-四鏈體/hemin過氧化物酶競爭試驗和紫外光譜法證明血根堿與G-四鏈體結合模式為外部堆積,變溫試驗表明K+和血根堿促進G-四鏈體結構的穩定性,圓二色譜中血根堿沒有使G-四鏈體結構發生改變,佐證了血根堿與G-四鏈體結合模式為外部堆積。血根堿抗腫瘤作用可能與c-myc密切相關,具體的作用機制還有待進一步研究闡明。
[1]OU Tianmiao,LU Yujing,TAN Jiaheng,et al.G-ouadruplexes: targets in anticancer drug design[J].Chem Med Chem,2008,3(5):690-713.
[2]WU Qiong,ZHENG Kangdi,LIAO Siyan,et al.Arene Ruthenium(II)complexes as low-toxicity inhibitor against the proliferation,migration,and invasion of MDA-MB-231 cells through binding and stabilizing c-myc G-quadruplex DNA[J].Organometallics,2016,35(3):317-326.
[3]WU Qiong,CHEN Tianfeng,ZHANG Zhao,et al.Microwaveassisted synthesis of arene ruthenium(ii)complexes[(η6-RC6H5)Ru(m-MOPIP)Cl]Cl(R=-H and-CH3)as groove binder to c-myc G4 DNA[J].Dalton Trans,2014,43(24):9216-9225.
[4]FAN Cundong,WU Qiong,CHEN Tianfeng,et al.Arene ruthenium(II)complexes induce S-phase arrest in MG-63 cells through stabilization of c-Myc G-quadruplex DNA[J]. Med Chem Comm,2014,5(5):597-602.
[5]莫滿芳.微流控芯片毛細管電泳在細胞分析中的應用研究[D].廣州:廣東藥學院,2013.
[6]林海,薛立群,楊青.血根堿抗腫瘤作用研究進展[J].動物醫學進展,2014,35(5):105-107.
[7]JI Xiaohui,SUN Hongxia,ZHOU Huaxi,et al.The interaction of telomeric DNA and C-myc22 G-quadruplex with 11 natural alkaloids[J].Nucleic Acid Therapeut,2012,22 (2):127-136.
[8]吳尚榮,金冰,張楠,等.一種不對稱菁染料及其與不同結構DNA的相互作用[J].高等學校化學學報,2014,35 (10):2085-2092.
[9]CHEN Yanhua,WU Qiong WANG Xicheng,et al.Microwaveassisted synthesis of arene Ru(II)complexes induce tumor cell apoptosis through selectively binding and stabilizing bcl-2 G-Quadruplex DNA[J].Materials,2016,9(5):386.
[10]王新寧,張召,吳孝惠,等.大黃素與c-myc G4-DNA相互作用的研究[J].廣東藥學院學報,2013,29(4):374-377. [11]李全文,張玲,郭江寧,等.陽離子金屬卟啉與四螺旋DNA相互作用的研究[J].廣東藥學院學報,2014,30 (3):278-284.
[12]楊舒,劉巖,楊千帆,等.博落回抗腫瘤作用及誘導人體端粒DNA形成G-四鏈體分子機制研究[J].中草藥,2011,42(4):738-742.
[13]GHOSH S,PRADHAN S K,KAR A,et al.Molecular basis of recognition of quadruplexes human telomere and c-myc promoter by the putative anticancer agent sanguinarine [J].Bba Gen Subjects,2013,1830(8):4189-4201.
[14]田明月,張秀鳳,潘然,等.原癌基因c-myc啟動區G-四鏈體結構及靶向小分子配體[J].化學進展,2010,22 (5):983-992.
[15]ZHANG Zhao,WU Qiong,WU Xiaohui,et al.Ruthenium (II)complexes as apoptosis inducers by stabilizing c-myc G-quadruplex DNA[J].Eur J Med Chem,2014,80(80): 316-324.
[16]LIAO Siyang,ZHANG Zhao,WU Qiong,et al.Microwaveassisted synthesis of phenanthroimidazole derivatives as stabilizer of c-myc G-quadruplex DNA[J].Bioorg Med Chem,2014,22(22):6503-6508.
[17]SONG Lifang,PAN Xiaoxia,SHEN Hong,et al.Microflow injectionpotassiumbioassaybasedonG-quadruplex DNAzyme-enhancedchemiluminescence[J].Biolumin Chemilumin,2014,29(8):1066-1073.
[18]孔德明,楊薇.G-四鏈體的構型、熱穩定性測試及其在鉀離子定量檢測中的應用[J].化學通報,2010,73(5): 388-395.
(責任編輯:陳翔)
Study on the interaction between c-myc G4-DNA and sanguinarine by spectrometry
HU Yingzhi1,2,3,SHEN Haihui1,2,3,WU Qiwang4,SHEN Hong4,SUN Yue1,2,3
(1.School of Traditional Chinese Medicine,Guangdong Pharmaceutical University;2.Key Laboratory of Digital Quality Evaluation of Chinese Materia Medica of State Administration of TCM,China;3.Engineering Technology Research Center for Chinese Materia Medica Quality of the Universities of Guangdong Province,Guangzhou,510006;4.Institute of Microanalytical Systems,Zhejiang University,Hangzhou 310058,China)
Objective To study the interaction between sanguinarine and c-myc G4-DNA.Methods The binding constants,binding modes,binding ratio and stabilization of sanguinarine with c-myc G4-DNA were studied by UV-Vis spectroscopy,circular dichroism,and melting temperature experiment method.Results In UV-Vis spectroscopy,it was found that there was a hypochromise of 35.4%(Δλ=7 nm)at the characterized absorption of sanguinarine in the presence of c-myc G4-DNA,and the binding constants value was 3.1×104mol/L.In G-quadruplex/hemin peroxidase competition experiment,sanguinarine competed with the hemin to bind with G-quadruplex,which led to a decrease of absorbance.The melting point of cmyc G4 DNA was increased about ΔTm=4.7℃ in melting temperature experiment.Conclusion sanguinarine can increase the stability of c-myc G4-DNA,and bind with c-myc G4-DNA at a ratio of 1:1 by external stacking,which may be one of the antitumor mechanisms of sanguinarine.
sanguinarine;c-myc G4-DNA;interaction
R914
A
1006-8783(2016)04-0431-05
10.16809/j.cnki.1006-8783.2016051706
2016-05-17
國家自然科學基金(81001600);浙江省自然科學基金(LY16B050004)
胡穎智(1991—),女,2014級碩士研究生,從事微流控分析與中藥分析研究,Email:hyztournesol@sina.com;通信作者:孫悅(1977—),女,博士,教授,從事微流控分析與中藥分析研究,Email:sunyuesdzb@163.com;沈宏,男,博士,副教授,主要從事分析化學研究,Email:shzju@zju.edu.cn。
網絡出版時間:2016-07-011 14:56 網絡出版地址:http://www.cnki.net/kcms/detail/44.1413.R.20160711.1456.006.html

