巴氏醋酸桿菌AS1.41產(chǎn)醋酸關(guān)鍵酶研究
陳 洋,高 冰,汪 超,李冬生,徐 寧,胡 勇(湖北工業(yè)大學(xué) 工業(yè)發(fā)酵湖北省協(xié)同創(chuàng)新中心湖北省食品發(fā)酵工程技術(shù)研究中心,湖北 武漢 430068)
巴氏醋酸桿菌AS1.41產(chǎn)醋酸關(guān)鍵酶研究
陳洋,高冰,汪超,李冬生,徐寧,胡勇*
(湖北工業(yè)大學(xué) 工業(yè)發(fā)酵湖北省協(xié)同創(chuàng)新中心湖北省食品發(fā)酵工程技術(shù)研究中心,湖北 武漢 430068)
巴氏醋酸桿菌(Acetobacerpasteurianus)將乙醇氧化成醋酸的關(guān)鍵酶是乙醇脫氫酶(ADH)和乙醛脫氫酶(ALDH)。在不同初始乙醇含量條件下,ADH和ALDH的酶活呈現(xiàn)動態(tài)變化,乙醇含量為4%時,ADH和ALDH的酶活達(dá)到最大,分別為7.43U/mg和7.18 U/mg。同時,酶活與產(chǎn)酸速率呈現(xiàn)出較高一致性:酶活越高,產(chǎn)酸速率越快。發(fā)酵溫度為32℃時,菌體生長最為活躍,酶活最大,產(chǎn)酸最快;加入0.5%的乙酸后,ADH和ALDH的酶活分別由8.12 U/mg和7.06U/mg提高到了9.43U/mg和8.52 U/mg,產(chǎn)酸速率也得到相應(yīng)提升。ALDH對乙醇、乙酸、溫度的穩(wěn)定性均高于ADH。
巴氏醋酸桿菌;乙醇脫氫酶;乙醛脫氫酶;乙醇;溫度;乙酸
醋酸菌是一類革蘭氏陰性好氧菌,其中醋桿菌屬(Acetobacter)、葡糖酸醋酸桿菌屬(Gluconoacetobacter)、葡糖桿菌屬(Gluconobacter)均可以將乙醇快速氧化為乙酸[1-2],因此,他們廣泛用于工業(yè)食醋的釀造。AS1.41是我國釀醋工業(yè)中常用的醋酸菌,該菌屬于醋桿菌屬中的巴氏醋酸桿菌(Acetobacterpasteurianus),具有較好的發(fā)酵性能,值得進(jìn)行研究。
將乙醇氧化為乙酸是食醋生產(chǎn)的主要過程,這一過程主要涉及到兩種較為關(guān)鍵的酶:乙醇脫氫酶(alcohol dehydrogenase,ADH)[3]和乙醛脫氫酶(aldehyde dehydrogenase,ALDH)[4]。這兩種酶結(jié)合于細(xì)胞膜上,位于膜的外側(cè)部分,吡咯喹啉醌(pyrroloquinolinequinine,PQQ)是他們的輔酶[5-6]。大量研究已經(jīng)表明,醋酸發(fā)酵是依賴于PQQ-ADH和PQQ-ALDH完成的,乙醇作為底物,在PQQ-ADH的催化下生成乙醛,乙醛接著在PQQ-ALDH的作用下生產(chǎn)醋酸[7]。周秉辰[8]研究發(fā)現(xiàn)醋酸菌的產(chǎn)酸速率與ADH的酶活存在著明顯的相關(guān)性,酶活越高產(chǎn)酸速率越快;TRCEK J等[9]研究發(fā)現(xiàn)與巴氏醋酸桿菌相比,葡糖醋桿菌能產(chǎn)生較高濃度的醋酸,其PQQ-ADH的活性和酸穩(wěn)定性明顯高于巴氏醋酸桿菌,同時PQQ-ADH的表達(dá)量也相應(yīng)較多;KANCHANARACHW等[10]從酶的穩(wěn)定性方面研究了醋酸菌耐高溫與乙醇脫氫酶的關(guān)系,結(jié)果發(fā)現(xiàn),乙醇脫氫酶氨基酸序列的差異性導(dǎo)致了酶的穩(wěn)定性不同,而乙醇脫氫酶的穩(wěn)定性與醋酸菌的耐高溫特性具有一定的相關(guān)性。
醋酸菌作為釀醋的核心微生物,其在發(fā)酵過程中會面臨各種壓力。高濃度初始乙醇是其首先要面對的挑戰(zhàn)。隨著發(fā)酵進(jìn)行,溫度及乙酸逐漸對醋酸菌產(chǎn)生抑制作用。雖然乙醇氧化產(chǎn)酸與PQQ-ADH和PQQ-ALDH直接相關(guān),但是在發(fā)酵過程中這兩種酶的動態(tài)變化及穩(wěn)定性與產(chǎn)酸之間的關(guān)系研究很少。本實驗在不同的乙醇、乙酸、溫度等條件下從酶活及酶的穩(wěn)定性等方面,探究發(fā)酵過程中PQQ-ADH和PQQ-ALDH與醋酸菌產(chǎn)酸的關(guān)系,揭示這兩種酶與產(chǎn)酸的規(guī)律。將該規(guī)律用于實際生產(chǎn),通過改變乙醇、溫度、乙酸等條件對酶的酶活及穩(wěn)定性進(jìn)行調(diào)控,達(dá)到提高醋酸產(chǎn)量的目的,為工業(yè)生產(chǎn)提供堅實的理論依據(jù)。
1 材料與方法
1.1料與試劑
1.1.1料與試劑
醋酸菌AS1.41:中國典型微生物保藏中心;葡萄糖、磷酸二氫鉀、磷酸氫二鉀、酵母粉、鐵氰化鉀、無水硫酸鎂、無水乙醇、體積分?jǐn)?shù)40%的乙醛、Triton X-100、乙二胺二乙酸二鈉鹽、硫酸鐵、十二烷基硫酸鈉、95%磷酸等均為分析純:國藥集團(tuán)化學(xué)試劑有限公司。
1.1.2養(yǎng)基
種子培養(yǎng)基:葡萄糖10 g/L,酵母粉10 g/L,滅菌冷卻到50℃條件下加入體積分?jǐn)?shù)為2%的乙醇;
發(fā)酵培養(yǎng)基:葡萄糖10 g/L,酵母粉15 g/L,無水硫酸鎂0.2 g/L,滅菌冷卻到50℃條件下加不同體積分?jǐn)?shù)的乙醇或者乙酸。
1.2器與設(shè)備
ZHJH-C1214B紫外超凈工作臺:上海智城分析儀器制造有限公司;GL-21高速冷凍離心機(jī):長沙平凡儀器儀表有限公司;XO-1000D超聲細(xì)胞破碎儀:上海實驗儀器廠;i8雙光束紫外可見分光光度計:濟(jì)南海能儀器有限公司;HNY-2112B柜式全溫振蕩培養(yǎng)箱:天津歐諾儀器儀表有限公司;SY-3010發(fā)酵罐:上海世遠(yuǎn)生物設(shè)備工程有限公司。
1.3驗方法
1.3.1養(yǎng)方法
發(fā)酵罐發(fā)酵的條件:發(fā)酵罐為10 L,攪拌的速度控制為120 r/m in,溶解氧濃度維持在22%,發(fā)酵溫度根據(jù)實驗要求控制。
1.3.2析方法
菌體密度:使用分光光度計在波長600 nm處測定吸光度值OD600nm。
酸度測定:0.5mol/LNaOH溶液滴定法,以醋酸計。
粗酶液的制備:參照問清江等[11]方法。
ADH、ALDH酶活的測定:參照參考文獻(xiàn)[12],分別取0.5m LM cllvaine緩沖液(pH 4.0),0.1m L粗酶液,0.1m L乙醇或乙醛(1.0mol/L)溶液,1%的Triton X-100溶液0.1m L加入15m L比色管中25℃保溫5min;再加入0.2m L鐵氰化鉀溶液(0.1mol/L),25℃反應(yīng)5m in(需要做空白對照)以后,加入0.5m L硫酸鐵-Dupanol溶液結(jié)束反應(yīng);加3.5m L蒸餾水混合,于25℃靜置20min,然后于波長660 nm處測定吸光度值。
酶活單位定義:在25℃、pH 4.0條件下,1min氧化lμmol乙醇的酶量為一個酶活力單位(U)。
酶的穩(wěn)定性:為了研究ADH和ALDH在不同溫度、乙醇、乙酸條件下的穩(wěn)定性,用10mmol/L磷酸鉀鹽緩沖溶液(pH 6.0)將ADH和ALDH粗酶液的質(zhì)量濃度調(diào)成1mg/m L,然后取相同體積的ADH和ALDH溶液測量其對乙醇、溫度、乙酸的穩(wěn)定性。乙醇穩(wěn)定性:酶液中加入體積分?jǐn)?shù)為0~35%的乙醇后30℃培養(yǎng)30m in。溫度穩(wěn)定性:酶液置于25~55℃培養(yǎng)30min。乙酸穩(wěn)定性:酶液中加入體積分?jǐn)?shù)為0~12%的乙酸后30℃培養(yǎng)30min。
相對酶活:實驗組的酶活與參照組的酶活之間的比值。相對酶活的計算公式如下:

2 結(jié)果與分析
2.1醇對發(fā)酵過程中ADH和ALDH酶活的影響
發(fā)酵培養(yǎng)基(2 L)滅菌后分別加入體積分?jǐn)?shù)為2%、4%、6%、8%的乙醇,接種8%的種子液,發(fā)酵罐中30℃發(fā)酵8 d。每天測量ADH和ALDH的酶活,醋酸的產(chǎn)量和醋酸菌的生物量,結(jié)果如圖1和表1所示。醋酸菌的產(chǎn)酸包括3個階段:高速積累期(0~3 d),平穩(wěn)增長期(4~6 d),過氧化期(>7 d)。乙醇含量的升高,醋酸菌受到的抑制作用增強(qiáng)。
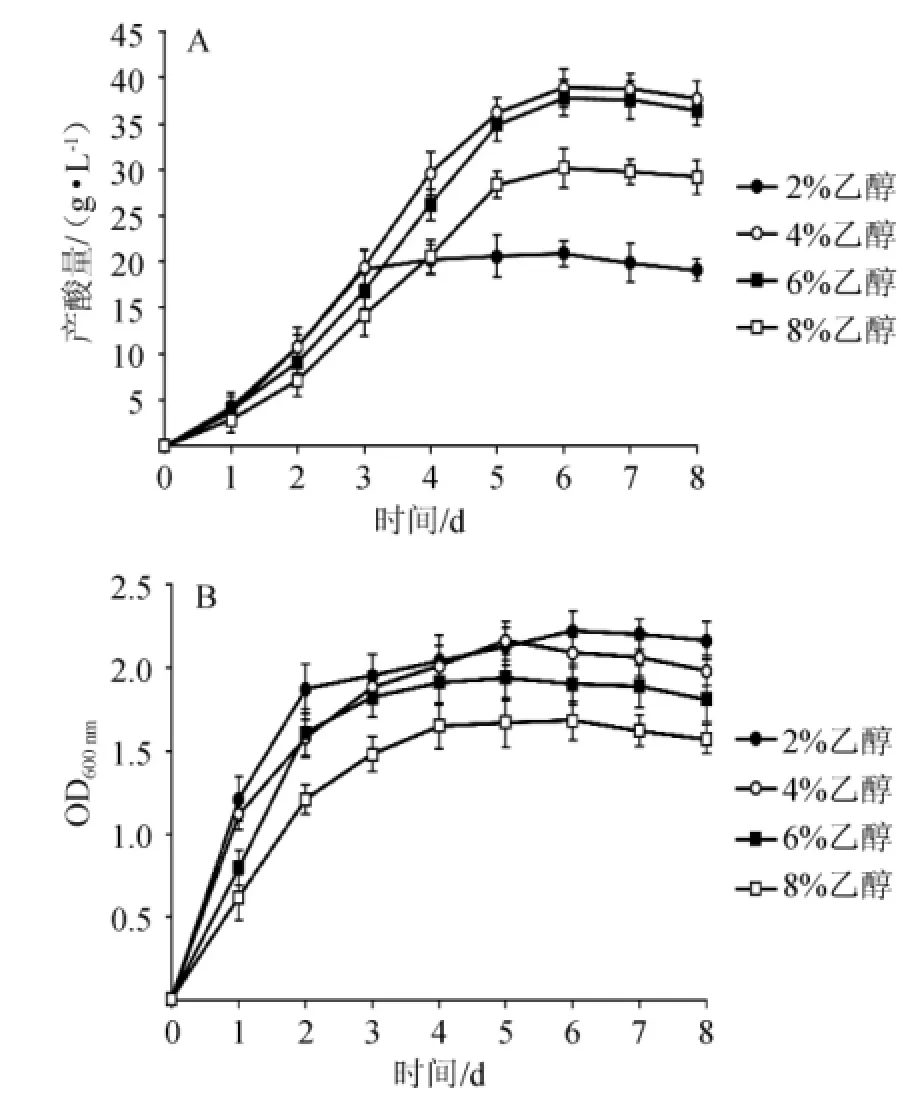
圖1 初始乙醇含量對菌株AS1.41產(chǎn)酸量(A)及生物量(B)的影響Fig.1 Effectof initia lethanol concentration on acid yield(A)and biomass(B)o f strain AS1.41
由圖1可知,在初始乙醇含量為2%時菌株AS1.41生長最好,OD600nm值為2.22。隨著乙醇含量的增加菌株AS1.41的生長周期逐漸延長。當(dāng)初始乙醇含量為4%時,菌株AS1.41產(chǎn)酸量最大,為38.9 g/L。當(dāng)初始乙醇含量達(dá)到8%時,菌株AS1.41的生長受到較強(qiáng)的抑制,產(chǎn)酸降至30.1 g/L。由表1可知,ADH和ALDH的酶活呈現(xiàn)動態(tài)變化。不同初始乙醇含量下,ADH和ALDH的活性均呈現(xiàn)出先增加后降低的趨勢,在3~4 d時,ADH和ALDH的酶活均達(dá)到峰值。乙醇含量為2%~4%時,隨乙醇含量的升高,ADH和ALDH的酶活也相應(yīng)提高,在乙醇含量為4%時,ADH和ALDH的最大酶活分別為7.43U/mg、7.18U/mg。初始乙醇含量>4%時,兩種酶的酶活均開始下降,且ALDH下降的速度比ADH緩慢。同時,由表1還可以看出,一定量乙醇的存在對ADH和ALDH的表達(dá)有誘導(dǎo)作用,當(dāng)乙醇含量超過這個范圍(4%)時,乙醇對醋酸菌會產(chǎn)生毒害作用,從而嚴(yán)重影響ADH和ALDH的表達(dá)。
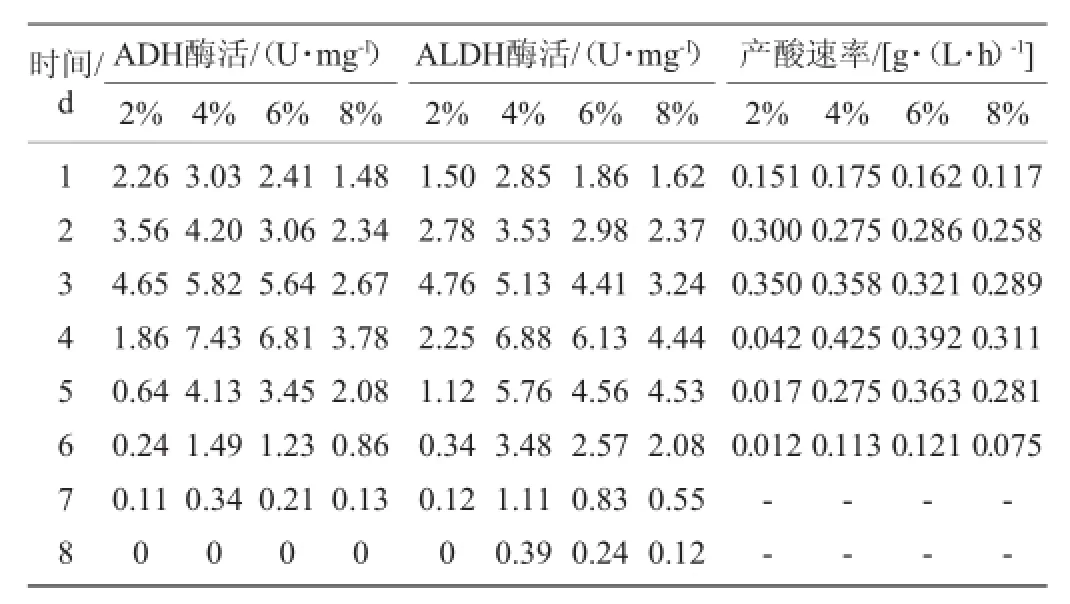
表1 不同初始乙醇含量下醋酸發(fā)酵過程中關(guān)鍵酶系的酶活力和產(chǎn)酸速率Table 1 Enzyme activity of the key enzym es and acid production rate during acetic fermentation at different initialethanol concentration
ADH和ALDH的酶活與產(chǎn)酸速率存在著一定的對應(yīng)關(guān)系。表1體現(xiàn)了產(chǎn)酸速率與酶活的關(guān)系:酶活高時產(chǎn)酸速率快。發(fā)酵初期菌體要適應(yīng)新環(huán)境,因而生長較弱,ADH和ALDH的表達(dá)量較少,酶活較低,此時產(chǎn)酸速率較小。隨著菌種的生長進(jìn)入對數(shù)期,ADH和ALDH的表達(dá)量增加,酶活處于較高的水平,此時,菌種產(chǎn)酸速率顯著加快,發(fā)酵液中大量積累醋酸。隨著發(fā)酵進(jìn)入后期,菌種停止生長甚至死亡,酶的分泌量急劇減少,產(chǎn)酸速率隨之下降直到停止。
在實際發(fā)酵過程中,可以通過控制發(fā)酵液中的乙醇含量調(diào)節(jié)ADH和ALDH的酶活,從而提高產(chǎn)酸量。對于連續(xù)補(bǔ)料發(fā)酵,可以控制乙醇含量為4%,此時ADH和ALDH的酶活維持在較高的水平,達(dá)到從酶學(xué)水平調(diào)控發(fā)酵,提升產(chǎn)量的目的。
2.2度對ADH和ALDH的影響
溫度是影響醋酸發(fā)酵的重要因素。發(fā)酵培養(yǎng)基(2 L)滅菌后加入體積分?jǐn)?shù)為4%的無水乙醇和8%的種子液,分別于28℃、30℃、32℃、35℃、37℃、39℃條件下在發(fā)酵罐(10 L)中發(fā)酵。每天測量ADH和ALDH的酶活,產(chǎn)酸量和醋酸菌的生長。菌種在不同溫度下的生長量、產(chǎn)酸量及酶活結(jié)果如圖2所示。

圖2 溫度對菌株AS1.41的生物量和產(chǎn)酸量(A)及ADH和ALDH的酶活(B)的影響Fig.2 Effect of tem perature on biom ass,acid yield(A)and enzyme activity of ADH and ALDH(B)of strain AS1.41
由圖2A可知,醋酸菌AS1.41在不同溫度下的生物量和產(chǎn)酸的表現(xiàn)是一致的,即生長越好產(chǎn)酸越高。在發(fā)酵溫度為32℃時,AS1.41的生長最好(OD600nm=2.23),產(chǎn)酸量最大(39.8 g/L)。由圖2B可知,ADH和ALDH的酶活與發(fā)酵溫度存在相關(guān)性:發(fā)酵溫度為32℃時,ADH和ALDH的酶活均達(dá)到最大,分別為8.34U/mg和7.23U/mg;隨著溫度繼續(xù)升高(>35℃),ADH和ALDH的酶活快速下降,且ADH的下降速率高于ALDH。
結(jié)果表明,不同溫度條件下ADH和ALDH的酶活水平與菌體的生長表現(xiàn)是一致的,培養(yǎng)溫度為32℃時,菌體生長最為活躍,酶活最高,產(chǎn)酸最快。溫度過高(>35℃)后,AS1.41的生長受到抑制,酶活降低,產(chǎn)酸速率下降。因此,在實際生產(chǎn)中,可以通過控制發(fā)酵溫度,使得發(fā)酵體系中ADH和ALDH處于較高酶活水平,從而提高生產(chǎn)強(qiáng)度。從本實驗的結(jié)果來看,32℃最適合作為AS1.41的發(fā)酵溫度。
2.3酸(乙酸)對ADH和ALDH的影響
醋酸是醋酸菌發(fā)酵的主要產(chǎn)物,發(fā)酵初期醋酸的存在會對發(fā)酵產(chǎn)生一定的影響[13-14],酶系水平可能也會發(fā)生一些變化。為研究底酸(乙酸)對酶的影響,發(fā)酵培養(yǎng)基(2 L)滅菌后加入體積分?jǐn)?shù)4%的乙醇和8%的種子液,同時分別加入0、0.5%、1.0%、1.5%、2.0%、2.5%的乙酸作為底酸,在發(fā)酵罐(10 L)中32℃發(fā)酵。每天測量ADH和ALDH的酶活,產(chǎn)酸量和AS1.41的生長量。不同底酸下菌種的最大生長量,最大產(chǎn)酸量和最大酶活如圖3所示。
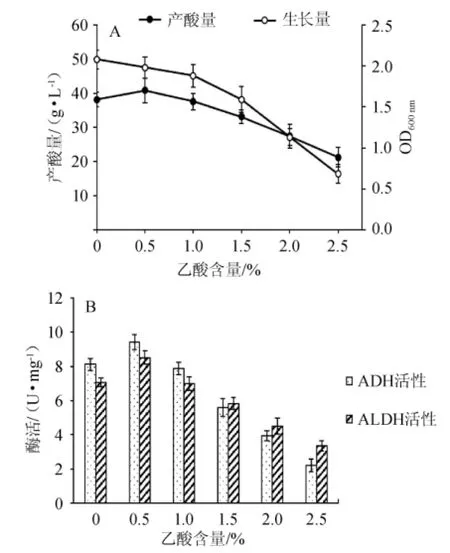
圖3 乙酸含量對菌株AS1.41的生物量和產(chǎn)酸量(A)及ADH和ALDH的酶活(B)的影響Fig.3 Effec t of acetic acid content on biom ass,acid yield(A)and activities of ADH and ALDH(B)of strain AS1.41
由圖3A可知,菌株AS1.41的生物量隨底酸的增加(0~1.5%)而緩慢減少,產(chǎn)酸量先增加后減少。底酸含量為0.5%時,菌株AS1.41的產(chǎn)酸量最大(40.8 g/L),生物量較好(OD600nm=1.98)。因此,發(fā)酵時加入0.5%的底酸對菌株AS1.41的產(chǎn)酸有促進(jìn)作用。從圖3B可知,發(fā)酵過程中,ADH和ALDH的酶活與底酸有一定關(guān)系:隨底酸的增加,ADH和ALDH的酶活均先增大后降低,當(dāng)?shù)姿岷浚?.0%時,酶活快速降低,且ADH酶活的下降速率高于ALDH。
結(jié)果表明,不同底酸含量下ADH和ALDH的酶活水平與菌體的產(chǎn)酸表現(xiàn)是一致的。加入0.5%的底酸后,ADH和ALDH的酶活分別由8.12 U/mg和7.06 U/mg提高到了9.43U/mg和8.52U/mg。因此,一定量的底酸存在會形成反饋激活作用,促進(jìn)ADH和ALDH的表達(dá),從而提高其酶活。因此,在實際的生產(chǎn)過程中,加入一定量(0.5%)的乙酸作為底酸,可有效提高ADH和ALDH的酶活,最終達(dá)到促進(jìn)發(fā)酵、提高產(chǎn)酸的目的。
2.4醇脫氫酶(ADH)和乙醛脫氫酶(ALDH)的穩(wěn)定性
酶在極端環(huán)境下的穩(wěn)定性是工業(yè)生產(chǎn)上十分關(guān)心的問題[15]。因此,研究了ADH和ALDH在不同乙醇、乙酸、溫度下的穩(wěn)定性,結(jié)果見圖4~圖6。
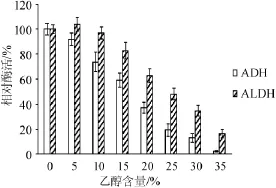
圖4 ADH和ALDH在不同乙醇含量下的穩(wěn)定性Fig.4 Stability of ADH and ALDH at differentethanol concentration
由圖4可知,乙醇含量<5%時,ADH和ALDH均非常穩(wěn)定,其酶活保持在較高的水平;乙醇含量為15%時,ALDH較為穩(wěn)定,其剩余酶活>82.78%,而ADH的酶活僅為初始酶活的59.32%;乙醇含量>15%時,ADH的酶活急劇下降;當(dāng)乙醇含量達(dá)到35%時,ADH幾乎完全失活,而ALDH仍保留了16.54%的酶活。由此可見,ALDH對乙醇的穩(wěn)定性明顯高于ADH。
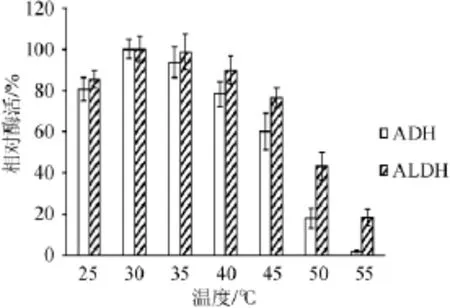
圖5 ADH和ALDH在不同溫度下的穩(wěn)定性Fig.5 Stability of ADH and ALDH at different tem perature
由圖5可知,ADH和ALDH的酶活在30℃時最穩(wěn)定;當(dāng)溫度為45℃時,ADH和ALDH的剩余酶活分別為60.1%和76.3%;溫度>50℃時,ADH和ALDH的酶活迅速降低,且ADH下降速率明顯高于ALDH。55℃時,ALDH保留了18.6%的酶活,而ADH失去了活性。因此,ALDH對溫度的穩(wěn)定性優(yōu)于ADH。
由圖6可知,酸的存在對ADH和ALDH的穩(wěn)定性有重要的影響。隨乙酸的含量從0增加到4%,ADH和ALDH的相對酶活從100%分別下降到58.5%和76.3%;乙酸含量超過6%時,ADH和ALDH的活性急劇下降,這對醋酸發(fā)酵極為不利。乙酸含量為10%時,ADH幾乎失活,而ALDH的剩余酶活僅為17.1%。由此可知,ALDH對乙酸的穩(wěn)定性強(qiáng)于ADH。
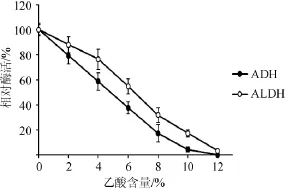
圖6 ADH和ALDH在不同乙酸含量下的穩(wěn)定性Fig.6 Stability of ADH and ALDH at different acetic acid content
結(jié)果表明,ALDH對乙醇、乙酸、溫度的穩(wěn)定性均高于ADH,因此,ADH是醋酸發(fā)酵過程中的限制酶。要保持較高的發(fā)酵效率就必須使ADH和ALDH在復(fù)雜發(fā)酵環(huán)境下仍保持較高的活性,因此,發(fā)酵條件必須進(jìn)行控制:發(fā)酵的初始乙醇含量要<10%,發(fā)酵溫度≤35℃,發(fā)酵液中的乙酸含量≤4%。
3 結(jié)論
通過發(fā)酵罐進(jìn)行分批發(fā)酵探究醋酸菌AS1.41產(chǎn)酸與關(guān)鍵酶系之間的關(guān)系。在不同初始乙醇濃度含量下,酶活與產(chǎn)酸速率呈現(xiàn)出較高一致性:酶活越高,產(chǎn)酸越快。2%~4%的初始乙醇可誘導(dǎo)ADH和ALDH的表達(dá),在此范圍內(nèi),ADH和ALDH的酶活明顯提高。發(fā)酵溫度為32℃時,菌體生長最為活躍,ADH和ALDH的酶活最大,產(chǎn)酸的速率最快,發(fā)酵溫度>35℃時,酶的表達(dá)受到抑制,AS1.41的產(chǎn)酸速率下降。在0.5%的底酸(乙酸)存在時,ADH和ALDH的酶活分別由8.12 U/mg和7.06 U/mg提升到了9.43 U/mg和8.52U/mg,產(chǎn)酸速率也得以提升。
通過對剩余酶活的測量來探究ADH和ALDH面對乙醇、溫度、乙酸時的穩(wěn)定性。與ADH相比,ALDH顯示出更好的乙醇、溫度以及乙酸穩(wěn)定性。本研究同時表明:當(dāng)乙醇含量<10%,溫度≤35℃,乙酸含量≤4%時,ADH和ALDH的酶活相對穩(wěn)定,對發(fā)酵也比較有利。
酶的表達(dá)量直接關(guān)系到酶的活性大小,酶的穩(wěn)定性直接關(guān)系到酶的作用時間,因此,ADH和ALDH的活性和穩(wěn)定性對AS1.41產(chǎn)酸有直接影響。在實際發(fā)酵過程中可以通過控制發(fā)酵的初始乙醇,底酸,溫度等條件達(dá)到調(diào)控酶的表達(dá)量和酶的穩(wěn)定性,最終達(dá)到提升產(chǎn)酸量,縮短發(fā)酵周期的目的。
[1]ADACHIO,TAYAMA K,SHINAGAWA E,et al.Purification and characterization of particulate alcohol dehydrogenase from Gluconobacter suboxydans[J].Agr Biol Chem,1978,42(11):2045-2056.
[2]ALTSCHUL S F,MADDEN T L,SCHAFFER A A,et al.Gapped BLAST and PSI-BLAST:a new generation of protein database search programs[J].Nucleic Acids Res,1997,25(17):3389-3402.
[3]ADACHIO,TAYAMA K,SHINAGAWA E,etal.Purification and properties of particulate alcohol dehydrogenase from Acetobacter aceti[J]. Agr Biol Chem,1978,42(12):2331-2340.
[4]ADACHIO,TAYAMA K,SHINAGAWA E,etal.Purificationand characterizationofmembrane-bound aldehydedehydrogenase from Gluconobactersuboxydans[J].Agr Biol Chem,1980,44(3):503-515.
[5]MATSUSHITA K,SHINAGAWA E,ADACHIO,et al.Quinoprotein D-glucose dehydrogenase of the Acinetobacter calcoaceticus respiratory chain:membrane-boundand soluble formsaredifferentmolecularspecies[J]. Biochem,1989,28(15):6276-6280.
[6]MATSUSHITA K,OHNO Y,SHINAGAWA E,et al.M embrane-bound D-glucose dehydrogenase from Pseudomonas sp.:solubilization,purificationand characterization[J].Agr BiolChem,1980,44(7):1505-1512.
[7]NANDA K,TANIGUCHIM,UJIKE S,et al.Characterization of acetic acid bacteria in traditionalacetic acid fermentation of rice vinegar(komesu)and unpolished rice vinegar(kurosu)produced in Japan[J].Appl Environ M icrobiol,2001,67(2):986-990.
[8]周秉辰.食醋生產(chǎn)中醋酸菌乙醇脫氫酶的活性與產(chǎn)酸速率關(guān)系的研究[J].中國釀造,2009,28(11):58-60.
[9]TRCEK J,TOYAMAH,CZUBA J,etal.Correlation between acetic acid resistance and characteristics of ADH PQQ-dependent in acetic acid bacteria[J].ApplM icrobiol Biotech,2006,70(3):366-373.
[10]KANCHANARACHW,THEERAGOOLG,YAKUSHIT,etal.Characterization of thermotolerant Acetobacter pasteurianus strains and their quinoprotein alcoholdehydrogenases[J].App l M icrobiol Biot,2010,85(3):741-751.
[11]問清江,慕娟,黨永,等.乙醇脫氫酶(ADH)產(chǎn)酶菌株的選育[J].微生物學(xué)雜志,2013,33(6):54-59.
[12]WOODW A.Methods in enzymology[M].Salt Lake City:Academic Press,1982.
[13]SEAKIA,MATSUSHITA K,TAKENO S,et al.Enymes responsible for acetateoxidation by acetic acid bacteria[J].Biosci Biotech Biochem,1999,63(12):2102-2109.
[14]DEORY I,ROMERO LE,CANTERO D.Optimum starting-up protocol of a pilot plant scale acetifier for vinegar production[J].J Food Eng,2002,52(1):31-37.
[15]JADHAY SB,BANKAR SB,GRANSTROM T,etal.Enhanced stability of alcohol dehydrogenase by non-covalent interaction with polysaccha rides[J].ApplM icrobiol and Biot,2014,98(14):6307-6316.
Study on the key enzymes of acetic acid production from Acetobacter pasteurianus ASI.41
CHEN Yang,GAO Bing,WANG Chao,LIDongsheng,XU Ning,HU Yong*
(HubeiResearch CenterofFood Fermentation Engineeringand Technology,Research CenterofFood Fermentation Engineering and Technology ofHubei,HubeiUniversity ofTechnology,Wuhan 430068,China)
The alcohol dehydrogenase(ADH)and aldehyde dehydrogenase(ALDH)were the key enzymeswhich ethyl alcoholwasoxidized into acetic acid by Acetobacterpasteurianus.The enzyme activity of ADH and ALDH presented dynamic changesunder the conditionsof different initial ethanolcontent.When ethanolcontentwas4%,theenzymeactivity of ADH and ALDH reached themaximum 7.43U/mg and 7.18U/mg,respectively.Enzymeactivity and acid production ratepresented ahigh consistency.Thehigher the enzyme activity,the faster the acid produces.When the fermentation temperaturewas32℃,thegrow th of thestrainwas themostactive;theenzymeactivity reached to the highest,and theacid production rate was the fastest.A fter adding acetic acid 0.5%,the enzyme activity of ADH and ALDH increased from 8.12 U/mg and 7.06 U/mg to 9.43 U/mg and 8.52 U/mg,respectively.Acid production ratewasalso improved.The stability of ALDH on ethanol,acetic acid,and temperature was higher than thatof ADH.
Acetobacerpasteurianus;ADH;ALDH;ethanol;temperature;acetic acid
TS264.2
0254-5071(2016)01-0038-05
10.11882/j.issn.0254-5071.2016.01.009
2015-10-28
湖北省自然科學(xué)基金(2015CFB678);湖北省級教育部門青年人才項目(Q20151412)
陳洋(1988-),男,碩士研究生,研究方向為食品微生物和發(fā)酵工程。
胡勇(1980-),男,講師,博士研究生,研究方向為細(xì)胞工程。

