油水乳液中水合物法分離甲烷/乙烯生成動力學
周文濤,李優,李鑫鋼,李永紅1,
(1天津大學化工學院,綠色合成與轉化教育部重點實驗室,天津 300072;2精餾技術國家工程研究中心,天津 300072;3天津化學化工協同創新中心,天津 300072)
油水乳液中水合物法分離甲烷/乙烯生成動力學
周文濤1,3,李優2,3,李鑫鋼2,3,李永紅1,2,3
(1天津大學化工學院,綠色合成與轉化教育部重點實驗室,天津 300072;2精餾技術國家工程研究中心,天津 300072;3天津化學化工協同創新中心,天津 300072)
低碳烯烴的分離在石化行業有著重要意義。使用恒容的釜式反應器進行了水合物法分離甲烷和乙烯混合氣動力學實驗,并研究了不同溫度和乳液用量對于水合分離效果和生成動力學的影響。在溫度為273.35 K、100 m l乳液用量條件下,混合氣中乙烯含量從34%降至9.97%,回收率達到90.36%,溫度越低、乳液量越多,乙烯回收率越高。提出了一套以逸度差為推動力的動力學模型,能夠較好地擬合實驗數據,同時根據參數能夠較好地預測實驗結果。
動力學;分離;回收;水合物;乙烯
引 言
當前我國石化行業在 FCC(fluid catalytic cracked)催化裂化過程中產生的催化裂化干氣量達到了130 M t·a-1以上,含有大量優質低碳輕烴和氫氣等高附加值物質,其中乙烯含量占到了 1M t·a-1[1],現有處理技術多直接作為工業或是民用燃料的方式直接燒掉,造成了極大的資源浪費。如何回收利用裂解干氣中具有高附加值的低碳烴成為了研究熱點。
傳統分離方法包括深冷分離[2-3]、吸收分離[4-6]、吸附分離[7-8]和膜分離技術[9-10],水合分離技術作為一種新型的分離方法,相對傳統的分離方法具有巨大潛力。首先水合分離技術與變壓吸附分離、膜分離技術相比具有更好的適用性,對原料氣的要求相對較低;深冷分離和低溫分離技術都需要在超低溫下操作,而水合分離技術能在 0℃以上進行操作,大大降低了操作條件和設備費用;同時水合分離具有儲氣量高和無污染的特點。Bishnoi等[11-12]系統地研究了甲烷、乙烷及其混合物在純水體系中生成速率。Kondo等[13]研究了甲烷、乙烷和丙烷的混合水合物的生成速率和組成,發現使用相平衡的計算方法來估算組成可以得到可以接受的精度。Giraldo等[14]也報道了類似的研究。Turner等[15]研究了油水乳液中形成水合物的動力學,并提出了縮殼擴散模型。Mu等[16]研究了微型乳液中甲烷水合物的生成,他們認為,當顆粒足夠小時,水合物的生成不再是擴散控制的。Liu等[17]研究了油水乳液分離裂化干氣的效果,他們測定了分離系數和分離效果,回收率能達到80%。Ma等[18]使用Chen-Guo模型計算了多組分的分離相平衡,他們發現 Chen-Guo模型可以很好地預測多組分的相平衡組成,包括氣相、液相和水合物相。Ribeiro等[19]總結了水合物生成的模型主要分為本征控制、傳質控制和傳熱控制機理。
本實驗采用水合物法成功實現了在油水乳液條件下分離甲烷和乙烯混合氣,從而實現對低碳烯烴的回收利用,研究了溫度和乳液量對其分離效果的影響。根據Chen-Guo方程的分布理論和Englezos等[12]、Giraldo等[14]的理論提出并建立了一套以逸度為推動力的動力學模型,與實驗結果擬合程度較高,為工業應用提供相應理論指導。
1 實驗裝置和實驗方法
1.1實驗試劑
實驗所用的甲烷/乙烯混合氣由天津盛唐氣體有限公司提供,乙烯濃度為 34%;正癸烷純度為98%,Span80、Tween80為醫藥級純度,均由A laddin工業有限公司提供。
1.2實驗裝置
實驗裝置如圖1所示,主要由高壓反應釜、低溫恒溫槽和數據采集系統構成。設備具體信息見文獻[20],氣相色譜儀GC9790用于測定混合氣組成。
1.3實驗步驟
乳液配制:按照體積比7:3配制120 m l乳液,首先量取84 m l正癸烷和36 m l水置于燒杯中,根據HLB=9,依次添加0.72 g Span(去離子水質量的2%)和0.5638 g Tween80加入到燒杯中,然后用高速分散劑在10000 r·min-1轉速下分散10 m in制得乳液。
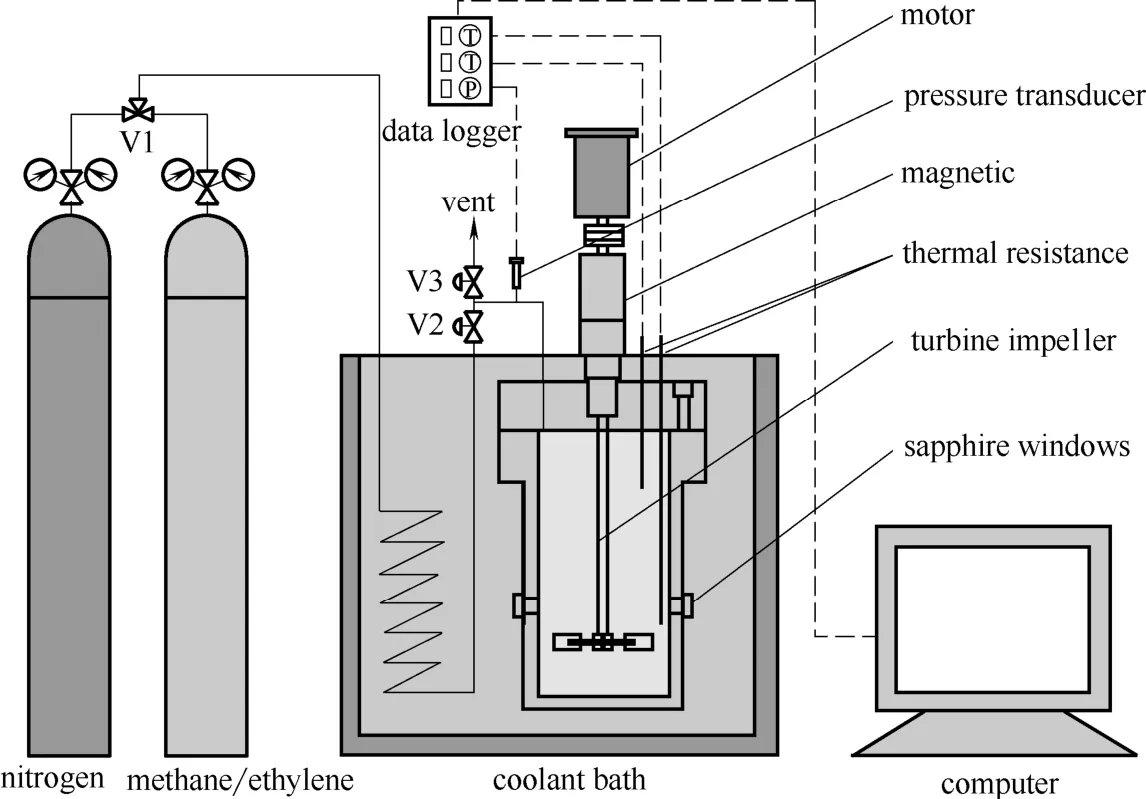
圖1 實驗裝置Fig.1 Schematic diagram of experimental apparatus
水合反應步驟:量取上述配制100 m l乳液于反應釜,先用N2檢查氣密性(加壓至7.00 MPa,0.5 h壓力不降即證明氣密性良好),然后用N2排除置換空氣3次;啟動低溫槽,開啟攪拌,降至實驗溫度,維持穩定后停止攪拌,用混合氣置換3次,然后升壓至初始實驗壓力5.0 MPa,關閉進氣閥。調節攪拌速度至 800 r·m in-1,啟動數據采集系統,每隔30 s記錄實驗過程中氣液相溫度以及壓力的變化。當系統壓力下降即證明水合物生成,系統壓力穩定3 h不再變化即可認為反應平衡,取出達到平衡后的混合氣用色譜進行成分分析。
1.4數據處理
利用反應前后乙烯的物料平衡得

式中, n0、 n1、n分別為反應前后氣相和乳液相中乙烯的量。

壓縮因子Z0、Z1分別通過P-T方程確定,采用普通混合規則計算得到回收率r為

式中, y0、x表示原料氣相和反應后乳液相中乙烯的摩爾分數,可通過測定反應前后氣相組成得到。
2 分離實驗結果與討論
在初始壓力為5.0 MPa,攪拌速度為800 r·min-1條件下,測定了不同反應溫度和乳液用量條件下反應體系壓力和溫度隨時間的變化關系,通過色譜分析檢測反應前后混合氣組成,計算出對應分離效果。
2.1反應溫度對分離效果的影響
如圖2和圖3所示,當反應溫度在冰點以上時,在乳液用量均為 100 m l的情況下,反應溫度為273.35 K時混合氣中乙烯含量經過單級水合分離之后從34%降到了9.97%,乙烯回收率達到了90.36%,具有良好的分離效果。同時從圖3中明顯發現隨著反應溫度的升高,乙烯回收率從 90.36%降到了83.75%,一方面是由于水合反應是放熱反應,低溫更能促進反應進行,讓更多的乙烯在水合物相中得到富集,另一方面就是溫度越低,分離效果越好,回收率越高。當反應溫度在冰點以下時,分離效果更好,但是鑒于本課題組在研究純甲烷動力學時發現冰點以下水合反應存在結冰等特殊情況[20],具有不確定性,且能耗較高,所以反應溫度為273.35 K時是比較合適的工藝條件。
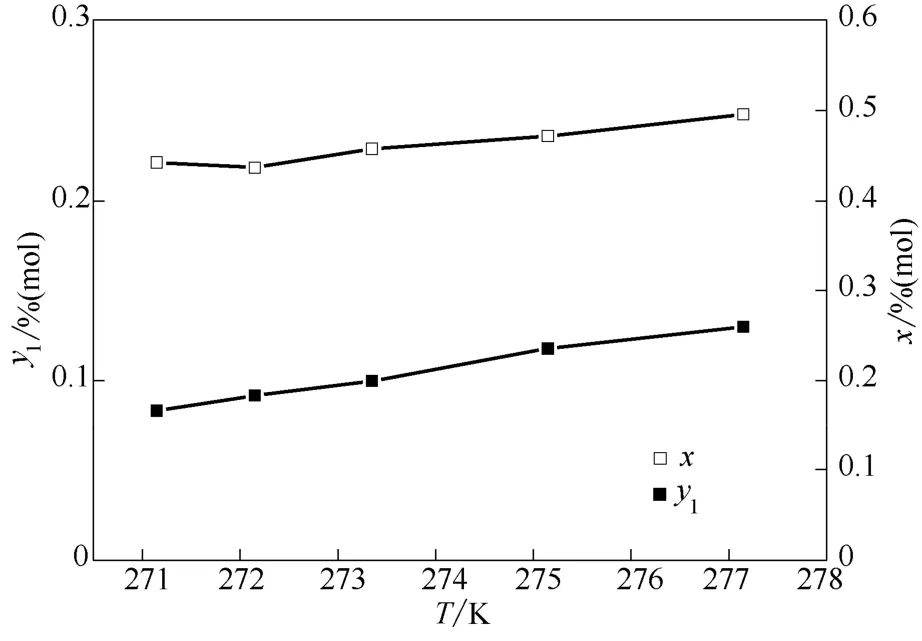
圖2 乙烯在氣相和水合相中濃度隨反應溫度的變化曲線Fig.2 Change of ethylene concentration in gas and hydrate phase at different temperature
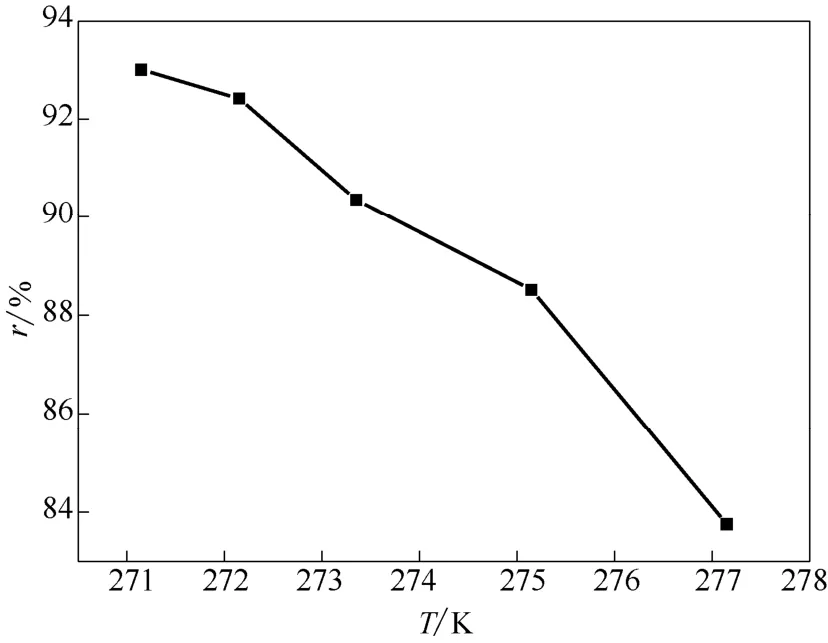
圖3 乙烯回收率隨反應溫度的變化曲線Fig.3 Change of ethylene recovery at different temperature
2.2乳液用量對分離效果的影響
在反應溫度維持在273.35 K不變時,從圖4中可以看出,隨著乳液用量從70 m l增加到100 m l,平衡氣相中乙烯的含量從13.97%降到了9.97%,同時從圖5中也可以看出乙烯的回收率也從78.59%升至90.36%,乳液量增多,更多的乙烯參與到水合反應,從而讓乙烯在水合物相得到富集,保證較好的分離效果。
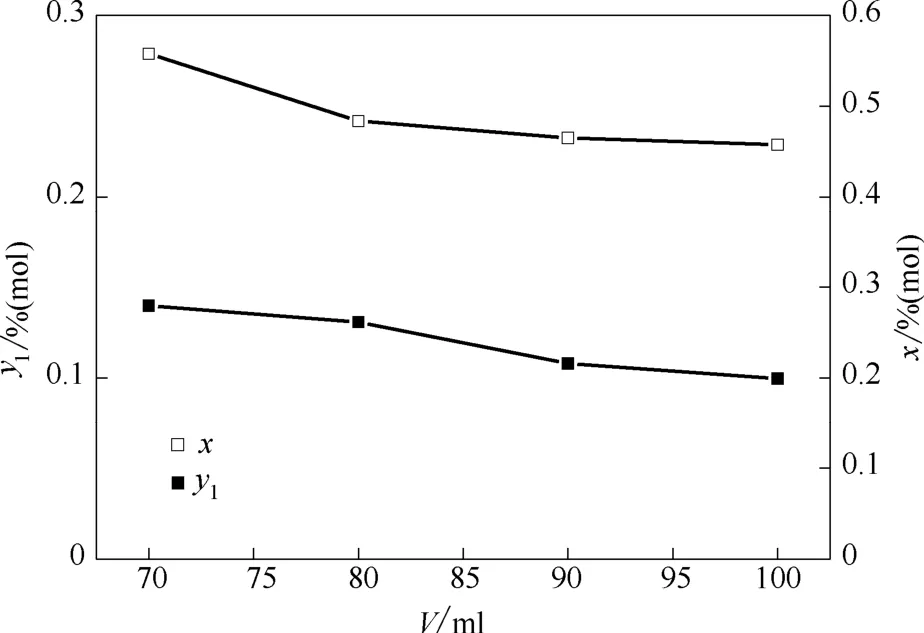
圖4 乙烯在氣相和水合相中濃度隨反應乳液量的變化曲線Fig.4 Change of ethylene concentration in gas and hydrate phase at different amount of emulsion
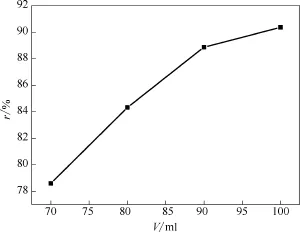
圖5 乙烯回收率隨反應乳液量的變化曲線Fig.5 Change of ethylene recovery in gas and hydrate phase at different amount of emulsion
2.3與純水體系分離效果的比較
在反應溫度為273.35 K條件下,利用100 m l的純水對混合氣進行水合分離。結果表明混合氣在純水體系中分離之后乙烯含量從 34%降到了12.07%,乙烯回收率達到91.86%,分離效果與油水乳液體系差別較小,但是通過對比整個水合過程發現(圖6),在乳液體系中,混合氣完成溶解、誘導和水合生長整個過程僅需 125 min,而純水體系時間長達 416 min,也說明了油包水乳液的存在一方面增大了氣液接觸面積,進而加快了水合反應速率,另一方面在實際工業應用中也能改善液相的流動性,不堵塞管道,油水乳液相比純水體系在工業應用中更具優勢。
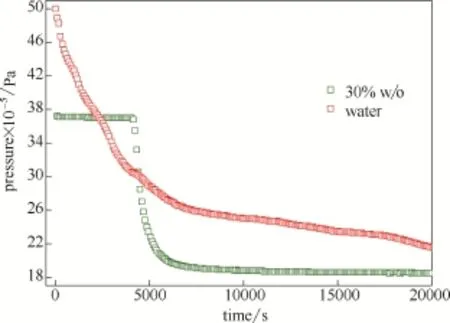
圖6 純水體系與乳液體系壓力曲線變化Fig.6 Change of pressure w ith time in pure water and w/o emulsion
3 水合物生成動力學實驗結果與討論
3.1水合物生成動力學模型
本文所采用的模型使用氣體實時逸度和平衡逸度的差作為推動力。根據 Giraldo等[14]的簡化理論,可以只使用某一種物質的水合物生成動力學常數和水合物生成的物質比例來預測混合水合物生成速率。
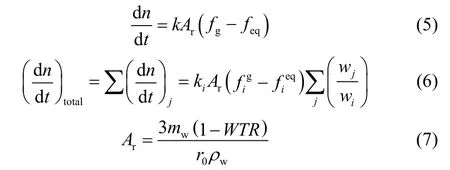
式中,ki為i組分的水合反應速率常數;Ar為氣液相界面積;wi為i組分水合反應的化學計量系數;fg為瞬時逸度;feq為平衡逸度。
本工作中,使用乙烯的動力學系數來計算整個過程的氣體消耗。根據Chen-Guo方程[21]來預測水合物中甲烷和乙烯的組成,使用Langmuir式吸附模型來進行計算。
3.1.1成核時間分布根據 Dalmazzone等[22]的理論,在水合物形成的初期,不同的液滴不是同時生成水合物的。水合物的形成遵循正態分布。
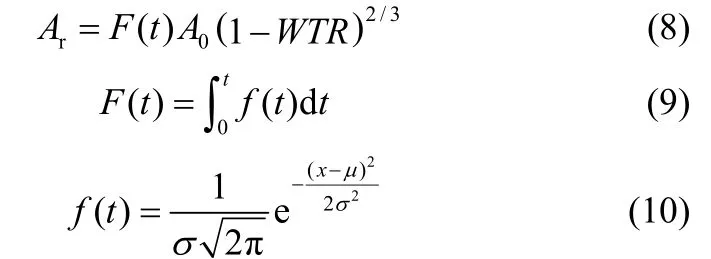
式中, f(t)為成核時間分布密度函數;F(t)為成核時間分布函數;μ為分布的期望,也可以理解為平均分布時間;σ為正態分布的標準差,標準差越大,成核過程分布得就越分散。對于本文的研究體系,當水合物的生成過程標準差小于30 s(每30 s測一次壓力)時可以認為,幾乎是同時成核的。本工作所觀測到的成核時間分布為100~288 s不等,間接證明了該體系下水合物并不是同時成核。
3.1.2模擬方法本文采用上述模型,回歸得到了乙烯在甲烷/乙烯混合水合物生成中的動力學參數。具體地,使用了ACM(Aspen Custom Modeler)中的參數估計模塊。因為在攪拌的情況下氣液間的相互作用是比較迅速的,所以可以認為氣液間始終處于相平衡。通過PR-EOS對氣液間的相平衡進行計算,相關的逸度也用該狀態方程算出。
參數的優化過程類似于動態優化的過程,其目標函數為觀測值與預測值的均方差。
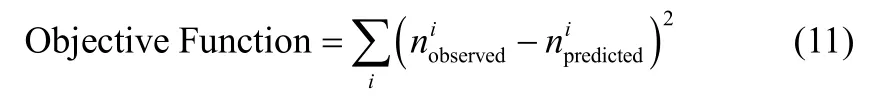
3.2不同溫度下的水合物生成情況
圖7為不同溫度下壓降曲線。分別對3組不同水浴溫度下的實驗得到的結果進行參數擬合,擬合的效果見圖7中的實線部分,與實驗結果基本吻合。擬合得到的參數值見表1。
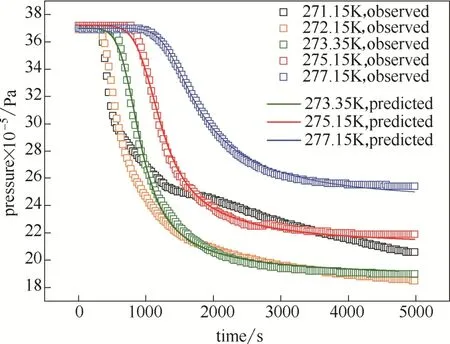
圖7 不同溫度下壓力隨時間的變化關系Fig.7 Change of pressure w ith time at different temperature

表1 不同溫度下回歸參數Table 1 Regressed parameters at different tem perature
如圖7所示,在冰點以下時由于結冰現象的存在,出現了拐點,壓力變化具有不確定性[20],故只針對冰點以上溫度進行擬合。如表1所示,隨著溫度從273.35 K提升至277.15 K,回歸得到的動力學常數k從1.16×10-6mol·bar-1·m-2提升至1.96× 10-6mol·bar-1·m-2。從圖7中可以看出隨著溫度的提升,壓降的曲線是在逐漸變平的。這與k隨溫度的提升而提升是不矛盾的。因為,水合的速率是由k與推動力兩個因素共同決定的。溫度提升后,雖然k值升高,但是逸度差的推動力變小了,所以曲線變得更為平緩。從表1中還觀察到,隨著溫度的提升,成核時間的標準差在逐漸變大,這說明隨著溫度的提升,水合物的成核在變得越來越不均勻。這與Dalmazzone等[22]的研究結果相符合。
3.3不同乳液用量的實驗結果
在反應溫度定在273.35 K條件下,從圖8中方塊所示的實驗結果可以看出隨著乳液用量的增多,水合反應速度更快。根據計算得到的參數,對不同乳液體積的實驗進行了預測。預測的過程中,由于成核的隨機性,平均成核時間仍需要重新計算。成核標準差采用冷浴溫度為 273.35 K條件下的標準差,如圖8實線部分所示,模型預測結果與實驗結果擬合效果較好。這說明本文提出的動力學控制的理論是合理的。由圖8中還可以看出隨著乳液用量的減少,平衡的壓力在逐漸升高,這是因為乳液用量提高后,水與油的量均增加,這就使更多的氣體進入到乳液中。
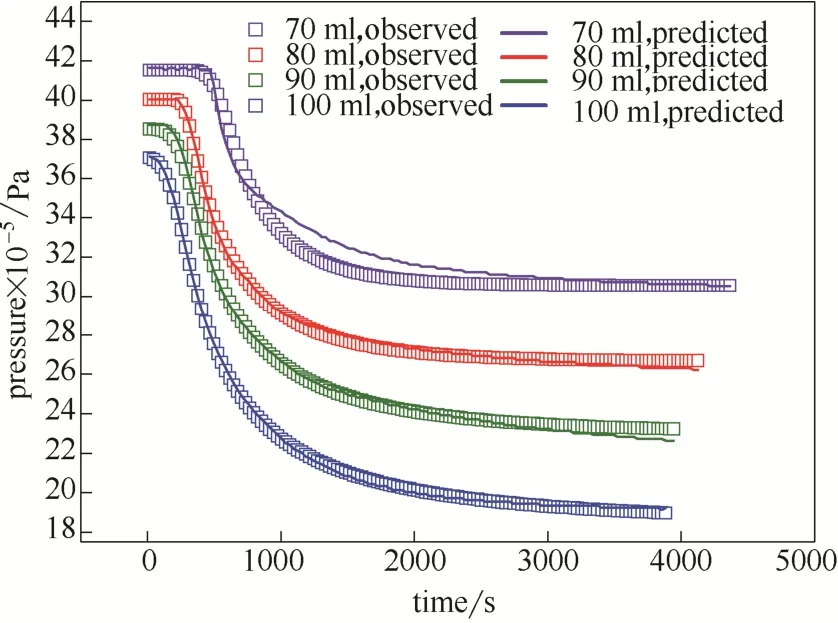
圖8 不同乳液量下壓力隨時間的變化關系Fig.8 Change of pressure w ith time at different amount of emulsion
4 結 論
在油水乳液中通過水合物法分離甲烷和乙烯的混合氣能夠達到較好效果,在溫度為273.35 K,乳液用量為 100 m l時,混合氣中乙烯含量能夠從34%降至9.96%,回收率達到90.36%,有較好的分離效果,隨著溫度降低和乳液含量的增多分離效果越來越好,且油水乳液相對于純水體系具有水合時間短的優勢。根據Chen-Guo方程和Giraldo等提出的以逸度差為推動力的油水乳液動力學模型能夠較好地擬合實驗數據,并且通過成核時間分布能夠準確描述水合物形成初期過程,根據回歸的參數也能夠準確地預測結果。
References
[1]丁雪. 催化裂化干氣中乙烯的低聚反應研究 [D]. 青島: 中國石油大學, 2010.
DING X. Study on the oligomerization of ethylene in FCC dry gas [D]. Qingdao: China University of Pertoleum, 2010.
[2]XU G, Li L, YANG Y, et al. A novel CO2cryogenic liquefaction and separation system [J]. Energy, 2012, 42 (1): 522-529.
[3]BARCLAY M A, BROOK T C, BARCLAY J A, et al. Apparatus and method for purifying natural gas via cryogenic separation: US 6082133 [P]. 2000.7.4.
[4]HUANG W Q, ZHENG Z N, SHI L, et al. Simulation and optimization of gasoline vapor absorption separation [J].Advanced Materials Research, 2013, 742: 492-496.
[5]FERON P H M, JANSEN A E. CO2separation w ith polyolefin membrane contactors and dedicated absorption liquids: performances and prospects [J]. Separation and Purification Technology, 2002, 27(3): 231-242.
[6]LI Y, YI H, TANG X, et al. Adsorption separation of CO2/CH4gas m ixture on the commercial zeolites at atmospheric pressure [J]. Chem ical Engineering Journal, 2013, 229: 50-56.
[7]MOFARAHI M, GHOLIPOUR F. Gas adsorption separation of CO2/CH4system using zeolite 5A [J]. M icroporous and Mesoporous Materials, 2014, 200: 1-10.
[8]ZHANG L, QIAN G, LIU Z, et al. Adsorption and separation properties of n-pentane/isopentane on ZIF-8 [J]. Separation and Purification Technology, 2015, 156: 472-479.
[9]W ILCOX J, HAGHPANAH R, RUPP E C, et al. Advancing adsorption and membrane separation processes for the gigaton carbon capture challenge [J]. Annual Review of Chem ical and Biomolecular Engineering, 2014, 5: 479-505.
[10]CHEN G Q, KANEHASHI S, DOHERTY C M, et al. Water vapor permeation through cellulose acetate membranes and its impact upon membrane separation performance for natural gas purification [J]. Journal of Membrane Science, 2015, 487: 249-255.
[11]CLARKE M, BISHNOI P R. Determ ination of the activation energy and intrinsic rate constant of methane gas hydrate decomposition [J]. The Canadian Journal of Chem ical Engineering, 2001, 79 (1): 143-147.
[12]ENGLEZOS P, KALOGERAKIS N, DHOLABHAI P D, et al. Kinetics of gas hydrate formation from m ixtures of methane and ethane [J]. Chem ical Engineering Science, 1987, 42 (11): 2659-2666.
[13]KONDO W, OHTSUKA K, OHMURA R, et al. Clathrate-hydrate formation from a hydrocarbon gas m ixture: compositional evolution of formed hydrate during an isobaric sem i-batch hydrate-form ing operation [J]. Applied Energy, 2014, 113: 864-871.
[14]GIRALDO C, MAINI B, BISHNOI R, et al. A simplified approach to modeling the rate of formation of gas hydrates formed from mixtures of gases [J]. Energy & Fuels, 2013, 27 (3): 1204-1211.
[15]TURNER D J, M ILLER K T, SLOAN E D. Methane hydrate formation and an inward growing shell model in water-in-oil dispersions [J]. Chemical Engineering Science, 2009, 64 (18): 3996-4004.
[16]MU L, LI S, MA Q L, et al. Experimental and modeling investigation of kinetics of methane gas hydrate formation in water-in-oil emulsion [J]. Fluid Phase Equilibria, 2014, 362: 28-34.
[17]LIU H, MU L, LIU B, et al. Experimental studies of the separation of C2 compounds from CH4+C2H4+C2H6+N2gas mixtures by an absorption-hydration hybrid method [J]. Industrial & Engineering Chemistry Research, 2013, 52 (7): 2707-2713.
[18]MA Q L, CHEN G J, SUN C Y. Vapor-liquid-liquid-hydrate phase equilibrium calculation for multicomponent systems containing hydrogen [J]. Fluid Phase Equilibria, 2013, 338: 87-94.
[19]RIBEIRO C P, LAGE P L C. Modelling of hydrate formation kinetics: state-of-the-art and future directions [J]. Chemical Engineering Science, 2008, 63 (8): 2007-2034.
[20]LI X, CHEN C, CHEN Y, et al. Kinetics of methane clathrate hydrate formation in water-in-oil emulsion [J]. Energy & Fuels, 2015, 29 (4): 2277-2288.
[21]CHEN G J, GUO T M. A new approach to gas hydrate modelling [J]. Chemical Engineering Journal, 1998, 71 (2): 145-151.
[22]DALMAZZONE D, HAMED N, DALMAZZONE C. DSC measurements and modelling of the kinetics of methane hydrate formation in water-in-oil emulsion [J]. Chemical Engineering Science,2009, 64 (9): 2020-2026.
K inetics of hydrate formation in water-oil emulsion for separation of methane and ethylene
ZHOU Wentao1,3, LI You2,3, LI Xingang2,3, LI Yonghong1,2,3
(1Key Laboratory for Green Chemical Technology of Ministry of Education, School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China;2National Engineering Research Center for Distillation Technology, Tianjin 300072, China;3Collaborative Innovation Center of Chemical Science and Engineering (Tianjin), Tianjin 300072, China)
Low-carbon olefin separation is important in petrochem ical industry. Separation of methane/ethylene mixture was studied by hydrate formation in water-in-oil (w/o) emulsion during isochoric and isothermal processes in an agitated reactor. With pressure-volume-temperature (PVT) method, the ethylene hydrate formation kinetics and separation efficiency were evaluated at various operating conditions of temperature and emulsion consumption. Ethylene concentration in gas mixture decreased from 34% to 9.97% and its recovery achieved to 90.36% w ith the use of 100m L emulsion at temperature of 273.35 K. Lower temperature and more emulsion were favorable for the recovery of ethylene. A kinetics-controlled model using fugacity difference as the driving force was proposed, which fitted the experiment data well and could predict experimental output accurately from operating parameters.
kinetics; separation; recovery; hydrate; ethylene
date: 2016-03-30.
Prof. LI Yonghong, yhli@tju.edu.cn
supported by the National Basic Research Program of China (2012CB215005).
TE 645
A
0438—1157(2016)08—3446—06
10.11949/j.issn.0438-1157.20160375
2016-03-30收到初稿,2016-05-30收到修改稿。
聯系人:李永紅。第一作者:周文濤(1991—),男,碩士研究生。
國家重點基礎研究發展計劃項目(2012CB215005)。