糖尿病周圍神經病變患者IL-6及IL-10水平與神經纖維損傷程度的相關性分析
蔡文婷 李小毅 毛春譜
江蘇無錫市第四人民醫院內分泌科 無錫 214062
?
糖尿病周圍神經病變患者IL-6及IL-10水平與神經纖維損傷程度的相關性分析
蔡文婷李小毅毛春譜
江蘇無錫市第四人民醫院內分泌科無錫214062
目的探討糖尿病周圍神經病變患者IL-6、IL-10水平與神經纖維損傷程度的相關性。方法選取2013-01—2015-01我院收治的2型糖尿病患者100例,根據血清IL-6和IL-10表達水平將患者分為IL-6+組和IL-6-組,以及IL-10+組和IL-10-組。比較不同血清IL-6、IL-10表達水平的糖尿病周圍神經病變患者的臨床資料、電生理檢測結果以及溫度感覺檢測結果。結果IL-6+組患者血清糖化血紅蛋白濃度明顯高于IL-6-組(P<0.05);IL-6+組患者腓腸神經SNAP振幅以及腓總神經CMAP 振幅明顯低于IL-6-組(P<0.05),IL-10+組患者腓腸神經SNAP振幅以及腓總神經CMAP 振幅、MNCV、F波最小潛伏期均明顯低于IL-10-組(P<0.05);IL-6+組WDT明顯高于IL-6-組(P<0.05);IL-10+組WDT明顯高于IL-10-組(P<0.05),IL-10+組CDT明顯低于IL-10-組(P<0.05)。結論血清IL-6和IL-10表達水平與糖尿病周圍神經病變患者神經纖維損傷程度有相關性,細胞因子IL-6和IL-10可能在糖尿病周圍神經病變發生過程中發生作用。
糖尿病;周圍神經病變;IL-6;IL-10;神經纖維損傷
糖尿病周圍神經病變(DPN)是最常見的2型糖尿病的長期并發癥(糖尿病),約50%的2型糖尿病患者受周圍神經病變的影響[1]。糖尿病周圍神經病變可涉及外周神經纖維。大外周神經纖維損傷可導致患者出現感覺異常、感覺喪失、肌肉無力,而小神經纖維損傷與疼痛、麻醉、腳潰瘍,以及自主神經癥狀有關[2]。臨床實踐中,DPN診斷常通過調查問卷,很少涉及臨床評價和電生理檢測,神經傳導研究(NCS)可記錄神經受累的范圍和程度,確認是否出現軸突損傷和(或)存在脫髓鞘[3]。為探討糖尿病周圍神經病變患者IL-6、IL-10水平與神經纖維損傷程度的相關性,本研究采用電生理及溫度感覺檢測對2013-01—2015-01我院收治的2型糖尿病患者100例進行研究,現報道如下。
1 資料和方法
1.1一般資料選取2013-01—2015-01我院收治的2型糖尿病患者100例。均經診斷均符合WHO1999年制定的診斷標準[4],年齡45~85歲。納入標準:(1)年齡≥18歲;(2)無認知功能障礙(簡易精神狀態評分≥27/30);(3)未合并其他神經系統病;(4)無嚴重全身感染或自身免疫性疾病、器官衰竭、血液系統疾病或惡性腫瘤;(5)未使用鎮痛或抗炎藥物,糖皮質激素或免疫調節治療方法。本研究經醫院倫理委員會討論通過,所有患者在納入研究前簽署知情同意書。
1.2研究方法所有患者于清晨空腹靜息抽取肘正中靜脈血2 mL,加入5% EDTA抗凝管中,于1 h內3 000 r/min離心5 min,分離血清和血漿并保存于-80 ℃冰箱內待測。IL-6和IL-10的檢測采用酶聯免疫吸附法(ELISA)檢測,試劑盒購買于上海酶聯生物科技有限公司,嚴格參照試劑盒檢測說明書操作。
根據血清IL-6和IL-10表達水平將患者分為IL-6+組和IL-6-組,以及IL-10+組和IL-10-組。IL-6+組43例和IL-6-組57例,IL-10+組14例和IL-10-組86例。
IL-6+組血清糖化血紅蛋白濃度明顯高于IL-6-組,差異有統計學意義(P<0.05),IL-6+組和IL-6-組年齡、性別、病程、BMI、腰圍、疼痛程度、空腹血糖、肌酐等一般資料比較差異無統計學意義(P>0.05),IL-10+組和IL-10-組年齡、性別、病程、BMI、腰圍、疼痛程度、空腹血糖、糖化血紅蛋白、肌酐等一般資料比較差異無統計學意義(P>0.05)。見表1。

表1 不同血清IL-6、IL-10表達水平的糖尿病周圍神經病變患者臨床資料比較
詳細記錄所有患者的臨床資料,并于出現神經病理性疼痛前1個月,通過0~10數字評定量表(NRS)評定疼痛強度。比較不同血清IL-6、IL-10表達水平的糖尿病周圍神經病變患者的臨床資料。
所有患者神經電生理測定采用丹麥Keypoint.net肌電圖儀。受試者均在屏蔽、安靜的環境中,仰臥放松,室溫保持在22~25 ℃,皮膚溫度控制在32~36 ℃。檢測患者的感覺神經動作電位(SNAP)和左腓腸神經的感覺神經傳導速度(SNCV),以及復合肌肉動作電位幅度(CMAP),運動神經傳導速度(MNCV)振幅,并記錄左腓總神經最小F波潛伏期。 皮膚交感反射(SSR)的檢測方法:記錄電極采用表面盤狀電極,置于手心記錄,手背參考,采用電剌激,以鞍形電極剌激腕部正中神經或內踝的脛神經(帶通濾波器0.1~100 Hz),記錄SSR值。比較不同血清IL-6、IL-10表達水平的糖尿病周圍神經病變患者電生理檢測結果。
溫度感覺檢測采用TSA-II溫度感覺神經檢測儀(以色列梅多克公司生產)檢測。在特定安靜的房間內,要求患者心無雜念,并通過1個30 mm×30 mm電極附著到左腳的背表面的皮膚傳遞熱或冷刺激。為確定檢測溫閾值(warm detection threshold,WDT)和冷檢測閾值(cold detection threshold,CDT),首先將皮膚置于32 ℃的溫度5 min,然后以緩慢的速度(1 ℃/s)降低或升高溫度,直到患者感覺到冷暖,停止刺激,記錄溫度。連續檢測4次,并記錄平均值。比較不同血清IL-6、IL-10表達水平的糖尿病周圍神經病變患者的WDT和CDT檢測值。

2 結果
2.1不同血清IL-6、IL-10表達水平的糖尿病周圍神經病變患者電生理檢測結果比較IL-6+組腓腸神經SNAP振幅以及腓總神經CMAP 振幅明顯低于IL-6-組,差異有統計學意義(P<0.05),IL-10+組腓腸神經SNAP振幅以及腓總神經CMAP 振幅、MNCV、F波最小潛伏期均明顯低于IL-10-組,差異有統計學意義(P<0.05)。見表2。
2.2不同血清IL-6、IL-10表達水平的糖尿病周圍神經病變患者溫度感覺檢測結果比較IL-6+組WDT明顯高于IL-6-組,差異有統計學意義(P<0.05);IL-10+組WDT明顯高于IL-10-組,差異有統計學意義(P<0.05),IL-10+組CDT明顯低于IL-10-組,差異有統計學意義(P<0.05)。見表3。
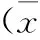
表2 不同血清IL-6、IL-10表達水平的糖尿病周圍神經病變患者電生理檢測結果比較±s)

表3 不同血清IL-6、IL-10表達水平的糖尿病周圍神經病變患者溫度感覺檢測結果比較±s)
3 討論
DPN的發病機制尚不完全清楚,高血糖、血脂異常、胰島素抵抗等均被認為與該病的發生有關[5-6]。高血糖的治療失敗提示早期生化介質包括山梨醇、蛋白質和脂蛋白糖基化,一旦被激活,可導致積累的脂氧合酶激活、氧化,引起神經生化途徑損傷。葡萄糖和氧化糖化蛋白可與神經元和內皮細胞的不同受體作用通過激活的炎癥信號,破壞線粒體的新陳代謝氧化應激,導致糖尿病周圍神經病變的發生[7-8])。
白介素在免疫系統起關鍵作用,根據其功能可分為抗炎和促炎兩大類,促炎包括TNF-α、IL-4和IL-6等,抗炎包括IL-2、IL-10等,其中一部分白介素細胞因子還具有神經保護功能[9-10]。本研究結果顯示,IL-6和IL-10上調血清水平可能導致糖尿病患者的腓腸神經SNAP和腓總神經CMAP幅度下降,高水平IL-10的血清水平減少腓總神經MNCV和最小的F波延遲,表明該細胞因子可能與軸突變性和脫髓鞘相關聯。高水平的血清IL-6和IL-10導致糖尿病患者對溫度感覺的敏感度下降,這可能涉及軸索、神經纖維損傷。40%以上的糖尿病患者血清IL-6水平升高,血清IL-6表達水平與SNAP和CMAP波幅呈顯著負相關。IL-6是促炎細胞因子,可能會影響神經膠質細胞和神經元參與DPN在運動的病理過程。IL-10被認為是一種抗炎細胞因子,具有抗炎和免疫調節作用的藥物,已發現在糖尿病患者中IL-10能夠增加促炎細胞因子表達水平[11]。此外,本研究還發現IL-6高水平表達患者的糖化血紅蛋白顯著升高,提示糖尿病和代謝紊亂的嚴重程度可能參與IL-6等細胞因子的活化過程。
綜上所述,血清IL-6和IL-10表達水平與糖尿病周圍神經病變患者神經纖維損傷程度有相關性,細胞因子IL-6和IL-10可能在糖尿病周圍神經病變發生過程中發揮作用。
[1]李劍波,成玉澤,石敏,等.血衆同型半腕氣酸與2型糖尿病外周神經病變的相關性[J].中華內科雜志,2011,50(1):14-17.
[2]甄燕,高素紅,武春林,等.度洛西汀聯合甲鈷胺治療痛性糖尿病周圍神經病變的療效及對患者血清BDNF、IL-6 水平的影響[J].臨床合理用藥,2015,8(4A):36-37.
[3]Isabel C,Costa J,Castro J,et al.Neurophysiological techniques to detect early small-fiber dysfunction in transthyretin amyloid polyneuropathy[J].Muscle Nerve,2014, 49(2):181-186.
[4]王素紅,張哲成,劉娜,等.高同型半耽氨酸血癥對2型糖尿病交感神經功能狀態的影響[J].天津醫藥雜志,2012,40(6):547-549.
[5]Tesfaye S,Boulton AJM,Dickenson AH.Mechanisms and ma-nagement of diabetic painful distal symmetrical polyneuropathy[J].Diabetes Care,2013,36(9):2 456-2 465.
[6]劉明生,胡稽蕾,崔麗英,等.糖尿病周圍神經病700例臨床與神經電生理分析[J].中華內科雜志,2005,44(3):173-176.
[7]Massie R,Mauermann ML,Staff NP,et al.Diabetic cervical radiculoplexus neuropathy:a distinct syndrome expanding the spectrum of diabetic radiculoplexus neuropathies[J].Brain,2012,135(10):3 074-3 088.
[8]阮園,謝曉競,馬建華,等.2型糖尿病神經病變患者血清IL-6、8-iso-PGF2α檢測及意義[J].現代生物醫學進展,2012,12(16):3 138-3 140.
[9]Vincent AM,Callaghan BC,Smith AL,et al.Diabetic neuropathy:cellular mechanisms as therapeutic targets[J].Nat Rev Neurol,2011,7(10):573-583.
[10]禹亞麗,程遠,田艷娟9 度洛西汀對痛性糖尿病神經病變患者血清腦源性神經營養因子和胰島素樣生長因子-1的影響[J].中國老年學雜志,2012,32(14):3 090-3 191.
[11]Zychowska M,Rojewska E,Kreiner G,et al.Minocycline influences the anti-inflammatory interleukins and enhances the effectiveness of morphine under mice diabetic neuropathy[J].J Neuroimmunol,2013,262(12):35-45.
(收稿2015-07-19)
R587.2
A
1673-5110(2016)18-0029-03

