2,3-丁二醇調控四甲基吡嗪及乙偶姻合成菌產物產量的研究
孟武,王瑞明,肖冬光
1(天津科技大學 生物工程學院,天津,300457) 2(齊魯工業大學 輕工學部,山東 濟南,250353)
?
2,3-丁二醇調控四甲基吡嗪及乙偶姻合成菌產物產量的研究
孟武1,2,王瑞明2,肖冬光1*
1(天津科技大學 生物工程學院,天津,300457) 2(齊魯工業大學 輕工學部,山東 濟南,250353)
發酵初期在枯草芽孢桿菌發酵培養基中添加2,3-丁二醇(2,3-BD)可以調控發酵產物乙偶姻,四甲基吡嗪(tetramethylpyrazine,TTMP)的產量。隨著2,3-BD添加量的增加,所產乙偶姻和TTMP的量隨之增加,當2,3-BD的添加量≥4.0 g/L時,乙偶姻和TTMP的產量不再增加。同時,枯草芽孢桿菌的生物量、糖轉化率也隨之變化。該調控方法對枯草芽孢桿菌的分子改造菌株(ΔbdhA)調控產乙偶姻和TTMP的產量影響不大。
四甲基吡嗪(tetramethylpyrazine,TTMP);乙偶姻;產量;枯草芽孢桿菌;調控
吡嗪類化合物是一類含有1,4-二氮雜苯母環的化合物總稱,具有似牛肉加熱時的香味、果仁及可可香味,稀釋至300 mg/kg時呈巧克力香味,在茅臺酒及芝麻香型白酒中大量存在,是白酒香氣的主要組分[1]。此外,四甲基吡嗪(TTMP)是一種對人體有益的物質,可以降血壓,并在醫藥合成中被廣泛應用[2-3]。乙偶姻通常情況下可添加于食品中,增加食品的香氣,是一種天然的食品添加劑[4],在醫藥行業,乙偶姻由于具有不同的構型可以用來合成稀有藥物及作為藥物中間體,另外,它在煙草[5]、塑料、化學及涂料工業上都有廣泛的應用[6]。
目前,在白酒行業中尚未對吡嗪類化合物的研究引起足夠重視,并且吡嗪類化合物的代謝途徑及調控機理尚不明確。白酒業的科研人員最初認為,吡嗪是由美拉德反應生成的[7],后來發現蛋白質加熱分解途徑、氨基酸類加熱分解途徑、微生物代謝產物途徑也能產生吡嗪類化合物。江南大學首次證實了中國白酒中TTMP并非美拉德途徑所產生,確定了白酒中TTMP的產生機制[8],并在“中國白酒169 計劃”中對相關研究結果進行了闡述,包括產生TTMP的微生物(枯草芽孢桿菌)、產生途徑及代謝調控,其TTMP的生產能力達到了國際領先水平,并將相關技術應用到了釀酒企業,明顯提高了TTMP的含量。
釀酒中產生吡嗪類化合物多以細菌發酵為主,尤其以芽孢桿菌類菌株中的枯草芽孢桿菌和地衣芽孢桿菌為主[9-10]。由于釀酒中產生吡嗪類化合物的合成機理尚不清確,吡嗪的種類及其對酒的風味及功能貢獻尚不明確,目前關于微生物發酵法生產乙偶姻的研究報道較少,且產量較低。劉建軍等獲得1株產乙偶姻的枯草芽孢桿菌,以葡萄糖為碳源,得到16.3 g/L的乙偶姻[11]。因此,研究TTMP和乙偶姻的代謝途徑與調控機制來提高其產量具有較大的實用價值。
以目前的研究水平,很難通過底物添加來調控提高TTMP和乙偶姻的產量。已有報道,通過補料和內源策略[12-13]、篩選基因突變株[14]等方法的研究,觀察其對TTMP和乙偶姻發酵產量以及減少副產物濃度的影響。本實驗中,通過在發酵前期添加2,3-丁二醇(2,3-BD)進行發酵調控實驗,研究對枯草芽孢桿菌TTMP和乙偶姻發酵產量的影響,從而以最低成本來提高所產TTMP和乙偶姻的量。主要考察了發酵初期添加2,3-BD對枯草芽孢桿菌的TTMP和乙偶姻發酵產量的影響,同時,結合2,3-BD調控對該菌株的基因改造菌株(ΔbdhA)的目的產物影響實驗,研究分析2,3-BD調控提高目的產物的效果及基本機理。
1 材料與方法
1.1菌種
枯草芽孢桿菌(BacillussubtilisBS2),由齊魯工業大學輕工學部王瑞明教授提供。
TTMP高產基因工程菌枯草芽孢桿菌B.subtilisBSA (ΔbdhA),由天津科技大學對B.subtilisBS2分子改造獲得。
1.2培養基及發酵培養方法
培養基:Luria-Bertani (LB培養基);YPG培養基(參照文獻[15])。
種子培養方法:在無菌條件下,用接種環取一環活化好的斜面菌種接種到裝有50 mL LB培養基的250 mL三角瓶中,37 ℃、200 r/min搖床振蕩培養12 h。然后按接種量2%(體積分數)接到裝有50 mL含10 g/L葡萄糖的LB培養基的250 mL三角瓶中,37 ℃、200 r/min搖床振蕩培養12 h,調整菌體生長量OD600值為0.05,作為種子。
發酵培養方法:將種子液按4%體積分數的接種量接種到裝有200 mL含70 g/L葡萄糖的YPG培養基的500 mL三角瓶中,37 ℃,200 r/min振蕩培養8 d,期間每12 h補加5 mL質量濃度為1 mg/mL的葡萄糖溶液。
添加2,3-BD調控實驗,在發酵初期向培養基加入分別為:1.0,2.0,3.0,4.0和5.0 g/L梯度質量濃度的2,3-BD,定時取樣分析產物產量、生物量變化情況。
1.3分析方法
HPLC色譜柱,Bio-Rad HPX 87H用于對產物進行分離,測定殘余葡萄糖的濃度。頂空固相微萃取(HS-SPME)和氮磷檢測器(GC-6890 NPD),分離并測定乙偶姻和TTMP的濃度。色譜柱為HP-INNOWax: 30 m×250 μm×0.25 μm,氣相色譜分析測定
2,3-BD的濃度。細胞生長量的測定:用紫外分光光度計對細胞生長的OD600值進行監測。
2 結果與分析
2.1培養條件對枯草芽孢桿菌產乙偶姻的影響
2.1.1pH對枯草芽孢桿菌產乙偶姻的影響
B.subtilisBS2的細胞生長量、TTMP和乙偶姻的發酵產量受pH的影響。在pH分別為6.5,7.0,7.5,8.0,8.5的條件下進行發酵。當pH控制在7.5時,B.subtilisBS2的OD600值最高,為12.16,結果如圖1;乙偶姻的合成在144 h達最高產量11.28 g/L,而后下降。當pH低于或高于7.5時,B.subtilisBS2的OD600值都低于10.38,乙偶姻的產量也在pH為7.5時達到最高值,結果如表1。

圖1 不同pH發酵條件對B.subtilis BS2菌體細胞生長的影響Fig.1 Effect of different pH control on the cell growth of B.subtilis BS2(數據是3組實驗平均值及標準偏差)
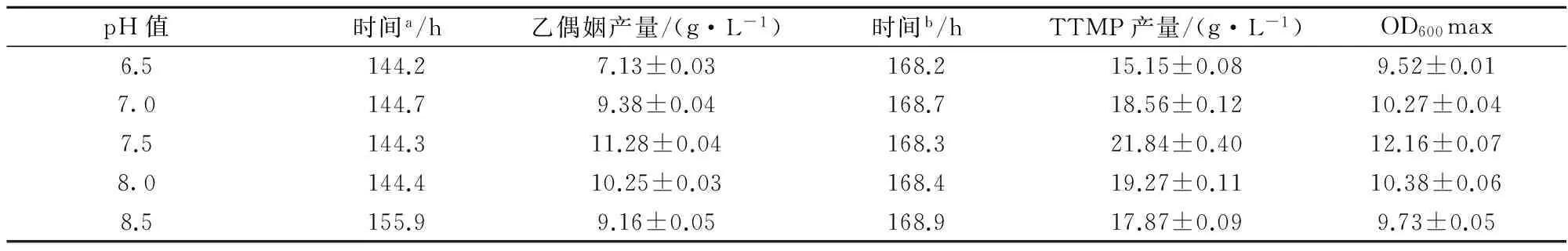
pH值時間a/h乙偶姻產量/(g·L-1)時間b/hTTMP產量/(g·L-1)OD600max6.5144.27.13±0.03168.215.15±0.089.52±0.017.0144.79.38±0.04168.718.56±0.1210.27±0.047.5144.311.28±0.04168.321.84±0.4012.16±0.078.0144.410.25±0.03168.419.27±0.1110.38±0.068.5155.99.16±0.05168.917.87±0.099.73±0.05
注:a從接種到乙偶姻產量達到最高時的發酵時間;b從接種到TTMP產量達到最高時的發酵時間。數據是3組實驗的平均值和標準偏差。
2.1.2添加2,3-BD對枯草芽孢桿菌產乙偶姻的影響
在發酵初期向培養基加入梯度質量濃度的2,3-BD:1.0,2.0,3.0,4.0和5.0 g/L,HPX 87H色譜柱檢測分析產物和碳源底物消耗變化量,HS-SPME聯合GC-6890 NPD分別檢測產物乙偶姻和TTMP含量變化量,如表2。隨著2,3-BD添加量由1.0 g/L增加到3.0 g/L,B.subtilisBS2產乙偶姻的最高產量由11.28 g/L提高到15.4 g/L。乙偶姻的合成受添加2,3-BD的影響,當培養基中2,3-BD的添加量提高到3.0 g/L以上時,發酵產物乙偶姻的產量不再增加并且隨著2,3-BD添加量的增加有所減少。同時,隨著添加2,3-BD量的增加,細胞生長略受影響。2,3-BD的添加,可以提高乙偶姻的產量和菌體細胞生長量,在添加量為3.0 g/L時OD600達到最大值為17.72,葡萄糖利用率隨著2,3-BD的添加也略有提高,見表2,圖2。綜合考慮發酵時間以及2,3-BD添加量、產物量,可見,2,3-BD調控B.subtilisBS2發酵產物,最佳添加量為3.0 g/L,可以得到15.4 g/L的乙偶姻最大產量。添加2,3-BD調控乙偶姻的產量,針對草芽孢桿菌的發酵生產是有效可行的。

圖2 添加2,3-BD調控(實心)對B.subtilis 的影響Fig.2 Effect of addition of 2,3-BD on the cell growth, 2,3-BD production and glucose specific uptake rate(residual glucose)by B.subtilis BS2. Product proles of BS2 (Open) and BS2 with addition of 3 g/L 2,3-BD (lled symbols) are shown (數據是三組實驗平均值及標準偏差)
2.2添加2,3-丁二醇對枯草芽孢桿菌產TTMP的影響
TTMP發酵產量同樣受pH的影響。當pH控制在7.5時,TTMP的合成在168 h左右達最高產量21.84 g/L,當pH低于或高于7.5時,TTMP的產量都低于此值,結果如表1。分析產物表明,添加2,3-BD對提高B.subtilisBS2產TTMP有較明顯的效果,并且2,3-BD添加量對TTMP和乙偶姻的產量影響有一致性,如表2。隨著2,3-BD添加量由1.0 g/L增加到3.0 g/L,B.subtilisBS2產TTMP的最高產量由21.84 g/L提高到29.65 g/L,當2,3-BD的添加量大于3 g/L時,發酵產物TTMP的產量不再增加并且隨著2,3-BD添加量的增加有所減少。總體上,添加2,3-BD調控TTMP和乙偶姻的產量影響有一致性,針對草芽孢桿菌的發酵生產是有效可行的。

表2 2,3-BD調控對B.subtilis BS2產物乙偶姻和TTMP的影響
注:a從接種到乙偶姻產量達到最高時的發酵時間;b從接種到TTMP產量達到最高時的發酵時間。數據是3組實驗的平均值和標準偏差。
2.3測定結果與分析
基因工程菌株枯草芽孢桿菌B.subtilisBSA (ΔbdhA),此菌體以葡萄糖為碳源合成乙偶姻和TTMP的主要發酵產物,與以上2,3-BD調控同理,以2,3-BD調控提高TTMP和乙偶姻的發酵產量。檢測B.subtilisBSA (ΔbdhA)的發酵產物乙偶姻,TTMP產量、菌體生長量,結果如表3。添加2,3-BD對提高該菌的乙偶姻和TTMP的產量沒有明顯效果,隨著2,3-BD添加量的增加,乙偶姻和TTMP的產量值有所浮動,但變化較小,同時對菌體細胞生長量略有提高的作用。
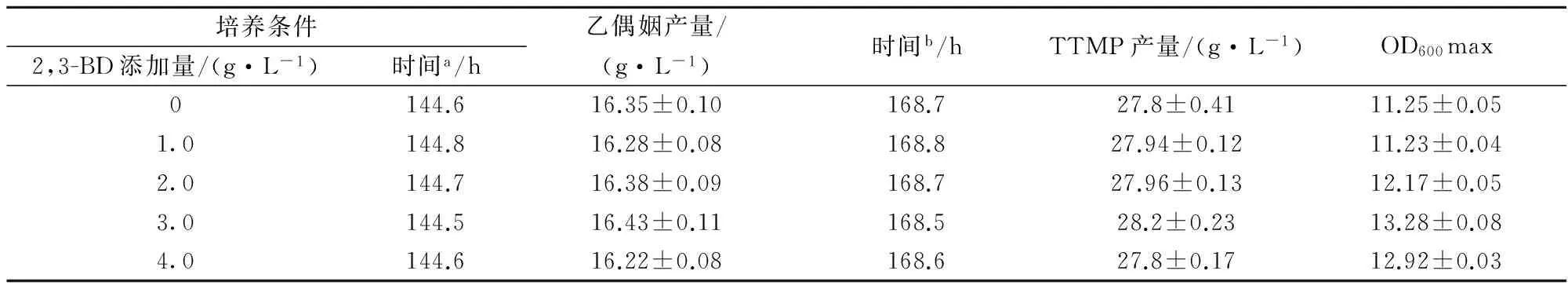
表3 2,3-BD調控對B.subtilis BSA (ΔbdhA)產物乙偶姻和TTMP的影響
注:a從接種到乙偶姻產量達到最高時的發酵時間;b從接種到TTMP產量達到最高時的發酵時間。數據是3組實驗的平均值和標準偏差。
3 討論
對比不同培養基的pH值對B.subtilisBS2產乙偶姻及TTMP量的影響,B.subtilisBS2的最適pH值是7.5左右。因為培養基的pH值主要影響菌體細胞膜表面帶電基團的解離及其微觀結構,引起細胞膜兩側質子動力的變化,進而影響營養物質的吸收及代謝物的分泌,從而導致乙偶姻及TTMP的產量都相對較高,菌體的細胞生長量也較高。
發酵初期添加2,3-BD調控B.subtilisBS2產乙偶姻及TTMP量實驗得出,該調控方法對該菌效果明顯。2,3-BD調控能提高B.subtilisBS2的乙偶姻和TTMP產量,以及菌體細胞生長量,其最佳添加量為3.0 g/L,但是對調控B.subtilisBSA (ΔbdhA)的乙偶姻及TTMP產量沒有明顯效果。發酵初期添加2,3-BD有利于這兩種菌的菌體生長,當添加量大于3.0 g/L時,乙偶姻及TTMP產量都有所降低。但總體評價,2,3-BD調控方法提高枯草芽孢桿菌發酵產乙偶姻及TTMP量是具有成本效益的。
實驗結果表明,發酵初期添加少量2,3-BD可以提高TTMP和乙偶姻的發酵產量,但具體機理尚不明晰。推測由于乙偶姻和2,3-BD的轉化之間是可逆的,兩者通過2,3-丁二醇脫氫酶又名3-羥基丁酮還原酶(由bdhA基因轉錄生成)催化合成,乙偶姻又作為前體合成TTMP,如圖3所示。

圖3 葡萄糖在枯草芽孢桿菌中生成乙偶姻和TTMP的代謝途徑Fig.3 The acetoin and TTMP biosynthetic pathways from glucose in B. subtilis BSA (ΔbdhA)
發酵初期加入2,3-BD,首先能夠起到反饋抑制的作用,同時2,3-丁二醇脫氫酶是可逆的,能夠促進乙偶姻的生成和積累,進而提高TTMP的產量。另外,有文獻報道,在培養基中缺乏碳源的條件下,2,3-BD能夠繼續充當碳源生成乙偶姻[16],利于乙偶姻的合成和積累,從而促進TTMP的合成。從誘導調控效果看,此方法對提高基因工程菌株枯草芽孢桿菌B.subtilisBSA (ΔbdhA)的乙偶姻及TTMP產量沒有明顯效果,分析可能是由于該菌為敲除基因bdhA的分子改造菌,如圖3所示,從而消除了乙偶姻跟2,3-BD的可逆合成,不能促進乙偶姻的生成和積累,進而也不能提高TTMP的產量,為2,3-BD調控的機理研究提供了一定依據。發酵初期添加2,3-BD調控提高枯草芽孢桿菌產乙偶姻和TTMP產量的具體機理還需要酶的結構功能以及代謝途徑做進一步研究。
[1]康文懷,徐巖.中國白酒中風味分析及其影響機制的研究[J].北京工商大學學報,2012,30(3):53-58.
[2]吳建峰.中國白酒中健康功能性成分四甲基吡嗪的研究[J].釀酒科技,2007,23(1):117-120.
[3]楊濤,李國友,吳林蔚,等.中國白酒健康因子的研究及其生產菌選育和在生產中的應用(I)[J].釀酒科技,2010,36(12):65-69.
[4]胡明一,王中.食用香料乙偶姻[J].精細與專用化學品,2002,18(1):20-21.
[5]常愛霞,賈興華,郝廷亮,等.特香型烤煙揮發性致香物質的測定與分析[J].中國煙草科學,2002,25(1):1-5.
[6]朱卓越,黃淑芳,楊華武,等.溴酸鈉氧化制乙偶姻[J].香料香精化妝品,2009,18(4):11-13.
[7]崔利.醬香型白酒中吡嗪類化合物的生成途徑及環節[J].釀酒,2007,39(5):39-40.
[8]徐巖,吳群,范文來,等.中國白酒中四甲基吡嗪的微生物產生途徑的發現與證實[J].釀酒科技,2011,23(7):37-40.
[9]黃永光,楊國華,張肖克,等.產醬香風味芽孢桿菌類菌株發酵代謝產物及其酶分析研究[J].釀酒科技,2013,31(1):41-45.
[10]張榮.產醬香功能細菌的篩選及其特征風味化合物的研究[D].無錫:江南大學,2009:5-8.
[11]田延軍,劉建軍,趙祥穎.一株枯草芽孢桿菌在制備3-羥基丁酮中的應用[P].2007.
[12]ZHU Bing-feng,XU Yan.A feeding strategy for tetramethylpyrazine production byBacillussubtilisbased on the stimulating effect of ammonium phosphate[J]. Bioprocess Biosyst Eng,2010,33(7):953-959.
[13]ZHU Bing-feng,XU Yan,et al.High-yield fermentative preparation of tetramethylpyrazine byBacillussp. using an endogenous precursor approach[J].J Ind Microbiol Biotechnol,2010,37(12):179-186.
[14]XIAO Zi-jun,XIE Neng-zi,et al.Tetramethylpyrazine production from glucose by a newly isolatedBacillusmutant[J].Appl Microbiol Biotechnol,2006,73(37):512-518.
[15]丁雪梅,趙樹欣.常壓室溫等離子體誘變選育高產TTMP菌株[J].釀酒科技,2015, http://www.cnki.net/kcms/detail/52.1051.TS.20150513.1535.012.html.
[16]ZHANG Xian,YANG Tao-wei,LIN Qing,et al.Isolation and identication of an acetoin high production bacterium that can reverse transform 2,3-butanediol to acetoin at the decline phase of fermentation[J]. World J Microbiol Biotechnol,2011,27(12):2 785-2 790.
Effects of cultivation conditions on the yields of acetoin and TTMP
MENG Wu1,2, WANG Rui-ming2, XIAO Dong-guang1*
1(Key Laboratory of Industrial Fermentation Microbiology, Ministry of Education,Tianjin University of Science and Technology, TEDA, Tianjin 300457, China)2(Key Laboratory of Shandong Microbial Engineering, Qilu University of Technology, Jinan 250353, China)
The effect of cultivation conditions on the yields of TTMP and acetoin compounds produced byBacillussubtiliswere investigated. The yields of TTMP and acetoin were influenced by the supplementation of 2,3-BD to fermentation medium. The yields of TTMP and acetoin were increased with the increasing addition of 2,3-BD until the concentration of supplemented 2,3-BD in matrix reached 4.0 g/L. Meanwhile, the biomass and glucose conversion rate were also changed with the addition of 2,3-BD. Using this method, the supplementation of 2,3-BD showed a little influence on TTMP and acetoin production by abdhAknockout strain ofB.subtilis.
tetramethylpyrazine(TTMP); acetoin; yield;B.subtilis;B.subtilis(ΔbdhA); regulation
10.13995/j.cnki.11-1802/ts.201601004
碩士研究生(肖冬光教授為通訊作者,E-mail:xiaoqq@tuet.edu.cn)。
本項目受國家高技術研究發展計劃(863計劃)(2012AA022108);山東省科技發展計劃(2014GSF121008)
2015-07-24,改回日期:2015-09-14

