一種改進的Aβ1-42寡聚體的制備與鑒定方法*
禹文峰, 孔 欣, 官志忠,**
(1.貴州醫科大學 分子生物學重點實驗室, 貴州 貴陽 550004; 2.貴州醫科大學 病理學教研室, 貴州 貴陽 550004)
?
一種改進的Aβ1-42寡聚體的制備與鑒定方法*
禹文峰1, 孔欣2, 官志忠1,2**
(1.貴州醫科大學 分子生物學重點實驗室, 貴州 貴陽550004; 2.貴州醫科大學 病理學教研室, 貴州 貴陽550004)
目的: 改進Aβ1-42寡聚體的制備與鑒定方式。方法: 以化學合成多肽Aβ1-42為原料在體外制備Aβ1-42寡聚體,用Western blotting進行鑒定;加入不同濃度Aβ1-42寡聚體后,用CCK-8法測定體外原代培養大鼠大腦皮質星形膠質細胞(AS)的存活率。結果: 化學合成的 Aβ1-42寡聚體分子量為4~188 kD,以64 kD最多,亦有少量4 kD單體存在;CCK-8法顯示Aβ1-42寡聚體對AS有明顯的神經毒性作用,并呈現劑量-效應關系。結論: 成功建立了一種改進的制備和鑒定Aβ1-42寡聚體的方法,為深入研究阿爾茨海默病提供了研究手段。
淀粉樣蛋白; 阿爾茨海默病; 寡聚體; 星形膠質細胞; 免疫印跡法
[Abstract]Objective: To improve method for preparation and identification of Aβ1-42oligomer. Methods: Aβ1-42oligomer was prepared by using chemical synthetic Aβ1-42polypeptideinvitro. The prepared peptide was identified by the assay of Western blotting. In order to confirm the neurotoxicity of the peptide, primary cultured astrocytes from the cortex of rats were treated with different concentrations of Aβ1-42oligomer and the survival rates of the cells were detected via Cell Counting Kit-8(CCK-8) assay. Results: The results indicated that chemical synthetic Aβ1-42oligomer weighed from 4 to 188 kd, in which the points with 64 kd were the most. In addition, a few points with 4 kd, a monomer, was also found. Furthermore, the neurotoxicity of Aβ1-42oligomer on astroytes was significantly detected with a manner of dose-dependence. Conclusions: An improved method for preparation and identification of Aβ1-42oligomer has been successfully established, which is important in the research work of Alzheimer's disease.
[Key words]amyloid; Alzheimer disease; oligomer; astrocytes; immunoblotting
阿爾茨海默氏病(Alzheimer disease, AD)是一種常見的神經退行性疾病,AD患者表現出進行性記憶能力降低、行為和認知功能障礙。AD的主要病理改變有腦組織老年斑及神經纖維纏結形成,老年斑的主要成分是β-淀粉樣蛋白(amyloid β-protein,Aβ)[1-2]。在AD的發病過程中,Aβ分子經歷了從可溶態到不溶纖維狀的轉變。神經細胞內的Aβ生成后分泌到細胞外,累積到一定程度后就會自發聚合構成寡聚體、原纖維體及中間體,最后會形成成熟、老化的纖維狀Aβ。目前認為,可溶性Aβ寡聚體是產生神經毒性作用的重要來源,比纖維狀Aβ的毒性更強,在AD的發病機理中起著重要作用[3-6]。Aβ寡聚體的穩定性較差,易被轉化為纖維體,引起毒性減弱,影響實驗效果,目前國內對Aβ寡聚體的制備和鑒定方法較少。為此,本研究在原有Aβ寡聚體制備的基礎上,對制備和鑒定方法的改進,并檢測其神經細胞毒性作用,為AD的研究提供可靠的方法。
1 材料與方法
1.1材料
新生24~48 h 的SD(Sprague-Dawley)大鼠由貴州醫科大學動物實驗中心提供。DMEM培養基、胎牛血清、F12無酚紅培養基購自Gibco公司(美國),0.25%胰蛋白酶、青—鏈霉素購自Hyclone公司(美國),GFAP兔抗牛多克隆抗體購自Dako公司(丹麥),Cyb3標記的羊抗兔IgG購自碧云天公司,Aβ1-42肽、六氟異丙醇、DMSO購自Sigma公司(美國),鼠抗Aβ多克隆抗體6E10購自Covance公司(美國),辣根過氧化物酶(HRP)標記的抗鼠二抗購自Santa Cruz公司(美國),預制膠、電泳槽、預染標準品、電泳液等購自life technologies公司(美國),聚乙烯二氟(PVDF)膜、ECL-Plus發光試劑購自Millipore公司(美國),高效顯影膠片購自柯達公司(美國),腫囊收縮素-8(CCK-8)試劑盒購自日本同仁公司。電泳儀(上海六一儀器廠)、CO2培養箱(日本SANYO公司)、高速離心機(德國eppendorf公司)、真空濃縮離心機(中國Heto)、超凈工作臺(中國SPEG AIR TECH)、-80 ℃冰箱(美國Thermo公司)、恒溫震蕩搖床、手術器械(眼科剪刀、鑷子等)經高壓消毒。
1.2方法
1.2.1星形膠質細胞(astrocyte,AS)培養及鑒定參照Mc Carthy等[7-9]方法并改進,取24~48 h內大鼠乳鼠的大腦皮質,消化漂洗后,棄廢液,加入含10%FBS的DMEM,吹打制成細胞懸液,接種至25 cm2培養瓶,放入37 ℃、5%CO2培養箱,24 h后換液1次;隨后3~4 d用含10% FBS的DMEM換液,至細胞長滿。培養7~9 d,純化并傳3~4代。傳代后,以細胞免疫熒光的方法對AS 特征性標記物膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)進行染色鑒定[10]。
1.2.2體外制備Aβ1-42參照文獻[11-14]在體外制備Aβ1-42寡聚體的方法,將HFIP置于冰上,在Aβ1-42粉末中加入充足的冷卻的HFIP(HFIP是一種高腐蝕性、揮發性的試劑,操作時注意安全),使終濃度為1 mmol/L。充分用液體吹打瓶壁,使Aβ1-42粉末徹底溶解。室溫孵育60 min,保持封閉。溶液必須是無色、清亮的。若是出現黃色、渾濁液體或是懸浮的肽,證明質量不好,不要使用。接著將其放在冰上靜置5~10 min后轉移并等量分裝至各個離心管中,蓋子打開,在通風櫥內室溫下過夜,使HFIP揮發完全。第2天觀察揮發情況,使用真空濃縮離心機使HFIP完全蒸發,最終只可有清晰透明的薄膜留在離心管底部,不應為白色或是厚實的塊狀物。將干燥的肽膜存于-80 ℃冰箱保存,使用時將其放在冰上,用DMSO充分溶解,終濃度為5 mmol/L。接著用不含酚紅的F12培養基來稀釋,為得到最好的效果,最好不要超過100 μmol/L的濃度。4 ℃孵育24 h后,14 000 g冰凍高速離心機離心10 min,上清液即為寡聚體。
1.2.3Aβ1-42寡聚體的鑒定采用Western-blotting法。在不含血清的培養基內加入100、200、300、400及500 nmol/L的Aβ1-42寡聚體,37 ℃培養箱內孵育24 h后取出上清液。將樣品變性后,加入至4%~12%的預制膠的孔中跑電泳。接著將膠上的條帶轉至PVDF膜上。轉膜成功后,將膜封閉2 h。用稀釋后的6E10-抗4 ℃孵育過夜后,再加入二抗在搖床上搖1 h。每進行下一步時,都要用含0.01%的吐溫-20的TBST清洗干凈。最后用ECL發光試劑觀察表達情況。
1.2.4CCK-8細胞存活率測定每孔8 000~10 000個星形膠質細胞接種在96孔板上,長滿后加入不含血清的DMEM高糖培養基培養,24 h后加入0.01、0.1、1.2及5 μmol/L Aβ1-42寡聚體,共同作用24 h后棄上清液,每孔加入培養基200 μL 及 CCK-8試劑20 μL避光共同孵育,待1 h后通過酶標儀測定450 nm處 OD值。重復3次。
1.3統計學方法
應用SPSS 21.0統計軟件進行分析,計量資料的比較采用one-way ANOVA方法檢驗。
2 結果
2.1AS中GFAP免疫熒光鑒定
星形膠質細胞以GFAP免疫熒光的方式染色,以Cy3標記陽性細胞呈紅色,在倒置顯微鏡下觀察,細胞計數AS占所有細胞的95%以上,見圖1。
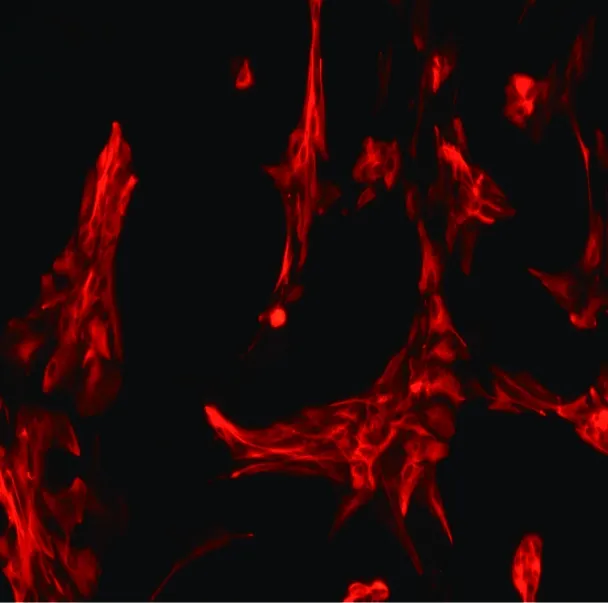
圖1 原代培養AS中的GFAP免疫熒光顯色(400×)Fig.1 GFA immunofluorescence of primary cultured astrocytes
2.2Aβ1-42寡聚體鑒定
經Western blotting鑒定,500 nmol/L濃度的Aβ寡聚體在4 kD和64 kD處比較明顯,其余濃度不明顯,見圖2。
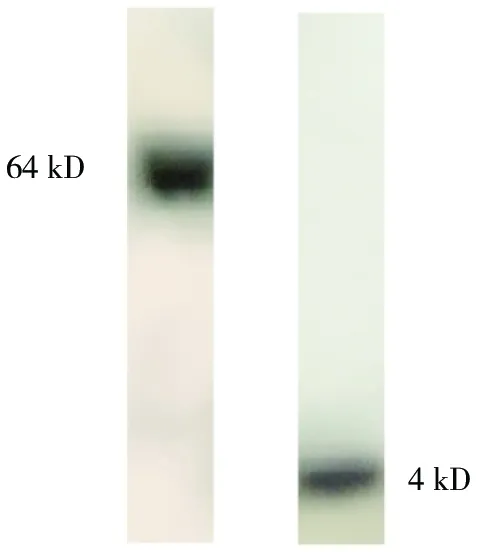
圖2 Aβ1-42寡聚體的鑒定結果(Western blotting)Fig.2 Identification of Aβ1-42 oligomer with Western blotting
2.3Aβ1-42對AS細胞存活率的影響
不同濃度的Aβ1-42對AS均有損傷作用,實驗結果呈現劑量-效應關系;自0.1 μmol/L濃度起,寡聚體的毒性作用更顯著,差異有統計學意義(P<0.05)。見圖3。
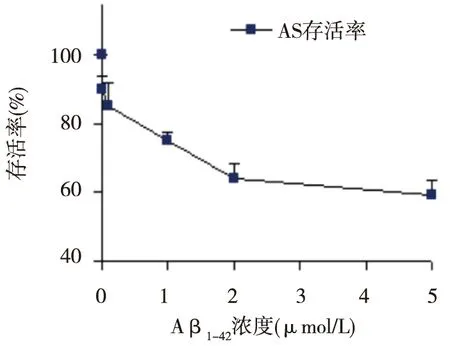
圖3 Aβ1-42對AS存活率的影響Fig.3 effect of Aβ1-42 on cell survival of primary cultured astrocytes
3 討論
Aβ級聯假說是AD發病機制中重要的學說,是引起AD神經退行變和癡呆的主要致病因素[15]。Aβ是淀粉樣蛋白前體蛋白(amyloid precursor protein,APP)經過蛋白酶水解后生成的氨基酸片段,Aβ分泌過多和異常積聚都會導致神經細胞的損傷[16]。Aβ的聚集和沉積會破壞神經細胞突觸結構和功能,誘導神經細胞凋亡,是造成記憶和認知功能障礙的重要因素[17-19]。
本實驗所采用的方法可以快速、成功的在體外制備Aβ1-42寡聚體,用Western blotting方法準確地鑒定其表達。實驗過程應注意的問題有:(1)在Aβ寡聚體的粉末中加入HFIP后,一定要蒸發完全,如果在通風櫥過夜后未干,可使用真空干燥器;(2)在寡聚體制作完成后,應盡快使用,因為其易變形,毒性易降低,如果長時間不用,在使用前應做不同濃度的Aβ寡聚體的鑒定,觀察其分子量表達情況;(3)在用Western blotting鑒定時,由于Aβ寡聚體的表達可有多種形式,可以是單體、二聚體、或者是三聚體等不同的多聚體形式。因此,分離膠的濃度應選擇4%~12%的梯度膠,這樣可以使各種不同分子量的多肽獲得清楚的分離效果,當其轉移至PVDF膜后,可以準確觀測到分子量的變化。
相較于以往對Aβ寡聚體的制備與鑒定的研究,本實驗在此基礎上加以改良,更為經濟、快捷、易于操作。在Aβ寡聚體的鑒定方面,普遍采用的方法是原子力顯微鏡(atomic force microscope , AFM)鑒定、酶聯免疫吸附法(enzyme-linked immunosorbent assay, ELISA)及免疫熒光檢測等。AFM是研究生物醫學樣品的重要工具之一,但并不是實驗室常規設備,使用不便。而ELISA法和免疫熒光的方法,操作耗時、花費較高。本研究采用的Western blotting 法是在無血清的培養基內加入不同濃度的Aβ寡聚體,37 ℃培養箱內孵育24 h后取出上清液進行鑒定,更為簡便、快速、經濟。
AS是神經系統表達最豐富的膠質細胞類型,在多種神經疾病的發生和發展過程中充當“雙刃劍”的重要角色。在AD早期,AS可在局部吞噬病變的神經細胞,維護細胞微環境。但隨著疾病的發展,AS釋放各類有害因子,參與氧自由基形成及興奮性毒性作用,加重神經細胞損傷。此外,Aβ的聚集和沉積能激活星形膠質細胞,使其釋放炎性因子,導致腦組織出現炎癥反應[20-21]。本實驗中發現,不同濃度的Aβ寡聚體對AS有一定的損害作用,細胞存活率降低。當然,也可以使用神經細胞或其他膠質細胞來進行Aβ寡聚體的神經毒性作用鑒定。
總之,本實驗提供了一種比較簡單、直觀、經濟的體外提取Aβ寡聚體的改進方法及鑒定方式,為AD的研究提供了實用的研究手段。
[1]官志忠.阿爾茨海默病的病理學及生物膜結構與受體改變機制[J].中華病理學雜志, 2003(1):69-71.
[2]Kumar A, Singh A, Ekavali. A review on Alzheimer’s disease pathophysiology and its management: an update[J]. Pharmacological Reports, 2015(67): 195-203.
[3]劉文娟,戴雪伶,姜招峰.β-淀粉樣蛋白神經毒性及其防治策略[J].生命科學, 2011(10):1023-1026.
[4]Anand R, Gill KD, Mahdi AA. Therapeutics of Alzheimer’s disease: past, present and future[J]. Neuropharmacology, 2014(76):27-50.
[5]Hardy J. The amyloid hypothesis for Alzheimer’s disease: a critical reappraisal[J]. J Neurochem, 2009(4): 1129-1134.
[6]Dal Pra I, Chiarini A, Gui L, et al. Do strocytes collaborate with neurons in spreading the ‘infectious’ Aβ and tau rivers of Alzheimer’s disease[J]. Neuroscientist, 2015(1): 9-29.
[7]Mc Carthy KD,Vellis JD.Preparation of separate astroglial and oligdendroglial cell cultures from rat cerebral tissue[J]. Cell Biol, 1980(85): 890-902.
[8]Schildge S, Bohrer C, Beck K, et al. Isolation and Culture of Mouse Cortical Astrocytes[J]. J Vis Exp, 2013(71): 1-7.
[9]湯婷婷,官志忠,禹文峰.SD大鼠大腦皮層星形膠質細胞的體外原代培養[J].貴陽醫學院學報,2014(2):158-161.
[10]張敬軍.星形膠質細胞的研究[J].中國藥理學通報, 2006(7): 788-791.
[11]Klein WL. Aβ toxicity in Alzheimer’s disease: globular oligomers (ADDLs) as new vaccine an drug targets[J]. Neurochemistry International, 2002(41):345-352.
[12]官志忠,齊曉嵐,歐陽凱,等.阿爾茨海默病發病中β淀粉樣蛋白與膽堿能尼古丁受體的相互作用[C].第十三屆全國診斷病理暨頭頸部及內分泌系統疾病學術研討會論文集, 2012:92-97.
[13]楊帆,李東風,徐書雯.Aβ1-42寡聚體與纖維體的制備及鑒定[J].中華老年學雜志, 2013(33):2076-2078.
[14]譚現偉.Aβ1-42寡聚體制備方法的研究[D].北京:北京交通大學, 2009:1-37.
[15]Galimberti D, Ghezzi L, Scarpini E. Immunotherapy against amyloid pathology in Alzheimer’s disease[J]. J Neurol Sci, 2013(1):50-54.
[16]Selkoe DJ. Alzheimer’s disease is a synaptic failure[J]. Science, 2002(298):789-791.
[17]Haass C, Selkoe DJ. Soluble protein oligomer in neurodegeneration: lessons from the Alzheimer's amyloid beta-peptide[J]. Nat Rev Mol Cell Boi, 2007(2):101-112.
[18]Shankar GM, Li S, Mehta TH, et al. Amyloid-beta protein dimers isolated directly from Alzheimer's brains impair synaptic plasticity and memory[J]. Nat Med, 2008(8):837-842.
[19]Butterfield DA. Amyloid β-peptide (1-42)-induced oxidative stress and neurotoxicity: implications for neurodegeneration in Alzheimer's disease brain[J]. Free Radical Research, 2002(12):1307-1313.
[20]Heneka MT, O'Banion MK. Inflammatory processes in Alzheimer's Disease[J]. J Neuroimmunol, 2007(1-2):69-91.
[21]王琦,周海霞.阿爾茨海默病中β淀粉樣蛋白對星形膠質細胞的作用[J].中國老年學雜志, 2011(18):3643-3645.
(2016-06-13收稿,2016-07-30修回)
中文編輯: 周凌; 英文編輯: 趙毅
An Improved Method for Preparation and Identification of Aβ1-42Oligomer
YU Wenfeng1, KONG Xin2, GUAN Zhizhong1,2
(1.theKeyLabofMedicalMolecularBiology,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China;2.DepartmentofPathology,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
國家自然科學基金(81360199); 國家自然科學基金(81260173); 教育部科學技術研究項目(213032A); 貴州省科技廳國際合作項目 [黔科合外G字 (2011)7014號]; 貴州省科技計劃 [黔科合重大專項字(2014)6008號]
Email:1457658298@qq.com
R34-33
A
1000-2707(2016)08-0878-04
10.19367/j.cnki.1000-2707.2016.08.003
**
網絡出版時間:2016-08-23網絡出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160823.1343.052.html

