第29屆中國化學奧林匹克(決賽)理論試題分析
陳胤霖 賀麒霖 黃禹鋮 柳晗宇 孫 桐唐 麒 楊中天 余子迪
(北京大學化學與分子工程學院,北京100871)
·競賽園地·
第29屆中國化學奧林匹克(決賽)理論試題分析
陳胤霖賀麒霖黃禹鋮柳晗宇*孫桐唐麒楊中天余子迪
(北京大學化學與分子工程學院,北京100871)
本文詳細介紹和評析了第29屆中國化學奧林匹克決賽理論試題,提供了解題思路、計算過程與討論,并提供了有關參考文章。
化學競賽;試題分析
www.dxhx.pku.edu.cn
2015年11月28日,第29屆中國化學奧林匹克(決賽)理論考試在安徽合肥順利舉行。試題全面考查了無機(描述)化學、結構化學、物理化學、分析化學與有機化學知識,體現了基礎概念與思維訓練的結合,側重理論推導能力與計算能力的考查。在出題背景與選材上,試題注重理論經典與科研前沿的結合,既保持了一貫的競賽傳統,也有很多新意。延續初賽試題分析的寫作風格,我們繼續為本次決賽理論試題編寫了詳細解析。
自發表以來,筆者[1]編寫的初賽試題分析受到了不少老師與同學的鼓勵與支持,當然也收到了許多批評與建議。我們聽取了這些意見,在繼承前稿風格的基礎上,更加側重于對試卷背景的拓展,將文獻解讀與試題分析穿插結合,揭示題目內外更加豐富的化學知識。由于筆者自身水平有限,文中難免存在一些不妥之處,歡迎老師和同學們繼續批評指正。
第1題
1-1 CH3SiCl3和金屬鈉在液氨中反應,得到組成為Si6C6N9H27的分子,此分子有一條三重旋轉軸,所有Si原子不可區分,畫出該分子的結構圖(必須標明原子種類,H原子可不標),并寫出化學反應方程式。
1-2金屬鈉和(C6H5)3CNH2在液氨中反應,生成物中有一種紅色鈉鹽,寫出化學反應方程式,解釋紅色產生的原因。
1-3最新研究發現,高壓下金屬Cs可以形成單中心的CsF5分子,試根據價層電子對互斥理論畫出CsF5的中心原子價電子對分布,并說明分子形狀。
分析與解答
1-1本題主要考查對氫的酸性、Na/NH3體系、親核取代反應和分子對稱性的掌握,要求學生對分子結構有較強的理解,能夠從結構判斷分子的反應性質,準確找到反應物的反應位點,正確判斷生成物的鍵連關系,并能通過對稱性分析推斷出分子的骨架結構。總體來說,這是一道綜合性很強的題目。
對于分子結構題,我們不能僅僅憑借分子式和題目所給出的對稱性來推測結構,而應該根據反應條件先推測出合成該分子的大致“機理”,明確每種試劑以及原料中每個基團的作用,從而推測出具體的鍵連關系,最后再根據分子式或者對稱性給出最終的分子結構。為了方便表達,將題目所求分子記為A。
首先,產物中C與Si原子的比例為1:1,這說明反應物CH3SiCl3的Si—C鍵比較穩定,在反應過程中沒有發生任何變化;甲基上的氫酸性很弱,不會在Na/NH3的環境下脫去,更不會以H-離子的形式離去,這說明分子式中27個H原子應有18個屬于甲基,同時分子中N原子只能連接1個H原子,因此反應只能發生在Si—Cl鍵,很明顯Cl原子在反應過程中可以作為離去基團。
在親核取代反應中,離去基團必然對應一種親核試劑。在Na/NH3體系中,一個合理的親核試劑便是由Na和NH3二者相互作用產生的NH2-。判斷出反應位點和大致機理后,再來看分子式:首先把分子式改寫為(CH3)6Si6N9H9,又考慮到剩下的9個H原子只可能連在N原子上,于是可以進一步寫成(CH3)6Si6(NH)9。再結合對稱性:A分子存在三重旋轉軸,而且所有Si原子化學環境相同,說明A分子具有比較高的對稱性。最先想到的是六元環結構,其中3個Si原子與3個N原子構成六元環的頂點,考慮上述結論,其結構可表示如下(記為B):
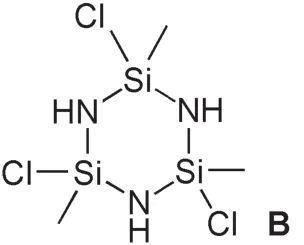
B中每個Si原子上還連有Cl原子,因此還可發生親核取代反應。注意到A分子中有6個Si原子,而上述B中只有3個Si原子,說明可能存在兩個B結構中的六元環,而兩個B通過化學鍵連接在一起成為A。再考查兩個B的化學式與A化學式的差別可以發現二者相差兩個NH基團,而NH基團正好可以形成兩個化學鍵,可以作為“橋”將兩個B分子連接在一起,于是可以得到A的分子結構如下:
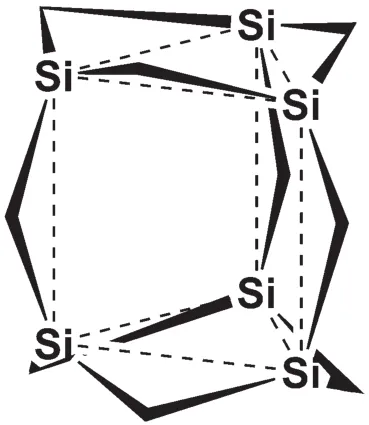
其中Si=Si—Me,楔形折點代表NH,虛線不表示鍵連關系。
反應方程式為:
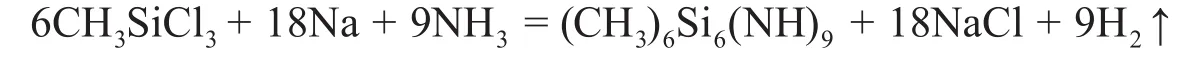
1-2本題主要考查對有機物顏色、顏色互補效應、Na/NH3體系的還原性,以及三苯甲基結構等的理解和掌握,要求學生掌握三苯甲基負離子穩定性的原因,正確判斷是Na/NH3體系的還原性而不是堿性在起作用,并且能夠從化合物的電子結構出發解釋顏色。
反應物中出現了Ph3CNH2,題目給定的Na/NH3體系是一個強極性、強堿性的環境,只有三苯甲基負離子能夠在這種條件下生成。而且題目還提到生成物中出現了紅色的鈉鹽,這種有機物的顏色一般是由于長程離域π鍵,導致分子軌道能級差減小,根據顏色互補效應,吸收藍綠光,從而顯現出紅色。在此條件下,只有此負離子與苯基共軛才能產生此效果,這進一步證實了的生成。
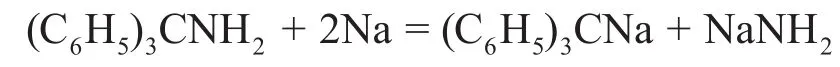
三苯甲基負離子中共有19個C原子參與共軛,其中18個苯環上的C原子提供18個電子,而中間的C原子提供2個電子,一共是20個離域電子。因此傳統地講離子形成離域鍵。
1-3本題主要考查原子結構和VSEPR模型,但考查突破常規,內涵比較豐富。題面背景是2013 年Nature Chemistry的一篇理論工作[2]。傳統化學原理一般認為原子中只有最外層電子參與成鍵和化學反應,內層電子不參與,因此堿金屬只有0和+1兩種氧化態。不過如果考慮到下面兩個因素,上述原理就不一定成立了:首先,堿金屬元素自上而下,隨著層數的增加,軌道能級差遞減。Cs位于堿金屬元素的底部,因此它的價層6s軌道與內層5p軌道之間能級差相差不大。其次,在高壓條件下,原子間距較小,使得次外層電子有可能參與成鍵。在這兩個情況下,Cs的氟化物有可能突破經典“價”的約束,出現更高的價態和氧化態。本題中,Cs的氧化態為+5。
在確定中心Cs原子的氧化態之后,下面需要確定中心原子的電子對數。CsF5與XeF5-為等電子結構,因此是AX5E2構型,其中有5個鍵對和2個孤電子對,Cs周圍一共有7對電子。根據VSEPR理論可以推測,Cs周圍的電子對分布為五角雙錐形,而兩對大位阻的孤電子對應分別處于“雙錐”的位置。因此,CsF5的分子形狀是正五邊形,如下圖所示:
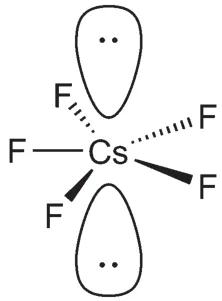
第2題
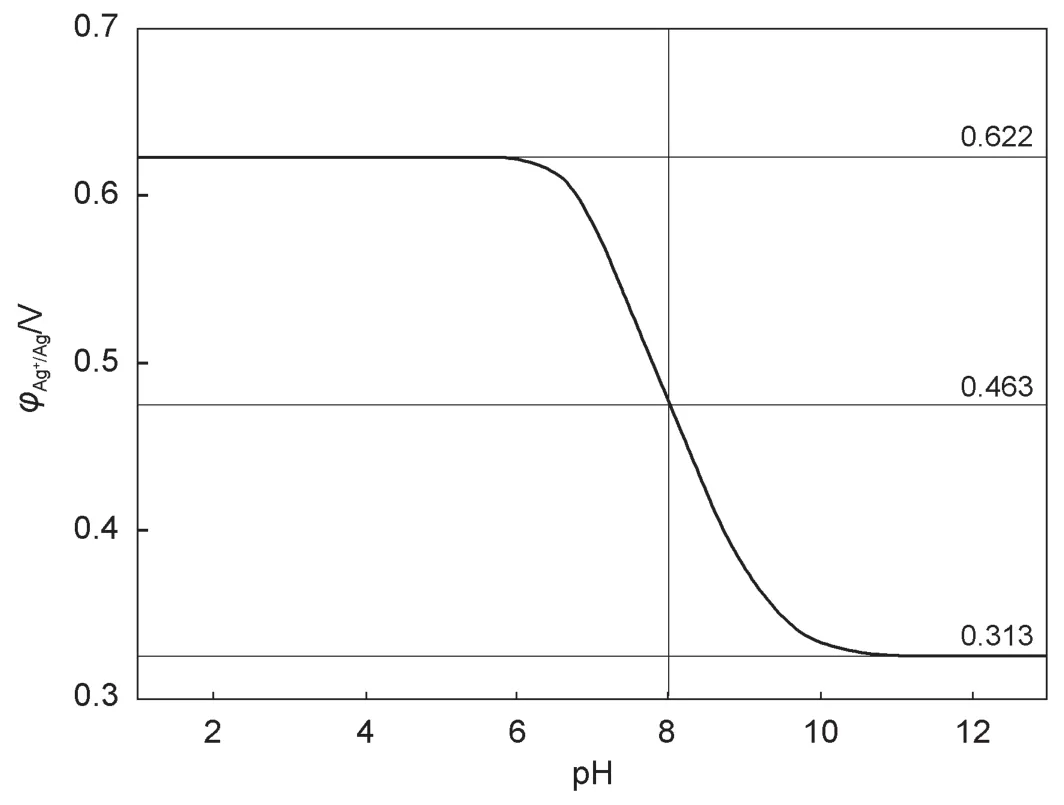
將銀電極插入298 K的1.000×10-1mol·L-1NH4NO3和1.000×10-3mol·L-1AgNO3混合溶液中,測得其電極電勢 φAg+/Ag隨溶液pH的變化如下圖所示。已知氨水的解離常數Kb為1.780×10-5,理想氣體常數R=8.314 J·mol-1·K-1,法拉第常數F=96500 C·mol-1。
2-3利用銀離子的配合反應設計一個原電池,其電池反應方程式為:
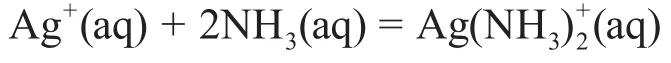
計算該原電池的標準電動勢。若未能算出銀氨配合物離子一、二級逐級標準穩定常數,可假設都是1.00×103。
分析與解答
本題涉及配位平衡、酸堿平衡,考查了能斯特方程的應用,以及在復雜體系中對物料守恒的使用,要求學生能夠理解 φ-pH圖,利用能斯特方程將圖中信息轉化為數學方程,正確使用分布系數簡化方程,并正確使用守恒方程求解未知量。
2-1本題考查對能斯特方程的直接運用。
由圖可知,在pH<6時pH對電極電勢沒有影響,φAg+/Ag保持在0.622 V不變。根據半反應的能斯特方程
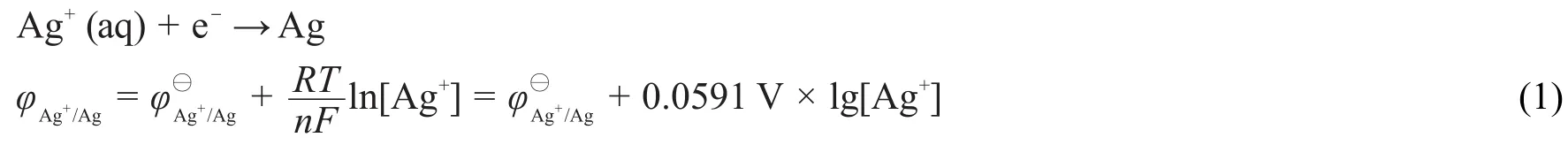
可知當pH<6時,[Ag+]保持不變,說明此時體系中的NH3濃度太低,配位平衡可以忽略。所以
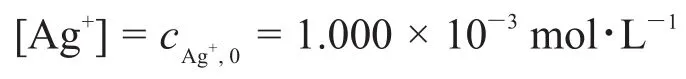
將 φAg+/Ag與[Ag+]代入能斯特方程可解出:
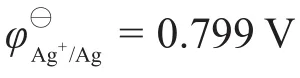
2-2本題需要考慮配位平衡,而且題目中要求計算逐級穩定常數,說明Ag(NH3)+與Ag(NH3)2+同時存在,而且由于穩定常數未知,二者濃度的相對大小就未知,因此不能輕易忽略其中任何一方的濃度。對于這樣的復雜體系,可以使用副反應系數和守恒方程來進行計算。
先來考慮NH3/NH4+的酸堿平衡,NH3的副反應系數為:

注意到

因此式(2)可改寫為:
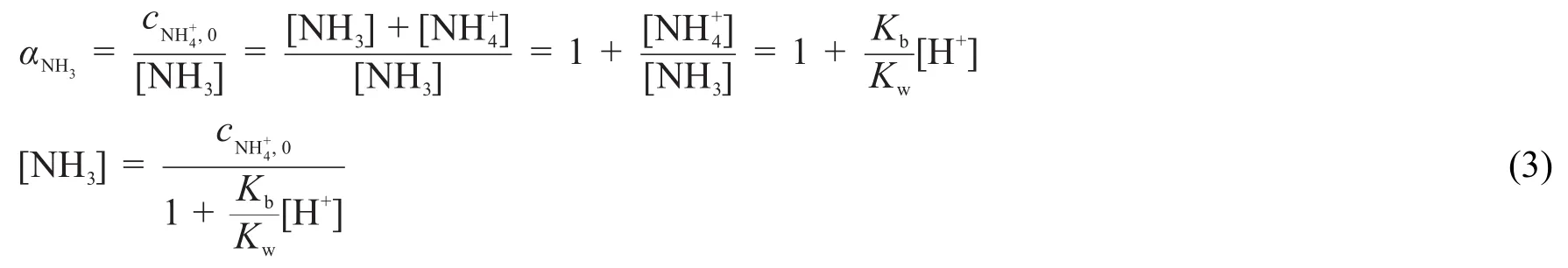
由式(3)可以計算出任何pH條件下NH3的濃度。
對Ag+也可以運用類似的技巧,求出[Ag+]與[NH3]的關系:
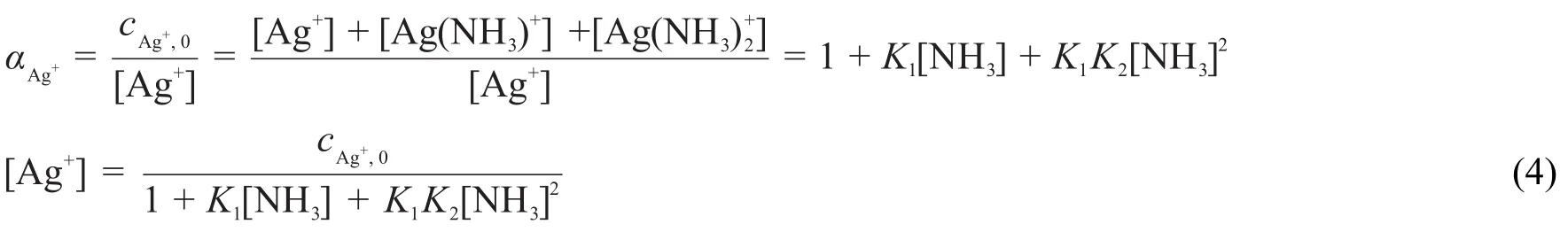
至此,得出了[Ag+]與[NH3]的關系(即式(4))和[NH3]與[H+]的關系(即式(3))。也就是說,對于任一pH,都可以通過式(3)和式(4)表示[Ag+];通過式(1)和圖中讀出的電極電勢數據可以求出[Ag+]大小。于是可以建立方程求解。
當pH=8時,由式(1)求出[Ag+]=2.064×10-6mol·L-1,由式(3)求出[NH3]=5.319×10-3mol·L-1。
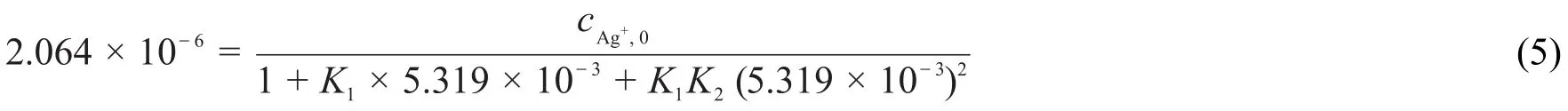
當pH>12時,由式(1)求出[Ag+]=5.979×10-9mol·L-1,由于是強堿性環境,因此
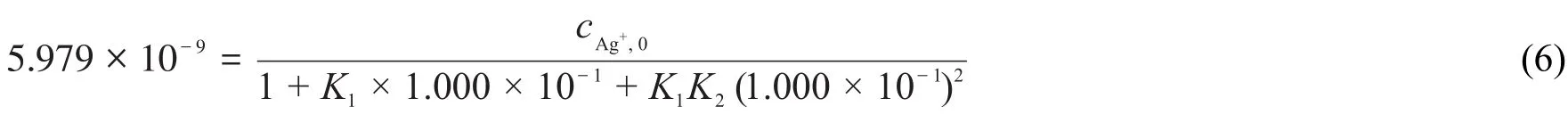
式(5)和式(6)聯立可解得:
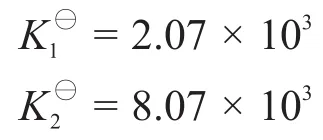
2-3本題主要考查配位平衡對電極電勢的影響,由已知簡單離子的標準電極電勢和配合物穩定常數,求配合物標準電極電勢的問題,屬于電化學中的簡單問題,直接應用能斯特方程即可求解。
對于半反應

代入式(1)可知:
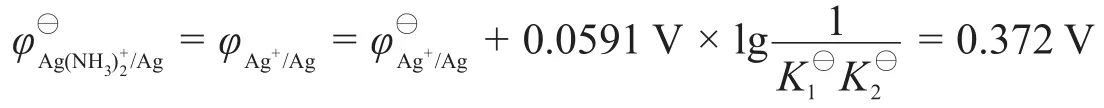
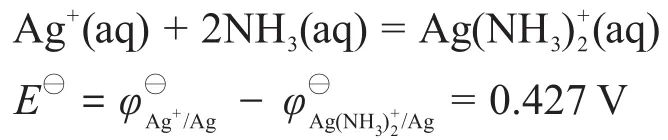
(若用假定的穩定常數計算,則結果為E?=0.355 V。)
第3題
CuO和Ba(NO3)2以物質的量比1:1混合,加熱溶解于稀硝酸中,將獲得溶液進行噴霧冷凍成小顆粒,并低溫干燥,干燥后物質移入鉑坩堝中,在1.0×105Pa的氧氣中加熱至620°C,并保溫18小時,獲得固體物質A和B的混合物,分離得到物質A和B。
元素和結構分析表明,物質A由Ba,Cu,O三種元素組成,Cu原子位于由O原子構成的四邊形的中心,四邊形通過共棱組成一維的銅氧鏈,Ba位于鏈之間。將1.00克①應更正為0.500克,詳見解答。A與足量碘化鉀混合,在氬氣氣氛下滴入3 mol·L-1鹽酸,直至固體完全溶解,得到溶液S(反應式1)。溶液S加水稀釋,得到白色固體沉淀C(反應式2);溶液S加入少量淀粉,得到藍色溶液,用0.100 mol·L-1硫代硫酸鈉溶液滴定,消耗44.54 mL(反應式3)。若A先用鹽酸溶解(反應式4),再滴入碘化鉀溶液(反應式5),直接得到含有沉淀C的溶液,該溶液用0.100 mol·L-1硫代硫酸鈉溶液滴定,消耗26.72 mL。
物質B在20%氧氣+80%氮氣混合氣氛保護下緩慢加熱至820°C,失重9.45%(反應式6),得到物質D,而緩慢降溫至400°C后,又恢復到原重量。
原子量:Ba:137.33,Cu:63.55,O:16.00
3-1寫出A、B、C和D的化學式。
3-2寫出反應的反應方程式(溶液中反應必須用離子方程式表示)。
3-3在上述滴定實驗中,用硫代硫酸鈉溶液滴定到接近終點時,常加入少量KSCN以提高測定精確度,闡明原理及必須在接近終點時才加入KSCN的理由。
分析與解答
首先需要推斷A、B、C、D的組成,我們所掌握的有效信息是制備完成之后對產物的結構和元素組成進行分析的數據,這里需要注意一開始的CuO和Ba(NO3)2的投料比并不是進行產物組成判斷的有效信息,可能有部分學生認為產物中Cu和Ba的比例一定是1:1,這是錯誤的,對產物組成的判斷只能由對產物的分析中得出,而不能由投料比進行武斷的推測,更何況這里不單單只生成一種物質。
對A的結構分析表明“Cu原子位于由O原子構成的四邊形的中心,四邊形通過共棱組成一維的銅氧鏈,Ba位于鏈之間”。根據晶體學的基本知識,很容易地判斷出A中Cu和O的比例是1:2,而Ba的量是不確定的。據此,不妨設A的化學式為BaxCuO2,x取決于A中Cu(II)和Cu(III)的比例,這需要由滴定分析的數據進行確定。
對A的滴定分析過程是典型的碘量法測定超導體組成的流程,對競賽熟悉的學生應該見過不少此類問題。“A與足量碘化鉀混合。在氬氣氣氛下滴入3 mol·L-1鹽酸,直至固體完全溶解,得到溶液S”此過程是讓I-還原A中的所有Cu至+1價,生成CuI和I2,注意到得到的是溶液S,稀釋后才產生白色固體C(CuI),不難想到過量的I-與CuI生成了配離子使其溶解。據此可以寫出方程式(為解題方便,先忽略CuI和I2的形式):
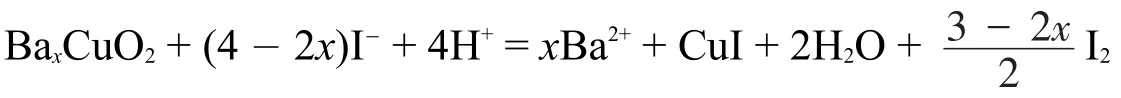
然后根據I2和硫代硫酸根的關系即可列出方程:
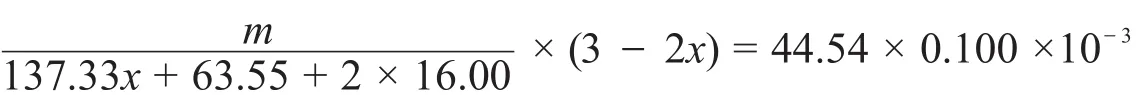
若按題目中的數據m=1.00 g解方程,則得出x=0.985,這個解并沒有意義,按正確值m=0.500 g解方程則可得x=0.667,即可得出A的化學式為Ba2Cu3O6,也就是
由于試卷上本題數據有誤,根據卷面上的數據解此方程只能得到沒有價值的解,對A的組成的推斷采用這種方法在考場上是不能成功的,但是有另一種解題方法能夠判斷出數據的錯誤。這種方法就是:先從兩次滴定數據入手,第一次滴定第二次滴定Cu(III),進而可以算出:
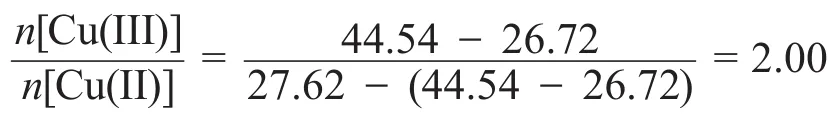
根據此比例,考慮到Cu和O的比例是1:1,則得出A的組成為Ba2Cu3O6,并能進一步判斷該數據是錯誤的。而第一種計算方法不需要用到第二次滴定的數據,但也不能判斷出錯誤的數據。然后我們可以寫出完整的反應方程式(注意物質的存在形式):
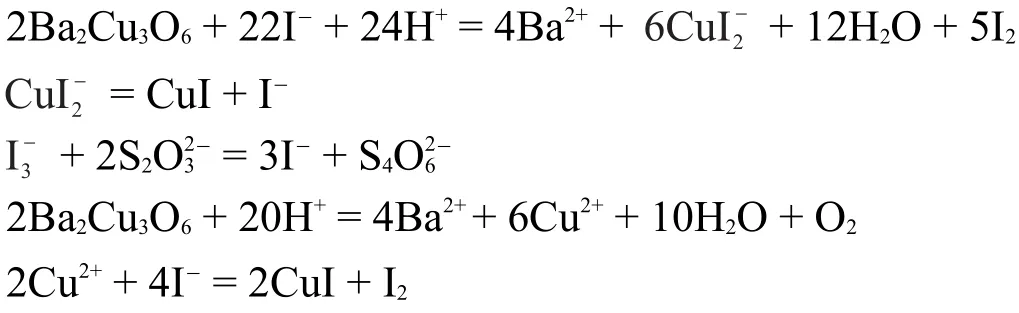
B的組成則需要根據熱重分析數據進行推斷,不難設想B也是Cu,Ba的氧化物,其失重應為失去O2轉化為其他氧化物,可能的組成形式有BaO、BaO2、CuO和Cu2O3(其實Cu(III)的氧化物在加熱失重后再降溫并不會恢復原重,但是在做題的時候不妨也將其考慮進去)。考慮到Cu(III)與不會同時存在,則可以把B的化學式寫成BaO2·xBaO·yCuO或者mBaO·Cu2O3·nCuO,其失重為:
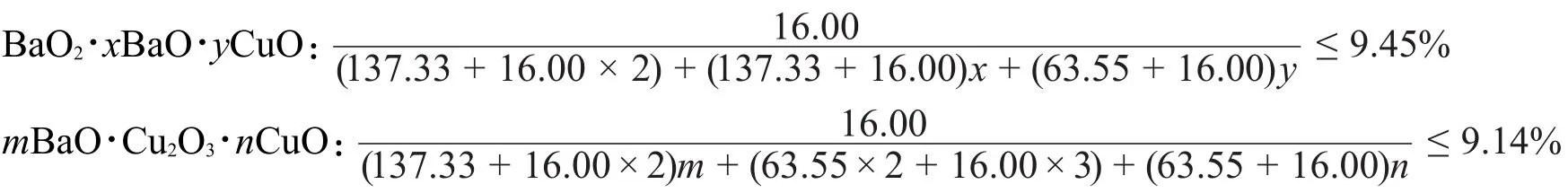
經過這樣簡單的數學處理,就可以清楚地得知B的組成應為BaO2·xBaO·yCuO類型,進而解出x=0,y=0,即B為BaO2。當然,如果對BaO2的性質有足夠的了解,就可以直接計算BaO2的失重,很快得到答案。其失重的反應方程式為:
在B的推斷過程中需要注意,題目中的已知信息不足以單從化學角度判斷B的組成,單純地從元素化學的角度猜測B的組成會非常困難,這時就需要學生重視數學工具的運用。
3-3直接考查間接碘量法測定銅含量的兩個問題,第一問比較簡單,認真學習過分析化學的學生解答此題應當是毫無困難的:由于CuI沉淀會吸附I2造成滴定誤差,因此需加入SCN-將CuI轉化為更難溶的CuSCN,釋放被吸附的I2。
第二問則存在一些疑問,按照《分析化學教程》(李克安主編,北京大學出版社)的說法[3],不能過早加入KSCN,是因為I2可能氧化加入的SCN-,從而達不到預期效果。但是根據計算,反應I2+2SCN-=2I-+(SCN)2的電極電勢為-0.23 V,是很難進行的,在滴定條件的I2濃度下,(SCN)2的平衡濃度為1.6×10-10mol·L-1才能使反應進行,這毫無意義。所以上述答案應該是存在問題的,另一種可能答案是:過早加入SCN-生成的CuSCN仍可能吸附I2,同時硫氰酸鹽中的其他雜質可能還原I2造成誤差。其他可能性請讀者自行思考。
評價
本題以低溫噴霧冷凍法制備超導體為背景,考查學生通過結構分析和元素分析數據進行推斷的能力以及對相關的分析化學和無機化學的基本知識的掌握情況,也考查了對數學工具的運用情況,難度適中。關于Ba2Cu3O6及其制備的相關內容,有興趣的同學可以閱讀相關文獻[4]。
第4題
氫最有可能成為21世紀的主要能源,但氫氣需要由其他物質來制備,制氫的方法之一是以煤的轉化為基礎。基本原理是用碳、水在氣化爐中發生如下反應:

利用CaO吸收產物中的CO2:

產物中的H2與平衡體系中的C、CO、CO2發生反應,生成CH4:

將2 mol C(s)、2 mol H2O(g)、2 mol CaO(s)放入氣化爐,在850°C下發生反應。
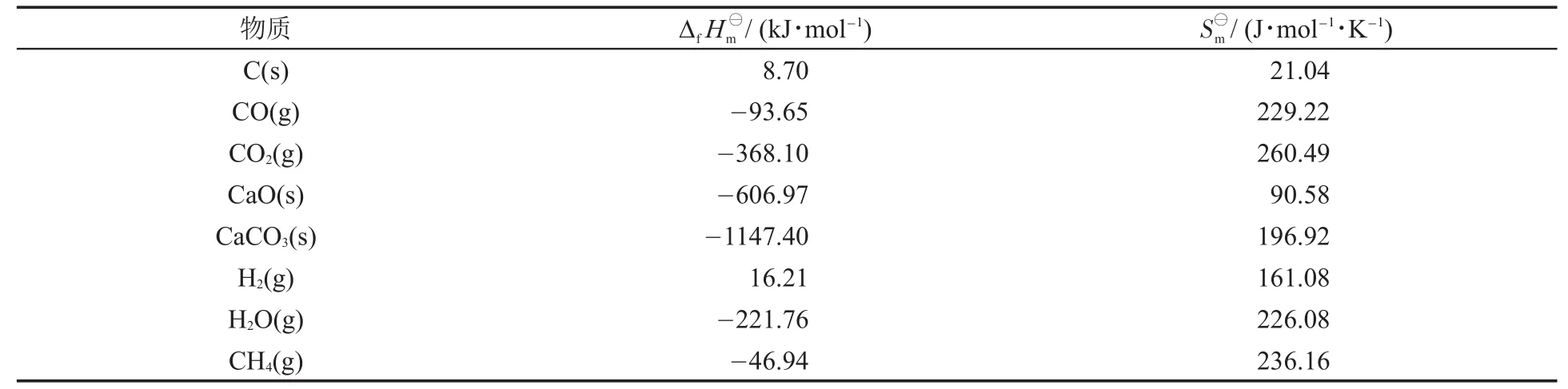
已知850°C下相關物種的熱力學參數:
4-1計算氣化爐總壓為2.50×106Pa時,H2在平衡混合氣中的摩爾分數。
4-2計算850°C從起始原料到平衡產物這一過程的熱效應。
4-3碳在高溫下是一種優良的還原劑,可用于冶煉多種金屬。試寫出600°C碳的可能氧化產物的化學式。從熱力學角度說明原因(假設600°C反應的熵變、焓變和850°C下的熵變、焓變相同)
分析與解答
本題是一道涉及多重平衡的熱力學試題。
4-1主要考查學生對多重平衡體系的分析能力。學生首先需要判斷題目給出的6個反應方程式中哪些是獨立的方程式,再利用這些方程式的平衡常數表達式推導幾種氣體的分壓關系,最后得到只關于 pH2
的方程求解。
首先選取以下4個獨立的方程式,其中C(s)+2H2O? CO2(g)+2H2(g)是題干中的式(1)和式(2)疊加得到的。它們的特點是互相之間不能通過疊加表示,但可以疊加表示出另外剩余的兩個方程式。求這4個方程式的平衡常數:
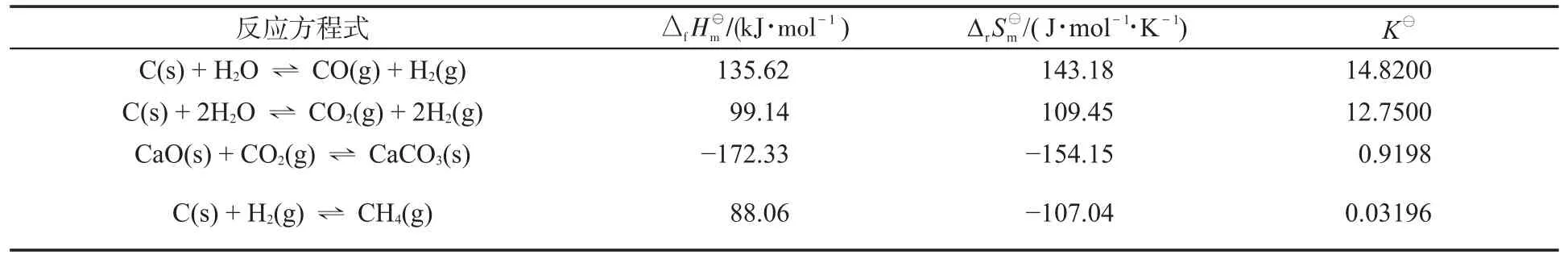
式(3)是本題的一個突破點,因為在式(3)中只有CO2這一種氣體,因此可以直接通過式(3)的平衡常數得到CO2的平衡分壓。

再根據式(2)有:

根據式(1):

將式(8)代入式(9)可以得到:
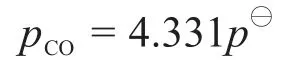
最后還有K?4的表達式:

氣體的總壓為:

將式(8)、式(10)和CO、CO2的分壓代入式(11),得到關于pH2的二次方程,解得:
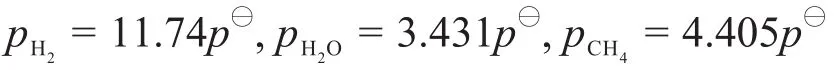
因此:
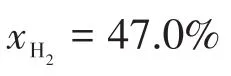
4-2考查學生對熱力學狀態函數的理解。如果通過4-1中4個獨立的方程式去求解,整個計算過程將會相當繁瑣。學生應該把這個平衡體系作為一個整體考慮,求得整體的末狀態,再計算由始態到末態的焓變。
體系中氫元素的物料守恒表達式為:
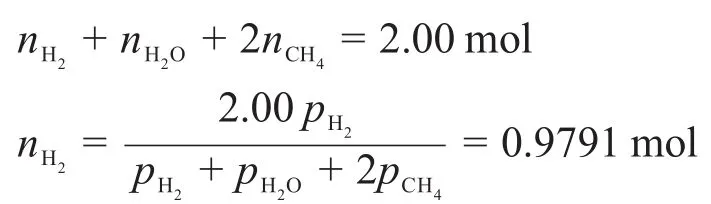
進而可以求得達到平衡時其他氣體的物質的量:
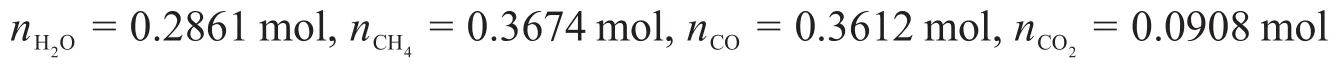
再考慮氧元素和碳元素的守恒可以求得:
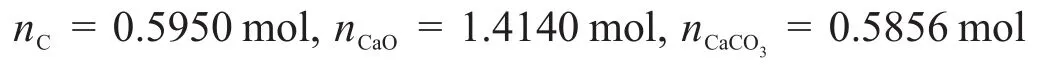
因此全過程的焓變為:
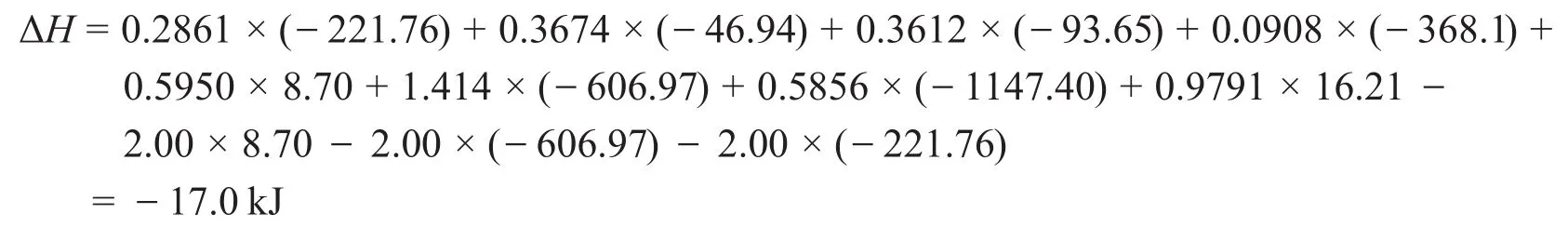
與參考答案有0.5 kJ的差值,是由于運算中保留的有效數字位數不同造成的。
4-3要求學生判斷在600°C的條件下碳的氧化產物,實際上要求學生找到一個合理的方法來判斷CO、CO2的穩定性。題目中沒有給出O2的熱力學數據,因此考慮CO的歧化反應:
由此得出:CO在600°C不穩定,它會自發歧化為C和CO2。碳的氧化產物是CO2。
本題是一道較為基礎的熱力學計算題,解題的關鍵在于理清多個平衡反應的關系,然后使用多重平衡原理解題。本題也要求學生有較強的計算能力。
第5題
MAX(M代表過渡金屬元素,A代表主族元素,X代表碳或氮)相是一類備受關注的新型陶瓷材料。由于獨特的層狀晶體結構,其具有自潤滑、高韌性、可導電等性能,可作為高溫結構材料、電極材料和化學防腐材料。某MAX相材料含有Ti、Al、N 3種原子,屬六方晶系,Ti原子的堆積方式為…BACBBCABBACBBCAB…,其中A、B、C都是密置單層。N原子占據所有的正八面體空隙,而Al原子占據一半的三棱柱空隙。如果Ti原子層上下同時接觸N和Al原子,則沿著晶胞c軸方向,Al 和N原子的投影重合。
5-1寫出該化合物的化學式,及每個正當晶胞中的原子種類和個數。
5-2沿著晶胞c軸方向,畫一條同時含有Al和N原子的直線,標出直線上的原子排列(無需考慮原子間距離,直線上總原子數不少于10個。Al、Ti、N分別用○,△,□表示)。
5-3已知Ti、N原子之間的平均鍵長為210.0 pm,Ti、Al原子之間的平均鍵長為281.8 pm,估算晶體的理論密度(原子量:Ti:47.87,Al:26.98,N:14.01,NA=6.02×1023mol-1)。
5-4晶粒尺寸會影響上述材料的性質,所以高溫制備時一般通過延長保溫時間來增加晶粒尺寸。判斷常溫下晶粒生長過程的熵變、焓變和自由能變化的正負,并從化學熱力學角度判斷常溫下該晶粒生長過程是否自發。
5-5以上描述均針對完美晶體。一般情況下,晶粒中會出現缺陷。從熱力學角度證明:對于足夠大的晶體,出現缺陷是自發的。
分析與解答
本題從一種新型材料入手,考查晶體結構和熱力學方面的知識,重點考查了學生對于密堆積這一從學習結構化學便開始接觸的概念的掌握程度。最后兩問涉及到熱力學的基本概念——熵,焓和吉布斯自由能。
本題涉及到的MAX相陶瓷由Ti、Al、N三種元素組成。其中,Ti的堆積方式在題目中給出:“…BACBBCABBACBBCAB…”可以看到Ti的重復單元是BACBBCAB。由結構化學基本知識可知:在兩個不同的密堆積層(假設為A、B)間,填隙層的排布形式和這兩層相同(即為A或B)的時候是占據四面體空隙,且與密堆積層的比例是2:1;如果填隙層和這兩層均不同的時候則是八面體空隙(C層),且與密堆積層的比例是1:1。
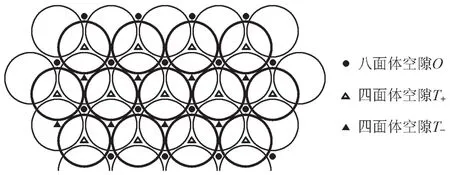
在此結構的一個重復單元BACBBCAB中,共有6組不同的密堆積層和2組相同的密堆積層。不同的密堆積層間有四面體空隙和八面體空隙,而相同的密堆積層間,由于原子的位置是相同的位置,形成的空隙是棱柱。在單一密堆積層中,3個原子形成三角形,所以在一組相同的密堆積層(設為A)中,形成的是三棱柱空隙。兩層A之間的三棱柱空隙可以再區分為與B層或C層一致的空隙(見下圖),所以三棱柱空隙的數量和密堆積層的比例是2:1。
根據上述分析,以及題目中給出的堆積方式,可以算得NTi:NN:NAl=8:(6×1):(2×2×0.5)= 4:3:1,所以得出晶體的組成為Ti4AlN3。一個正當晶胞應包含一個重復單位BACBBCAB,則應含有兩個化學式,即含有8個Ti原子,2個Al原子和6個N原子。
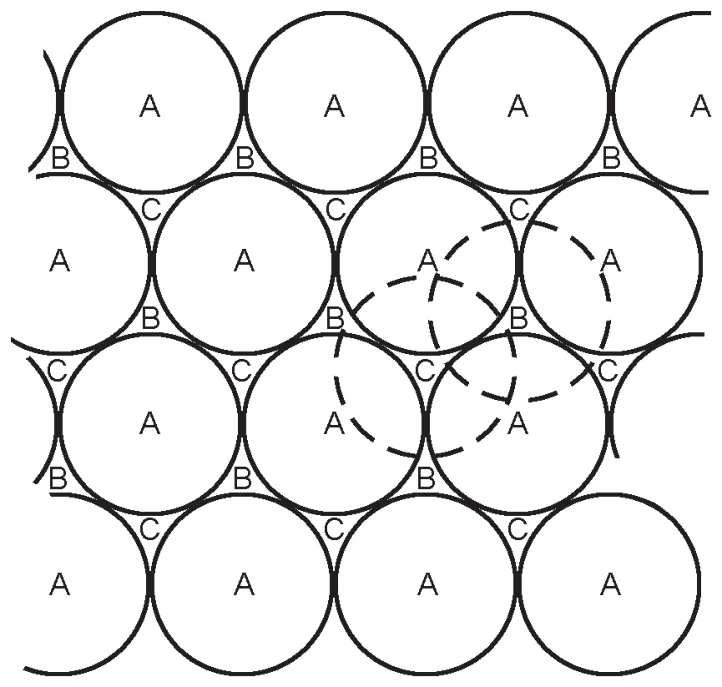
至此已經知道了此MAX晶體的組成,但是B層與B層三棱柱空隙有A,C兩種,仍然不知道Al的具體位置。試題的最后一句話還有一條信息,即Al和N原子的投影重合,由此可知Al占據的位置應與其上下兩層N一致。
先寫出Ti和N的堆積形式:以大寫字母表示Ti的堆積類型,希臘字母代表N的堆積類型,□表示Al的位置:
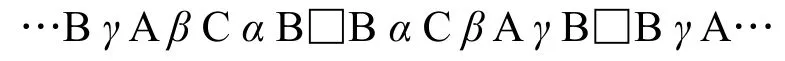
則可以很清楚地看出Al應占據三棱柱空隙,以小寫字母加下劃線表示之:
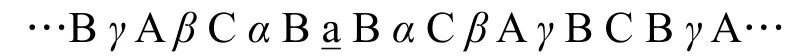
不同的堆積中原子不會重疊,只要抽取ABC中任意一種密堆積層的原子作為一個序列即可完成第二問;若抽取A層,則為…—Ti—N—Al—N—Ti—…,抽象成符號即為:
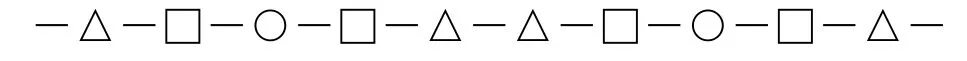
晶體的密度計算如下:六方晶系晶胞體積V=a2c cos 60°。其中a相當于Ti形成的八面體的邊長,其中兩個Ti—N連接形成了八面體的對角線長度,所以

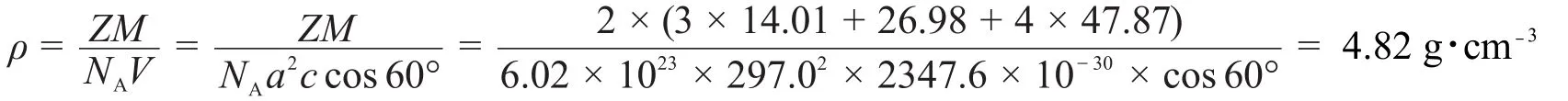
5-4重點考查了一定過程的熱力學參數的變化。原子由氣體變成固體,其排列由無序變得規則,所以無論是高溫還是常溫,體系的熵一定減少,即ΔS<0。高溫下結晶過程是自發的,所以其吉布斯自由能變小于0,由ΔG=ΔH-TΔS則可知其焓變一定是小于0的,因此在溫度降低的時候,反應依然自發。本題也可以類比晶體陳化的過程,其中小晶體的單位質量表面能比較大,所以也可以得出焓變小于0。
5-5在完美晶體形成缺陷的過程中,由于原子間距變化,焓減小。但是由于混亂度增加,所以熵增加。因此缺陷的形成在焓變上是不利的,在熵變上則是有利的。注意到題目中所述“足夠大”的晶體的缺陷的形成是自發的,則需要解釋吉布斯自由能在晶體尺寸的增加過程中減小的原因,答案中“熵效應占據主導”實際上只是把這個現象復述了一遍。下面我們嘗試解釋:首先焓變基本上是恒定的,同時,單位體積中產生缺陷的熵是不變的,但是隨著晶體體積的增大,產生缺陷的狀態數增加,由玻爾茲曼熵計算公式,熵增的值也增加,所以在大晶體中出現缺陷必然自發。
本題考查了晶體學中的基礎知識:密堆積,由點入面,層層遞進,既達到考查學生基礎的目的,也對其對結構化學的理解程度提出了不小的要求。后兩問十分新穎,在結構中考查了學生對熱力學的認識,最后一問注重了學生對于熵的基本理解。整道題難度適中,區分度偏高。
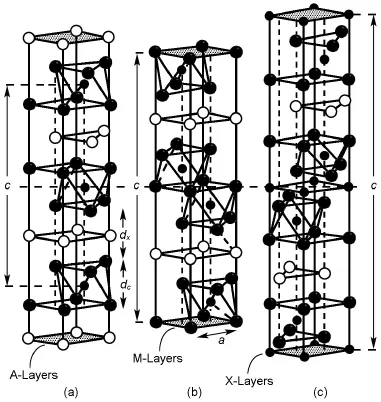
對于本題介紹的新型材料MAX有興趣的同學可以繼續深入了解。MAX是六方晶系,其晶體結構是類似于巖鹽結構的Mn+1Xn與緊密堆積的A族原子面在c方向交錯堆疊而成,故其通式為Mn+1AXn。2000年,Barsoum[5]對這種新型材料按照n的個數分為三類:M2AX(211相),M3AX2(312相),M4AX3(413相)。如下圖所示,(a)、(b)、(c)分別是211相、312相、413相的晶胞結構,其中平行于c軸的輔助線穿過A層的一個三角形空隙。
第6題
反應體系為氣體、催化劑為固體的異相催化反應很普遍。設氣體在均勻的固體催化劑表面發生單層吸附,各吸附活性中心能量相同,忽略吸附粒子間相互作用,吸附平衡常數不隨壓力變化。
6-1理想氣體X在180 K和3.50×105Pa條件下,1 g固體的吸附量為1.242 cm3。在240 K達到相同的吸附量時,需要將壓力增加到1.02 MPa。估算X在該固體表面的摩爾吸附焓變(假設此溫度范圍內摩爾吸附焓變為定值)。
6-3假如產物B也發生表面吸附,反應機理變為:
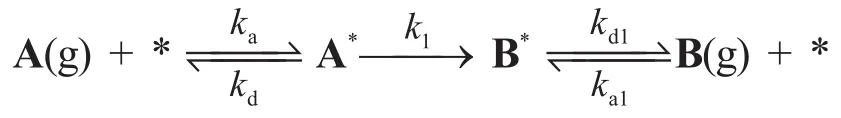
其中由A*生成B*的表面反應為決速步驟。假設ka,kd,k1都和問題6-2中的相同。當產物B的分壓pB遠大于pA時的反應對于A來說是一級反應,且速率常數k3可表達為pB的函數:求B(g)在催化劑上的吸附平衡常數KB=ka1/kd1。
分析與解答
這是一道很典型的化學動力學題,主要考查學生對化學動力學中三大假設和反應速率計算的掌握。題目選取異相催化反應作為背景,在介紹相關知識的同時,也對學生的應變能力提出了一定的要求。
6-1熱身題目,考查基本的化學熱力學與平衡計算。首先寫出兩個溫度下的平衡常數:
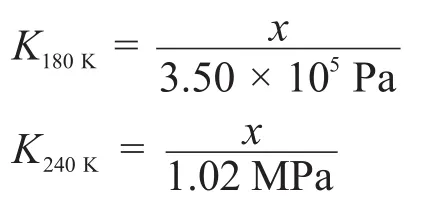
其中x是表示1 g固體吸附1.242 cm3氣體的一個物理量。然后就可計算出吸附反應的焓值,也即摩爾吸附焓變:

代入K180 K和K240 K,消去x即可求出摩爾吸附焓:
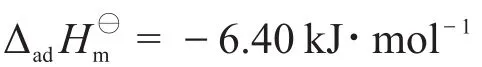
此外,也可以通過吉布斯自由能來計算摩爾吸附焓:
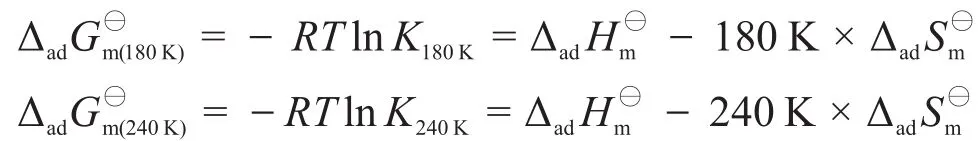
以上兩種方法都可以得到本題的答案,請讀者自行推導它們之間的關系。
6-2這是一道典型、常規的動力學題目。首先注意題目中的幾句話:
①“該表面反應為決速步驟”,在決速步驟之前的A的吸附和解離過程可以認為是一個快速平衡的過程。即:
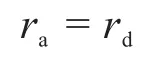
②“吸附態A*的濃度用表面覆蓋度(A*所占據的活性中心個數與表面活性中心總個數之比)表示。”在吸附化學中,速率和表面覆蓋率成正比。假如用來表示A*的表面覆蓋率,則可表示“表面未覆蓋率”,那么:
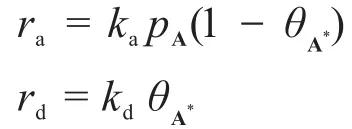
③“高壓下為5 kPa·s-1,低壓下為0.1 s-1。”在高壓和低壓下,反應速率常數不僅數值不同,單位也不同。高壓下反應級數為零級,而低壓下則變為一級。讀者應該帶著這個信息進行解題。
由速控步假設可得:
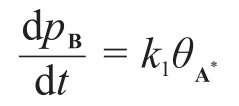
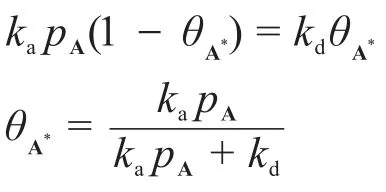
在這一步我們也可以得到反應的平衡常數:
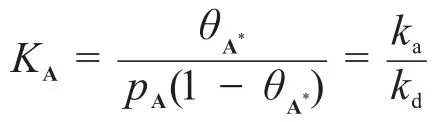
那么:
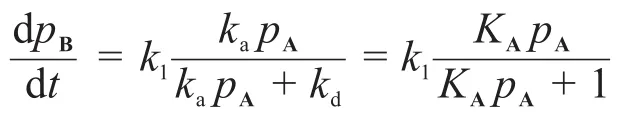
在高壓條件下,KApA?1:
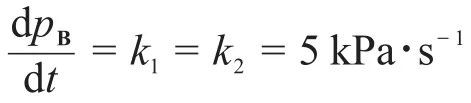
在低壓條件下,KApA?1:
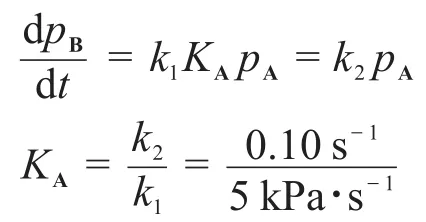
則在pA=50 kPa時,
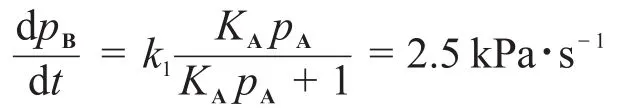
6-3本題是6-2的擴展。但要注意的是,在這里“表面未覆蓋率”為對于兩個快速平衡,有:
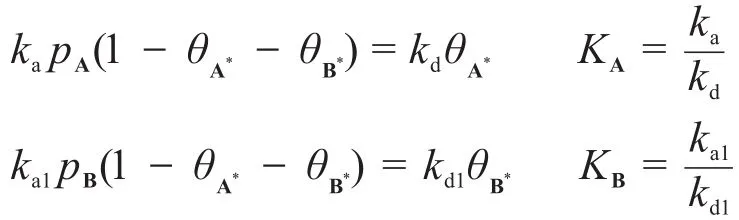

由穩態近似,有:
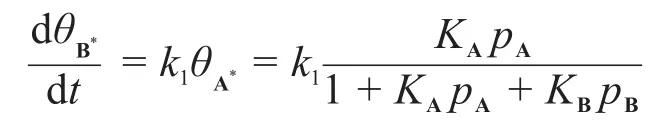
又 pB?pA,且總反應對A為一級,需1+KApA? KBpB,因此:
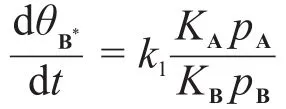
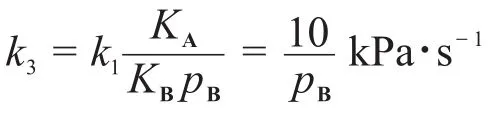
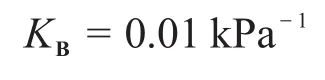
第7題
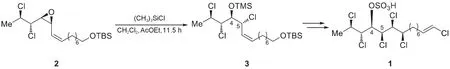
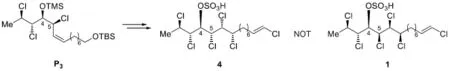
海洋生物體內蘊含著豐富的生物活性物質,誤食某些海鮮食品會導致嚴重的食物中毒。細胞毒素chlorosulpholipid是從某海洋生物體中分離得到的一種天然產物,其全合成研究表明,該分子內含有的多氯代結構對其生物活性具有重要意義。在該分子合成路線中,氯原子的引入涉及如下所示的環氧開環反應(TBS=t-Bu(CH3)2Si):
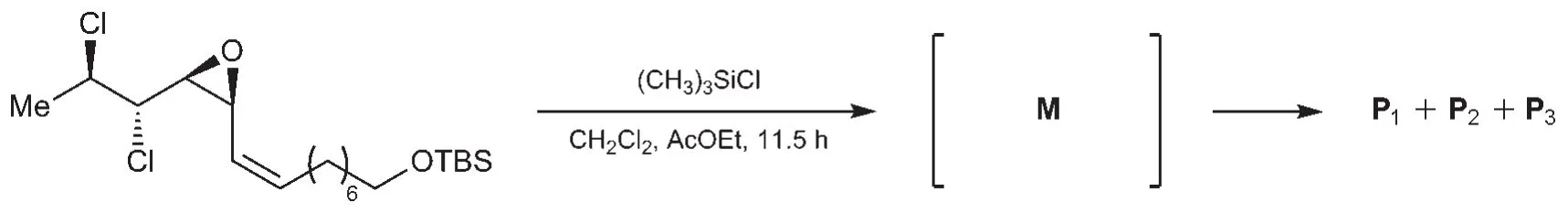
以二氯甲烷與乙酸乙酯為溶劑,得到3種開環產物P1、P2和P3。
7-1給出中間體M的結構簡式。
7-2給出P1、P2和P3的結構簡式,以及由M得到相應產物的生成機理。
背景
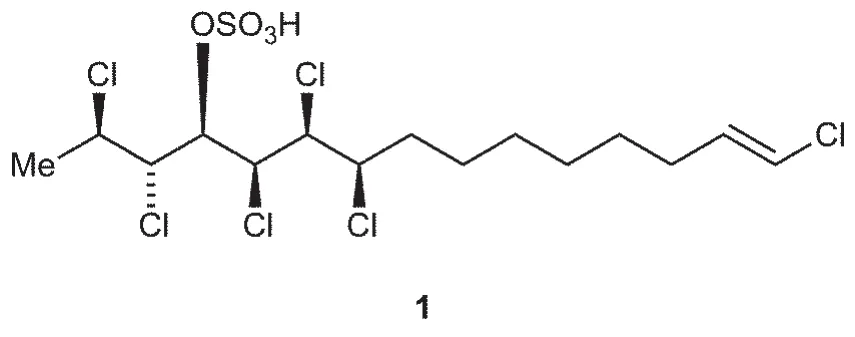
有機合成中的三大選擇性——化學、區域與立體選擇性,始終是有機化學家關注的經典問題之一。這樣一類涉及選擇性的策略合成,在細胞毒素chlorosulpholipid中得到了集中的體現。chlorosulpholipid是一類含有多手性中心的多鹵代磺酸酯化合物,由于在自然界中的稀缺性,chlorosulpholipid的生物特性一直未得到深入的研究,因而有必要實現這類化合物的實驗室合成。2009年,Carreira小組[6]在Nature雜志上發表文章,首次實現了chlorosulpholipid(1)的全合成,不僅用合成的方法確證了這類化合物的結構,而且揭示了它們未被開發的反應性質。如下圖所示,1呈一長鏈結構,包含6個手性中心。如何合理地構建這些手性中心便是能否成功合成這類化合物的關鍵。
分析與解答
7-1這是一個簡單的酸堿反應。多氯代底物2帶有一個特征的環氧基團,可以用其孤對電子進攻TMSCl,生成加合物中間體M。這里Lewis酸TMSCl用3d軌道接受電子,生成五配位中間體,再經Si—Cl鍵斷裂得到對應的內鹽。
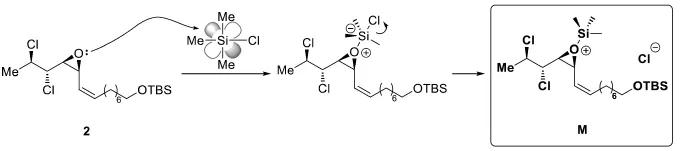
7-2考查了中間體M的特殊反應性。題目已經提示:內鹽M在溶劑中繼續反應,發生環氧開環。但產物有3種,而不是預想的1種。如何推理出這些產物的結構?從簡單情況入手:Cl-直接進攻環氧,開環得到產物。由于反應發生在偶極非質子溶劑中,遵循SN2機理,因而產物的構型發生翻轉。再考查區域選擇性:由于烯丙位碳在SN2過渡態中可以發生共軛,降低過渡態能量,因此氯原子選擇性地在右側的烯丙位碳上反應。
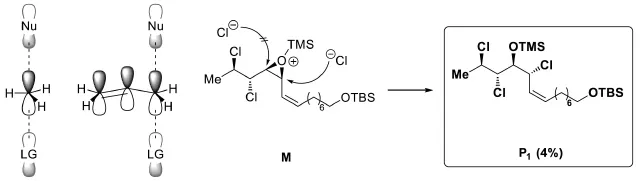
然而,這并不是反應的全貌:化合物P2和P3仍需解析。此時應該關注M的結構中可以使反應發生特殊走向的因素:脂環構象控制、插烯規則及鄰基參與等。由于三元環與烯烴互為鄰位,因此可推斷這里發生了SN2'反應,這樣就得到了P2的結構:
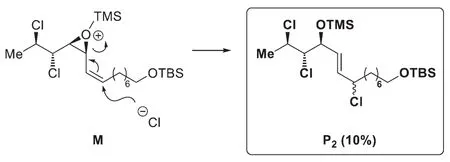
再來考查其余的結構因素:三元環左側的氯原子帶有孤對電子,可以通過鄰基參與形成有利的五元環中間體,再經開環得到P3:

需要指出的是,本題通過提示主、副產物的數目來引導我們推導出它們的結構。但在實際科研過程中,情況遠比這復雜得多。考查chlorosulpholipid的結構可以看出,Carreira教授設計一步TMSCl開環反應的原意是得到與產物構型相同的4,5-syn化合物3,由下圖可以看出中間體3與產物1手性中心的對應關系:
與7-2小題對比可知,3即是直接一步SN2產物P1,然而P1的收率只有4%,遠遠低于預期。事實上,由于氯原子親核能力較差,這樣一步鄰基參與的開環產物是作者始料未及的。在原文獻中,Carreira小組甚至將收率較高(39%)的副產物P3直接誤認就是化合物3,導致直到全合成進行到最后一步才發現,得到的產物4竟與目標產物1構型不同,從而導致了原始合成路線的更改。可以看出,即使是對于經驗豐富的科研工作者,有機合成中發生的各種特殊情況,尤其是涉及三大選擇性的特殊反應,始終需要密切的關注與詳盡的探究。這也是有機化學能夠吸引一代又一代化學家的魅力之一。
第8題
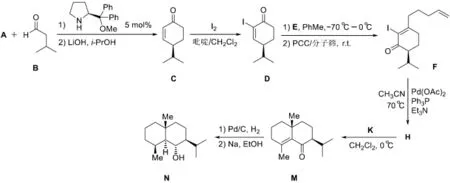
從簡單易得的化合物出發,合成復雜天然產物是合成化學家們追求的目標。復雜天然產物的人工合成挑戰著合成化學家的智慧。如下所示為天然產物萜類化合物eudesmane合成路線的片段(反應條件中“r.t.”表示室溫,PCC為CrO3/吡啶/鹽酸):
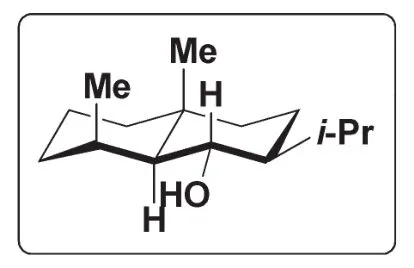
8-1給出產物N的穩定構象。
8-2給出試劑E、K及中間產物H的結構簡式。
8-3給出由M到N轉換的中間產物的結構簡式。
8-4給出中間產物C的逆合成分析(不考慮立體化學),據此給出反應物A的結構簡式。
8-5通過反應過程中關鍵中間體結構的形成,簡述形成C的過程中的立體控制機制。
背景
eudesmane是一個包含超過1000種萜類分子的大家族,這些分子大多具有較小的相對分子質量和剛性的環系,這對于高質量的合成是極具挑戰的。Scripps研究所的Baran教授小組[7]在2009年發表了基于選擇性碳氫鍵氧化的eudesmane家族的全合成方法。
分析與解答
8-1此題考查了十氫化萘衍生物構象,N為一個反式的十氫化萘;由于取代基中異丙基體積最大,因此它在穩定構象中位于平伏鍵。正確答案為:
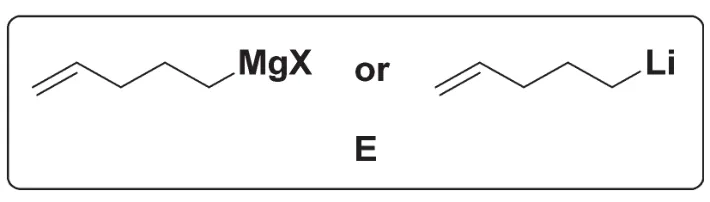
8-2本題重點考查了有機化學中的逆向思維,即已知反應物和底物來推斷反應條件。D經E處理,再由PCC氧化兩步反應轉變為F,其中羰基發生了移位,并且引入了一個5個碳的鏈烴基R (R=—CH2CH2CH2CH=CH2),因此E中應包含這個烴基R。與R直接相連的碳是底物D中的羰基碳,因此E應該是具有一定親核性的有機金屬化合物。D為α,β-不飽和酮,有機金屬化合物對其親核進攻有1,2-加成和1,4-加成兩種可能,當有機金屬化合物為鋰試劑或格氏試劑時,在空阻較小的情況下更容易對羰基加成,因此E的最佳選擇是格氏試劑RMgX或RLi:
在E的作用下,D首先被親核加成,生成一個烯丙醇D',隨后在氧化劑PCC作用下發生氧化反應,由于D'為三級醇,無法被直接氧化,因此實際發生了氧化重排反應,生成α,β-不飽和酮F。可能的反應機理如下:
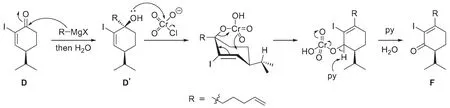
F到H的轉化為分子內的Heck反應[8],但此時碘原子和末端雙鍵有兩種反應方式,即使用最末端氫偶聯生成七元環或使用次末端氫偶聯生成六元環。考慮到六元環在形成過程中活化能較低,以及M和N的結構,可知H的結構為:
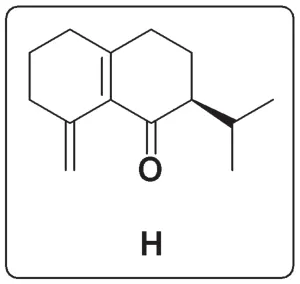
H到M引入了一個甲基,并且雙鍵發生了位移。H中引入甲基的碳為α,β-不飽和酮中具有親電性的碳原子,因此甲基化試劑應是一個有機金屬化合物,可供選擇的有鋰試劑、格氏試劑和烷基銅鋰試劑。考慮到烷基銅鋰試劑對α,β-不飽和酮的1,4-加成選擇性最好,因此選擇烷基銅鋰試劑,即條件K 為Me2CuLi。
8-3由M至N發生了兩步還原反應,由于碳碳雙鍵較羰基的極性小,因此Pd/C+H2條件對應碳碳雙鍵的加氫還原,而最后羰基的還原使用活潑金屬還原。第一步還原由于甲基和異丙基的空阻,催化劑和氫氣從分子平面后方接近碳碳雙鍵,因此反應具有立體專一性,第一步產物為:

8-4 C是一個α,β-不飽和酮,可以由β-羥基酮脫水生成,而β-羥基酮可以切斷為碳負離子和羰基化合物,即可以由羥醛縮合反應得到。因此前兩步的逆合成分析如下:
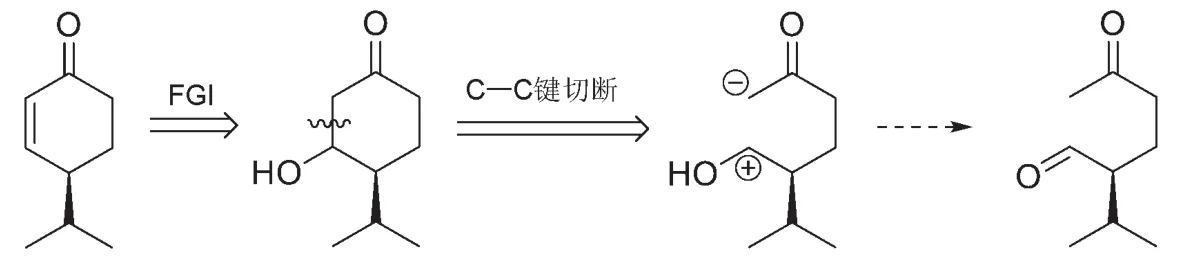
接下來的起始物質是一個1,5-二羰基化合物,一個常見的切斷方法是從一個羰基的α碳和β碳之間進行切斷,因此有如下圖的a、b兩種切斷方式。但對比題目中合成路線的起始物B,只有切斷b滿足題意。至此A的結構也躍然紙上。
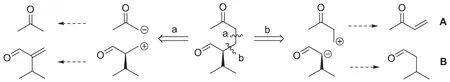
于是完整的逆合成分析為:

8-5這道題目考查了立體化學知識,條件中的不對稱四氫吡咯衍生物是不對稱催化劑。底物中醛羰基的活性最高,先與催化劑結合經由中間體X生成亞胺鹽。
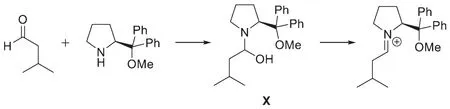
在中間體X脫水的過程中由于碳氮鍵可以自由旋轉,氮原子的構型也可以翻轉,所以兩個穩定的交叉式構象有較大的能量差異,使得生成的亞胺鹽具有特定的構型,即異丁基與大位阻的二苯基甲氧基甲基處于盡量遠離的位置。
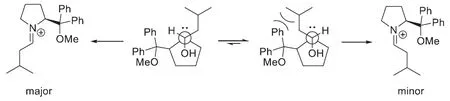
隨后亞胺陽離子發生β-消除生成穩定的E型烯胺中間體,進而對體系中的α,β-不飽和酮(A)進行Michael加成,由于二苯基甲氧基甲基特定的空間取向,化合物A只能從平面下方接近烯胺,生成異丙基朝上的產物。隨后烯醇負離子互變至末端,對剛剛生成的亞胺陽離子進行親核加成,得到β-氨基酮,之后消除催化劑得到產物C。這步反應利用了小分子不對稱胺作為催化劑,一方面提供了不對稱環境,高立體選擇性地生成了化合物C,同時二級胺催化了A與B的Robinson成環反應,非常巧妙。
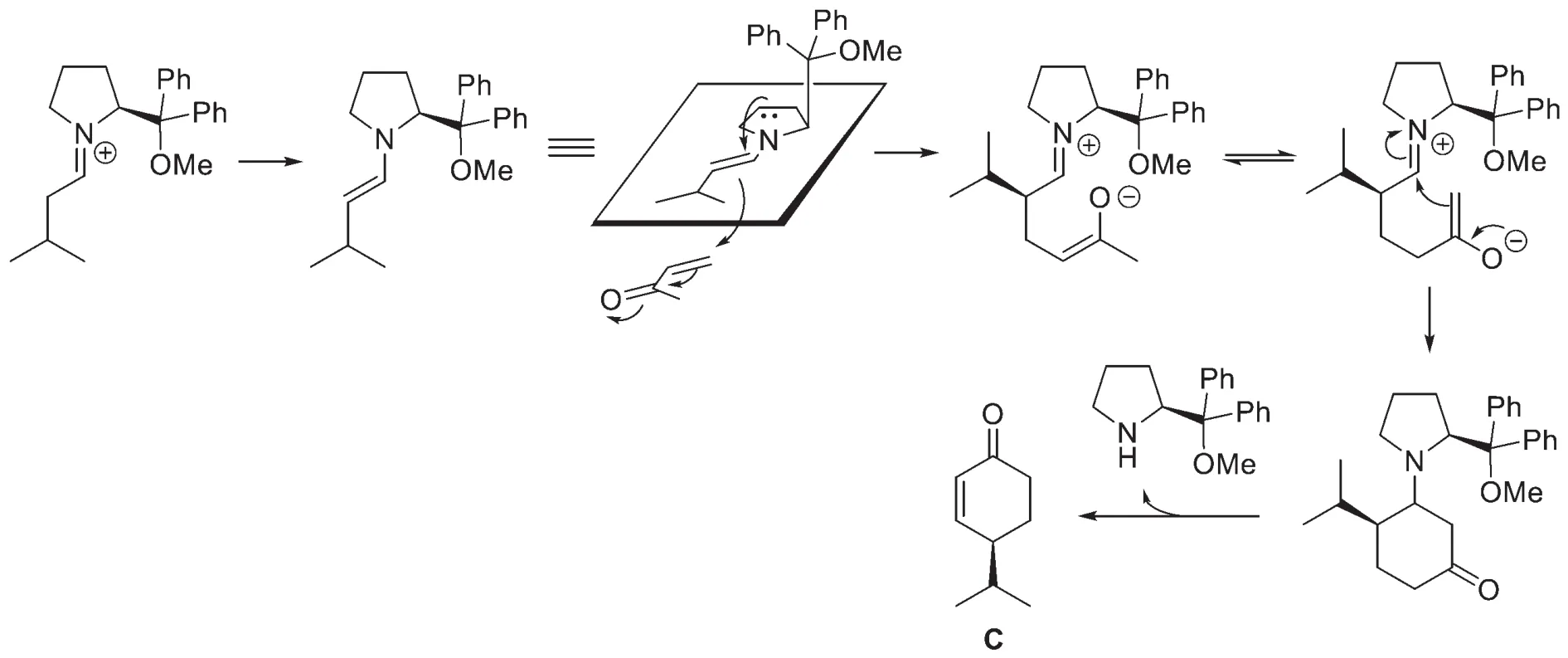
本題結合金屬偶聯反應中極為重要的Heck反應,考查了學生對有機化學中構象分析、立體化學、氧化反應、重排反應和手性控制等知識的掌握,要求學生能夠靈活運用有機合成的知識,能夠進行合理的逆合成分析,并具有較寬的知識面。
第9題
Wittig于1953年報道了磷葉立德(phosphoniumylide,又稱Wittig試劑)與醛、酮反應,將羰基直接轉化為碳碳雙鍵,同時生成副產物三苯氧膦,稱之為Wittig反應,是構建碳碳雙鍵的重要方法。有關改進和拓展Wittig反應的研究得到了廣泛的重視和發展,文獻報道了如下所示的類似Wittig反應的研究:

9-1給出反應物中C=N雙鍵的構型(Z或E)。
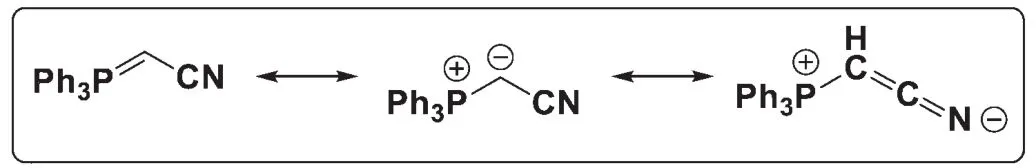
9-2畫出反應物Ph3P=CHCN的共振結構式。
9-3指出下列哪一種1H NMR譜信息可用來測定反應物C=N雙鍵構型。
I.
I.化學位移II.II.磁各向異性III.III.屏蔽效應IV.NOE效應
9-4說明反應物結構中的—SO2Me基團對該反應的作用。
9-5研究上述反應機理時,發現如下反應:
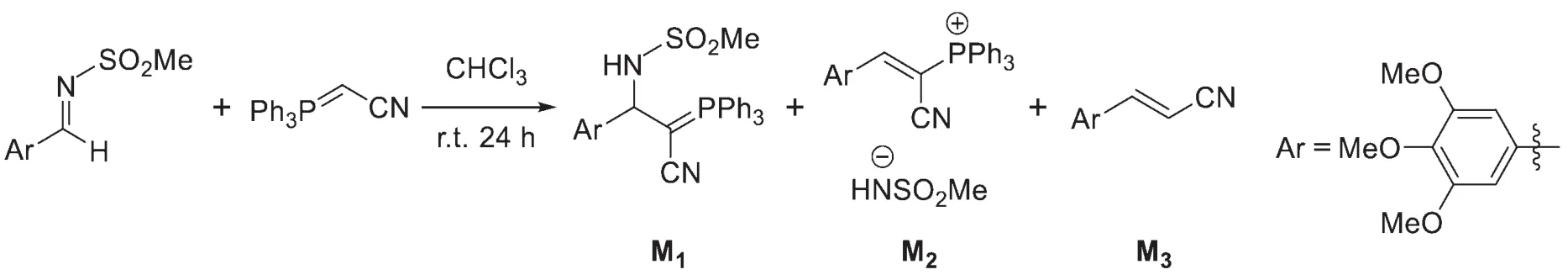
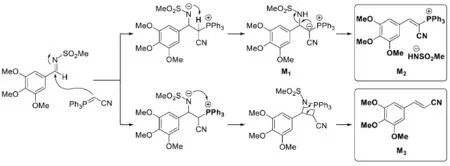
分別給出生成M2和M3的反應機理。
9-6在9-5反應中,以四氫呋喃(THF)為溶劑,室溫下反應后,再用福爾馬林(formalin)淬滅反應,得到如下實驗結果:
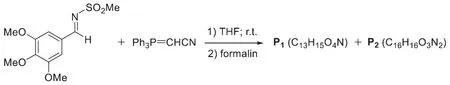
寫出P1、P2的結構簡式。
9-7 Wittig反應一般是在非質子極性溶劑中進行,但在9-6反應中,用福爾馬林(formalin)淬滅反應得到了產物P1和P2,寫出P2形成過程中關鍵中間體的結構簡式。
分析與解答
9-1考查了順反異構的判斷。根據順序規則,碳碳雙鍵中兩個大基團分別位于雙鍵兩側,故為E型。
9-2考查了共振式的書寫。Wittig試劑可以寫成雙鍵及內鹽兩種形式,同時注意到氰基可以與負離子共軛,因此還可以寫出第3個極限式:
9-3以雙鍵構型的判斷為例,考查了1H NMR的相關知識。一般來說,如果雙鍵連有至少兩個氫原子,則可以通過它們的耦合系數(來自一維或二維氫譜)來判斷雙鍵構型。但如果雙鍵上僅有一個氫原子,則需要另尋他法。本題就利用了Overhauser核效應(Nuclear Overhauser Effect,NOE)來判斷雙鍵的構型。有別于自旋耦合效應,NOE發生在空間上鄰近(而非共價鍵鄰近)的兩個或兩組氫原子間。本題中,E構型中雙鍵H與SO2Me甲基上的H在空間上較為接近,可以發生NOE效應;而Z構型中雙鍵H與甲基H位置較遠,它們之間不能發生NOE效應,這樣就能夠方便地判斷雙鍵的構型。

事實上,化學位移也可以判斷反應物的Z/E構型,請讀者思考這里引起化學位移差異的結構因素。
9-4考查了電子效應。—SO2Me具有吸電子效應,增強了C=N雙鍵的極性,從而增強了C的親電性,有利于葉立德試劑的進攻。
9-5反應機理的書寫是有機化學的重要內容。本題考查了一個類Wittig反應中主、副產物的生成機理:首先,葉立德試劑對亞胺進行親核進攻,生成一個內鹽。此時氮負離子可以進攻兩個位點:氰基α-H與鏻正離子。若選擇進攻氰基α-H,會得到一個新的葉立德試劑,即副產物M1。接下來發生消除反應得到烯基鏻鹽M2。若選擇進攻鏻正離子,則會形成四元環中間體,再經消除得到M3,這與經典的Wittig反應類似。
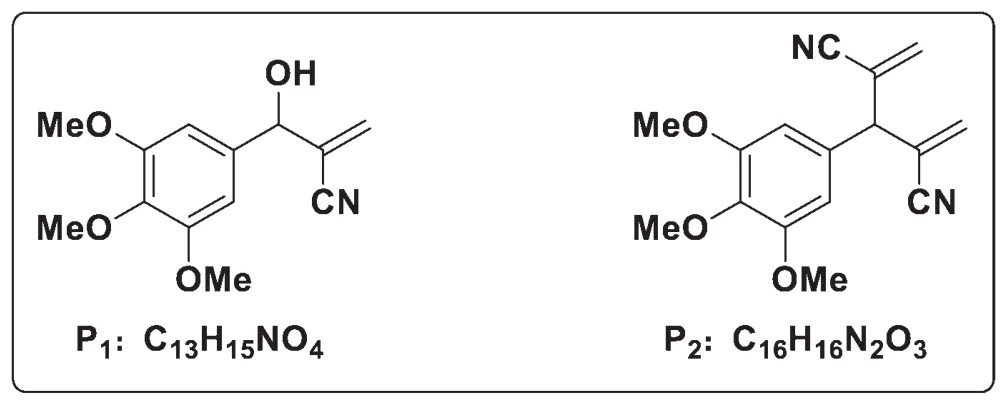
9-6考查結構的推斷,是全卷中難度較高的一題。已知題中兩個產物是在9-5的基礎上,使用福爾馬林淬滅反應得到的。首先計算出P1的不飽和度Ω=7,P2的不飽和度Ω=10,進而考慮底物的結構及9-5的反應產物:底物中磺酰胺基較為穩定,不會水解,但產物中磺酰基卻不存在,說明兩個產物中的氮原子來自葉立德的氰基,而多出的C、O則來自福爾馬林。M2作為一個親電試劑與葉立德試劑或水繼續反應,反應后生成的新葉立德試劑可以與甲醛反應。底物去掉磺酰基后化學式為C10H12O3,P1中增加的1個N和3個C必定來自一分子葉立德和一分子甲醛;P2中增加的2個N和6個C則是來自兩分子葉立德和兩分子甲醛,應是M2與另一分子葉立德反應,然后和兩分子甲醛縮合生成的。推出P1與P2結構如右:
9-7承接9-6小題,主要考查機理推斷。P2的生成過程為:首先是葉立德對烯基季膦鹽的親核進攻,在磺酰胺負離子的作用下拔掉氫離子得到一個雙葉立德,然后再與甲醛進行縮合便可以得到P2。
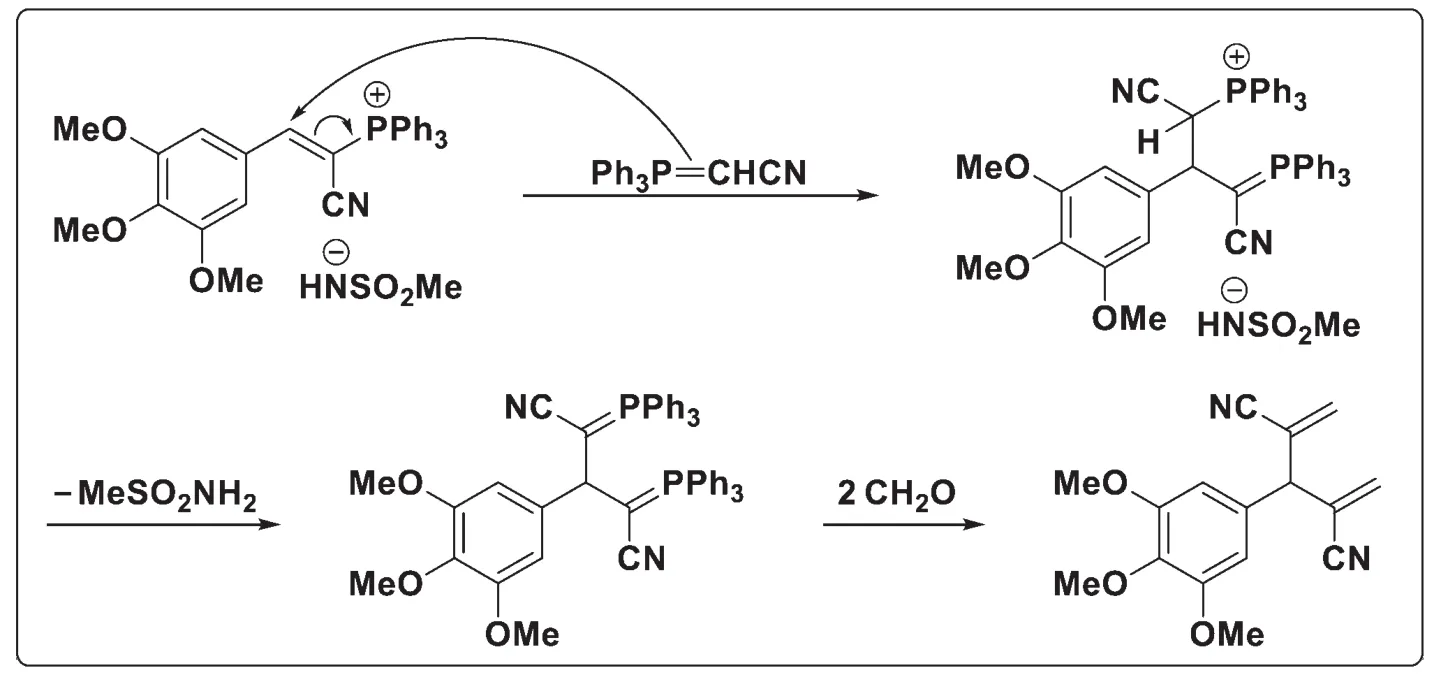
另外,P1的生成過程為:水作為親核試劑進攻烯基季膦鹽,得到的葉立德再與甲醛縮合,得到P1。
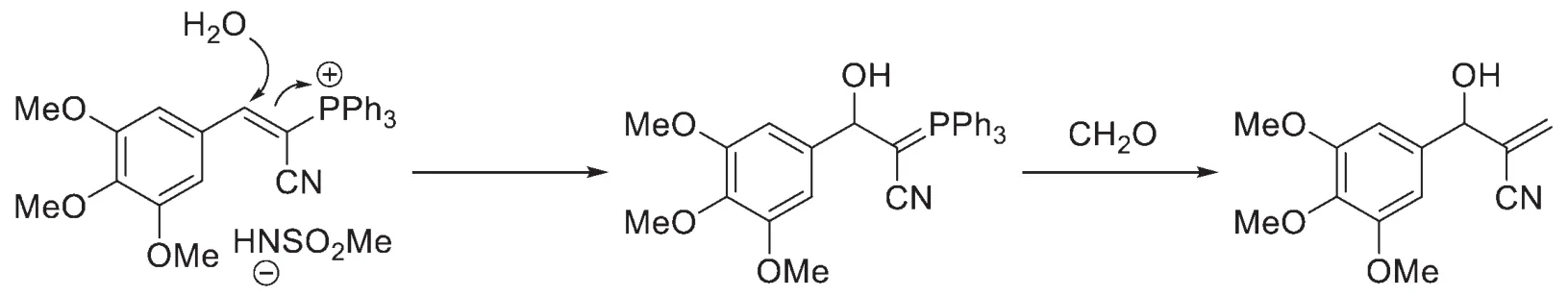
至此,我們可以做一個總結:有別于經典的Wittig反應,該反應底物分別為磺酰基取代的亞胺與帶有缺電子基團的Wittig試劑。雖然C=N鍵的極性不如C=O鍵,但強吸電子基的存在使得C=N足以與反應性較差的穩定型葉立德試劑反應。底物取代模式的改變可以更精確地調控該反應的更多細節。雖然題面并沒有涉及到立體化學,但實際上本反應的立體選擇性也相當重要。題目的原始文獻[9]指出,此工作還詳細探究了此類反應的立體選擇性。
本題考查了學生對有機化學的基本概念和反應機理的掌握情況及結構推斷的能力,題目前后關聯性較大,學生可以通過合理安排做題順序獲取更多用于解題的信息。
[1]賀麒霖,米天雄,孫桐,楊中天,余子迪,柳晗宇.大學化學,2015,30(5),69.
[2]Miao,M.S.Nat.Chem.2013,5,846.
[3]李克安.分析化學教程.北京:北京大學出版社,2005:154.
[4]Brosha,E.L.;Garzon,F.H.;Raistrick,I.D.J.Solid State Chem.1996,122,176.
[5]Barsoum,M.W.Prog.Solid State Chem.2000,28,201.
[6]Nilewski,C.;Geisser,R.W.;Carreira,E.M.Nature 2009,457,573.
[7]Chen,K;Baran,P.S.Nature 2009,459,824.
[8]Heck,R.F.J.Am.Chem.Soc.1968,90,5518.
[9]Fang,F;Li,Y.;Tian,S.K.Eur.J.Org.Chem.2011,No.6,1084.
The Theory Test Analysis for 29th Chinese Chemical Olympiad(Finals)
CHEN Yin-LinHE Qi-LinHUANG Yu-ChengLIU Han-Yu*SUN TongTANG QiYANG Zhong-TianYu Zi-Di
(College of Chemistry and Molecular Engineering,Peking University,Beijing 100871,P.R.China)
The problems in the theory test of 29th Chinese Chemical Olympiad(Finals)were resolved.The problem-solving techniques and calculations were developed,and the background and bibliography involved were provided.
Chinese Chemical Olympiad;Problem solving
O6;G64
10.3866/PKU.DXHX20160246
,Email:hanyuliu@pku.edu.cn

