不同顏色糙米的酚類物質組成及抗氧化活性分析
葉玲旭,劉興訓,周素梅,鐘葵,佟立濤,劉麗婭,周閑容,馬曉軍
1(江南大學 食品學院,江蘇 無錫,214122)2(中國農業科學院 農產品加工研究所/農業部農產品加工綜合性重點實驗室,北京, 100193)
?
不同顏色糙米的酚類物質組成及抗氧化活性分析
葉玲旭1,2,劉興訓2,周素梅2,鐘葵2,佟立濤2,劉麗婭2,周閑容2,馬曉軍1*
1(江南大學 食品學院,江蘇 無錫,214122)2(中國農業科學院 農產品加工研究所/農業部農產品加工綜合性重點實驗室,北京, 100193)
以8種不同顏色的糙米為研究對象,分別提取糙米中游離型和結合型酚,并對提取物中的酚類物質(總酚、總黃酮、總花青素、總原花青素、總酚酸)的含量以及ABTS自由基(ABTS+)清除能力與鐵離子還原能力進行了研究,比較了不同顏色間糙米的酚類物質和抗氧化活性的差異以及兩者與顏色參數間的相關性。研究結果表明:糙米的抗氧化活性與結合型、游離型的酚類物質含量呈正相關(P<0.05);結合型酚類物質的含量和抗氧化活性與糙米顏色均無顯著相關(P>0.05);游離型酚類物質含量、組成以及抗氧化活性與糙米顏色有相關,糙米顏色越深酚含量越高、抗氧化活性越強,且原花青素主要存在于紅色糙米或部分黑色糙米中。
糙米; 酚類物質;抗氧化活性; 顏色
我國是世界上第一大稻米生產國,稻米資源豐富、歷史悠久、品種多樣,按照種皮顏色分為普通稻和彩色稻兩大類[1]。彩色稻常作為特殊稻,其糙米顏色可分為綠色、紅色、紫色和黑色等[2];而普通糙米的顏色大多為淺棕色。研究表明,彩色糙米顏色的形成與糙米中酚類物質有關[3]。此外,長期食用糙米能降低Ⅱ型糖尿病、肥胖、冠心病等慢性疾病的風險,這與糙米中酚類物質的強抗氧化活性相關[4]。
糙米中的酚類物質包括酚酸、花青素和原花青素三大類[5]。酚酸以游離態和結合態的形式普遍存在于稻米中[6];花青素和原花青素主要以游離形式存在于深顏色糙米中[5]。目前,稻米中結合型酚的研究相對較少,但結合型酚能促進腸道微生物生長、預防結腸癌、抗氧化能力強于游離酚[7]。與其他彩色谷物一樣,不同顏色糙米的酚類含量、組成以及抗氧化能力不同[2, 8-11]。SHEN[8]對黑色和紅色糙米的研究表明:黑色和紅色糙米的游離酚含量、抗氧化能力均高于普通糙米,游離酚含量與糙米籽粒顏色有關;MIN[10]的研究表明,彩色的結合酚含量高于普通糙米,但無顯著差異。此外,有關綠色糙米酚類物質的報導較少。
本文選取了我國8種不同顏色的糙米為原料,分析了糙米中不同形態酚類物質的含量、組成及抗氧化活性,并對酚類含量、抗氧化能力、糙米顏色參數三者間的關系作了初步探索。
1 材料與方法
1.1材料與試劑
選取8種不同顏色的糙米,旋風磨磨粉,過80目,4 ℃保存備用,品種詳細信息見表1。

表1 實驗用彩色糙米樣品
水溶VE(Trolox,純度≥97%)、三吡啶三吖嗪(TPTZ,純度≥98.5%)、沒食子酸、原兒茶酸、綠原酸、咖啡酸、香草酸、丁香酸、p-香豆酸、阿魏酸、香草醛(色譜純),Sigma-Aldrich公司;ABTS (2,2-聯氮-二(3-乙基-苯并噻唑-6-硫磺)二銨鹽)(分析純),Sigma-Aldrich公司;蘆丁(純度≥98%)、矢車菊素葡萄糖苷(純度≥98%)、兒茶素(純度≥98%)(色譜純),北京索萊寶生物有限公司;福林酚(分析純),北京索萊寶生物有限公司;無水甲醇、Na2CO3、HaNO2、過硫酸鉀、六水氯化鋁和乙酸乙酯(分析純),北京國藥集團。
1.2儀器與設備
CT410旋風式樣品磨,福斯賽諾分析儀器(蘇州)有限公司;U-3010 紫外可見分光光度計,日本Hitachi 公司;SP-Max 2300A光吸收型全波長酶標儀,上海閃譜生物科技有限公司;D25LT型色彩色差儀,德國HunterLab公司;LXJ-ⅡB低速大容量多管離心機,上海安亭科學儀器廠;RE-52AA 旋轉蒸發器,上海亞榮生化儀器廠;Agilent 1200高效液相色譜儀,美國安捷倫公司。
1.3實驗方法
1.3.1糙米粉顏色測定
采用D25LT色差儀測定糙米樣品的顏色,以L*、a*和b*三個參數表示。L*表示亮度(數值100表示白色,0表示黑色),a*表示紅綠色,b*表示黃藍色,C為顏色飽和度,C=(a*2+b*2)1/2。
1.3.2游離型和結合型酚的提取
游離酚的提取[12]:稱取1 g樣品加入15 mL 4 ℃酸化甲醇提取10 min,離心取上清液,重復3次合并上清液,于45 ℃下旋轉蒸發,并用酸化甲醇定容至10 mL,放置-20 ℃保存。
結合酚的提取[12]:提取游離酚后所得殘渣中,加入20 mL 2 mol/L NaOH,在N2保護下攪拌1 h后,調pH值至1.5~2.0,添加等體積的正己烷除脂,用等體積的乙酸乙酯萃取5次,合并提取液于45 ℃旋轉蒸發至干,并用體積分數為50%的甲醇定容至10 mL,-20 ℃保存。
1.3.3總酚含量的測定
于1 mL稀釋提取液[8]中,加入0.5 mL稀釋1倍的福林酚試劑、2.5 mL 75 g/L Na2CO3,混合均勻,室溫下反應2 h,于760 nm波長下測定混合液的吸光值。根據不同濃度的沒食子酸繪制標準曲線,計算樣品中總酚含量,結果表示為mg/100g。
1.3.4總黃酮含量的測定
于1 mL稀釋提取液[8]中加入1.5 mL H2O(雙蒸水)和0.15 mL 50 g/L NaNO2反應5 min,再加入0.15 mL 100g/L AlCl3·6H2O混勻反應5 min,于混合液中加入1 mL 1 mol/L NaOH 反應15 min。采用415 nm測定混合液的吸光值。根據不同濃度的蘆丁繪制標準曲線,計算樣品中總黃酮含量,結果表示為mg/100 g。
1.3.5總原花青素的提取及測定
參照文獻[2, 13]提取并測定原花青素含量。稱2.0 g糙米,加入25 mL體積分數為80%的甲醇提取8 h,離心取上清液,定容至25 mL,提取液過0.22 μm濾膜保存。取0.4 mL 提取液加入1 mL 4.5 mol/L硫酸甲醇溶液與1 mL 10 g/L香草醛甲醇溶液,于30 ℃反應15 min,并用純甲醇溶液代替香草醛溶液作為樣品的空白對照,于500 nm下測定吸光值。根據不同濃度的兒茶素繪制標準曲線,計算樣品中總原花青素含量,結果表示為μg/g。
1.3.6總花青素的提取及測定
采用pH示差法測定總花青素[10]。0.5 g樣品加入15 mL酸化甲醇提取3次,離心取上清液。提取液分別用pH1.0和pH 4.5的緩沖液稀釋10倍,分別采用520 nm和700 nm測定稀釋液的吸光值。以不同濃度的矢車菊素葡萄糖苷繪制標準曲線,得到摩爾消光系數,按公式(1)計算樣品中總花青素含量,結果表示為μg /g。
總花青素濃度/(μg·g-1)=A×MW×V×DF/(ε×L×m×1 000)
(1)
式中:A,吸光度,A=(A520nm-A700nm)pH1.0-(A520nm-A700nm)pH 4.5;MW,矢車菊素葡萄糖苷(kuromanin)的分子質量;DF,稀釋系數;V,提取液體積,mL;ε,摩爾消光系數,L/(cm×mol);L,比色皿寬度,cm;1 000,換算系數;m,樣品質量,g。
1.3.7酚酸的組成
采用HPLC測定酚酸含量[12],8種酚酸(沒食子酸、原兒茶酸、綠原酸、咖啡酸、香草酸、丁香酸、p-香豆酸和阿魏酸)作為外標。使用SB-C18柱(250 mm×4.6 mm,5 μm)色譜柱,檢測波長280 nm和320 nm,柱溫為40 ℃,進樣量為10 μL,流動相A(2%甲酸)和流動相B(乙腈),梯度洗脫:A 95%~75%,0~30 min;A 60%,30~50 min;A 95%,50~60 min。流速為 0.8 mL/min。
1.3.8抗氧化活性評價
ABTS+清除能力(ABTS radical scavenging capacity,ARSC)測定[14]:ABTS溶液(7 mmol/L)與過硫酸鉀溶液(7.35 mmol/L)按2∶1的體積混合后,黑暗條件下放置12~16 h,形成ABTS+,記為ABTS+母液。用甲醇調節ABTS+母液使其在734 nm下吸光值為(0.70±0.02),記為ABTS+工作液。3.9 mL ABTS+工作液與0.1 mL提取液混合,室溫下反應6 min后立即測定吸光值,記為Asample。以甲醇作對照,吸光值記為Acontrol。按下列公式計算清除率。ABTS+清除率/%=(1-Asample/Acontrol)×100,以不同濃度的Trolox繪制標準曲線,根據清除率計算抗氧化能力,結果表示為μmol/g。
鐵離子還原/抗氧化能力(ferric reducing antioxidant power,FRAP)測定[12]:制備FRAP試劑,在96孔板中加入20 μL提取液和260 μL FRAP試劑,反應30 min后在593 nm下測定吸光值。以不同濃度的Trolox溶液繪制標準曲線,根據吸光值計算樣品的FRAP值,結果以μmol/g表示。
1.4數據分析
采用SPSS 20.0、Excel 2013 進行數據分析和圖像處理,實驗均進行2次重復,數值以(平均值±SD)表示。
2 結果與分析
2.1糙米顏色
采用糙米粉末測定的顏色參數值反應糙米籽粒的顏色,其結果見表2。L*表示亮度,a*表示紅綠色,b*表示黃藍色,C為顏色飽和度。從表2可以看出,綠色和普通糙米的L*值最高,黑色糙米最低,紅色糙米居中;綠色糙米的a*為負,普通糙米其數值最低,深色(黑色和紅色)糙米的a*較高,紅色糙米的a*最高;黑米的b*值和C值最小,色彩飽和度和低。不同顏色糙米,其顏色參數存在顯著差異(P<0.05),采用色差儀可以清晰的分辨糙米的顏色。
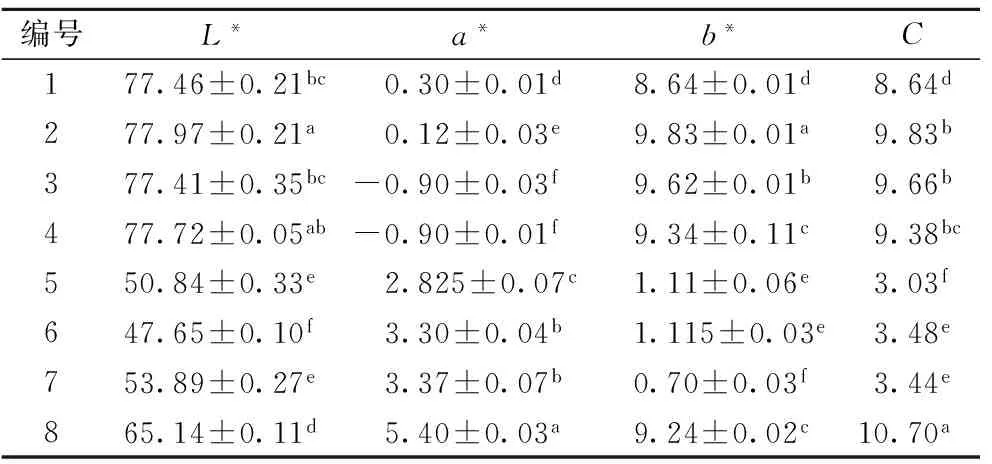
表2 不同顏色糙米的顏色參數
注:同一列相同字母表示無顯著性差異(P>0.05),不同字母表示差異顯著。表5同。
2.2不同顏色糙米的總酚含量
圖1為不同顏色糙米游離型和結合型的總酚含量。從圖1可以看出,所有樣品的游離型總酚含量均明顯大于結合型總酚含量。不同顏色糙米的游離型總酚含量存在明顯的差異(P<0.05),而不同顏色間結合型總酚含量差異較小。所選的8種樣品,黑色糙米游離型總酚含量最高,且遠高于淺色(淺棕色和綠色)糙米,含量是淺色糙米的7~10倍,這與SHEN[8]和CHEN[11]等對彩色糙米游離型酚的研究結果相似。
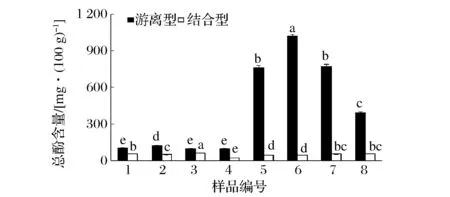
圖1 彩色糙米游離型和結合型總酚含量Fig.1 Total phenolic content in free and bound forms of pigmented rice varieties注:所有品種間游離型總酚和結合型總酚分別進行顯著性分析(P<0.05)。
2.3不同顏色糙米的總黃酮含量
不同顏色糙米游離型和結合型總黃酮含量的變化趨勢與總酚相同(結果見圖2)。由圖2可知,所有樣品的游離型總黃酮含量均大于結合型總黃酮含量,其中深色(黑色和紅色)糙米的游離型總黃酮含量與結合型的差異較大;不同顏色間結合型總黃酮含量差異小,而游離型總黃酮含量差異顯著(P<0.05)。深色(黑色和紅色)糙米游離型總黃酮含量遠高于淺色(淺棕色和綠色)糙米,淺棕色與綠色糙米間游離型總黃酮差異小,黑色糙米是綠色糙米的2~3倍多,這與SHEN[8]等對彩色糙米游離型總黃酮含量的研究結果相近。
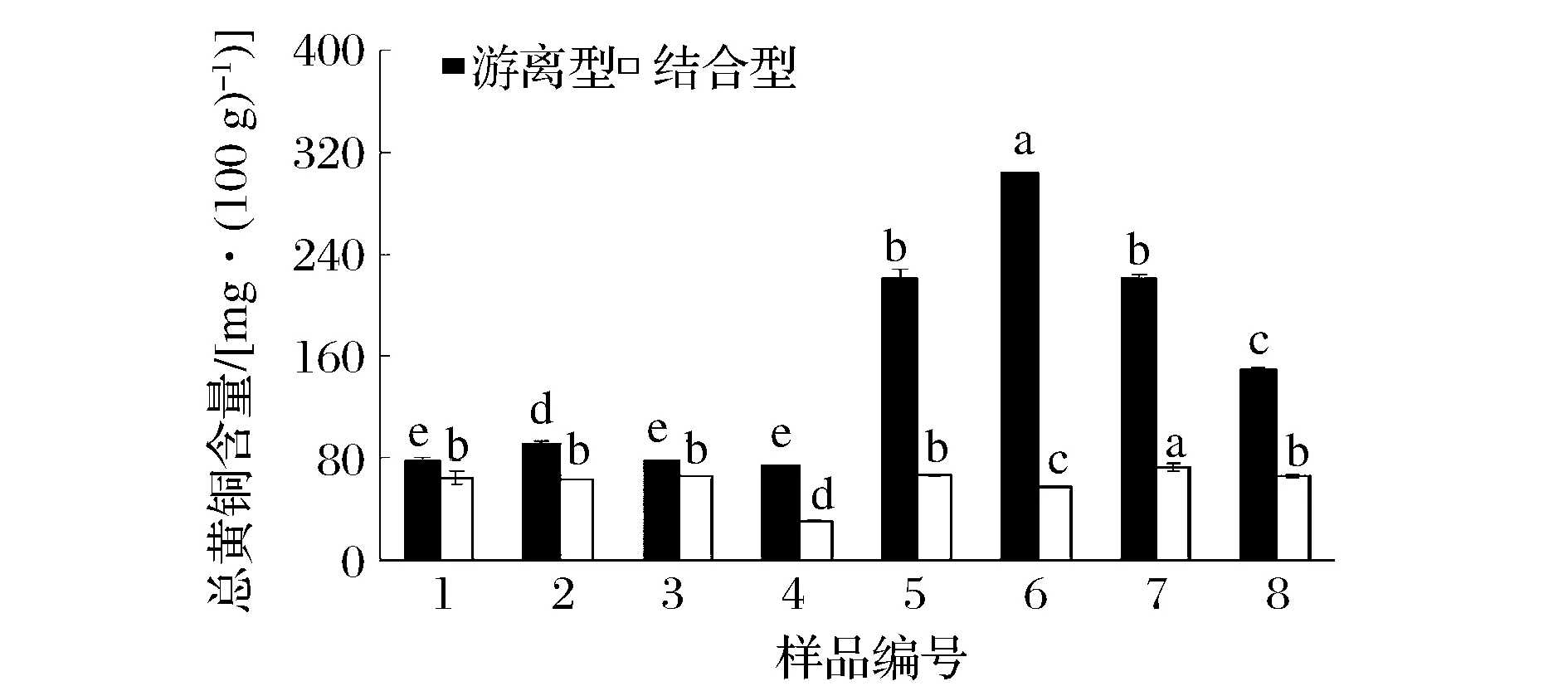
圖2 彩色糙米游離型和結合型總酚含量Fig.2 Total flavoniod content in free and bound forms of pigmented rice varieties注:所有品種間游離型總黃酮和結合型總黃酮分別進行顯著性分析(P<0.05)。
2.4總原花青素和總花青素含量
花青素是一類水溶性類黃酮物質,原花青素屬于黃酮物質,主要由黃烷-3醇單元聚合而成,且兩類物質主要以游離態形式存在于深色糙米中[10],如表3所示。
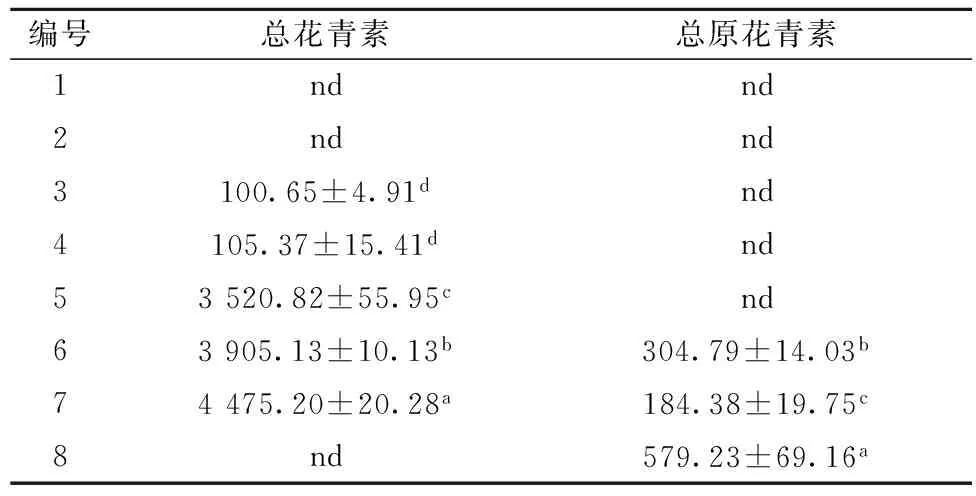
表3 不同顏色糙米總花青素含量和總原花青素 單位:μg/g
注:同一列相同字母表示無顯著性差異(P>0.05),不同字母表示差異顯著; nd-not detected,未檢測出。
普通糙米未檢測出TAC(總花青素含量)和TPAC(總原花青素含量);綠色糙米僅含有微量的TAC(值為100.65~105.37 μg/g);黑色糙米含較高的TAC(值為3 520.82~4 475.20 μg/g),為綠色糙米的30~40倍,同時檢測出6和7號樣品含有TPAC(值分別為304.79和184.38 μg/g);而紅色糙米僅含有較高的TPAC(579.23 μg/g)。大多數研究指出花青素存在于黑色稻米、原花青素存在于紅色稻米中[5],本研究發現花青素主要存在于黑色糙米并少量存在于綠色糙米中,原花青素主要存在于紅色糙米以及部分黑色糙米中。深色糙米擁有高含量的花青素或原話花青素,進一步說明了深色糙米的游離型總酚和總黃酮含量顯著高于淺色糙米。
2.5酚酸含量
酚酸是糙米中常見的酚類物質,采用HPLC法測定酚酸組成和含量(結果見表4)。表4中總酚酸含量為8種酚酸含量之和,總量為游離型和結合型2種形式的酚酸含量之和。從表4可知,糙米中結合型的酚酸主要為阿魏酸和p-香豆酸,且不同顏色間結合型總酚酸含量差異小,與前人[15]研究結果一致。不同顏色糙米游離型酚酸的含量和組成不同:普通糙米和綠色糙米的游離型酚酸主要是沒食子酸、阿魏酸和p-香豆酸,紅色糙米是阿魏酸、p-香豆酸、香草酸和原兒茶酸,黑色糙米是香草酸、原兒茶酸、阿魏酸和p-香豆酸;黑色糙米游離型總酚酸含量最高,普通糙米次之。上述結果與SOMPONG[16]和IRAKLI等[17]的研究結果相近。
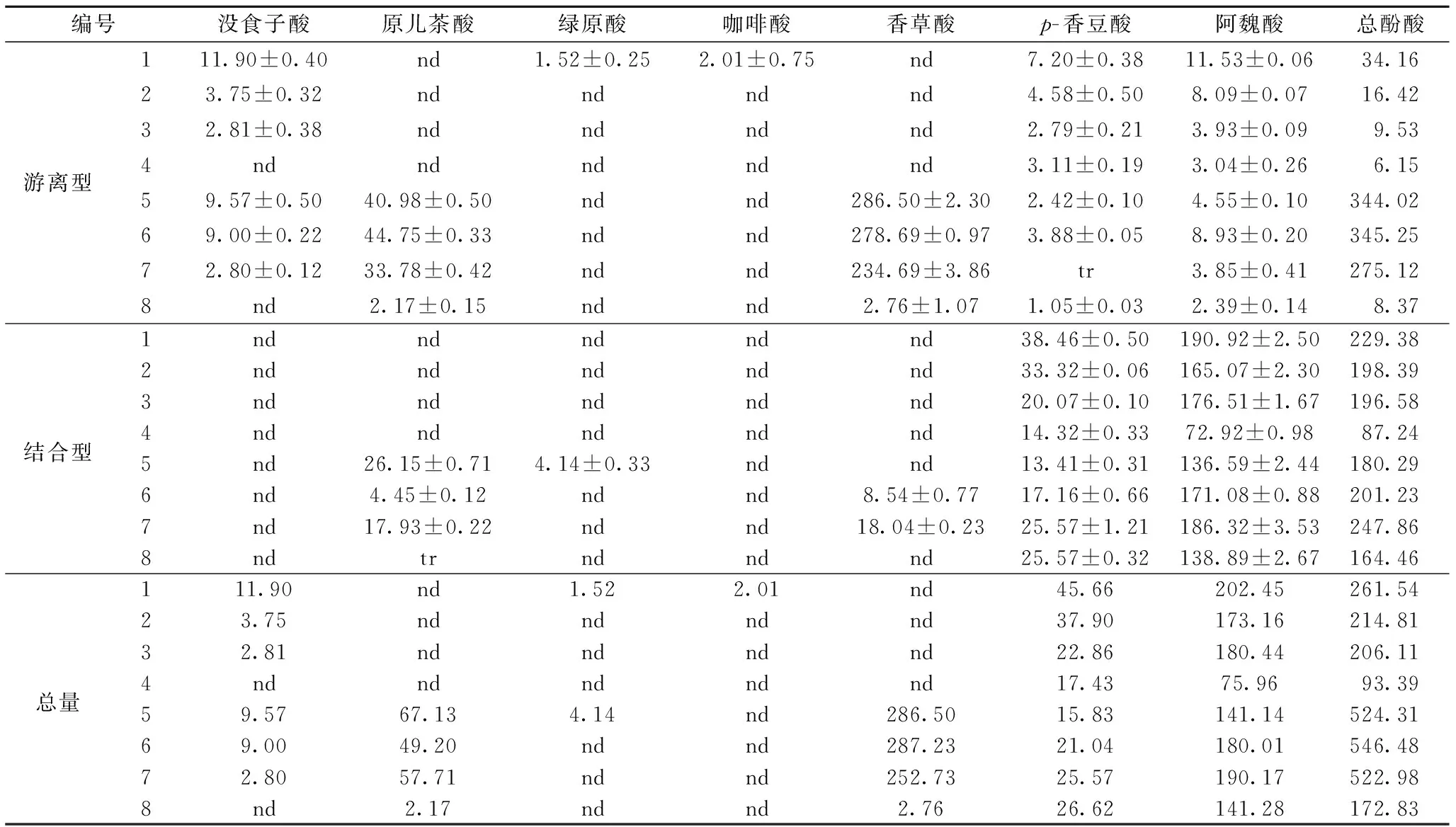
表4 不同品種彩色糙米的酚酸含量 單位:μg/g
注:nd- 未檢測出,tr-痕量;所有樣品丁香酸未檢測出。
2.6抗氧化活性
以Trolox(水溶VE)作為陽性對照,不同顏色糙米游離型和結合型提取物的ARSC、FRAP值如表5所示。結果顯示,結合型提取物的ARSC與FRAP值變化范圍小,不同顏色間的差異不顯著;不同顏色間游離型提取物的ARSC和FRAP值差異顯著(P<0.05),深色糙米遠大于淺色糙米,淺色糙米中普通糙米的ARSC略大于綠色糙米,與CHEN[11]研究結果相似。
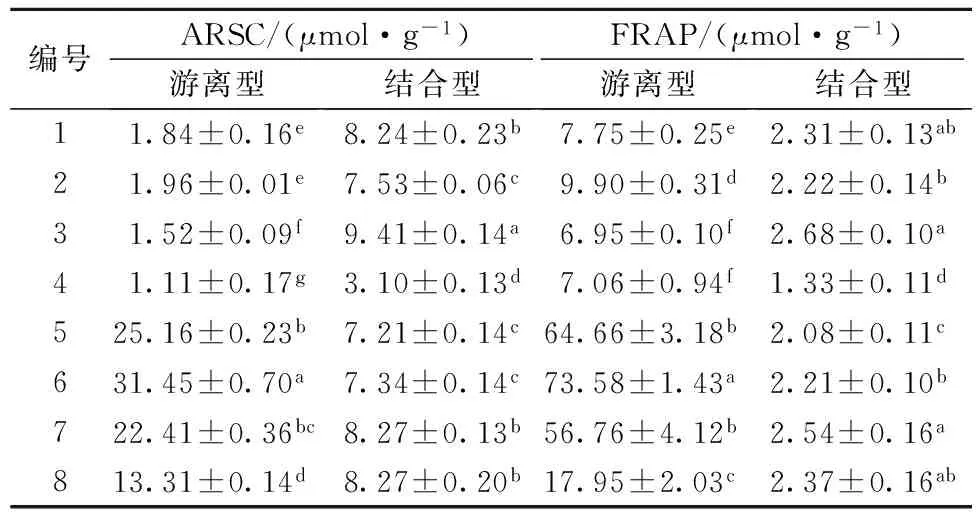
表5 不同品種糙米游離型和結合型提取物的ABTS+清除能力和鐵離子還原能力
2.7相關性分析
糙米中酚類物質(總酚、總黃酮、總量酚酸、總花青素、總原花青素)、抗氧化能力、顏色參數三者間的相關性分析結果見表6。由表6可知,酚類物質(除原花青素外)與ARSC和FRAP值(極)顯著相關(P<0.01或0.05),說明酚類物質是彩色糙米的主要抗氧化性物質,這與GUNARATME[2]研究結論一致。結合型酚類物質(總酚、總黃酮、總酚酸)以及抗氧化活性均與L*、a*、b*和C無顯著相關(P>0.05),說明結合酚含量以及抗氧化活性與種皮顏色無關;游離型酚類物質(除總原花青素外)、抗氧化活性均與L*值、b*值、C呈極顯著負相關(P<0.01),總酚、總黃酮、總原花青素含量、TEAC值分別與a*成正相關(P<0.05),說明糙米顏色越深游離型酚含量越高、抗氧化活性越強,且原花青素主要存在于紅色糙米或部分黑色糙米中。SHEN[8]研究結果顯示紅色糙米其游離型的總酚、總黃酮、抗氧化能力與L*、b*、C無顯著相關性(P>0.05),而與a*值顯著相關(P<0.05),進一步解釋了本研究中原花青素的含量與L*、b*、C無關而與a*相關。
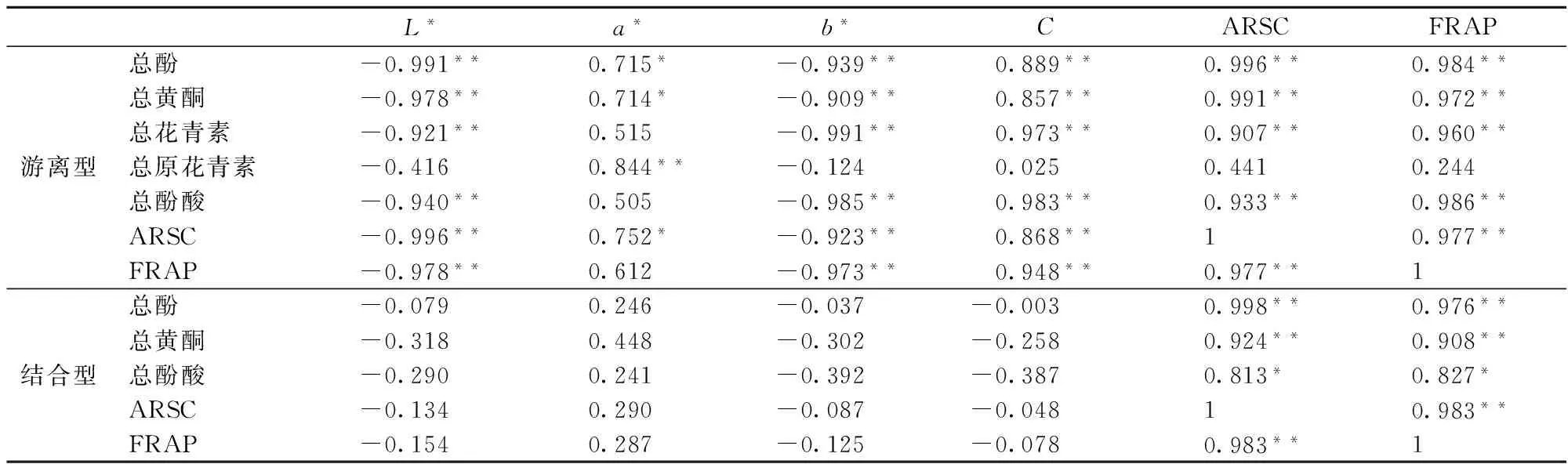
表6 酚類含量與品種顏色以及抗氧化活性的相關性分析
注:*表示表示顯著相關(P<0.05);**表示極顯著相關(P<0.01)。
3 結論
(1)抗氧化活性與結合型和游離型的酚類物質含量呈正相關(P<0.05)。
(2)結合型酚類物質的含量和抗氧化活性與糙米顏色無顯著相關(P<0.05)。
(3)游離型酚類物質含量、組成以及抗氧化活性與糙米顏色有相關。糙米顏色越深酚含量越高、抗氧化活性越強,且原花青素主要存在于紅色糙米或部分黑色糙米中。
[1]戴蘊青, 何計國, 袁芳, 等. 五彩米營養成分分析與評價[J]. 中國糧油學報, 2006(1): 20-23.
[2]GUNARATNE A, WU Kao, LI Dong-qin, et al. Antioxidant activity and nutritional quality of traditional red-grained rice varieties containing proanthocyanidins[J]. Food Chemistry, 2013, 138(2/3): 1 153-1 161.
[3]ABDEL-AALl E S M, YOUNG J C, RABALSI I. Anthocyanin composition in black, blue, pink, purple, and red cereal grains[J]. Journal of Agricultural and Food Chemistry, 2006, 54(13): 4 696-4 704.
[4]BURLANDO B, CORNARA L. Therapeutic properties of rice constituents and derivatives (OryzasativaL.): A review update[J]. Trends in Food Science and Technology, 2014, 40(1): 82-98.
[5]SHAO Ya-Fang,BAO Jin-song. Polyphenols in whole rice grain: genetic diversity and health benefits[J]. Food Chemistry, 2015, 180: 86-97.
[6]AL-FARSI M A,LEE C Y. Optimization of phenolics and dietary fibre extraction from date seeds[J]. Food Chemistry, 2008, 108(3): 977-985.
[7]ACOSTA-ESTRADA B A, GUTIéRREZ -URIBE J A, SERNA-SALDVA S O. Bound phenolics in foods, a review[J]. Food Chemistry, 2014, 152(6): 46-55.
[8]SHEN Yun, JIN Liang, XIAO Peng, et al. Total phenolics, flavonoids, antioxidant capacity in rice grain and their relations to grain color, size and weight[J]. Journal of Cereal Science, 2009, 49(1): 106-111.
[9]DE MIRA N V M, MASSARETTO I L, PASCUAL C d S C I, et al. Comparative study of phenolic compounds in different Brazilian rice (OryzasativaL.) genotypes[J]. Journal of Food Composition and Analysis, 2009, 22(5): 405-409.
[10]MIN B, GU Li-wei, MCCLUNG A M, et al. Free and bound total phenolic concentrations, antioxidant capacities, and profiles of proanthocyanidins and anthocyanins in whole grain rice (OryzasativaL.) of different bran colours[J]. Food Chemistry, 2012, 133(3): 715-722.
[11]CHEN Xiao-qiong, NAGAO N, ITANI T, et al. Anti-oxidative analysis, and identification and quantification of anthocyanin pigments in different coloured rice[J]. Food Chemistry, 2012, 135(4): 2 783-2 788.
[12]TI HUI-HUI, LI QING, ZHAN Ghang Rui-fen, et al. Free and bound phenolic profiles and antioxidant activity of milled fractions of different indica rice varieties cultivated in southern China[J]. Food Chemistry, 2014, 159(13): 166-174.
[13]SUN B, RICARDO-DA-SILVA J M, SPRANGER I. Critical factors of vanillin assay for catechins and proanthocyanidins[J]. Journal of Agricultural and Food Chemistry, 1998, 46(10): 4 267-4 274.
[14]RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine, 1999, 26(9/10): 1 231-1 237.
[15]SOSULSKI F, KRYGIER K, and HOGGE L. Free, esterified, and insoluble-bound phenolic acids. 3. Composition of phenolic acids in cereal and potato flours[J]. Journal of Agricultural and Food Chemistry, 1982, 30(2): 337-340.
[16]SOMPONG R, SIEBENHANDL-EHN S, LINSBERGER-MARTIN G, et al. Physicochemical and antioxidative properties of red and black rice varieties from Thailand, China and Sri Lanka[J]. Food Chemistry, 2011, 124(1): 132-140.
[17]IRAKLI M N, SAMANIDOU V F, BILIADERIS C G, et al. Simultaneous determination of phenolic acids and flavonoids in rice using solid-phase extraction and RP-HPLC with photodiode array detection[J]. Journal of Separation Science, 2012, 35(13): 1 603-1 611.
Phenolic compounds and antioxidant activity of brown rice in different color of bran
YE Ling-xu1,2, LIU Xing-xun2, ZHOU Su-mei2, ZHONG Kui2, TONG Li-tao2,LIU Li-ya2, ZHOU Xian-rong2, MA Xiao-jun1*
1(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)2(Institute of Food Science and Technology (IFST), Chinese Academy of Agricultural Sciences (CAAS), Beijing 100193, China)
Eight different color brown rice were used to extract the free and compound form of phenolics. The content of phenolic compounds, including total phenolic , total flavonoids, total anthocyanins, total proanthocyanidin, total phenolic acids, and the capacity of ABTS+radical scavenging and ferric ion reduction were studied. We also compared the difference of phenolic compounds and antioxidant activity in different color brown rice as well as the correlation between color parameters, phenolic content and antioxidant activity. Those results shown that antioxidant activity and content of phenols in both free and bound forms were positively correlated (P<0.05); the compound form of phenols and antioxidant activity were unrelated with rice bran color (P>0.05); while the free phenolic content and composition, antioxidant activity were related with rice bran color. The more dark color of the rice, the more phenols, and the stronger antioxidant activity. Proanthocyanidin was mainly existed in red rice and some black rice varieties.
brown rice; phenolics; antioxidant activity; color
10.13995/j.cnki.11-1802/ts.201609013
碩士研究生(馬曉軍教授為通訊作者,E-mail: maxiaojun@jiangnan.edu.cn)。
農業部公益性行業科研專項經費:活性稻米、雜糧等食品加工及裝備研究與示范(201403063);中國農業科學院基本科研業務費(2015ZL048);中央級公益性科研院所基本科研業務費專項資金(中國農業科學院農作物科學研究所)資助項目
2015-12-24,改回日期:2016-01-22

